Los fármacos antagonistas del factor de necrosis tumoral alfa representan un importante avance en el tratamiento de enfermedades inflamatorias como la artritis reumatoide, las espondiloartropatías y la enfermedad inflamatoria intestinal. Se reconoce el incremento de tuberculosis con infliximab, pero disponemos de menos datos que relacionen la tuberculosis específicamente con adalimumab. Presentamos los casos de 2 pacientes con artritis reumatoide y un paciente con espondilitis anquilopoyética en tratamiento con adalimumab, que desarrollaron tuberculosis pulmonar y diseminada a pesar de seguir las medidas de cribado y profilaxis recomendadas por las guías, y revisamos la asociación entre el tratamiento con antagonistas del factor de necrosis tumoral alfa y tuberculosis.
Tumour necrosis factor-alpha antagonist drugs represent a significant advance in the treatment of inflammatory diseases, such as rheumatoid arthritis, spondyloarthropathies, and intestinal inflammatory disease. The increase in tuberculosis with infliximab is known, but there is less data available that specifically associates tuberculosis with adalimumab. We present the cases of 2 patients with rheumatoid arthritis and one patient with ankylopoietic spondylitis on treatment with adalimumab, who developed pulmonary and disseminated tuberculosis despite following the screening and prophylaxis measures recommended in guidelines. We also review the association between treatment with tumour necrosis factor-alpha antagonists and tuberculosis.
El factor de necrosis tumoral alfa (TNF-α) es una citocina proinflamatoria producida por macrófagos y linfocitos T que interviene en la patogenia de diversas enfermedades inflamatorias crónicas1. Es un componente importante de la respuesta inmunológica al inducir la diferenciación de monocitos a macrófagos, y tiene un papel clave en la formación y mantenimiento del granuloma2. En este grupo de fármacos biológicos están incluidos el infliximab (anticuerpo monoclonal en forma quimérica murino-humano), el etarnecept (proteína de fusión de la porción soluble del receptor de TNF humano y la porción Fc de la inmunoglobulina G1, que funciona neutralizando el propio TNF) y el adalimumab (anticuerpo monoclonal recombinante humano que se une al TNF-α, de forma que evita que éste actúe sobre sus receptores de membrana p55 y p75). Se han identificado múltiples complicaciones y efectos adversos con el uso de infliximab, algunos no suficientemente probados, como encefalopatía desmielinizante, neoplasias e insuficiencia cardíaca, y otros como infecciones (bacterianas, micóticas y tuberculosis) con datos más concluyentes3–8. Se dispone de menos datos en relación con el adalimumab, si bien algunos estudios han apuntado un riesgo similar5. Presentamos 3 casos de pacientes en tratamiento con adalimumab que desarrollaron tuberculosis a pesar de seguir las recomendaciones de las guías clínicas.
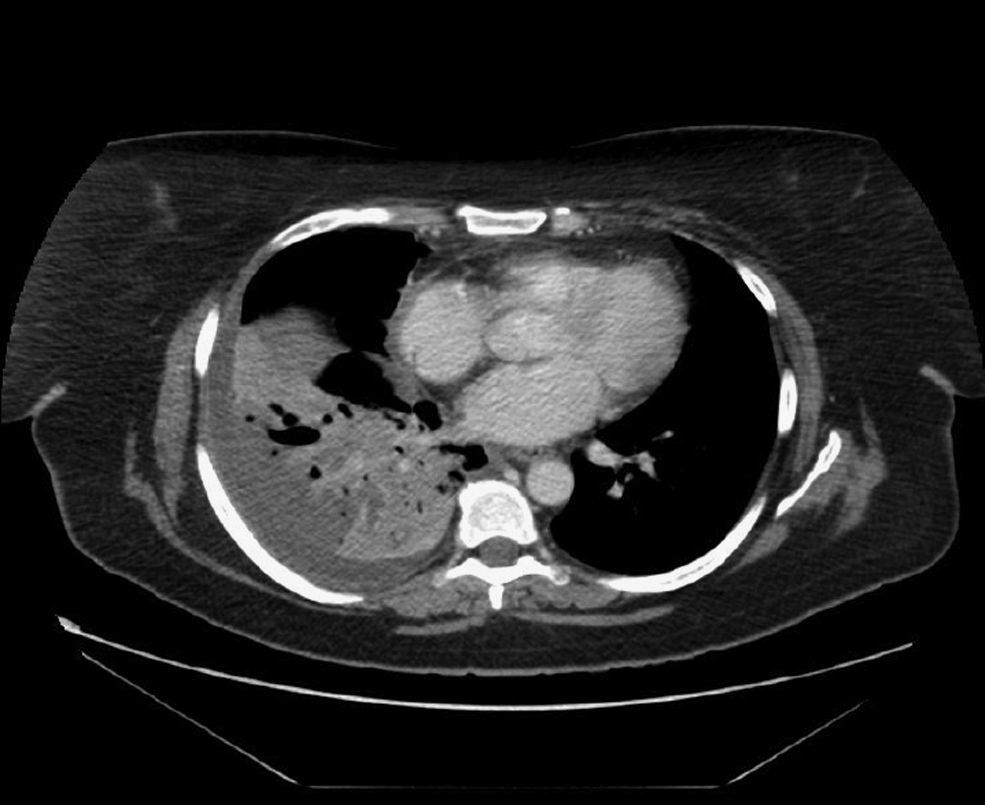
Observación clínicaCaso 1Mujer de 49 años, diagnosticada de artritis reumatoide (AR) a los 40, en tratamiento con metotrexato y esteroides a dosis bajas y, desde febrero de 2006, con adalimumab por vía subcutánea (40mg cada 2 semanas). La AR se hallaba en remisión. Presentaba una prueba de la tuberculina y un efecto de refuerzo negativos. Se había incrementado la dosis de esteroides a 10mg de prednisona ante la presencia de un cuadro indicativo de eritema nudoso 3 meses antes. Acudió a urgencias por cuadro de tos, sudoración profusa y fiebre, que alcanzó 38°C, de 4 semanas de evolución. Se estableció el diagnóstico de neumonía de la comunidad y recibió tratamiento con amoxicilina-ácido clavulánico, sin mejoría, por lo que acudió de nuevo a urgencias. En la radiografía de tórax se apreció una consolidación en el lóbulo inferior derecho. La tomografía computarizada (TAC) mostró una consolidación parenquimatosa en dicho lóbulo (fig. 1). Se inició tratamiento con levofloxacino, con parcial mejoría clínica y radiológica. Al séptimo día reapareció la fiebre. Mediante la inducción de esputo se obtuvo una muestra donde se detectaron bacilos ácido-alcohol resistentes y en la que el cultivo para Mycobacterium tuberculosis complex fue positivo. Se instauró tratamiento con isoniacida, rifampicina y piracinamida. La paciente reingresó al cabo de una semana por vómitos, dolor abdominal e ictericia; la bioquímica hepática mostró bilirrubina de 7,3U/l, a expensas de bilirrubina directa; aspartato aminotransferasa de 146U/l, alanina aminotransferasa de 158U/l, fosfatasa alcalina de 515U/l y gammaglutamil transpeptidasa de 136U/l. Se interrumpió el tratamiento tuberculostático. A los 11 días del ingreso se reinstauraron progresivamente la isoniacida y la rifampicina, y se inició estreptomicina, hasta que las pruebas de sensibilidad permitieron retirarla. La evolución posterior de la paciente fue buena y su AR está en remisión.
Caso 2Varón de 37 años, diagnosticado de espondilitis anquilopoyética a los 21. En el último año se había instaurado adalimumab por vía subcutánea (40mg cada 2 semanas). Previamente, por presentar una prueba de la tuberculina positiva, había recibido isoniacida durante 9 meses. Acudió a urgencias hasta en 3 ocasiones en un mes por malestar general, sudoración vespertina, tos no productiva y febrícula. En la exploración física presentaba 37,8°C de temperatura y la impresión que daba era de gravedad. En la radiografía de tórax se apreciaron un infiltrado parahiliar izquierdo y un patrón micronodulillar difuso bilateral. En la TAC se observó dicho infiltrado en el segmento posterior del lóbulo superior izquierdo, además de micronódulos bilaterales, adenopatías hiliares y mediastínicas bilaterales, derrame pleural izquierdo y bazo e hígado con lesiones micronodulares de hasta 1,5cm, todo ello indicativo de enfermedad miliar tuberculosa. La toracocentesis mostró un líquido pleural claro con un 95% de linfocitos, adenosindesaminasa de 104U/l y lactatodeshidrogenasa de 623U/l. Las baciloscopias de esputo y orina fueron negativas, y el cultivo positivo en esputo y lavado broncoalveolar para M. tuberculosis complex. Se inició tratamiento con 3 fármacos (isoniacida, rifampicina y piracinamida) a dosis bajas, ya que las transaminasas se encontraban elevadas (aspartato aminotransferasa: 49U/l; alanina aminotransferasa: 132U/l; fosfatasa alcalina: 766U/l; gammaglutamil transpeptidasa: 308U/l). A lo largo de un mes las transaminasas se normalizaron progresivamente y se trató con dicha pauta a dosis plenas durante 6 meses; las pruebas de resistencia mostraron sensibilidad a los fármacos de primera línea. La evolución clínica del paciente, tanto desde el punto de vista de la tuberculosis como de la espondilitis, ha sido buena.
Caso 3Varón de 62 años, diagnosticado de AR a los 51. Tenía antecedentes de afectación pleuropulmonar con enfermedad ampollosa bilateral y neumotórax espontáneo 5 años antes. Tanto la prueba de la tuberculina como el efecto de refuerzo eran negativos. Se le había prescrito adalimumab por vía subcutánea (40mg cada 15 días) 10 meses antes, y además recibía prednisona (10mg/día). Acudió a consulta refiriendo aumento de la disnea de 2 meses de evolución, que se había hecho de pequeños esfuerzos, y expectoración hemoptoica ocasional. En la exploración física presentaba crepitantes bilaterales. La TAC mostraba afectación intersticial micronodular bilateral y difusa de predominio subpleural, así como múltiples ampollas y áreas de enfisema de predominio subpleural y centrolobulillar. Se recibió cultivo positivo en esputo para M. tuberculosis complex y se instauró tratamiento con 4 fármacos, con buena tolerancia y respuesta clínica.
DiscusiónPresentamos 3 casos de pacientes en tratamiento con adalimumab que desarrollaron tuberculosis pulmonar a pesar de seguir las recomendaciones de prevención de tuberculosis de la Sociedad Española de Reumatología9. El tratamiento con anti-TNF-α aumenta hasta 5 veces el riesgo de tuberculosis activa. De acuerdo con la base de datos de la Food and Drug Administration, las tasas de tuberculosis en los pacientes tratados con infliximab y etarnecept fueron 54 y 28 por 100.000, respectivamente, para unas tasas de tuberculosis en el mismo período de 5,2 a 6,8 casos por 100.0006. La mayoría de estos casos se manifestaron como enfermedad extrapulmonar, ocurrían una mediana de 12 semanas después de la primera infusión del fármaco y tenían como factores adicionales favorecedores de la tuberculosis la administración de otros inmunodepresores, historia de tuberculosis latente o activa y procedencia de zona endémica7,8. En un estudio nacional basado en el registro BIOBADASER (Base de Datos de Productos Biológicos de la Sociedad Española de Reumatología), de un total de 5.198 pacientes tratados con bioterapia, hubo 15 casos de tuberculosis (todos en pacientes con infliximab y sólo uno con adalimumab), lo que constituye una tasa de 172 por 100.000 pacientes/años3,4. El hecho de estar con tratamiento inmunodepresor8 además de anti-TNF-α, lo cual ocurría en nuestros 3 pacientes, no se considera suficiente para explicar el incremento de tuberculosis observado2. La tuberculosis habitualmente ocurre poco tiempo después del inicio del anti-TNF7 y es probable que represente una reactivación de una infección latente, mientras que cuando aparece tardíamente representaría una nueva infección que progresa de forma directa a enfermedad activa.
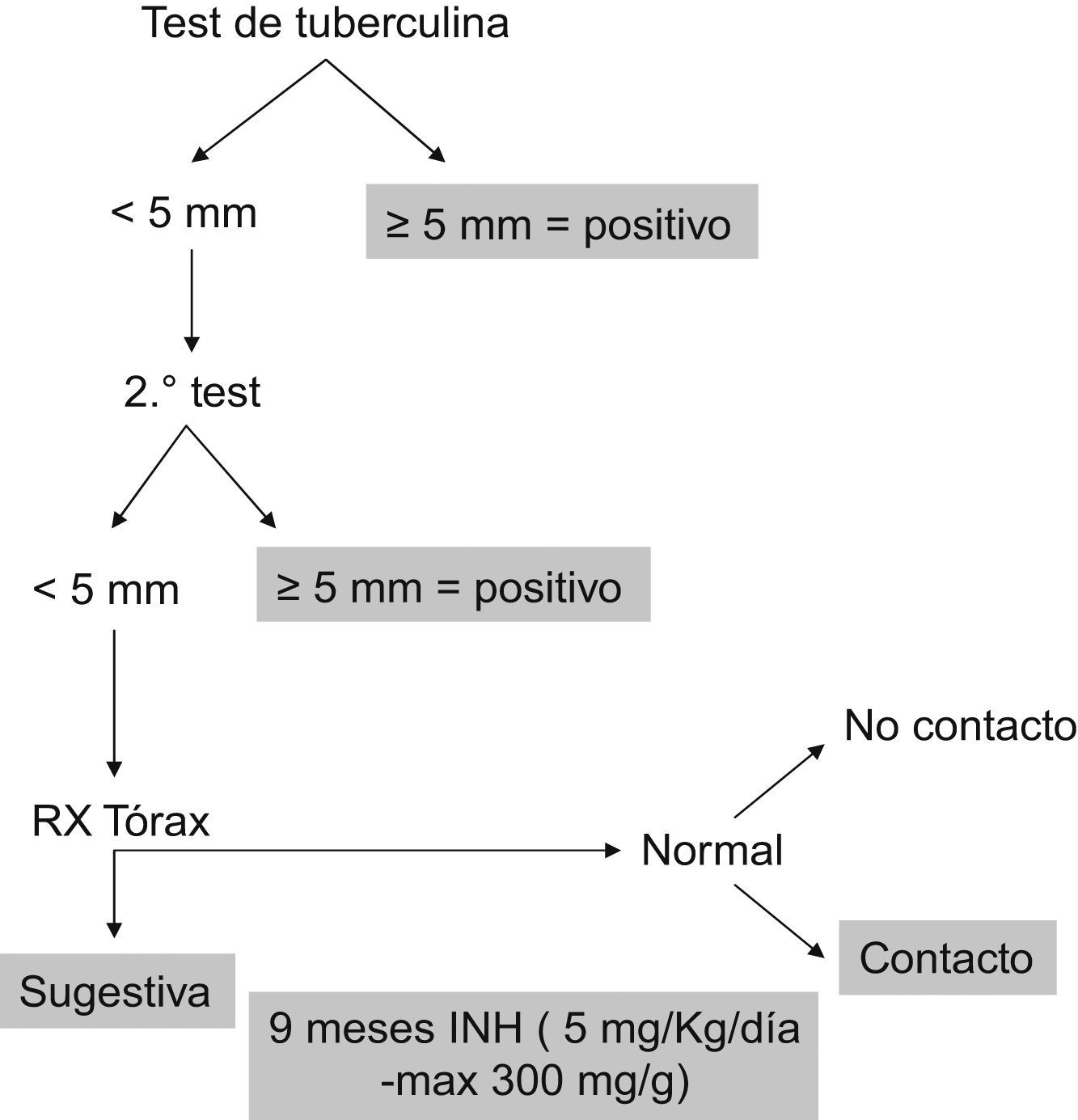
Las sociedades de reumatología españolas e internacionales9 recomiendan, cuando la prueba de la tuberculina es positiva (=5mm de induración), 9 meses de isoniacida. Si la prueba es negativa, también se recomienda profilaxis cuando hay evidencia de enfermedad remota en la radiografía de tórax o si ha habido contacto estrecho con un caso de tuberculosis9–11 (fig. 2). Según la experiencia acumulada con infliximab, el intervalo desde el inicio del tratamiento hasta el desarrollo de tuberculosis está aumentando, probablemente por haber realizado profilaxis con isoniacida7. Los intervalos de tiempo desde la introducción del adalimumab en nuestros 3 pacientes (de 30, 12 y 10 meses) nos hacen pensar en la posibilidad de nueva infección. Empleando dichas recomendaciones, se ha apreciado un descenso de hasta el 74% de casos de tuberculosis en pacientes con AR tratados con infliximab3,9, si bien en el estudio de Sichletidis et al12 un 22,2% de los pacientes desarrolló tuberculosis a pesar del adecuado protocolo de profilaxis. Nuestro caso 2, dado que la prueba de la tuberculina era positiva, recibió la quimioprofilaxis recomendada, pero sin éxito. El nuevo método diagnóstico basado en la producción in vitro de interferón gamma en respuesta a antígenos de M. tuberculosis (IGRA, de interferon-gamma release assay) será de especial utilidad en estos pacientes, en los que una prueba de la tuberculina negativa no debe excluir la existencia de infección latente13–16, y podrá usarse para distinguir verdaderos positivos de falsos positivos causados por la vacunación antituberculosa; sin embargo, se necesita más investigación para determinar su sensibilidad y especificidad.
El momento óptimo para reiniciar el tratamiento anti-TNF en casos de tuberculosis activa no está determinado, pero en general se debe esperar a que se instaure tratamiento específico, a conocer los tests de susceptibilidad y a constatar una mejoría clínica evidente10,11. En ninguno de nuestros pacientes se ha reintroducido hasta el momento el adalimumab. Tras la interrupción del anti-TNF-α se ha descrito un empeoramiento paradójico de la tuberculosis (síndrome inflamatorio de reconstitución inmunitaria), que no se apreció en ninguno de nuestros pacientes.
Como conclusiones podemos resaltar que ni la quimioprofilaxis adecuada cuando la prueba de la tuberculina es positiva (caso 2) ni la negatividad de ésta (casos 1 y 2) son óbice para una vigilancia estrecha a fin de detectar la presencia de tuberculosis. La presentación atípica de tuberculosis puede provocar retraso diagnóstico. La presencia de paniculitis y leves cambios radiológicos en el caso 1 debería habernos conducido a una búsqueda exhaustiva de tuberculosis desde el principio. Son necesarios más datos para verificar si los pacientes con tuberculosis que han tomado adalimumab desarrollan más toxicidad hepática que el resto (2 de nuestros pacientes la presentaron), y si se precisa un seguimiento analítico ante el riesgo de hepatitis tóxica. Es de máxima importancia la comunicación a un observatorio de farmacovigilancia con la intención de recoger todos los casos y precisar la relación de cada uno de los anti-TNF con la presencia de las distintas complicaciones3,17.