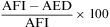La traqueobroncomalacia es una enfermedad de la vía aérea central que se caracteriza por debilidad de la pared y disminución dinámica de la luz de la tráquea y los grandes bronquios, especialmente durante la espiración. Es más frecuente en individuos de edad media y ancianos con exposición previa a cigarrillo. Genera síntomas crónicos, como tos, disnea, aumento de las infecciones recurrentes y mal tratamiento de las secreciones, pero también puede evolucionar hasta falla respiratoria crónica y muerte. Usualmente se confunde con otras enfermedades comunes, como enfermedad pulmonar obstructiva crónica (EPOC) o asma. Sus causas pueden ser congénitas o adquiridas y su diagnóstico involucra la evaluación dinámica de la vía aérea con tomografía y fibrobroncoscopia, y se clasifica en leve, moderada o grave, según el grado de colapso espiratorio de la vía aérea. El tratamiento contempla una primera fase, en la que se deben controlar las enfermedades concomitantes, como EPOC, asma o reflujo gastroesofágico. En la traqueobroncomalacia sintomática difusa moderada a grave se debe considerar la traqueobroncoplastia con reforzamiento de la pared posterior. Se pueden utilizar stents de silicona en Y para la identificación de pacientes que potencialmente se beneficiarían del tratamiento quirúrgico como también se pueden utilizar para tratamiento sintomático definitivo en pacientes con riesgo quirúrgico alto. Se necesita un mayor número de estudios prospectivos para poder unificar criterios comunes para el tratamiento de esta enfermedad, usualmente subdiagnosticada.
Tracheobronchomalacia is a central airway disease characterised by weakness of the wall and dynamic decrease in the tracheal lumen and the large bronchi, particularly while exhaling. It is more common in middle age and the elderly with previous exposure to cigarettes. It causes chronic symptoms such as cough, dyspnea, increase in recurrent infections, and poor secretion management, but it can also progress to chronic respiratory failure and death. It is usually confused with other common diseases like chronic obstructive pulmonary disease (COPD) or asthma. Its causes can be congenital or acquired and its diagnosis involves the dynamic assessment of the airway with tomography and fibrobronchoscopy. It is classified as mild, moderate or severe depending on the degree of collapse of the airway when exhaling. Management consists of a primary phase, in which concomitant diseases must be controlled, such as COPD, asthma or gastro-oesophageal reflux. In diffuse moderate to severe symptomatic tracheobronchomalacia tracheobronchoplasty must be considered with strengthening of the posterior wall. Silicone and “Y” stents can be used to identify patients who could potentially benefit from surgical treatment as well as being used for the definitive symptomatic treatment with high surgical risk. More prospective studies need to be done in order to standardise certain common criteria for the management of this usually under-diagnosed disease.
La palabra malacia proviene del griego “malakia”, que en términos médicos quiere decir ablandamiento del componente óseo o cartilaginoso de una estructura del organismo. La traqueobroncomalacia es una enfermedad de la vía aérea central, en la que se desarrolla debilidad de la pared de la tráquea y los bronquios por ablandamiento o destrucción de los cartílagos de soporte, que se puede acompañar o no de disminución del número y el tamaño de las fibras elásticas de la pared posterior, las que se aproximan estrechamente, especialmente durante la espiración1, y causan disminución de por lo menos el 50% del área transversal de la luz de la tráquea. La relación de cartílago/tejido blando en la tráquea normal es aproximadamente de 4,5:1, y en pacientes con traqueobroncomalacia puede llegar a ser tan baja como 2:1. En estudios histopatológicos se ha encontrado infiltrado inflamatorio, linfocitos T y antigeno leucocitario humano (HLA, human leukocyte antigen) clase ii expresado en los macrófagos2. La inmunohistoquímica del cartílago dañado depende de la gravedad del deterioro. En malacia grave el cartílago desaparece y el colágeno lo reemplaza. En pacientes con lesiones traqueales secundarias a ventilación mecánica (VM) prolongada, un tejido fibroso reemplaza el cartílago. Se describe, además, un deterioro tipo policondrítico, que es una forma de traqueobroncomalacia cartilaginosa, pero con excesivo componente inflamatorio, en el que los cartílagos muestran espacios vacíos e infiltrado inflamatorio mixto2.
La prevalencia de la traqueobroncomalacia en el adulto es desconocida porque los datos se derivan de estudios realizados en poblaciones seleccionadas y no en la población general. Según los estudios de Nuutinen3 llevados a cabo en la década de 1970, es más común en los hombres de edad media y ancianos con antecedente de exposición a cigarrillo. En un estudio japonés que involucró a 4.283 pacientes a los que se les realizó broncoscopia para evaluación de enfermedades respiratorias se describió traqueobroncomalacia en el 12,7% de los casos4. En otro estudio se diagnosticó en el 44% de los casos llevados a broncoscopia cuando se evaluó la población de pacientes con diagnóstico de bronquitis crónica5.
En la traqueomalacia, la obstrucción de la vía aérea es dinámica, por tanto, se puede presentar hiperinflación y atrapamiento de aire. Durante la espiración normal, el aumento de la presión intratorácica predispone al estrechamiento de la vía aérea, el que se contrarresta debido a la rigidez del árbol traqueobronquial, a la presión intraluminal y a las estructuras de soporte1. En la vía aérea malácica el aumento progresivo de la presión intratorácica excede la presión intratraqueal y lleva entonces a limitación al flujo aéreo que desencadena los síntomas, como disnea, dificultad para expulsar adecuadamente las secreciones, infecciones recurrentes y, ocasionalmente, falla respiratoria crónica1.
Es una enfermedad subdiagnosticada, en la que existen pacientes asintomáticos y otros con síntomas que se confunden frecuentemente con los de otras enfermedades respiratorias, como el asma y la enfermedad pulmonar obstructiva crónica (EPOC) (tabla 1)1. A pesar de ser una enfermedad benigna, debe tenerse en cuenta que puede causar morbilidad progresiva y, ocasionalmente, falla respiratoria y muerte1.
En la actualidad hay controversia con respecto a la diferenciación entre el colapso espiratorio normal de la vía aérea, el colapso dinámico excesivo de la vía aérea (CDEVA) y la traqueobroncomalacia2; algunos autores denominan traqueobroncomalacia al debilitamiento cartilaginoso de la vía aérea y CDEVA cuando hay sólo debilidad y redundancia de la pared posterior, pero hasta el momento, desde el punto de vista práctico, el enfoque del tratamiento de la traqueobroncomalacia y el CDEVA es el mismo cuando presentan manifestaciones clínicas graves, de hecho, en algunas oportunidades se encuentra una combinación de las 26.
ClasificaciónSe puede presentar en forma localizada o difusa, dañar sólo la tráquea (traqueomalacia), los bronquios (broncomalacia) o la tráquea y los grandes bronquios (traqueobroncomalacia)1. Existen varios esquemas de clasificación propuestos para la traqueobroncomalacia en el adulto. Según los hallazgos morfológicos, se pueden identificar las tráqueas con estrechamiento coronal de sus paredes laterales (denominada tráquea en forma de sable), con estrechamiento anteroposterior en forma de luna creciente o con reducción lateral y anteroposterior de la luz circunferencial o concéntrica (figs. 1 y 2), según el origen si se trata de una enfermedad congénita o adquirida o según la gravedad en leve, moderada o grave1.
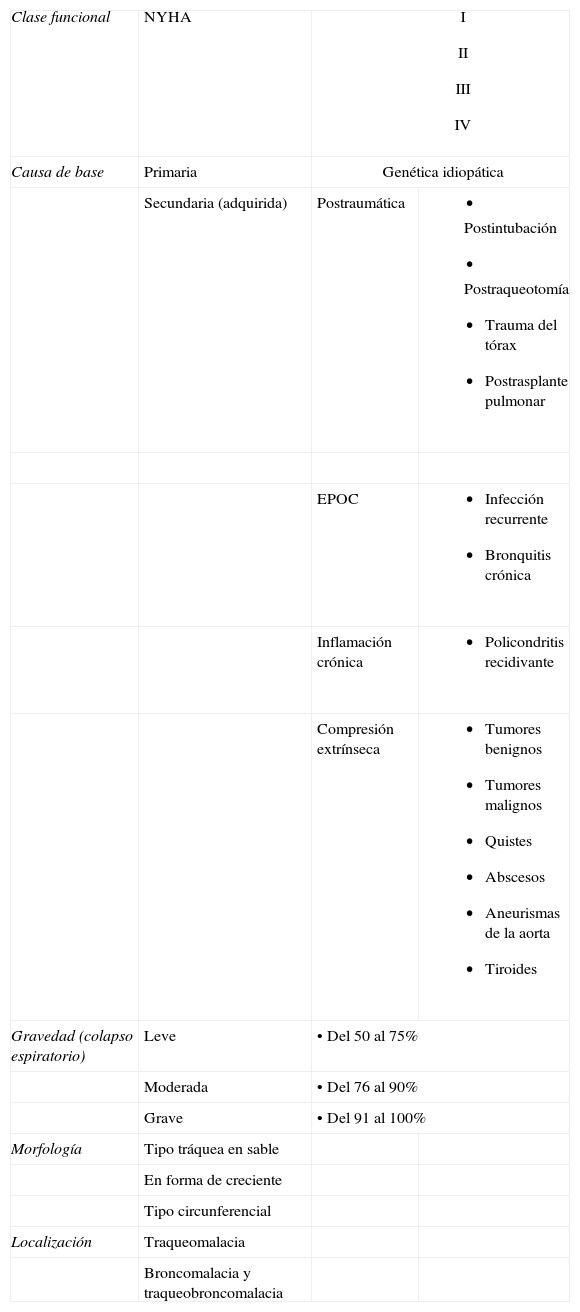
Murgu y Colt2 proponen una clasificación llamada FEMOS (functional class, etiology, morphology, origin, severity) (tabla 2)2. Este sistema tiene el inconveniente de no reflejar exactamente el curso clínico y el pronóstico. Carden et al propusieron otra clasificación similar frecuentemente usada en los estudios y las revisiones (tabla 3)1.
Clasificación de traqueobroncomalacia según Murgu y Colt2 FEMOS (functional class, etiology, morphology, origin, severity)
| Clase funcional | NYHA |
| |
| Causa de base | Primaria | Genética idiopática | |
| Secundaria (adquirida) | Postraumática |
| |
| EPOC |
| ||
| Inflamación crónica |
| ||
| Compresión extrínseca |
| ||
| Gravedad (colapso espiratorio) | Leve | •Del 50 al 75% | |
| Moderada | •Del 76 al 90% | ||
| Grave | •Del 91 al 100% | ||
| Morfología | Tipo tráquea en sable | ||
| En forma de creciente | |||
| Tipo circunferencial | |||
| Localización | Traqueomalacia | ||
| Broncomalacia y traqueobroncomalacia | |||
EPOC: enfermedad pulmonar obstructiva crónica; NYHA: New York Heart Association.
Clasificación de traqueobroncomalacia en adultos, según Carden et al1
| Primaria (congénita) | Genética | |
| Idiopática | Tráquea gigante o síndrome de Mounier-Kuhn | |
| Secundaria (adquirida) | Postraumática |
|
| Enfisema/EPOC | ||
| Infección crónica/bronquitis | ||
| Inflamación crónica | •Policondritis recidivante | |
| Compresión extrínseca de la tráquea |
| |
| Anillos vasculares |
EPOC: enfermedad pulmonar obstructiva crónica.
Traqueobroncomalacia congénita o primaria: de particular importancia en el adulto es la traqueobroncomegalia o el síndrome de Mounier-Kuhn, que es una de las pocas anormalidades de la tráquea que produce dilatación difusa de la vía aérea. La patogénesis de base se relaciona con defectos congénitos o atrofia del tejido muscular y elástico de la tráquea y de los bronquios centrales. Se manifiesta a menudo en hombres de edad media, el diagnóstico se hace en el 75% después de los 28 años. Usualmente son asintomáticos, pero cuando presentan síntomas, tienen tos crónica, producción de esputo, disnea y hemoptisis, dificultad en el tratamiento de las secreciones con infecciones recurrentes, desarrollo de bronquiectasias y, ocasionalmente, fibrosis pulmonar1.
En las imágenes, la tráquea y los bronquios centrales están marcadamente agrandados con diámetro de la tráquea mayor a 3cm y del bronquio derecho mayor de 2,4cm e izquierdo mayor de 2,3cm. La debilidad de la pared de la vía aérea entre los anillos lleva a la formación de pliegues o bolsas, lo que da aspecto corrugado con formación de divertículos y, por supuesto, colapso espiratorio1.
En 1973, Himal Stein et al clasificaron la enfermedad en 3 tipos: tipo 1 (agrandamiento sutil difuso y simétrico del árbol traqueobronquial), tipo 2 (agrandamiento más evidente con divertículos o configuración irregular excéntrica) y tipo 3 (divertículos y bolsas en la tráquea que se extienden a todo el árbol bronquial)7.
Traqueobroncomalacia postraumáticaTubos endotraqueales y traqueostomia: la utilización de tubos endotraqueales y traqueotomías puede producir estenosis traqueal. La intubación recurrente y la duración de la intubación pueden predisponer al desarrollo de traqueobroncomalacia, ésta es la causa más común de traqueomalacia focal adquirida en el adulto1. Su patogénesis tiene que ver con la presión ejercida por el manguito que daña el flujo sanguíneo y lleva a destrucción y a pérdida del cartílago de soporte con debilitamiento de la pared traqueal, usualmente es una malacia segmentaria8.
VM crónica a largo plazo: se describe como causa de malacia en niños cuando es por ventilación a presión positiva desde pocas semanas hasta meses, como por ejemplo en pacientes con atrofia muscular o distrofia con muchos años de VM con presión positiva vía traqueotomía. A pesar de usar tubos sin manguito, no se sabe si el deterioro miopático de la muscularis de la mucosa contribuye además a la dilatación y a la debilidad de la pared. Hasta ahora no se conoce cuál es la presión en la vía aérea crítica y el tiempo de uso de un ventilador para producir las lesiones. No hay descripciones de traqueobroncomalacia secundaria a uso crónico de VM no invasiva con presión positiva, esto es importante, porque usualmente la presión positiva continua en la vía aérea (CPAP, continuous positive airway pressure) funciona como un stent neumático8.
Trauma cerrado del tórax: después de trauma cerrado del tórax se pueden presentar lesiones por fracturas no identificadas de la tráquea, como por ejemplo cuando hay lesiones con el cinturón de seguridad1. Estas alteraciones pueden sanar como estenosis o malacia.
Postneumonectomía o lobectomía: la traqueomalacia asociada a neumonectomía o la lobectomía, especialmente de los lóbulos superiores, usualmente se detecta en el segmento por encima del sitio de anastomosis8. Los pacientes trasplantados del pulmón son susceptibles de tener alteraciones en el sitio de sutura y también distal a la anastomosis con posibilidad de malacia asociada. Éste se debe fundamentalmente a la isquemia sufrida por la mucosa bronquial en las primeras semanas postrasplante, ya que no se realiza en forma habitual la anastomosis de la arterial bronquial.
Por inflamación crónica: la policondritis recidivante es una enfermedad autoinmunitaria infrecuente que se caracteriza por episodios recurrentes de condritis e inflamación del tejido conectivo circundante del pabellón auricular, la nariz y el árbol traqueobronquial. Esta enfermedad afecta más frecuentemente a mujeres en edad media (el 50% tiene deterioro de la vía aérea y glotis). Característicamente, se observa destrucción y fibrosis del cartílago traqueal o bronquial con preservación de la pared posterior normal, y las complicaciones respiratorias infecciosas son la causa principal de muerte en estos pacientes9.
Por compresión extrínseca: los tumores extrínsecos pueden invadir, destruir y debilitar la pared traqueobronquial, y causar traqueobroncomalacia. Dentro de las entidades no malignas cabe destacar la asociación de la enfermedad con el bocio intratorácico y los aneurismas aórticos1.
Asociados a EPOC: algunos autores consideran la traqueobroncomalacia como una extensión de la obstrucción periférica de la vía aérea. Una proporción importante de pacientes con enfisema grave tiene algún grado de malacia de la vía aérea central. El debilitamiento de la pared puede estar relacionado con la lesión crónica secundaria a la exposición a cigarrillo o puede tener que ver con la hipermovilidad de las vías aéreas, como es usual en el enfisema8.
En 1958, Herzog demostró en pacientes con enfisema una invaginación exagerada de la pared posterior de los bronquios fuentes que causaba oclusión espiratoria de los lóbulos superiores, y propuso que este fenómeno podía estar en relación con la formación de las bulas1.
En 1972, se encontró EPOC en 24 de 35 pacientes con traqueobroncomalacia y se indicó que la presencia de la traqueobroncomalacia aceleraba la progresión del enfisema y la bronquitis crónica10. En estudios posteriores se ha descrito la asociación de traqueobroncomalacia y EPOC en el 57% de los pacientes estudiados. Sin embargo, no todo colapso de la vía aérea es traqueobroncomalacia y es importante diferenciarla del colapso dinámico “normal” de la vía aérea8.
Loring et al intentaron establecer la relación existente entre el colapso central de la vía aérea y su contribución a la limitación al flujo observada en pacientes con EPOC y asma11. En 80 pacientes con sospecha o comprobada traqueobroncomalacia se encontró que el 40% tenía EPOC y el 24% tenía asma, y no se encontró correlación entre el grado de obstrucción expresado por el volumen espiratorio forzado en el primer segundo (VEF1) y el colapso de la vía aérea central. En otros estudios similares se ha identificado también que el colapso de la tráquea contribuye modestamente a la resistencia total de la vía aérea11. Estudios recientes indican que los pacientes con EPOC pueden beneficiarse más de las intervenciones dirigidas a tratar la traqueobroncomalacia grave cuando se encuentra concomitante8.
DiagnósticoLos pacientes con traqueobroncomalacia presentan síntomas no específicos o síntomas que se sobreponen con los de las enfermedades más prevalentes, como la EPOC y el asma1. Por esta razón, el diagnóstico puede pasar desapercibido1.
Por otra parte, la evaluación radiológica usual del tórax no la detecta, ya que éste es un proceso dinámico que necesita imágenes más elaboradas con maniobras dinámicas especiales12.
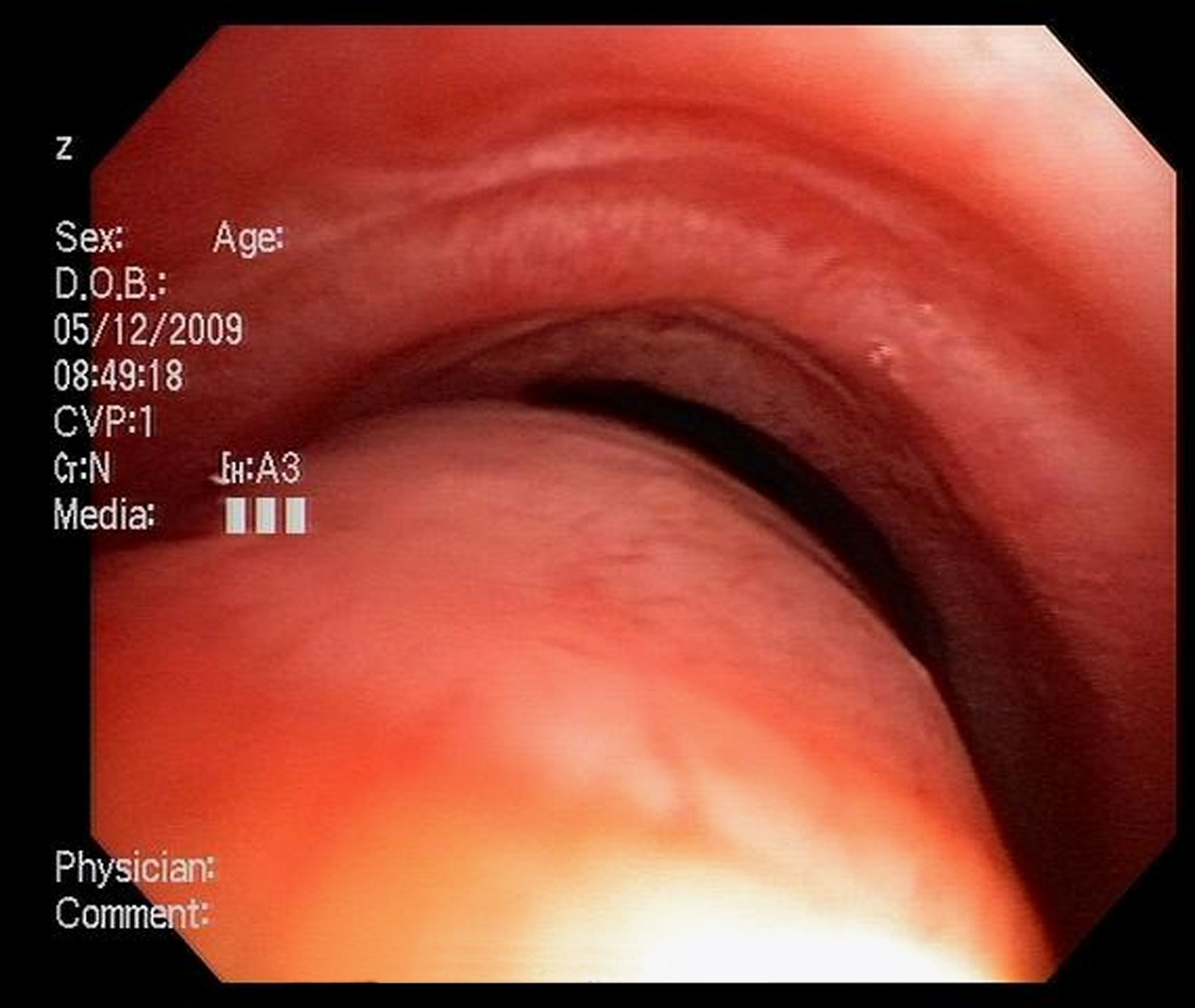
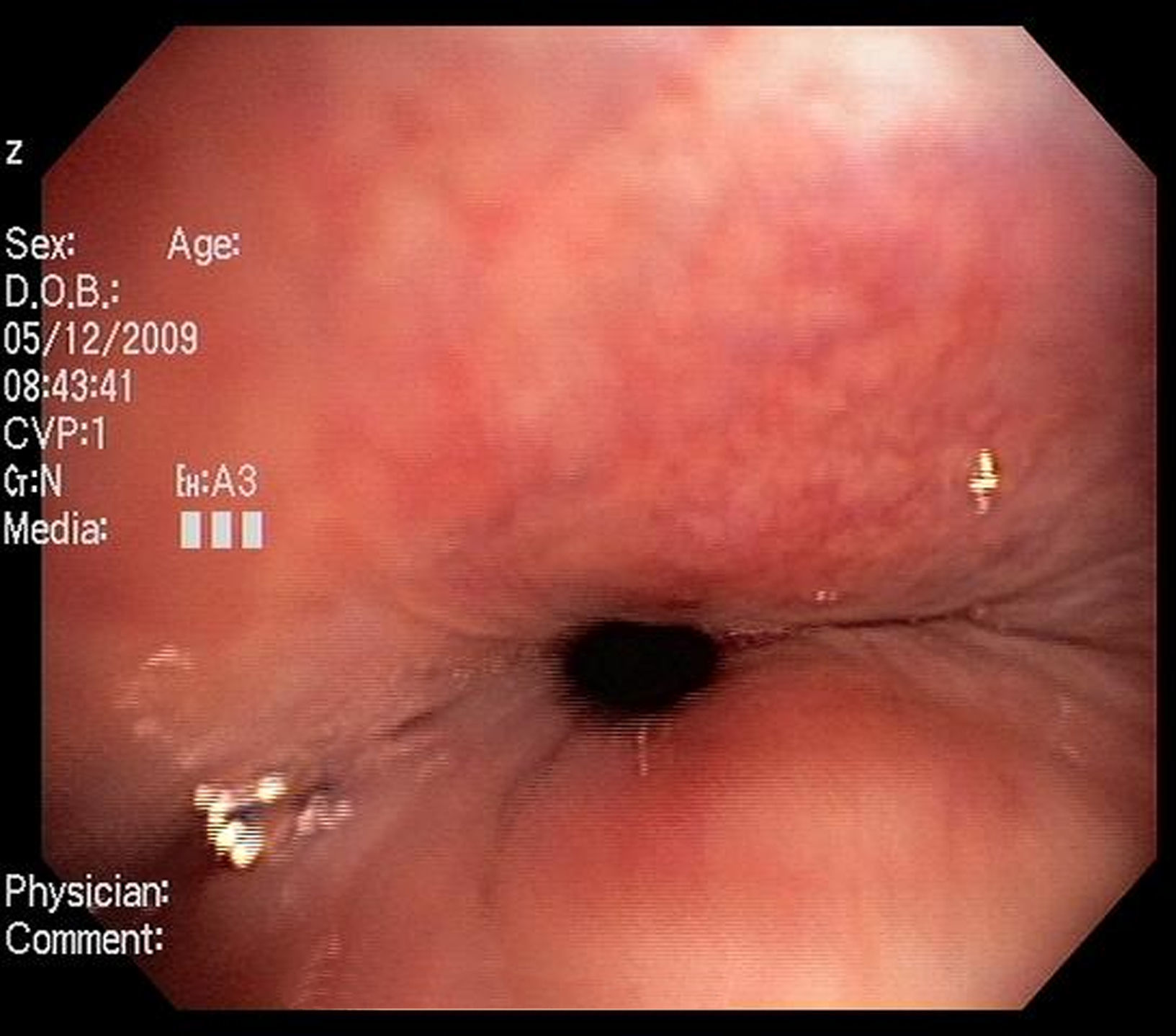
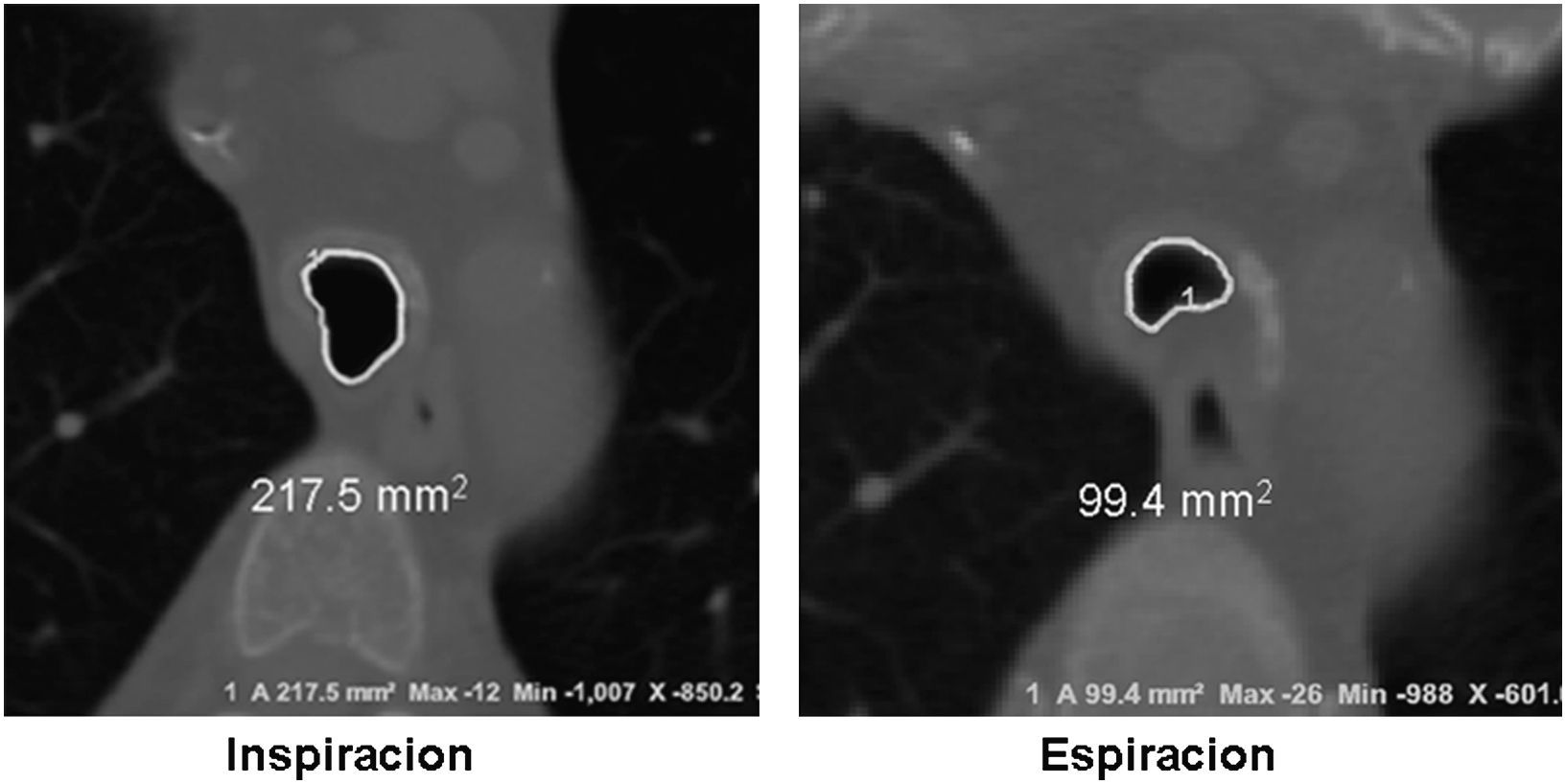
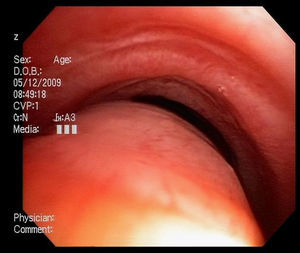
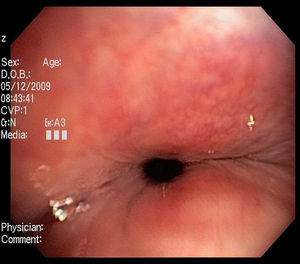
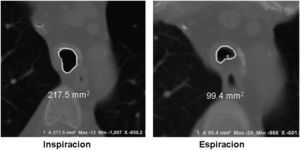
Imágenes: los estudios de imágenes tradicionales efectuados al final de la inspiración no evalúan el colapso cambiante de la vía aérea durante el ciclo respiratorio, es necesario tomar imágenes durante las 2 fases del ciclo y no al final de cada uno de ellos12. La tomografía computarizada (TC) es ideal para la evaluación no invasiva de esta entidad, especialmente las imágenes logradas con TC multidetector, con el que ahora es posible identificar la vía aérea central en pocos segundos y crear reconstrucciones tridimensionales con una excelente resolución espacial en tiempo real y posibilidad de medir el área de la vía aérea en diferentes momentos del ciclo respiratorio con maniobras, como la tos o la espiración profunda13,14 (fig. 3)17.
El protocolo de la TC dinámica de la vía aérea central que sigue el Departamento de Radiología de Beth Israel Deaconess Medical Center incluye imágenes al final de la inspiración y dinámicas durante la espiración tomadas en sentido cráneo caudal. Para calcular el porcentaje de colapso luminal, se sustrae el área espiratoria dinámica (AED) del área al final de la inspiración (AFI) y se divide por el AFI, posteriormente se multiplica por 1006,15,16. Se considera que hay malacia si el porcentaje de colapso luminal durante la espiración dinámica es mayor del 50%6,15,16.
En un estudio reciente, se evaluó a 29 pacientes con diagnóstico de traqueobroncomalacia y se comparó la escanografía dinámica de la vía aérea con el gold standard: la broncoscopia dinámica. El diagnóstico correcto por escanografía se hizo en el 97% de los casos (28 de 29 pacientes), esto indica que la escanografía dinámica de la vía aérea es un método altamente sensible para detectar malacia de la vía aérea18.
La resonancia magnética nuclear de la vía aérea central con y sin esfuerzo respiratorio también puede cumplir los objetivos de medir el índice de colapsabilidad de la vía aérea, según estudios recientes8.
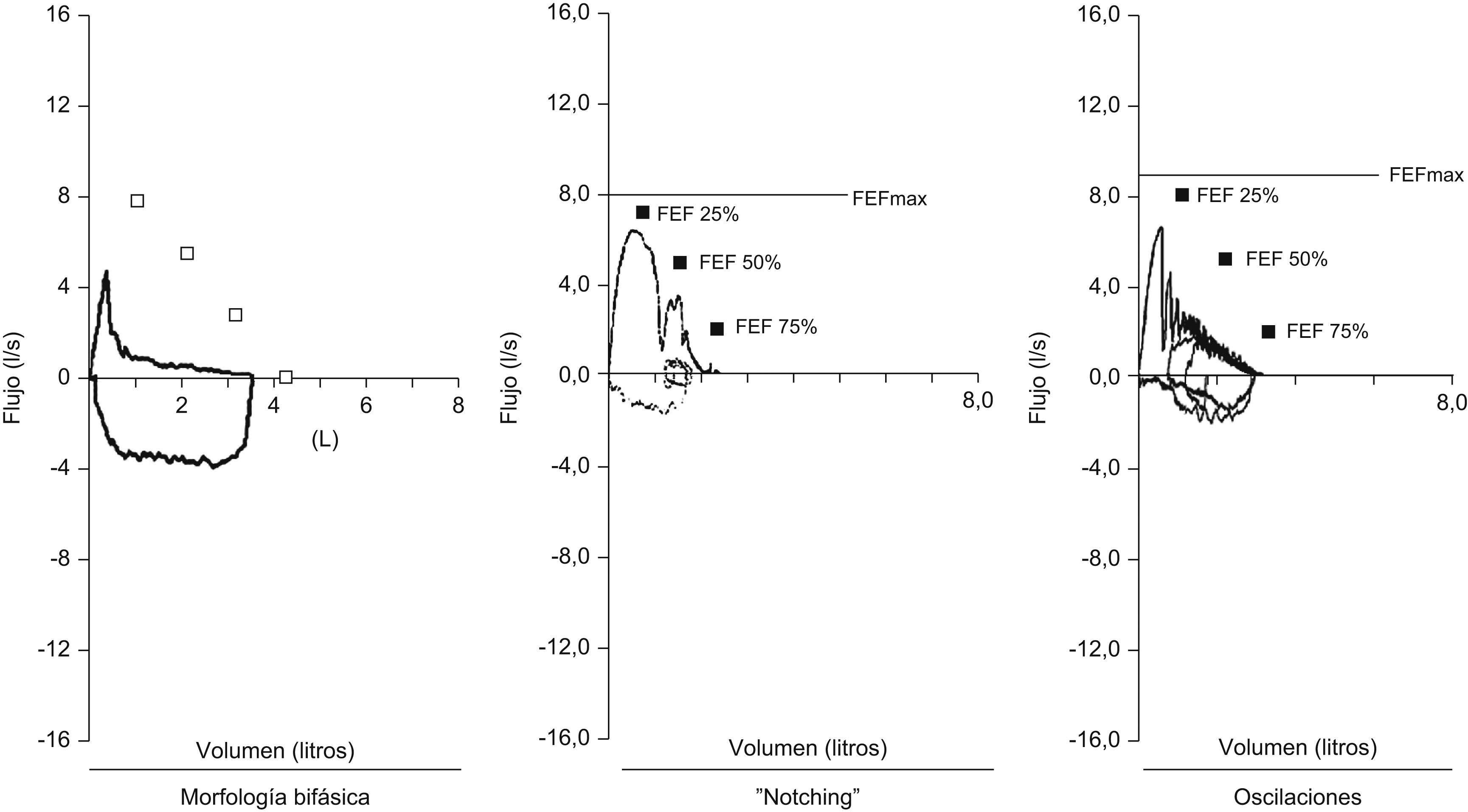
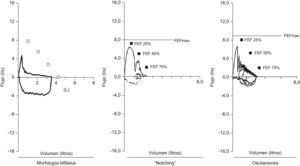
Pruebas de función pulmonar: la utilidad de las pruebas de función pulmonar en el diagnóstico de traqueobroncomalacia es limitada. Se describe una morfología bifásica caracterizada por la disminución rápida del flujo espiratorio máximo después del pico inicial, en relación con el colapso de la vía aérea central secundario a la presión transmural negativa1, notching de la curva espiratoria, oscilaciones en la curva (fig. 4)1 y reducción de la ventilación voluntaria máxima. No se pueden diferenciar los hallazgos descritos en traqueobroncomalacia con los del colapso dinámico aumentado de la vía aérea, la apnea obstructiva del sueño y las alteraciones neuromusculares de la laringe13.
Recientemente se reportó que el colapso de la vía aérea central no se correlaciona con el grado de obstrucción expresado en el VEF1; el deterioro de la tráquea y los grandes bronquios puede estar presente independientemente de la obstrucción identificada en el VEF16,11.
Broncoscopia: la visualización del colapso dinámico de la vía aérea es el gold standard para el diagnóstico de traqueobroncomalacia1,6. Se prefiere la fibrobroncoscopia, en la que el individuo pueda respirar espontáneamente con sedación superficial y seguir instrucciones para identificar el comportamiento de la tráquea durante la respiración espontánea6,15.
Se considera traqueobroncomalacia leve si el estrechamiento de la luz es del 50 al 75%, moderado si es del 76 al 90% y grave si es del 91 al 100%, es decir, si hay contacto de las paredes anterior y posterior6,15. Se utilizan maniobras, como la inspiración profunda y la espiración forzada y se toman imágenes y medidas en diferentes puntos del árbol bronquial examinado6,15.
El protocolo de fibrobroncoscopia dinámica seguido en el Beth Israel Deaconess Medical Center para diagnóstico de traqueobroncomalacia está descripto en la tabla 46,15, incluye evaluación en la tráquea superior a la altura del cartílago cricoides, en la tráquea media a 5cm de la carina, en la tráquea distal a 2cm de la carina, en los bronquios fuentes y en el bronquio intermediario durante el ciclo respiratorio.
Protocolo de fibrobroncoscopia dinámica
| Laringe | ||||
| Edema | Leve | |||
| Sí | Moderado | |||
| Grave | ||||
| No | ||||
| Tráquea | ||||
| Tráquea proximal a la altura del cricoides | ||||
| Normal (<50%) | Leve (51–75%) | Moderada (76–90%) | Grave (>90%) | |
| Inspiración | ||||
| Espiración | ||||
| Tráquea media a 5cm de la carina | ||||
| Espiración | ||||
| Tráquea distal a 2cm de la carina | ||||
| Espiración | ||||
| Bronquio fuente derecho | ||||
| Espiración | ||||
| Bronquio intermedio proximal | ||||
| Espiración | ||||
| Bronquio fuente izquierdo | ||||
| Espiración | ||||
| Otros | ||||
| Inspiración | ||||
| Espiración | ||||
Según recomendaciones de la División de Neumología Intervencionista del Beth Israel Deaconess Medical Center, Boston, MA.
No hay guías definidas de tratamiento para la traqueobroncomalacia. Los pacientes asintomáticos con diagnóstico incidental no requieren tratamiento. La identificación de individuos sintomáticos que se beneficiarán con las diferentes alternativas de intervención no deja de ser un desafío15.
Tratamiento inicial: la primera línea de tratamiento es el control de los síntomas de las enfermedades de base concomitantes. En la mayoría de los casos es suficiente con las medidas de soporte iniciales, como suspensión del cigarrillo, tratamiento efectivo de las infecciones respiratorias, rehabilitación y técnicas de respiración y relajación, medidas no farmacológicas para el reflujo gastroesofágico, tratamiento de las alteraciones en el tracto respiratorio superior, identificación y tratamiento de la apnea obstructiva del sueño1.
Tratamiento farmacológico: antes de intentar cualquier intervención más intensiva, es de particular importancia el tratamiento farmacológico óptimo de las enfermedades asociadas. Especialmente, el tratamiento del broncoespasmo en la EPOC o el asma, que promueve variaciones importantes de la presión intratorácica y empeoramiento del colapso de la tráquea y de los grandes bronquios con malacia.
El tratamiento para el reflujo gastroesofágico y enfermedades como la policondritis, en la que se incluyen los antiinflamatorios no esteroideos en la enfermedad leve o los esteroides en dosis progresivas en formas más graves, disminuye la frecuencia y la gravedad de las recurrencias, pero no detiene la pérdida tardía del cartílago de soporte y no tiene influencia en la sobrevida8.
Ventilación no invasiva con presión positiva en la vía aérea: cuando las medidas anteriores no funcionan o se presentan exacerbaciones con mayor frecuencia, se puede intentar la utilización de CPAP, que actúa como un stent neumático. La presión positiva reduce la resistencia pulmonar y el trabajo respiratorio, mantiene la vía aérea abierta y mejora el flujo espiratorio.
Se necesitan estudios controlados para confirmar los beneficios de esta intervención, se recomienda el uso de CPAP nasal intermitente en el día y el uso continuo durante la noche. La presión positiva estabiliza al paciente y sirve como tratamiento puente hacia otras alternativas más específicas, como colocación de stent en la vía aérea o cirugía1.
Stents: hay 3 tipos de stents disponibles: metálicos, de silicona e híbridos. Desafortunadamente, hasta el momento no existe el stent ideal.
Los stents restauran la arquitectura endoluminal de la vía aérea, la mantienen abierta y mejoran los síntomas y la función ventilatoria. Los cambios constantes del tamaño y la forma de la obstrucción en la traqueobroncomalacia hacen que con frecuencia los stents migren o se fracturen. Además, existen otras potenciales complicaciones, como la formación de tejido de granulación y los tapones muco. En general, las complicaciones con los stents de silicona para tratamiento de la traqueobroncomalacia difusa han disminuido con la implementación del uso de stents en forma de Y y el uso concomitante de N-acetilcisteína y guafenesina6,15.
En un estudio reciente, Ernst et al15 evaluaron prospectivamente el efecto del stent de silicona en Y en 75 pacientes con diagnóstico de traqueobroncomalacia difusa grave. Evaluaron síntomas, calidad de vida, función pulmonar y tolerancia al ejercicio antes y a los 14 días postintervención. El stent se usó como alternativa única de tratamiento en algunos casos o como tratamiento puente hacia la traqueobroncoplastia definitiva6,15. Se identificaron beneficios en calidad de vida, pruebas funcionales y disminución de la disnea, pero encontraron una alta frecuencia de complicaciones relacionadas con el stent6,15.
Los stents en la vía aérea deben considerarse sólo en pacientes con síntomas graves con seguimiento adecuado que pueda anticipar y corregir las complicaciones relacionadas con el stent. En individuos con enfermedad grave que sean candidatos para corrección quirúrgica, el stent se usa como primer paso para identificar los beneficios de la estabilización o la normalización de la vía aérea.
Por otra parte, se aceptan los stent como tratamiento a largo plazo en aquellos pacientes con mejoría sintomática que no son candidatos al tratamiento quirúrgico, con vigilancia estrecha para identificar las complicaciones y lograr mejorar la calidad de vida1,6,15.
Cirugía: la meta del tratamiento quirúrgico es estabilizar la pared membranosa de la tráquea intratorácica, los bronquios fuentes y el bronquio intermedio. Actualmente, para casos seleccionados la cirugía indicada es la traqueobroncoplastia. En este procedimiento se hace una plicatura y un reforzamiento con malla de marlex de la pared redundante posterior para prevenir la protrusión espiratoria hacia la luz de la vía aérea. Con el tiempo, la malla se incorpora a la pared con el subsecuente endurecimiento de la parte membranosa15.
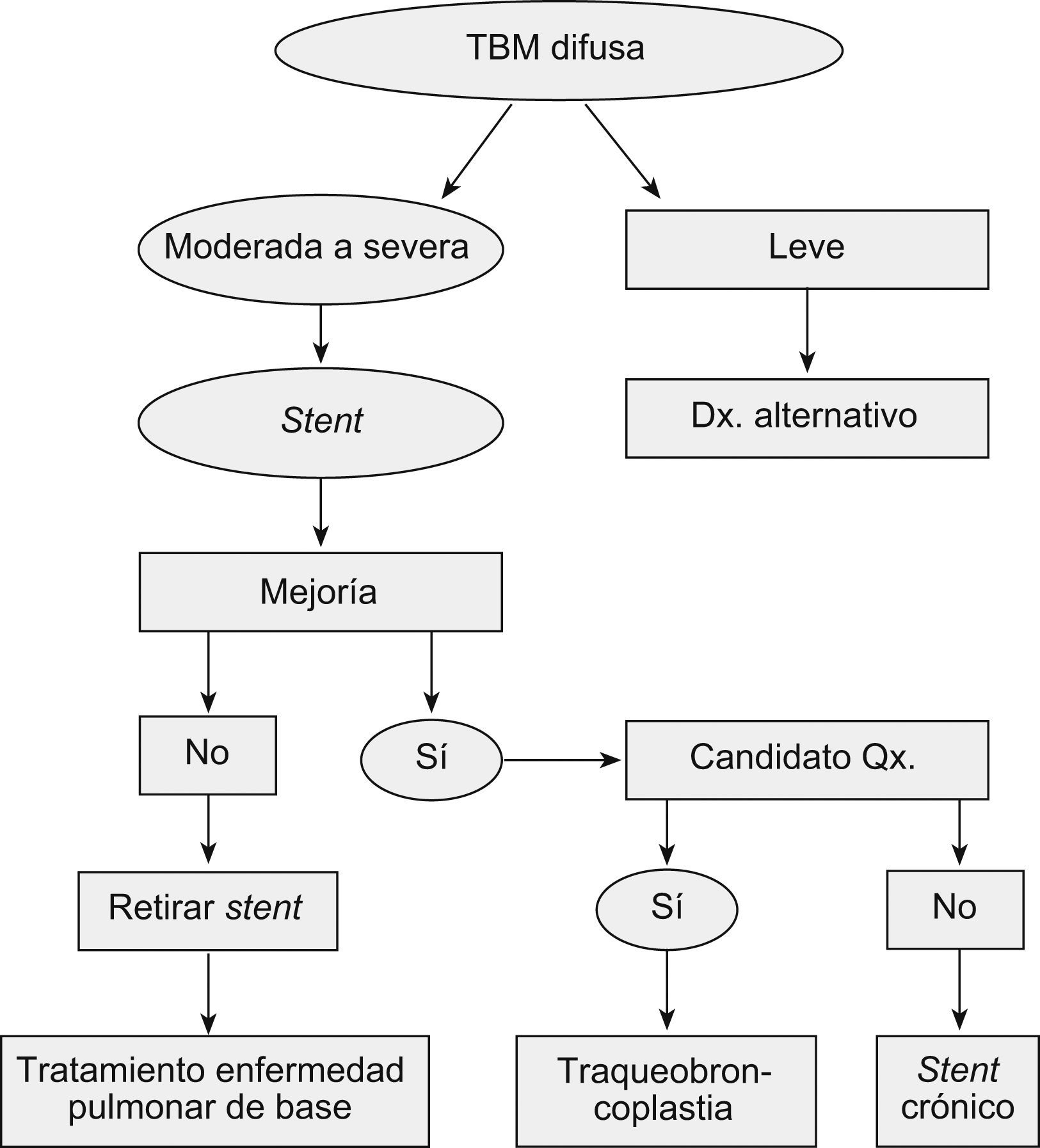
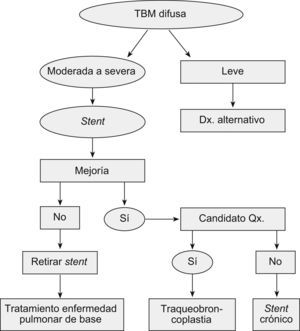
Majid et al15 recientemente reportaron la más grande serie de casos de traqueobroncomalacia difusa grave, llevados a estabilización de la vía aérea central con traqueobroncoplastia mediante el uso de malla de marlex. Hubo mejoría de los síntomas, la calidad de vida, el estado funcional y la capacidad de ejercicio con resultados estadísticamente significativos en los 35 pacientes seleccionados con enfermedad grave15. Además, propusieron un algoritmo de tratamiento y seguimiento que incluía la utilización del stent en Y para identificar a los pacientes que se beneficiarían de la cirugía (si son potencialmente operables) o, en su defecto, para tratamiento crónico (fig. 5)15.
Otras alternativas de tratamiento quirúrgico son la reconstrucción laringotraqueal, la resección traqueal con reconstrucción y la traqueostomia, que puede ser una alternativa para sobrepasar el segmento malácico y facilitar, además, el tratamiento de secreciones y la aplicación de presión positiva en la vía aérea14,15.
ConclusionesLos progresos en las técnicas de imágenes y el desarrollo de la broncoscopia intervencionista han mejorado el entendimiento, el reconocimiento y el tratamiento de la traqueobroncomalacia en el adulto.
Aún hay trabajo por hacer en el campo de la unificación de los criterios de clasificación, de diagnóstico y guías de tratamiento con estudios prospectivos que clarifiquen las dudas actuales. Las intervenciones mínimamente invasivas disponibles y los procedimientos quirúrgicos sólo se pueden utilizar hasta ahora en casos seleccionados y en centros médicos de referencia.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.