Los autoanticuerpos séricos apoyan el diagnóstico de sospecha en la enfermedad intersticial difusa (EPID) asociada a enfermedades autoinmunes sistémicas (EPID-EAS). Su presencia en el lavado broncoalveolar (LBA) no ha sido estudiada.
ObjetivosDemostrar la presencia de autoanticuerpos en el LBA de pacientes con EPID de inicio, compararlos con los resultados del suero y analizar los aspectos clínicos de los pacientes con autoanticuerpos en el LBA.
MétodosSe analizaron autoanticuerpos contra antígenos extraíbles del núcleo (ENA) mediante inmunoblot en el LBA de 155 pacientes con sospecha diagnóstica de EPID y 10 controles.
ResultadosSe detectaron 7 especificidades ENA en el LBA de 19 pacientes (anti-Ro52, anti-Ro60, CENP-B, anti-La, Jo-1, Sm/RNP y anti-SL70), siendo el anti-Ro52 el más frecuente (13 pacientes; 68,4% de los positivos). Siete pacientes presentaron más de una especificidad. Catorce fueron diagnosticados de EPID-EAS, 3 de neumonía intersticial con rasgos autoinmunes, uno de neumonía intersticial no específica idiopática y otro de silicosis. En 10 casos (52%) se detectaron autoanticuerpos de clase IgA en el LBA. Los autoanticuerpos detectados en LBA también se hallaron en el suero de 17 pacientes (90%). No hubo diferencias clínicas significativas entre los pacientes con autoanticuerpos en LBA con respecto a aquellos con EPID-EAS o neumonía intersticial con rasgos autoinmunes con LBA negativo.
ConclusiónEl estudio de ENA en LBA es factible y puede ser una herramienta útil en el algoritmo inicial en la EPID, concretamente, para apoyar el diagnóstico de sospecha de la EPID-EAS.
Serum autoantibodies support the diagnosis of interstitial lung disease (ILD) related to systemic autoimmune diseases (SAD-ILD). Nevertheless, their presence in the bronchoalveolar lavage (BAL) has not been explored.
ObjectivesTo demonstrate the presence of autoantibodies in the BAL of ILD patients at onset of clinical evaluation, its relation with serum autoantibodies and to analyze clinical features of patients with autoantibodies in BAL.
MethodsAutoantibodies against extractable nuclear antigens (ENAs) were analyzed by immunoblot in the BAL of 155 patient with suspected diagnosis of ILD and 10 controls.
ResultsSeven ENAs were detected in the BAL of 19 patients (Anti-Ro52, Anti-Ro60, CENP-B, Anti-La, Jo-1, Sm/RNP and Anti-SL70). The most frequent ENA was anti-Ro52 (13 patients; 68,4% of positives ones). Seven patients presented more than one ENAs. Fourteen were diagnosed of SAD-ILD, 3 of interstitial pneumonia with autoimmune features, one of non-specific idiopathic pneumonia and other of silicosis. In 10 cases (52%) IgA autoantibodies were also detected. The autoantibodies observed in BAL were also detected in the serum of 17 patients (90%). There were no significant clinical differences with the patients with SAD-ILD or interstitial pneumonia with autoimmune features with patients with negative BAL.
ConclusionThe study of ENAs in BAL is feasible and can be a useful tool in the ILD initial algorithm, specifically sustaining the suspected diagnosis of SAD-ILD.
La heterogeneidad de las diferentes entidades que conforman la enfermedad pulmonar intersticial difusa (EPID) hace que para llegar a un diagnóstico de certeza se requiera un estudio secuencial y sistematizado con una aproximación diagnóstica multidisciplinar1–3. En la presentación inicial de un paciente con EPID se deben considerar varios aspectos. Estas entidades pueden compartir características clínicas, funcionales o radiológicas similares2. De hecho, siempre hay que descartar una causa subyacente de EPID no diagnosticada previamente (como las enfermedades autoinmunes sistémicas [EAS]).
Es por ello que la incorporación de herramientas que añadan información útil al algoritmo diagnóstico de las EPID es fundamental. Los autoanticuerpos son los principales biomarcadores en el diagnóstico de la EPID relacionada con las EAS4. Su detección puede apoyar un diagnóstico de sospecha y, en algunos casos, son predictores de la evolución de la enfermedad5. Habitualmente, los autoanticuerpos se estudian en suero, pero también pueden ser aislados en otras matrices biológicas y se ha demostrado su síntesis in situ en múltiples tejidos6,7. Partiendo de esta premisa y de la descripción de centros germinales en el epitelio pulmonar en pacientes con EAS8, formulamos la hipótesis de que los autoanticuerpos pueden ser detectados también en el lavado broncoalveolar (LBA) de pacientes con EPID. El objetivo principal del estudio fue identificar diferentes autoanticuerpos frente a antígenos nucleares extraíbles (ENA) en el LBA de pacientes con sospecha diagnóstica de EPID. Como objetivo secundario se planteó relacionar la presencia de estos autoanticuerpos en LBA y suero, con parámetros clínicos, radiológicos y funcionales respiratorios.
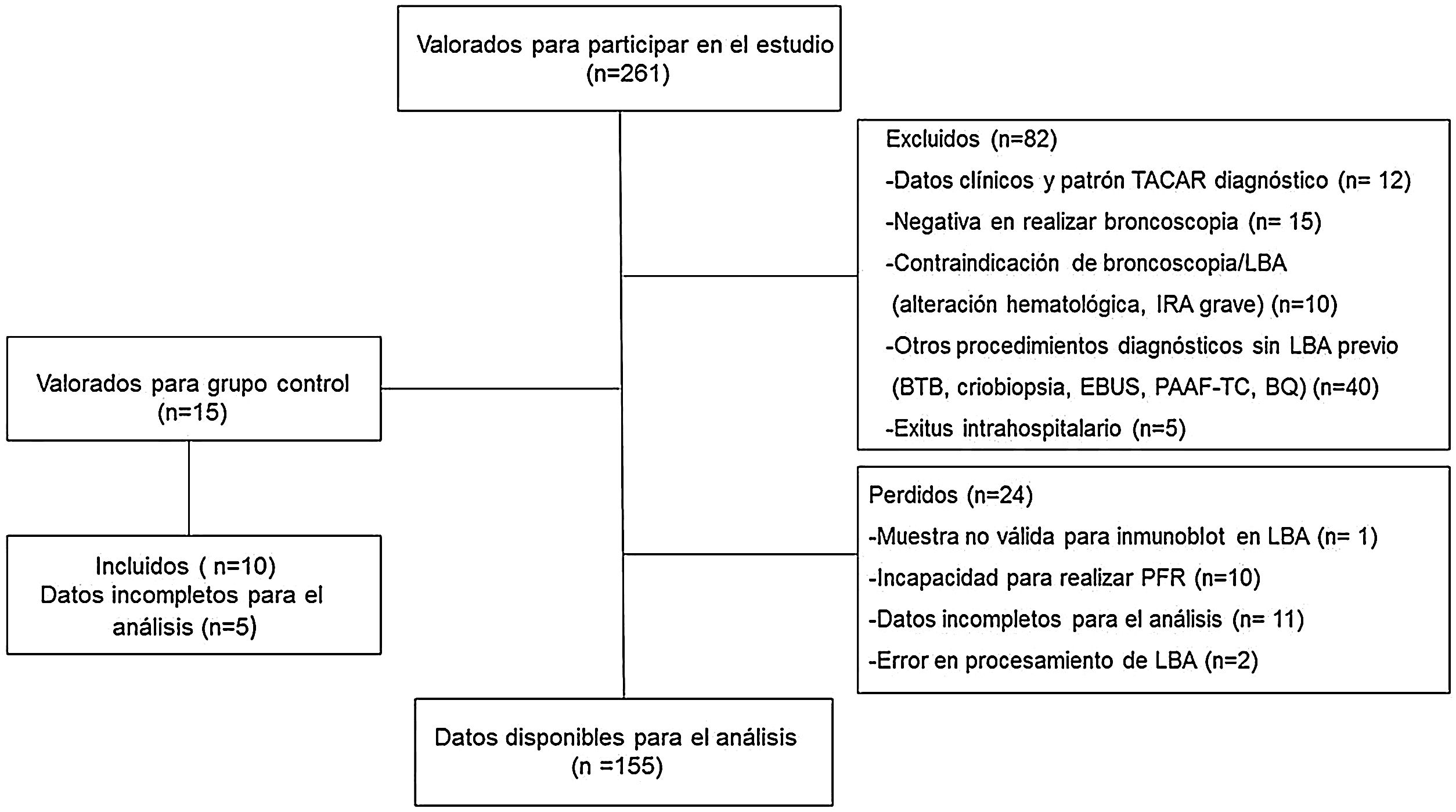
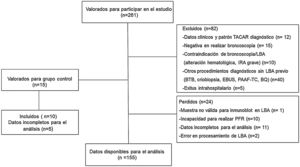
Material y métodosInclusión de pacientes y recogida de muestras de LBAEstudio prospectivo longitudinal observacional. Los criterios de inclusión fueron los siguientes: pacientes≤80 años con sospecha inicial de EPID, atendidos en la consulta monográfica o ingresados por esta causa en 2 hospitales universitarios entre los años 2014 y 2019. Los pacientes que presentaban un diagnóstico de EAS sin evidencia previa de EPID fueron también valorados para su inclusión. Las muestras de LBA en los controles procedían de pacientes que requirieron exploración con fibrobroncoscopia por hemoptisis minor, sin evidencia por tomografía axial computarizada de alta resolución de enfermedad parenquimatosa. La figura 1 resume, mediante un diagrama de flujo, los pacientes incluidos y excluidos.
Los parámetros clínicos, radiológicos y anatomopatológicos fueron revisados por el comité multidisciplinar de EPID de los centros participantes. El diagnóstico de EPID y de neumonía intersticial con rasgos autoinmunes (IPAF) se estableció de acuerdo con los documentos de consenso de la ATS/ERS9–12. El diagnóstico de EAS fue establecido según los criterios de ACR/EULAR13–17.
Se incluyeron las siguientes variables: datos demográficos, historia de tabaquismo, antecedentes patológicos personales, familiares, laborales, de exposición ambiental, características clínicas funcionales y radiológicas.
La espirometría forzada, la medición de volúmenes pulmonares, la capacidad de difusión del monóxido de carbono y la prueba de la marcha de 6 minutos fueron realizadas de acuerdo con las recomendaciones internacionales, utilizando los valores de referencia publicados por Roca et al.18–21. El Composite Physiologic Index se calculó mediante la fórmula descrita por Wells et al.22.
El LBA se obtuvo a través de un fibrobroncoscopio flexible, mediante la técnica estandarizada descrita previamente23. Brevemente, el extremo del broncoscopio flexible se enclavó en el bronquio segmentario/subsegmentario de la zona parenquimatosa con mayor afectación, habitualmente en el lóbulo medio o língula. Las 3 alícuotas recogidas fueron de 50ml, de suero a temperatura corporal para la mejor tolerancia del paciente. Para el estudio de los autoanticuerpos se utilizó la tercera alícuota. Las muestras centrifugadas se conservaron congeladas a −20°C en alícuotas de 1,5ml hasta su uso.
El estudio fue aprobado por el comité ético de cada hospital (n.o de registro PI-20-209 y 2018501) y todos los pacientes incluidos firmaron un consentimiento informado. Los derechos de los pacientes fueron protegidos por la Declaración de Helsinki.
Determinación de autoanticuerpos en sueroLos anticuerpos antinucleares (ANA) se determinaron mediante inmunofluorescencia indirecta (IFI) sobre células HEp-2 (INOVA Diagnostics Inc., Barcelona, España). Los ENA se estudiaron mediante CLIA, QUANTA Flash® ENA 7 (Jo-1, Scl-70, SSB, Ro-52, SSA, Sm y Sm/RNP) y QUANTA Flash® Centromere (CENP-B) (INOVA Diagnostics Inc., Barcelona, España). Los sueros positivos fueron verificados mediante el inmunoblot Euroline ANA Profile (Euroimmun, Lübeck, Alemania).
Determinación de autoanticuerpos en LBALos ENA se estudiaron mediante el inmunoblot Euroline ANA Profile en un automatizador EUROBlotMaster (ambos de Euroimmun, Lübeck, Alemania). Los resultados obtenidos se escanearon e interpretaron mediante el software EUROLineScan system (Euroimmun, Lübeck, Alemania), que permite obtener resultados semicuantitativos. Este método posibilita la detección simultánea de los siguientes anticuerpos: AMA-2, ribosomal-p, histonas, nucleosoma, dsADN, PCNA, CENP-B, Jo-1, PM100, Scl-70, SSB, Ro-52, SSA, Sm y Sm/RNP. Se aplicaron 2 modificaciones respecto al protocolo del proveedor:
1) La dilución óptima se estableció mediante diluciones seriadas. Algunas muestras mantuvieron la positividad a una dilución equivalente a la del suero (1/100); sin embargo, las positividades menos intensas pueden perderse a partir de la dilución 1/10, por lo que se estableció que las muestras debían procesarse sin diluir.
2) Se utilizó en paralelo un conjugado IgA además del IgG.
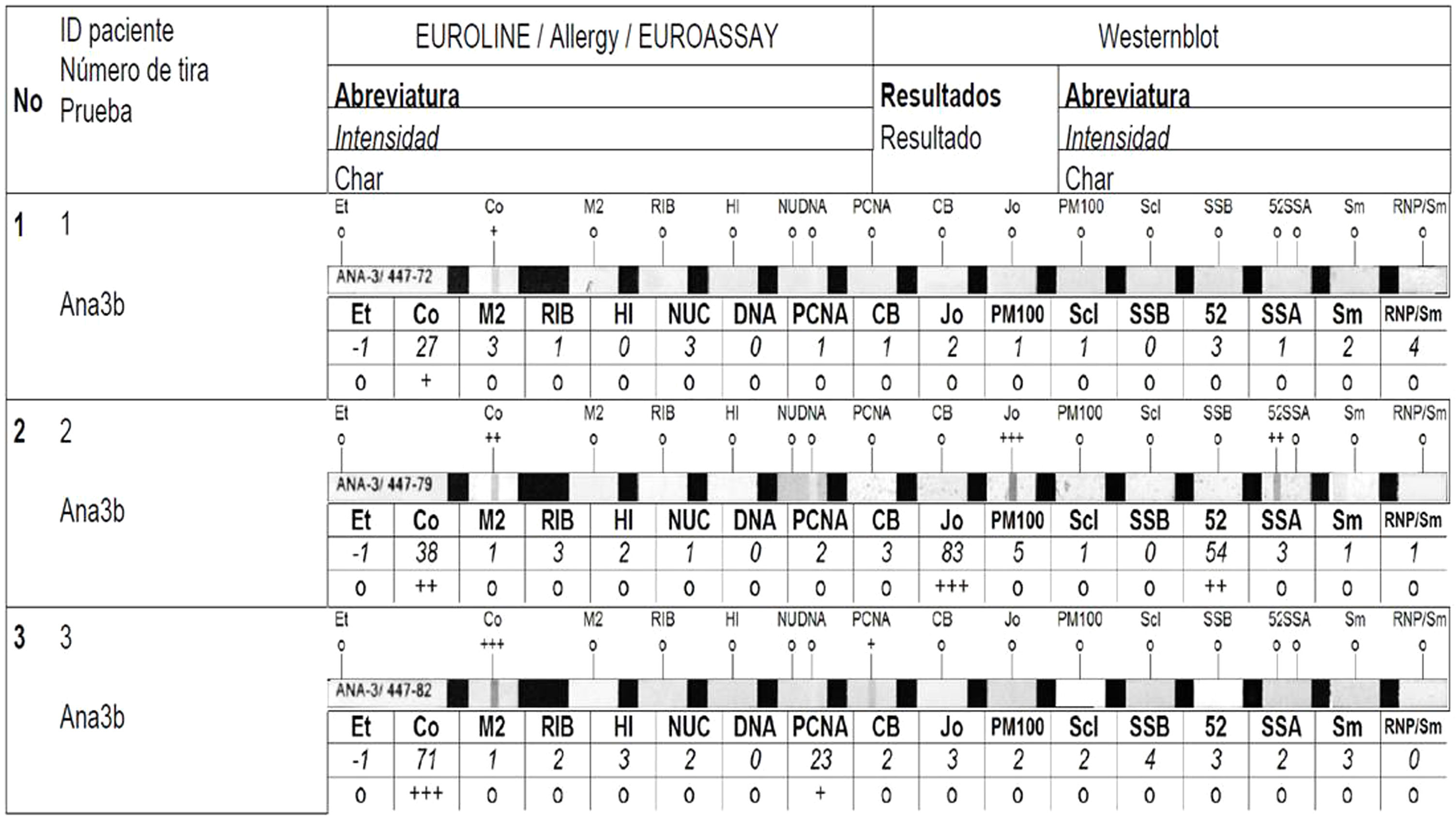
Para evitar considerar como positivos artefactos de tinción, se estableció que solamente las bandas que el software de análisis catalogara como intensidad media (++) o elevada (+++) serían consideradas como positivas (fig. 2).
Las muestras positivas fueron confirmadas mediante IFI sobre células HEp-2 con una dilución 1/1 (INOVA Diagnostics Inc., Barcelona, España). Los patrones ANA se informaron según la nomenclatura ICAP24.
Análisis estadísticoSe realizó un análisis descriptivo de los datos. Los resultados de las variables cuantitativas se expresaron como media±desviación estándar o mediana con rango intercuartílico. Se utilizaron porcentajes y frecuencias absolutas para las variables cualitativas. En el caso de las variables cuantitativas o cualitativas ordinales, previamente se utilizó un test de normalidad de la varianza (test de Kolmogorov-Smirnov). Cuando la distribución de las variables fue normal se prosiguió con un test de comparación de medias (t de Student para muestras independientes). Cuando la distribución fue no normal, se utilizó el equivalente no paramétrico (U de de Mann-Whitney para muestras independientes). En el caso de las variables cualitativas, se utilizaron tablas de contingencia y el estadístico chi-cuadrado de Pearson. La variable dependiente fue la presencia o no de ENA en el LBA. El resto de los parámetros fueron las variables independientes. Un valor de p inferior a 0,05 fue considerado como estadísticamente significativo. Los análisis fueron realizados utilizando el paquete estadístico SPSS® 14.0 (IBM SPSS Statistics, Armonk, NY, EE. UU.).
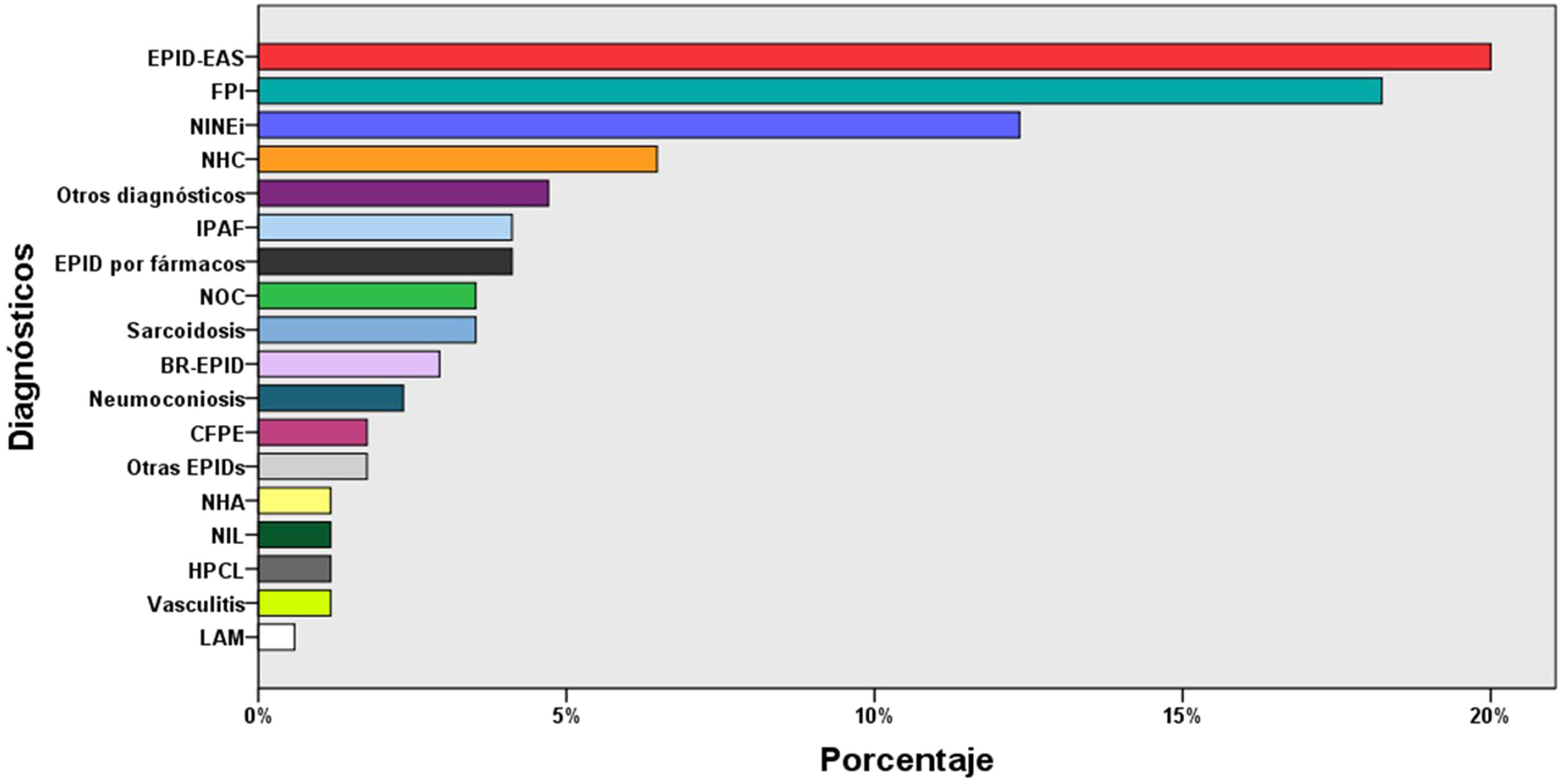
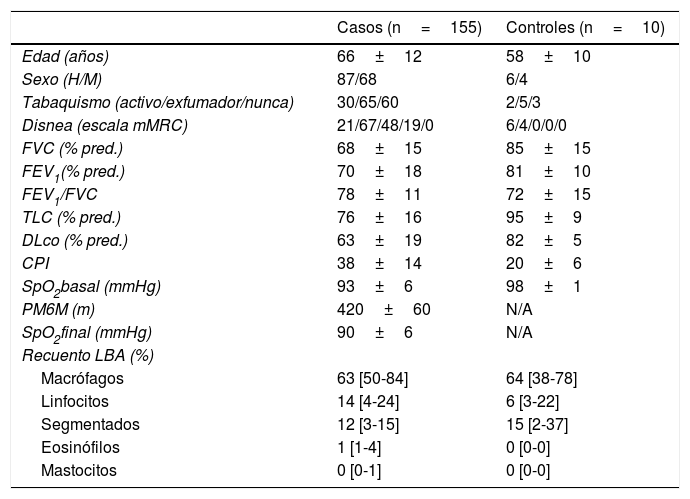
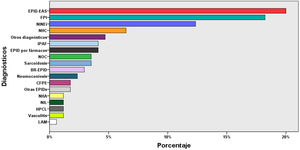
ResultadosCaracterísticas de los pacientesSe incluyeron 155 pacientes, de los cuales 87 eran varones (56,1%), con una edad media de 66±12 años, y 10 controles, de los cuales 6 eran varones (60%), con una edad media de 58±10 años. Los datos clínicos, funcionales y el recuento celular del LBA de estos pacientes se resumen en la tabla 1. Los diagnósticos más frecuentes fueron: EPID-EAS (36 pacientes; 23%), fibrosis pulmonar idiopática (31; 20%) y neumonía intersticial no específica idiopática (20; 13,5%) (fig. 3).
Datos demográficos, funcionales y recuento celular en el lavado broncoalveolar de los pacientes incluidos y de los controles
| Casos (n=155) | Controles (n=10) | |
|---|---|---|
| Edad (años) | 66±12 | 58±10 |
| Sexo (H/M) | 87/68 | 6/4 |
| Tabaquismo (activo/exfumador/nunca) | 30/65/60 | 2/5/3 |
| Disnea (escala mMRC) | 21/67/48/19/0 | 6/4/0/0/0 |
| FVC (% pred.) | 68±15 | 85±15 |
| FEV1(% pred.) | 70±18 | 81±10 |
| FEV1/FVC | 78±11 | 72±15 |
| TLC (% pred.) | 76±16 | 95±9 |
| DLco (% pred.) | 63±19 | 82±5 |
| CPI | 38±14 | 20±6 |
| SpO2basal (mmHg) | 93±6 | 98±1 |
| PM6M (m) | 420±60 | N/A |
| SpO2final (mmHg) | 90±6 | N/A |
| Recuento LBA (%) | ||
| Macrófagos | 63 [50-84] | 64 [38-78] |
| Linfocitos | 14 [4-24] | 6 [3-22] |
| Segmentados | 12 [3-15] | 15 [2-37] |
| Eosinófilos | 1 [1-4] | 0 [0-0] |
| Mastocitos | 0 [0-1] | 0 [0-0] |
CPI: Composite Physiologic Index; DLco: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: cociente volumen espiratorio forzado en el primer segundo y capacidad vital forzada expresada como porcentaje absoluto; FVC: capacidad vital forzada; H: hombre; M: mujer; mMRC: escala de disnea modificada (Medical Research Council); N/A: no aplica; PM6M: prueba de la marcha de 6 minutos; SpO2 inicial: saturación arterial de oxígeno al inicio de la PM6M; SpO2 final: saturación arterial de oxígeno al final de la PM6M; TLC: capacidad pulmonar total; % pred.: porcentaje del valor predicho.
Los resultados de las variables cuantitativas se expresaron como media±desviación estándar o mediana [rango intercuartílico].
Diagnósticos del total de pacientes (n=155). BR-EPID: bronquiolitis respiratoria asociada a EPID; CFPE: combinación de fibrosis pulmonar y enfisema; EPID: enfermedad pulmonar intersticial difusa; EPID-EAS: EPID asociada a enfermedad autoinmune sistémica; FPI: fibrosis pulmonar idiopática; HPCL: histiocitosis pulmonar de células de Langerhans; IPAF: neumonía intersticial con rasgos autoinmunes; LAM: linfangioleiomiomatosis; NHA: neumonitis por hipersensibilidad aguda; NHC: neumonitis por hipersensibilidad crónica; NIL: neumonía intersticial linfocítica; NINEi: neumonía intersticial no específica idiopática; NOC: neumonía organizada criptogénica.
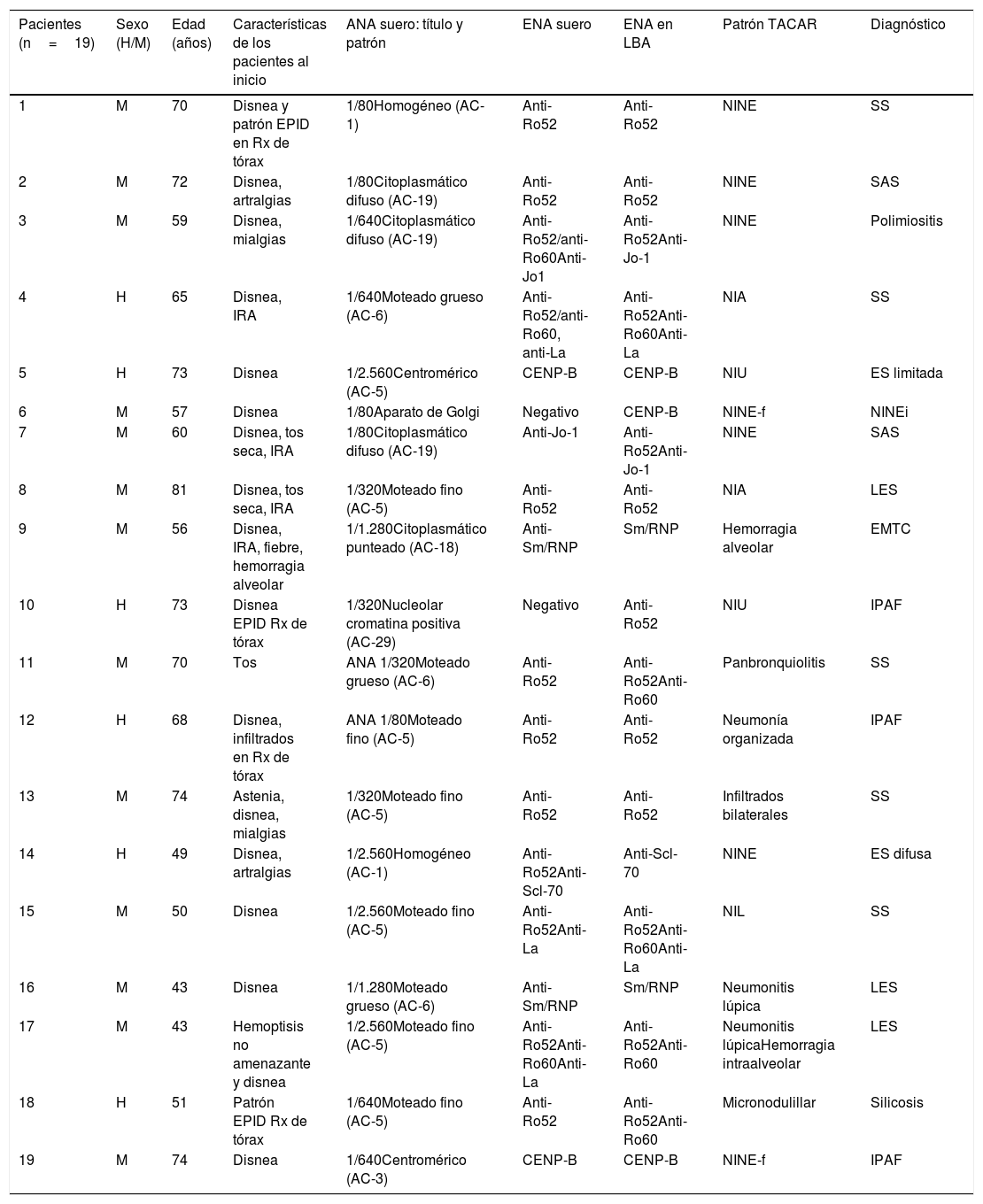
Se detectaron 7 especificidades diferentes (28 en total) en el LBA de 19 pacientes, lo cual representa un 39,5% del total de los pacientes con el diagnóstico final de EPID-EAS o IPAF. La media de edad fue de 60±12 años y estuvo formado por 14 mujeres (73,6%) y 5 varones (26,3%). Catorce pacientes fueron diagnosticados de EPID-EAS, un caso de neumonía intersticial no específica idiopática, 3 casos de IPAF y un caso de silicosis. Casi un tercio de los casos (5; 26,3%) iniciaron con títulos bajos de ANA en suero (1/80). En el grupo de pacientes con EPID-EAS o IPAF, 10 presentaron patrón radiológico de EPID durante su inicio. Cuatro pacientes tenían un diagnóstico previo de EAS y la EPID supuso una complicación aguda en el transcurso de su enfermedad (bronquiolitis en paciente con síndrome de Sjögren o neumonitis lúpica en pacientes con lupus eritematoso sistémico). La tabla 2 resume las características clínicas de estos pacientes al inicio del estudio, los autoanticuerpos en suero y en LBA, el patrón en la tomografía axial computarizada de alta resolución y su diagnóstico final. Cuando se compararon los datos clínicos y funcionales y el recuento celular del LBA de los pacientes con EPID-EAS o IPAF con autoanticuerpos en LBA positivo con aquellos que no lo presentaron no se encontró ninguna diferencia clínica ni funcional estadísticamente significativa (tabla 3). No se observó ningún ENA en el LBA del grupo control ni otras formas de EPID no asociadas con EAS.
Características clínicas y autoanticuerpos en suero y en el lavado broncoalveolar de los pacientes con anticuerpos extraíbles del núcleo positivos
| Pacientes (n=19) | Sexo (H/M) | Edad (años) | Características de los pacientes al inicio | ANA suero: título y patrón | ENA suero | ENA en LBA | Patrón TACAR | Diagnóstico |
|---|---|---|---|---|---|---|---|---|
| 1 | M | 70 | Disnea y patrón EPID en Rx de tórax | 1/80Homogéneo (AC-1) | Anti-Ro52 | Anti-Ro52 | NINE | SS |
| 2 | M | 72 | Disnea, artralgias | 1/80Citoplasmático difuso (AC-19) | Anti-Ro52 | Anti-Ro52 | NINE | SAS |
| 3 | M | 59 | Disnea, mialgias | 1/640Citoplasmático difuso (AC-19) | Anti-Ro52/anti-Ro60Anti-Jo1 | Anti-Ro52Anti-Jo-1 | NINE | Polimiositis |
| 4 | H | 65 | Disnea, IRA | 1/640Moteado grueso (AC-6) | Anti-Ro52/anti-Ro60, anti-La | Anti-Ro52Anti-Ro60Anti-La | NIA | SS |
| 5 | H | 73 | Disnea | 1/2.560Centromérico (AC-5) | CENP-B | CENP-B | NIU | ES limitada |
| 6 | M | 57 | Disnea | 1/80Aparato de Golgi | Negativo | CENP-B | NINE-f | NINEi |
| 7 | M | 60 | Disnea, tos seca, IRA | 1/80Citoplasmático difuso (AC-19) | Anti-Jo-1 | Anti-Ro52Anti-Jo-1 | NINE | SAS |
| 8 | M | 81 | Disnea, tos seca, IRA | 1/320Moteado fino (AC-5) | Anti-Ro52 | Anti-Ro52 | NIA | LES |
| 9 | M | 56 | Disnea, IRA, fiebre, hemorragia alveolar | 1/1.280Citoplasmático punteado (AC-18) | Anti-Sm/RNP | Sm/RNP | Hemorragia alveolar | EMTC |
| 10 | H | 73 | Disnea EPID Rx de tórax | 1/320Nucleolar cromatina positiva (AC-29) | Negativo | Anti-Ro52 | NIU | IPAF |
| 11 | M | 70 | Tos | ANA 1/320Moteado grueso (AC-6) | Anti-Ro52 | Anti-Ro52Anti-Ro60 | Panbronquiolitis | SS |
| 12 | H | 68 | Disnea, infiltrados en Rx de tórax | ANA 1/80Moteado fino (AC-5) | Anti-Ro52 | Anti-Ro52 | Neumonía organizada | IPAF |
| 13 | M | 74 | Astenia, disnea, mialgias | 1/320Moteado fino (AC-5) | Anti-Ro52 | Anti-Ro52 | Infiltrados bilaterales | SS |
| 14 | H | 49 | Disnea, artralgias | 1/2.560Homogéneo (AC-1) | Anti-Ro52Anti-Scl-70 | Anti-Scl-70 | NINE | ES difusa |
| 15 | M | 50 | Disnea | 1/2.560Moteado fino (AC-5) | Anti-Ro52Anti-La | Anti-Ro52Anti-Ro60Anti-La | NIL | SS |
| 16 | M | 43 | Disnea | 1/1.280Moteado grueso (AC-6) | Anti-Sm/RNP | Sm/RNP | Neumonitis lúpica | LES |
| 17 | M | 43 | Hemoptisis no amenazante y disnea | 1/2.560Moteado fino (AC-5) | Anti-Ro52Anti-Ro60Anti-La | Anti-Ro52Anti-Ro60 | Neumonitis lúpicaHemorragia intraalveolar | LES |
| 18 | H | 51 | Patrón EPID Rx de tórax | 1/640Moteado fino (AC-5) | Anti-Ro52 | Anti-Ro52Anti-Ro60 | Micronodulillar | Silicosis |
| 19 | M | 74 | Disnea | 1/640Centromérico (AC-3) | CENP-B | CENP-B | NINE-f | IPAF |
ANA: anticuerpos antinucleares; Anti-Scl-70: anticuerpos dirigidos contra la topoisomerasa I; CENP-B: anticuerpos dirigidos contra proteínas del centrómero B; EMTC: enfermedad mixta del tejido conectivo; ENA: anticuerpo extraíble del núcleo; EPID: enfermedad pulmonar intersticial difusa; ES: esclerodermia; H: hombre; IPAF: neumonía intersticial con rasgos autoinmunes; IRA: insuficiencia respiratoria aguda; LBA: lavado broncoalveolar; LES: lupus eritematoso sistémico; M: mujer; NIA: neumonía intersticial aguda; NIL: neumonía intersticial linfocítica; NINE: neumonía intersticial no específica; NINEi: neumonía intersticial no específica idiopática; NINE-f: neumonía intersticial no específica fibrótica; NIU: neumonía intersticial usual; Rx: radiografía; SAS: síndrome antisintetasa; SS: síndrome de Sjögren; TACAR: tomografía axial computarizada de alta resolución.
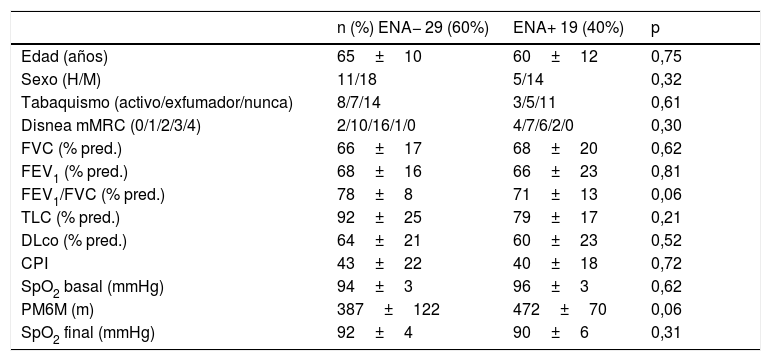
Comparación de variables funcionales en pacientes con EPID-EAS e IPAF de acuerdo con la presencia de anticuerpos extraíbles del núcleo en el lavado broncoalveolar
| n (%) ENA− 29 (60%) | ENA+ 19 (40%) | p | ||
|---|---|---|---|---|
| Edad (años) | 65±10 | 60±12 | 0,75 | |
| Sexo (H/M) | 11/18 | 5/14 | 0,32 | |
| Tabaquismo (activo/exfumador/nunca) | 8/7/14 | 3/5/11 | 0,61 | |
| Disnea mMRC (0/1/2/3/4) | 2/10/16/1/0 | 4/7/6/2/0 | 0,30 | |
| FVC (% pred.) | 66±17 | 68±20 | 0,62 | |
| FEV1 (% pred.) | 68±16 | 66±23 | 0,81 | |
| FEV1/FVC (% pred.) | 78±8 | 71±13 | 0,06 | |
| TLC (% pred.) | 92±25 | 79±17 | 0,21 | |
| DLco (% pred.) | 64±21 | 60±23 | 0,52 | |
| CPI | 43±22 | 40±18 | 0,72 | |
| SpO2 basal (mmHg) | 94±3 | 96±3 | 0,62 | |
| PM6M (m) | 387±122 | 472±70 | 0,06 | |
| SpO2 final (mmHg) | 92±4 | 90±6 | 0,31 |
CPI: Composite Physiologic Index; DLco: capacidad de difusión del monóxido de carbono; EPID-EAS: enfermedad pulmonar intersticial difusa asociada a enfermedad autoinmune sistémica; FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: cociente volumen espiratorio forzado en el primer segundo y capacidad vital forzada expresada como porcentaje absoluto; FVC: capacidad vital forzada; H: hombre; IPAF: neumonía intersticial con rasgos autoinmunes; M: mujer; mMRC: escala de disnea modificada (Medical Research Council); PM6M: prueba de la marcha de 6 minutos; SpO2 inicial: saturación arterial de oxígeno al inicio de la PM6M; SpO2 final: saturación arterial de oxígeno al final de la PM6M; TLC: capacidad pulmonar total; % pred.: porcentaje del valor predicho.
El ENA más frecuente fue el anti-Ro52 (13 pacientes; 68,4% de los positivos), seguido de anti-Ro60 (5; 26,3%), anti-CENP-B (3; 15,8%), anti-La, Jo-1 y Sm/RNP (2; 10,5%) y anti Scl-70 (1; 5,3%). Siete pacientes (36,8%) fueron positivos para más de un ENA. La intensidad de las bandas fue elevada en todos los pacientes, incluidos los que presentaban ANA a título bajo.
Comparativa de los pacientes ENA positivos en suero y LBADiecisiete pacientes (90%) con autoanticuerpos en LBA mostraban estos mismos anticuerpos en suero. En 3 pacientes (7, 11 y 15) se observaron especificidades en el LBA que no fueron detectadas en suero. Sin embargo, un paciente presentó autoanticuerpos anti-Ro52 en LBA con suero negativo. Este paciente falleció por una neoplasia de pulmón meses después de la aparición del autoanticuerpo en LBA, por lo que la seroconversión no pudo estudiarse. Tampoco se ha comprobado la positivización en suero de una paciente con CENP-B en el LBA y diagnóstico de neumonía intersticial no específica idiopática. Por el contrario, hubo 3 pacientes que mostraron una cantidad inferior de especificidades en LBA que en suero (3, 14 y 17).
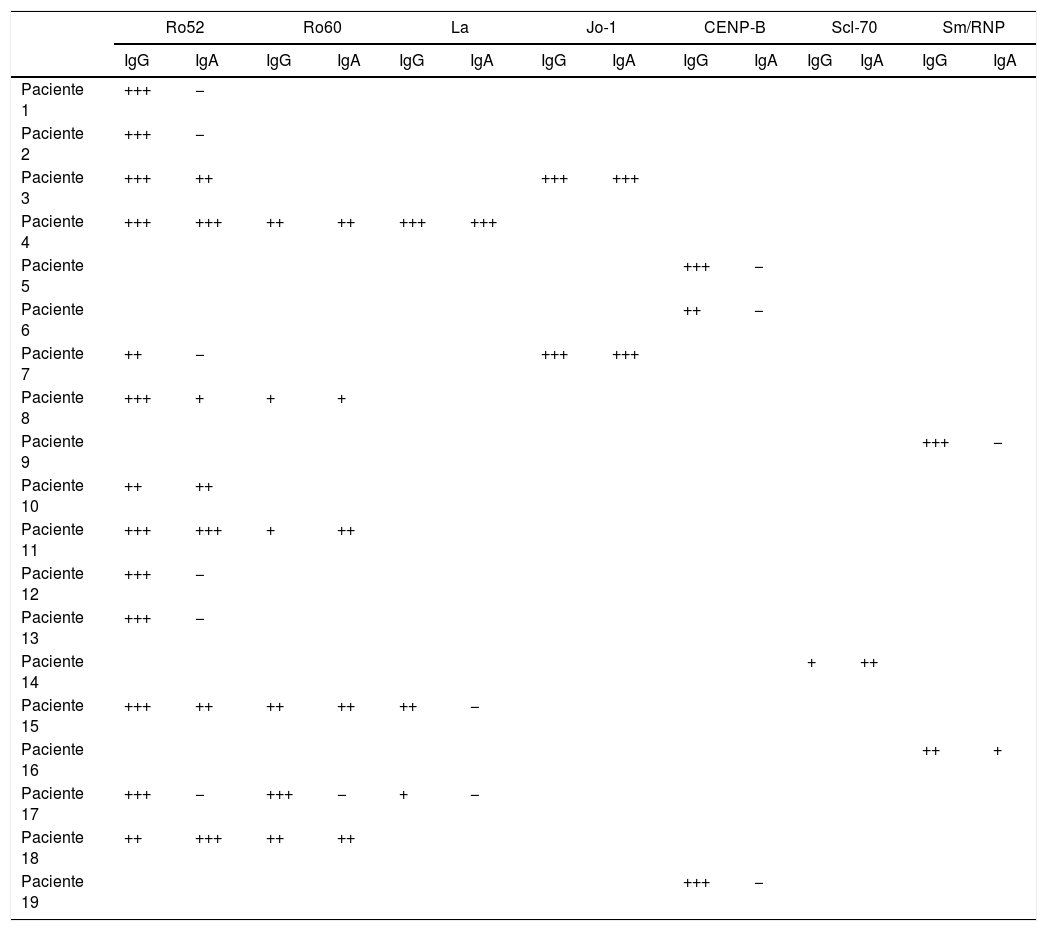
Comparativa de los pacientes con ENA en LBA de clase IgA e IgGMás de la mitad (10/19) de los pacientes con anticuerpos de clase IgG en el LBA presentaron anticuerpos de clase IgA frente a las mismas especificidades. De las 28 especificidades encontradas, 13 mostraron exclusivamente anticuerpos de clase IgG. En 2 casos se observó mayor intensidad de IgA que de IgG. En uno de ellos, la intensidad de la banda IgG fue baja, por lo cual, según el punto de corte establecido para el estudio, de no haberse realizado el estudio con anticuerpos IgA este paciente habría sido considerado como negativo (tabla 4).
Resultados del inmunoblot de anticuerpos extraíbles del núcleo en el lavado broncoalveolar (conjugados IgG; IgA)
| Ro52 | Ro60 | La | Jo-1 | CENP-B | Scl-70 | Sm/RNP | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IgG | IgA | IgG | IgA | IgG | IgA | IgG | IgA | IgG | IgA | IgG | IgA | IgG | IgA | |
| Paciente 1 | +++ | − | ||||||||||||
| Paciente 2 | +++ | − | ||||||||||||
| Paciente 3 | +++ | ++ | +++ | +++ | ||||||||||
| Paciente 4 | +++ | +++ | ++ | ++ | +++ | +++ | ||||||||
| Paciente 5 | +++ | − | ||||||||||||
| Paciente 6 | ++ | − | ||||||||||||
| Paciente 7 | ++ | − | +++ | +++ | ||||||||||
| Paciente 8 | +++ | + | + | + | ||||||||||
| Paciente 9 | +++ | − | ||||||||||||
| Paciente 10 | ++ | ++ | ||||||||||||
| Paciente 11 | +++ | +++ | + | ++ | ||||||||||
| Paciente 12 | +++ | − | ||||||||||||
| Paciente 13 | +++ | − | ||||||||||||
| Paciente 14 | + | ++ | ||||||||||||
| Paciente 15 | +++ | ++ | ++ | ++ | ++ | − | ||||||||
| Paciente 16 | ++ | + | ||||||||||||
| Paciente 17 | +++ | − | +++ | − | + | − | ||||||||
| Paciente 18 | ++ | +++ | ++ | ++ | ||||||||||
| Paciente 19 | +++ | − | ||||||||||||
Las cruces indican el grado de intensidad de las bandas: débil (+); intermedia (++); fuerte (+++).
Las intensidades débiles se interpretaron como negativas.
En todos los casos, el patrón de IFI detectado concuerda con el asociado a las especificidades obtenidas. Ro52 y Ro60 no se asocian a ningún patrón en los ANA, por lo que no todos los sueros fueron positivos.
DiscusiónEl presente estudio evidencia la presencia de autoanticuerpos en el LBA de pacientes con EPID durante su proceso diagnóstico. Hasta donde conocemos, se trata de un hallazgo nuevo no descrito previamente. Se detectaron positividades para 7 especificidades de ENA diferentes, siendo el anti-Ro52 la más frecuente. El estudio en el LBA mostró concentraciones altas de autoanticuerpos desde el inicio en todos los pacientes, independientemente del título de ANA en suero.
La detección de ENA en el LBA es una técnica económica y accesible. Los presentes resultados ponen de manifiesto que pueden añadir información en el cribado de la EPID de origen autoinmune cuando se combina con el estudio en suero. Su detección mediante diferentes técnicas (inmunoblot, IFI) confirma que se trata de una estrategia reproducible que podría incorporarse al diagnóstico de rutina.
El LBA es una técnica ampliamente utilizada en el algoritmo diagnóstico de las EPID2,25. Su análisis podría reflejar los mecanismos humorales e inmunobiológicos que tienen lugar en el pulmón de manera más fidedigna y anticipada que en sangre periférica26. Sin embargo, la información sobre biomarcadores de EPID en LBA es todavía limitada. La mayoría de las moléculas estudiadas están relacionadas con la activación aberrante de las células epiteliales o de los macrófagos alveolares y, en menor medida, con la alteración de la respuesta inmunitaria8,27,28.
La aparición de autoanticuerpos en suero puede adelantarse años a las primeras manifestaciones clínicas1,12. Conocer el órgano en el que se está iniciando la autoinmunidad podría abrir la puerta a nuevas estrategias diagnósticas o terapéuticas. En la presente serie, todos los pacientes se estudiaron al iniciarse las manifestaciones pulmonares (clínicas o radiológicas), por lo cual planteamos que su aparición en el LBA podría servir como marcador temprano de desarrollo de EPID en pacientes con EAS. A diferencia de las neumonías intersticiales idiopáticas, el estudio de los autoanticuerpos en las EPID-EAS representa un aspecto fundamental, ya que su presencia está directamente relacionada con la patogénesis y el daño tisular28,29.
Tres pacientes mostraron autoanticuerpos en LBA no detectables en suero, y otros 3 presentaron autoanticuerpos en suero no detectables en LBA. Estas disparidades pueden reflejar diferencias en la respuesta local. Los autoanticuerpos detectados únicamente en el LBA podrían provenir directamente del pulmón y los exclusivos del suero, sintetizarse en otros tejidos. Estos hallazgos apoyan la utilidad del estudio de ambas matrices en paralelo.
El hecho de que no se obtuviera ningún resultado positivo en otro grupo de EPID frecuentes, como la fibrosis pulmonar idiopática o la neumonitis por hipersensibilidad, también puede indicar que la detección de los autoanticuerpos en el LBA es muy indicativa de una EAS de base. Al respecto, debemos señalar que dentro del grupo con LBA positivo se incluyó un caso de silicosis con positividad también en suero. Aunque este resultado puede parecer discordante, se ha descrito que la exposición al polvo de sílice es un factor de riesgo para el desarrollo de varias EAS30,31. Así mismo, hay que destacar que tampoco se detectaron autoanticuerpos en el grupo control ni en pacientes con enfermedades que por su similitud clínica o radiológica pueden confundirse con una EPID en su inicio (insuficiencia cardíaca congestiva, infección en inmunosuprimidos, entre otras)2.
Al comparar el grupo de pacientes con LBA positivo con aquellos con diagnóstico de EAS o IPAF con LBA negativo no encontramos diferencias significativas en los parámetros clínicos ni funcionales. Pese a esto, consideramos que podría ser interesante analizar la evolución de estos pacientes para valorar el papel de los autoanticuerpos en el pronóstico de estas enfermedades.
El ENA más frecuente detectado en el LBA de estos pacientes fue el anti-Ro52. El anti-Ro52 se encuentra en varias EAS, como el síndrome de Sjögren, el lupus eritematoso sistémico o la esclerodermia, entre otras. Su presencia en suero se ha relacionado con una mayor prevalencia de EPID32 y con un peor pronóstico cuando coexiste con autoanticuerpos específicos de miopatías inflamatorias32-34. En nuestra serie, los pacientes con anti-Ro52 positivo en el LBA fueron en su mayoría mujeres y tuvieron diferentes diagnósticos con manifestaciones clínicas y radiológicas muy variadas. Se observaron desde casos asintomáticos que fueron estudiados por un patrón radiológico compatible con EPID hasta pacientes que comenzaron con insuficiencia respiratoria aguda, hemorragia alveolar o signos de neumonía intersticial aguda en la tomografía axial computarizada de alta resolución. Este hallazgo clínico es de interés en los pacientes con lupus eritematoso sistémico, en los cuales la prevalencia de EPID en general es menor que en otras EAS13. Sin embargo, cuando esta se presenta, lo puede hacer como complicación aguda, como ocurrió en nuestros casos. Estos resultados están en línea con lo publicado en la literatura, en la cual se describe que los pacientes con anti-Ro52 positivo en suero pueden tener un fenotipo clínico muy heterogéneo35.
En el grupo de los pacientes con LBA positivo se pudieron detectar también autoanticuerpos con alta especificidad y relevancia clínica, entre los que destacamos el Jo-1, el Sm/RNP y el Scl-70. Estos autoanticuerpos se encuentran entre los criterios clasificatorios de diferentes EAS, como el síndrome antisintetasa, la enfermedad mixta del tejido conectivo y la esclerosis difusa, respectivamente. Así mismo, es conocido que estos marcadores también pueden ofrecer información pronóstica29,35,36.
Actualmente, no se dispone de protocolos estandarizados sobre el estudio inmunológico en el cribado de la EPID. Muchos laboratorios realizan únicamente el estudio de ANA mediante IFI, y si estos son negativos, no se estudian las especificidades ENA. En el presente trabajo, el aislamiento de los ENA en el LBA detectados también en suero respalda las recomendaciones planteadas por otros autores de ampliar el análisis de autoanticuerpos en suero. Además de los marcadores de miositis, los anti-Ro52, por su alta prevalencia y por no presentar un patrón ANA característico en suero (pudiendo ser negativos), deberían estudiarse de manera rutinaria en estos pacientes4,29,35,36.
Otro hallazgo inesperado es la mayor prevalencia de anticuerpos de clase IgG sobre los IgA. En las mucosas, los anticuerpos de clase IgA son mayoritarios y la concentración pulmonar de IgG es muy baja. Sin embargo, hemos encontrado pacientes positivos para anticuerpos de clase IgG y negativos para IgA. Esta aparente incongruencia podría explicarse por una falta de sensibilidad del conjugado IgA polimérica. También podría deberse a que las IgA poliméricas están fuertemente unidas a la capa de moco y no llegan a la fase líquida que se recoge en el LBA. En sangre periférica, las inmunoglobulinas de isotipo IgA tienen una semivida de pocos días, por lo que son minoritarias37. Por este motivo, es muy improbable que los anticuerpos de clase IgA detectados en nuestros pacientes procedan de una contaminación con sangre periférica. Así mismo, pese a ser minoritarios, su mera presencia demuestra la síntesis in situ. Este hecho apoyaría la hipótesis descrita en otros estudios de que, al menos en algunos pacientes, el pulmón sea un órgano involucrado en los mecanismos de autoinmunidad26,38. Estos resultados necesitan ser replicados mediante ensayos funcionales y abren la puerta a futuras investigaciones.
Nuestro estudio presenta algunas limitaciones. En primer lugar, no se dispone de una cohorte de validación para determinar el valor predictivo de la prueba. Puesto que el objetivo principal del estudio era detectar la presencia de autoanticuerpos en el LBA, los hallazgos presentados responden a la pregunta de la investigación. Segundo, los pacientes en el grupo control no eran voluntarios sanos y algunos tenían antecedentes de tabaquismo. Es reconocido que a pesar de que el LBA es una técnica mínimamente invasiva, puede resultar molesta en algunos pacientes, dificultando la realización en población sana. Por último, aunque el estudio recoge pacientes de 2 centros, el grupo de pacientes con EAS es relativamente reducido para generar un adecuado tratamiento estadístico. Sin embargo, asumimos que refleja la práctica clínica real de las unidades de EPID en nuestro medio, en donde un porcentaje elevado de pacientes es referido con un diagnóstico previo de EAS para su seguimiento.
En resumen, el presente estudio demuestra que es posible detectar mediante técnicas convencionales autoanticuerpos en el LBA de pacientes con EPID de inicio. Su análisis en paralelo con el del suero añade información valiosa en el algoritmo diagnóstico de estas enfermedades. Podría ser de utilidad para identificar de manera precoz a aquellos pacientes con EAS con afectación intersticial en los diversos escenarios en que puede presentarse.
FinanciaciónEste trabajo ha sido financiado mediante las siguientes ayudas: Beca para la investigación de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR): proyecto 020, Beca EPID Futuro 2014, Ayudas para estancias en otros centros SEPAR 2018, (Karina Portillo), Fondo de Investigación Sanitaria P16/0216 (Marian García-Nuñez) y Beca Separ-Boehringer EPID 2018 para jóvenes investigadores (Laura Rodriguez Pons).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.