Estudiar el significado clínico de Aspergillus fumigatus y Candida albicans en las secreciones respiratorias de los pacientes con fibrosis quística (FQ) y las inmunorrespuestas séricas frente a estos hongos.
Pacientes y métodosSe estudió a 66 pacientes con FQ (34 varones; edad media: 16,2 años). Como grupo control se utilizaron los sueros de 15 individuos sanos.
ResultadosLas concentraciones de inmunoglobulina (Ig) G, IgA e IgM frente a A. fumigatus y C. albicans estuvieron más elevadas en los pacientes con FQ que en el grupo control. No hubo correlación entre el hallazgo de A. fumigatus en las secreciones respiratorias y las inmunorrespuestas séricas frente al hongo. Sí hubo correlación entre la presencia de C. albicans en las secreciones respiratorias y las inmunorrespuestas frente a C. albicans. A medida que aumentaba la edad de los pacientes, aumentaba la probabilidad de cultivar A. fumigatus en las secreciones respiratorias. La presencia de estos hongos en muestras respiratorias no fue un factor de riesgo para un mayor deterioro respiratorio.
ConclusionesComo respuesta a la elevada colonización del aparato respiratorio inferior por A. fumigatus y C. albicans, los pacientes con FQ presentan respuestas séricas elevadas de IgG, IgA e IgM frente a estos hongos. En los pacientes con FQ el cultivo de esputos y aspirados orofaríngeos no sirve para evaluar la colonización del aparato respiratorio inferior por A. fumigatus, pero sí por C. albicans. En estos pacientes, la colonización fúngica del aparato respiratorio inferior no es un factor de riesgo para el deterioro respiratorio.
The aim of this study was to analyze the clinical significance of Aspergillus fumigatus and Candida albicans in respiratory secretions from patients with cystic fibrosis and to assess the immune response to these fungi in serum.
Patients and methodsThe study included 66 patients with cystic fibrosis (34 men; mean age, 16.2 years). Sera from 15 healthy individuals were used as controls.
ResultsThe serum concentrations of immunoglobulin (Ig) G, IgA, and IgM against A fumigatus and C albicans were higher in patients than in the control group. There was no correlation between the presence of A fumigatus in respiratory secretions and the immune response to the fungus measured in serum. In contrast, the presence of C albicans in respiratory secretions was correlated with the immune response to that fungus. The likelihood of obtaining A fumigatus cultures from respiratory secretions increased with age. The presence of these fungi in respiratory samples was not a risk factor for greater respiratory impairment.
ConclusionsIn response to increased colonization of the lower respiratory tract by A fumigatus and C albicans, patients with cystic fibrosis have elevated serum levels of IgG, IgA, and IgM against those fungi. In patients with cystic fibrosis, culture of sputum and oropharyngeal secretions is adequate for the assessment of lower respiratory tract colonization by C albicans but not A fumigatus. Fungal colonization of the lower respiratory tract is not a risk factor for greater respiratory impairment in patients with cystic fibrosis.
En la fibrosis quística (FQ) se produce una infección broncopulmonar crónica por bacterias que da lugar a la formación de bronquiectasias. Además de la colonización bacteriana, los pacientes con FQ están predispuestos a la colonización fúngica por la capacidad que tienen algunos hongos de colonizar el aparato respiratorio inferior y por los frecuentes ciclos de antibióticos que precisan para el control de su enfermedad1,2. Los hongos que se cultivan con más frecuencia en las secreciones respiratorias de estos pacientes son Aspergillus fumigatus y Candida albicans. A. fumigatus se aísla en las secreciones respiratorias de los afectados de FQ con una frecuencia que oscila entre un 9 y un 57%3,4; en el caso de C. albicans la frecuencia es algo más elevada4,5. En los pacientes con FQ la colonización del aparato respiratorio inferior por A. fumigatus se traduce en una tasa elevada de respuestas inmunitarias frente al hongo6,7. En la actualidad no está claramente definido el papel de los hongos en la FQ, aunque se considera que son microorganismos no patógenos8, excepto en los casos de aspergilosis invasiva9 y de aspergilosis broncopulmonar alérgica10,11. Sin embargo, algunos investigadores señalan que en ciertos casos A. fumigatus puede contribuir a la patogenia de la enfermedad, quizá por factores de virulencia intrínsecos a este hongo12, hecho no contrastado por otros3.
En este trabajo nos planteamos 3 objetivos principales: a) analizar las respuestas séricas inmunitarias de inmunoglobulina G (IgG), inmunoglobulina A (IgA) e inmunoglobulina M (IgM) frente A. fumigatus y C. albicans en los pacientes con FQ; b) determinar si el cultivo de las secreciones respiratorias refleja de forma fidedigna la colonización del aparato respiratorio inferior por estos hongos en los pacientes con FQ, y c) estudiar el significado clínico de la presencia de estos hongos en las secreciones respiratorias de los pacientes con FQ.
Pacientes y métodosPoblación de estudioSe estudió de manera prospectiva a 66 pacientes con FQ (34 varones y 32 mujeres), con una edad media ± desviación estándar de 16,2 ± 8,3 años (rango: 3-36). En todos ellos el diagnóstico se estableció por un test del sudor con valores de cloro superiores a 60mEq/l en 2 determinaciones y clínica indicativa del diagnóstico13. La media de su capacidad vital forzada (FVC) en porcentaje del valor teórico fue del 79,85 ± 26,24%, y la del volumen espiratorio forzado en el primer segundo (FEV1) fue del 72,09 ± 31,28%. El estudio fue aprobado por el Comité de Ética del hospital. Se informó a todos los pacientes de las características del estudio, pero no se requirió consentimiento firmado porque no se modificó la práctica clínica habitual de la Unidad de FQ.
Diseño y métodos de estudioSe evaluó prospectivamente a los pacientes durante sus visitas de control a la consulta de la Unidad de FQ (cada 3 o 4 meses) a lo largo de un período de entre 2 y 6 años. En cada consulta, además de la exploración física general, se realizó una exploración selectiva de la cavidad bucal con el fin de evaluar si había en ésta colonización por C. albicans. A los pacientes con C. albicans en la cavidad bucal se les trató con un antifúngico tópico y se retiraron temporalmente del estudio hasta su erradicación. Se realizaron consultas y estudios adicionales cuando los clínicos responsables lo consideraron necesario. Se efectuó un estudio anual que incluía radiografía de tórax (evaluada con el sistema de puntuación de Brasfield siempre por el mismo neumólogo)14 y espirometría. Todas las secreciones respiratorias se cultivaron para hongos durante los 6 años del estudio. Durante los últimos 4 años del estudio se analizó en cada paciente al menos una muestra de suero cada 8 meses. Tras una primera fase del estudio, ya mencionada, el suero restante se congeló a –20°C para su procesamiento posterior en una segunda fase del estudio. En esta segunda fase se analizaron las respuestas humorales IgG, IgA e IgM frente a A. fumigatus y C. albicans sólo en los pacientes que tenían al menos 4 muestras de secreciones respiratorias analizadas en el último año del estudio (n = 66). Como grupo control se utilizaron los sueros de 15 individuos sanos, no atópicos ni fumadores, de similar edad y sexo que la población de estudio.
Definición de diagnósticos específicosSe definieron varios grupos de acuerdo con los resultados microbiológicos: pacientes que tuvieron al menos un cultivo positivo para A. fumigatus o C. albicans en las secreciones respiratorias durante todo el tiempo que duró el estudio (pacientes con A. fumigatus o pacientes con C. albicans, respectivamente), y pacientes que nunca tuvieron A. fumigatus o C. albicans en las secreciones respiratorias durante el estudio (pacientes sin A. fumigatus o pacientes sin C. albicans, respectivamente).
Procesamiento de las secreciones respiratoriasLas muestras respiratorias (esputos o aspirados orofaríngeos en los menores de 2 años o en los pacientes con dificultad para expectorar) se recogieron con una frecuencia variable, habitualmente una en cada consulta, con un máximo de una al mes. Las muestras se trataron con N-acetilcisteína durante un tiempo no superior a 30min para lograr su fluidificación. A continuación se realizaron siembras por duplicado, en medio de Sabouraud-cloranfenicol y de Sabouraud-cloranfenicol-actidiona a 2 temperaturas, una a 30 oC y otra a 37 oC, durante 4 semanas, con revisión diaria y lectura semanal.
EspirometríaSe efectuó espirometría a 60 pacientes mayores de 5 años que fueron capaces de realizarla. La FVC y el FEV1 se midieron sin broncodilatación con un espirómetro VMax 20 (SensorMedics Corporation, Yorba Linda, California, EE.UU.) según las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica15. Los resultados se expresaron como porcentaje de los valores teóricos de acuerdo con la edad, sexo, peso, estatura y raza basados en los teóricos de la Comunidad Económica del Carbón y el Acero16. Para su análisis estadístico se han utilizado los valores medios obtenidos por cada paciente a lo largo del estudio.
Sistema de puntuación de BrasfieldEl sistema de puntuación de Brasfield valora 5 aspectos radiológicos: atrapamiento aéreo, sombras lineales, lesiones noduloquísticas, consolidaciones segmentarias o lobulares y una impresión general de la gravedad. En el caso del atrapamiento aéreo, las marcas lineales y las lesiones noduloquísticas, la puntuación 0 significa ausente, y se puntúa de 1 a 4 según la gravedad. En las lesiones mayores, la puntuación 0 indica ausente y se puntúa de 3 a 5 según la gravedad. En cuanto a la gravedad general, 0 significa ausente y se puntúa de 1 a 5 según la gravedad. La puntuación total se obtiene restando la suma de todo lo anterior de 25. Por tanto, a mayor puntuación, mejor estado radiológico, de modo que 25 indica una radiografía de tórax sin alteraciones. Para su análisis estadístico se han utilizado los valores medios obtenidos por cada paciente a lo largo del estudio.
Análisis de las inmunoglobulinas G, A y M séricas específicas frente a A. fumigatus y C. albicansLos resultados de IgG, IgA e IgM específicas frente a A. fumigatus y C. albicans se determinaron por métodos de enzimoinmunoanálisis. Para A. fumigatus, cada pocillo de la microplaca (Costar 3590 Corp., Cambridge, Massachusetts, EE.UU.) se llenó con 0,1ml del antígeno de A. fumigatus diluido a 1:2.000 en tampón fostato salino (PBS), pH: 7,2. Después de incubarse durante 18h a 4 oC, se lavó la placa con PBS-TW 20 (Sigma, San Luis, EE.UU.), se añadió a todos los pozos 0,1ml de PBS con un 2% de albúmina bovina (Sigma) y se incubaron a 37 oC durante 1h. A continuación volvió a lavarse la placa en PBS-TW y se añadió a cada pocillo 0,1ml del suero de los pacientes diluido a 1:1.000 en PBS-TW, tras lo cual se incubaron durante 1h a temperatura ambiente. Seguidamente volvieron a lavarse las placas con PBS-TW y se añadió en cada pocillo, para la IgG específica, una anti-IgG humana marcada con peroxidasa diluida a 1:8.000 en PBSTW con un 25% de suero de ternera fetal; para la IgA, una anti-IgA humana a 1:2.000, y para la IgM, una anti-IgM humana a 1:2.000 (Biosource International, Camarillo, California, EE.UU.), y se incubaron durante 1h a temperatura ambiente. Los pocillos se lavaron en PBS-TW y se añadió 0,1ml de sustrato (o-fenilendiamina, 2mg/ml, en agua destilada y un 0,03% de peróxido de hidrógeno) a temperatura ambiente. Después de 15min se paró la reacción en color añadiendo 0,1ml de ácido sulfúrico 4N. Los resultados se expresaron en densidades ópticas (DO) y se midieron a 492nm mediante un espectrofotómetro Titertek-Multiscan (Flow Laboratories, Irvine, Escocia, Gran Bretaña). Todas las pruebas se realizaron por duplicado. Para las IgG, IgA e IgM específicas frente a C. albicans se utilizó el mismo método, con las antiinmunoglobulinas humanas de la casa comercial Sanofi Diagnostic Pasteur (Laboratorio Arístegui, Bilbao, Vizcaya, España). Como grupo control se utilizaron los sueros de 15 individuos sanos, no atópicos ni fumadores. Se consideró que la reacción inmunológica era positiva cuando su valor era mayor que la media más 2 desviaciones estándar del valor de dicha inmunoglobulina en el grupo control (respecto a A. fumigatus: IgG positiva > 0,67 DO; IgA positiva > 0,21 DO; IgM positiva > 0,94 DO. Respecto a C. albicans: IgG positiva > 0,56 DO; IgA positiva > 0,41 DO; IgM positiva > 0,90 DO).
Análisis estadísticoSe utilizó la prueba de la χ2 para comparar entre sí las variables cualitativas. La variable del sistema de puntuación de Brasfield se consideró semicuantitativa y se utilizaron análisis no paramétricos (H de Kruskal-Wallis, prueba de Spearman) cuando se estudió la asociación con otras variables. Si una de las variables se consideraba cuantitativa y la otra cualitativa, se estudió la diferencia de las medias y se comprobó la homogeneidad de las variancias mediante la prueba de Bartlett. Si ambas variables eran cuantitativas, se realizaron correlaciones utilizando el coeficiente de correlación de Pearson. Se llevó a cabo un análisis multivariable para estudiar la posible asociación entre las inmunorrespuestas frente a A. fumigatus y a C. albicans con la edad, el sexo, parámetros espirométricos y sistema de puntuación de Brasfield. El estimador utilizado de la media poblacional fue la media muestral. Para estimar la variabilidad poblacional (variancia, desviación estándar) se empleó la distribución de la t de Student con n-1 grados de libertad. Todos los análisis se realizaron con los programas estadísticos DBase-IV, EpiInfo versión 6.04-b (Borland Internacional, Scotts Valley, California, EE.UU.) y SPSS para Windows versión 8.0 (Chicago, Illinois, EE.UU.).
ResultadosSe cultivaron 1.239 muestras de secreciones respiratorias de 66 pacientes (18,77 cultivos de media por paciente; rango: 4-48). A. fumigatus se cultivó en 256 muestras de secreciones respiratorias (20,7%) y C. albicans en 588 (47,5%). Cuarenta pacientes tuvieron al menos un cultivo positivo para A. fumigatus y 58 tuvieron al menos un cultivo positivo para C. albicans (datos ya publicados)6.
Durante el estudio, el 92,1% de los pacientes tuvo al menos una respuesta inmunológica positiva a A. fumigatus en alguna ocasión y el 91% a C. albicans. Los valores de anticuerpos IgG, IgA e IgM frente a A. fumigatus y C. albicans estuvieron significativamente más elevados en los pacientes con FQ que en el grupo control (p < 0,001) (tabla I).
Comparación de las respuestas inmunitarias específicas a A. fumigatus y a C. albicans entre los pacientes con fibrosis quística (FQ) y el grupo control
| Respuesta inmunitaria | Pacientes con FQ (n = 66) | Grupo control (n = 15) | p |
| IgG-A. fumigatus (DO) | 0,94 ± 0,49 | 0,43 ± 0,12 | < 0,001 |
| IgA-A. fumigatus (DO) | 0,32 ± 0,23 | 0,13 ± 0,04 | < 0,001 |
| IgM-A. fumigatus (DO) | 0,99 ± 0,51 | 0,50 ± 0,22 | < 0,001 |
| IgG-C. albicans (DO) | 1,23 ± 0,81 | 0,36 ± 0,10 | < 0,001 |
| IgA-C. albicans (DO) | 0,74 ± 0,67 | 0,19 ± 0,11 | < 0,001 |
| IgM C. albicans (DO) | 0,85 ± 0,47 | 0,48 ± 0,21 | < 0,001 |
Todos los resultados se expresan como media ± desviación estándar.
DO: densidades ópticas; IgA-A. fumigatus: inmunoglobulina A específica frente a A. fumigatus; IgA-C. albicans: inmunoglobulina A específica frente a C. albicans; IgG-A. fumigatus: inmunoglobulina G específica frente a A. fumigatus; IgG-C. albicans: inmunoglobulina G específica frente a C. albicans; IgM-A. fumigatus: inmunoglobulina M específica frente a A. fumigatus; IgM-C. albicans: inmunoglobulina M específica frente a C. albicans.
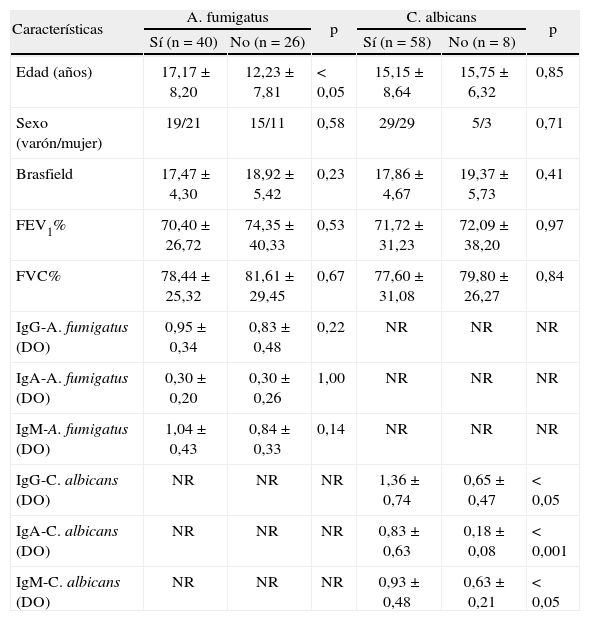
Las características de los pacientes según la presencia de A. fumigatus y C. albicans se muestran en la tabla II. Respecto a la edad, fue mayor en el grupo de pacientes con A. fumigatus que el grupo de pacientes sin dicho hongo, y no hubo diferencias entre los pacientes con y sin C. albicans. Además, la edad se asoció con un aumento de la probabilidad de cultivar A. fumigatus en las secreciones respiratorias (r = 0,28; p < 0,05), pero no con la probabilidad de cultivar C. albicans (r = 0,10; p = 0,41). No hubo diferencias significativas en los valores de inmunoglobulinas específicas frente a A. fumigatus entre los pacientes con y sin A. fumigatus, ni hubo una correlación significativa entre los valores de inmunoglobulinas específicas y la probabilidad de cultivar A. fumigatus en las secreciones respiratorias.
Características de los afectados de fibrosis quística (n = 66) con y sin A.fumigatus y con y sin C. albicans en las secreciones respiratorias
| Características | A. fumigatus | p | C. albicans | p | ||
| Sí (n = 40) | No (n = 26) | Sí (n = 58) | No (n = 8) | |||
| Edad (años) | 17,17 ± 8,20 | 12,23 ± 7,81 | < 0,05 | 15,15 ± 8,64 | 15,75 ± 6,32 | 0,85 |
| Sexo (varón/mujer) | 19/21 | 15/11 | 0,58 | 29/29 | 5/3 | 0,71 |
| Brasfield | 17,47 ± 4,30 | 18,92 ± 5,42 | 0,23 | 17,86 ± 4,67 | 19,37 ± 5,73 | 0,41 |
| FEV1% | 70,40 ± 26,72 | 74,35 ± 40,33 | 0,53 | 71,72 ± 31,23 | 72,09 ± 38,20 | 0,97 |
| FVC% | 78,44 ± 25,32 | 81,61 ± 29,45 | 0,67 | 77,60 ± 31,08 | 79,80 ± 26,27 | 0,84 |
| IgG-A. fumigatus (DO) | 0,95 ± 0,34 | 0,83 ± 0,48 | 0,22 | NR | NR | NR |
| IgA-A. fumigatus (DO) | 0,30 ± 0,20 | 0,30 ± 0,26 | 1,00 | NR | NR | NR |
| IgM-A. fumigatus (DO) | 1,04 ± 0,43 | 0,84 ± 0,33 | 0,14 | NR | NR | NR |
| IgG-C. albicans (DO) | NR | NR | NR | 1,36 ± 0,74 | 0,65 ± 0,47 | < 0,05 |
| IgA-C. albicans (DO) | NR | NR | NR | 0,83 ± 0,63 | 0,18 ± 0,08 | < 0,001 |
| IgM-C. albicans (DO) | NR | NR | NR | 0,93 ± 0,48 | 0,63 ± 0,21 | < 0,05 |
Todos los resultados, excepto el sexo, se expresan como media ± desviación estándar.
DO: densidades ópticas; FEV1%: volumen espiratorio forzado en el primer segundo, en porcentaje sobre el valor teórico estándar; FVC: capacidad vital forzada, en porcentaje sobre el valor teórico estándar; IgA-A. fumigatus: inmunoglobulina A específica frente a A. fumigatus; IgA-C. albicans: inmunoglobulina A específica frente a C. albicans; IgG-A. fumigatus: inmunoglobulina G específica frente a A. fumigatus; IgG-C. albicans: inmunoglobulina G específica frente a C. albicans; IgM-A. fumigatus: inmunoglobulina M específica frente a A. fumigatus; IgM-C. albicans: inmunoglobulina M específica frente a C. albicans; NR: no realizado.
La probabilidad de cultivar C. albicans en las secreciones respiratorias se asoció con un deterioro respiratorio mayor, aunque sólo alcanzó significación estadística para el sistema de puntuación de Brasfield (r = –0,24; p < 0,05). A diferencia de lo observado para A. fumigatus, las respuestas inmunitarias específicas frente a C. albicans fueron significativamente mayores en los pacientes con C. albicans que en los pacientes sin C. albicans. Además, hubo una correlación significativa entre la probabilidad de cultivar C. albicans en las muestras respiratorias y los valores de inmunoglobulinas específicas (r = 0,63, p < 0,001 para la IgG específica frente a C. albicans; r = 0,61, p < 0,001 para la IgA específica, y r = 0,40, p < 0,05 para la IgM específica).
Correlación entre las inmunorrespuestas específicas con la edad, el sexo y la situación respiratoria en los pacientes con fibrosis quísticaEn la tabla III se muestran las correlaciones entre las concentraciones de IgG, IgA e IgM específicas frente a A. fumigatus y C. albicans, así como las características de los pacientes. No hubo correlación significativa entre el sexo y los valores de IgG, IgA e IgM específicas frente a A. fumigatus. Sin embargo, a diferencia de lo hallado para A. fumigatus, las mujeres sí presentaron concentraciones de IgG, IgA e IgM específicas frente a C. albicans mayores que los varones, con significación estadística para la IgG e IgM (p < 0,05).
Correlación entre los valores de inmunoglobulinas séricas específicas frente a A. fumigatus y C. albicans con la edad y situación respiratoria en los pacientes con fibrosis quística (n = 66)
| Características | IgG-A .fumigatus | IgA-A. fumigatus | IgM-A. fumigatus | IgG-C. albicans | IgM-C. albicans | IgM-C. albicans |
| Edad | 0,30a | 0,27a | 0,07 | 0,20 | 0,11 | 0,11 |
| Brasfield | −0,43b | −0,53b | −0,28a | −0,47b | −0,35a | −0,35a |
| FEV1% | −0,46b | −0,50b | −0,18 | −0,37a | −0,15 | −0,15 |
| FVC1% | −0,35a | −0,36a | −0,18 | −0,25 | −0,19 | −0,19 |
Los resultados expresan el valor de r.
FEV1%: volumen espiratorio forzado en el primer segundo, en porcentaje sobre el valor teórico estándar; FVC: capacidad vital forzada, en porcentaje sobre el valor teórico estándar; IgA-A. fumigatus: inmunoglobulina A específica frente a A. fumigatus; IgA-C. albicans: inmunoglobulina A específica frente a C. albicans; IgG-A. fumigatus: inmunoglobulina G específica frente a A. fumigatus; IgG-C. albicans: inmunoglobulina G específica frente a C. albicans; IgM-A. fumigatus: inmunoglobulina M específica frente a A. fumigatus; IgM-C. albicans: inmunoglobulina M específica frente a C. albicans.
Para eliminar posibles factores de confusión se realizó un análisis de regresión lineal múltiple. En este análisis, utilizando el FEV1 como variable dependiente y las IgG, IgA e IgM frente a A. fumigatus, presencia de A. fumigatus en las secreciones respiratorias, edad y sexo como covariables, la edad fue la variable que más contribuyó a un FEV1 menor (beta = –0,21; standar error (SE) = 0,32; p < 0,05). Se observaron resultados similares cuando se utilizó la FVC como variable dependiente (beta = –0,18; SE = 0,42; p < 0,05). Tras un análisis de regresión logística, la edad también fue la principal variable asociada con un Brasfield inferior (beta = –0,14; SE = 0,12; p < 0,05), definido para este análisis como un sistema de puntuación de Brasfield < 18.
Cuando se utilizó el FEV1 como variable dependiente y las inmunorrespuestas frente a C. albicans, presencia de C. albicans en las secreciones respiratorias, edad y sexo como covariables, se objetivó que la edad fue la variable que contribuyó en mayor medida a un FEV1 menor (beta = –0,22; SE = 0,34; p < 0,05). Se observaron resultados similares cuando se utilizó la FVC como variable dependiente. En el análisis de regresión logística la edad también fue la única variable asociada con un sistema de puntuación de Brasfield inferior.
DiscusiónNuestros resultados muestran que la mayoría de los pacientes presentó en algún momento del estudio una respuesta inmunitaria frente a A. fumigatus y C. albicans, lo que confirma la elevada tasa de exposición de los pacientes con FQ a estos hongos7. Al comparar las respuestas inmunitarias de los pacientes con FQ con las del grupo control observamos, ampliando las investigaciones de otros autores17, que los pacientes con FQ tienen títulos de inmunoglobulinas séricas específicas IgG, IgA e IgM frente a A. fumigatus y C. albicans significativamente más elevados que los individuos sanos, como respuesta a la colonización fúngica del aparato respiratorio inferior9. Esta facilidad para colonizar las vías aéreas inferiores se debe al daño existente en la primera línea de defensa frente a los hongos (barrera epitelial mucosa y macrófagos alveolares), que es secundario a las bronquiectasias. Esta colonización fúngica estimula las respuestas tipo T helper-1, con una gran producción de IgG, IgA e IgM frente a estos hongos, y en algunos pacientes una respuesta T helper-2, con producción de IgE específicas6,18.
Como se ha demostrado en investigaciones anteriores17, no encontramos relación entre la presencia o ausencia de A. fumigatus en las secreciones respiratorias (esputos o aspirados orofaríngeos) y los valores de IgG, IgA e IgM frente este hongo. A diferencia de A. fumigatus, los títulos de inmunorrespuestas frente a C. albicans fueron mayores en los pacientes que tenían C. albicans en las secreciones respiratorias que en los pacientes sin C. albicans. Sabiendo que las inmunorrespuestas fúngicas séricas traducen el grado de exposición a los hongos19-21, puede plantearse que el cultivo de estas muestras respiratorias no refleja el grado de exposición del tejido pulmonar a A. fumigatus, pero sí a C. albicans. Esto podría explicarse porque la presencia de un hongo en las secreciones respiratorias puede depender del tamaño de sus esporas, como observaron Mullins y Seaton22. Así, A. fumigatus, con esporas de pequeño tamaño, queda atrapado en las vías aéreas distales y puede encontrarse en el pulmón con mayor frecuencia de lo que cabría esperar por el cultivo de esputos o aspirados orofaríngeos. Una segunda hipótesis capaz de explicar esta discordancia entre el aislamiento de A. fumigatus en las muestras respiratorias y las respuestas inmunitarias específicas sería que quizá A. fumigatus puede desencadenar una respuesta inmunitaria específica, que persistiría en el organismo después de haber sido eliminado por las células fagocíticas locales23. Por ello, creemos que en los pacientes con FQ el cultivo de esputos y aspirados orofaríngeos no es un método válido para conocer la colonización del aparato respiratorio inferior por A. fumigatus, ya que infravaloran dicha colonización, pero sí es válido para conocer la colonización por C. albicans. Nuestros resultados muestran que las inmunorrespuestas humorales específicas frente a A. fumigatus y C. albicans sí pueden ser unos buenos marcadores de la colonización respiratoria por estos 2 hongos20.
Sin embargo, nuestro trabajo tiene algunas limitaciones metodológicas, ya que sólo se descartó la contaminación por C. albicans de la cavidad bucal mediante examen físico y no se descartaron otros posibles reservorios de este hongo, como son el aparato digestivo y la vagina. Así, el hecho de que las mujeres con FQ presentaran unos títulos de anticuerpos IgG e IgM frente a C. albicans significativamente mayores que los varones podría explicarse por la facilidad con que C. albicans coloniza el aparato genitourinario de las mujeres, especialmente si reciben ciclos frecuentes de antibióticos, con la posibilidad de generar también inmunorrespuestas específicas a la misma24.
En nuestro estudio también intentamos averiguar si A. fumigatus, C. albicans o sus inmunorrespuestas podían ser factores de riesgo para un mayor deterioro respiratorio. Sabiendo que muchas de las variables estudiadas están relacionadas unas con otras (así, a medida que aumenta la edad de los pacientes empeora su estado respiratorio), se realizó el análisis multivariable para intentar eliminar los factores de confusión. Una vez eliminados éstos, demostramos que ni el hallazgo de A. fumigatus ni el de C. albicans en las secreciones respiratorias, ni sus inmunorrespuestas séricas específicas IgG, IgA e IgM fueron factores de riesgo independientes para un mayor deterioro respiratorio, como ya habían señalado algunos autores para A. fumigatus3.
En resumen, los pacientes con FQ tienen títulos séricos elevados de IgG, IgA e IgM específicas frente a A. fumigatus y C. albicans en respuesta a la colonización del aparato respiratorio inferior por estos hongos. Para evaluar el grado de colonización del aparato respiratorio inferior de los pacientes con FQ por A. fumigatus no son válidos los cultivos de esputos ni aspirados orofaríngeos, sino que deben utilizarse las inmunorrespuestas séricas IgG, IgA e IgM frente a A. fumigatus. El aumento de la edad de los pacientes fue el principal factor de riesgo asociado con la probabilidad de cultivar A. fumigatus en las muestras respiratorias. Por último queremos destacar que la presencia de A. fumigatus y de C. albicans en las secreciones respiratorias de los pacientes con FQ no es un factor de riesgo independiente asociado con un deterioro respiratorio mayor, por lo que no debe realizarse un tratamiento específico de la colonización fúngica.
AgradecimientosAl Dr. José Francisco Cañón, de la Organización Nacional de Trasplantes, por su ayuda inestimable con el análisis estadístico.