Las sales de persulfato son uno de los agentes más frecuentemente implicados en el origen del asma ocupacional (AO). El objetivo de este estudio ha sido establecer la evolución de la hiperrespuesta bronquial y de las pruebas inmunológicas en pacientes con AO por persulfatos en función de que persista o no la exposición a dichas sales.
Pacientes y métodosSe estudió a 10 pacientes con AO por exposición a sales de persulfato, diagnosticados con prueba de provocación bronquial específica, en los que como mínimo habían transcurrido 3 años tras el diagnóstico. En todos los casos se realizaron un exhaustivo interrogatorio clínico y laboral, espirometría forzada y prueba de provocación bronquial inespecífica con metacolina, se determinaron los valores de inmunoglobulina E total y se practicaron pruebas cutáneas con las distintas sales de persulfato.
ResultadosEn el momento del control evolutivo, 7 pacientes habían abandonado la exposición a persulfatos. De los pacientes con hiperrespuesta bronquial positiva que habían abandonado el trabajo, se observó una mejoría significativa de ésta en 3 de ellos. Este hecho no se observó en ninguno de los pacientes que siguieron expuestos. La prueba cutánea específica se negativizó en 3 pacientes que no estaban expuestos en el momento del control evolutivo. Desde el punto de vista clínico, la mayoría de los pacientes continuaron presentando síntomas, aunque éstos habían mejorado, excepto en un caso en que, a pesar de evitar la exposición, empeoraron.
ConclusionesAunque pueden persistir los síntomas de asma y la hiperrespuesta bronquial positiva, la evolución de los pacientes con AO por persulfato parece ser favorable si se evita la exposición. Esta respuesta no parece diferir de la comunicada en otros casos de AO.
Persulfate salts are among the most frequently implicated causes of occupational asthma. The aim of this study was to describe the course of bronchial hyperresponsiveness and immunologic test results in patients with occupational asthma due to persulfate salts.
Patients and methodsTen patients with occupational asthma due to persulfate salts were studied. Diagnosis was based on specific bronchial challenge tests performed at least 3 years before enrollment. An exhaustive medical and work history was taken during interviews with all patients, and all underwent spirometry and nonspecific bronchial challenge testing. Total immunoglobulin E levels were determined and skin prick tests to several persulfate salts were performed.
ResultsAt the time of evaluation, 7 patients had avoided workplace exposure to persulfate salts. The bronchial hyperresponsiveness of 3 of those 7 patients had improved significantly. No improvement was observed in patients who continued to be exposed. Specific skin prick tests became negative in 3 patients who were no longer exposed at the time of the follow-up evaluation. Most of the patients continued to report symptoms, although improvements were noted. One patient, however, reported worsening of symptoms in spite of avoidance of exposure.
ConclusionsAlthough asthma symptoms and bronchial hyperresponsiveness may persist for patients with occupational asthma due to persulfate salts, their condition seems to improve if they avoid exposure. This course does not seem to differ from that reported for other cases of occupational asthma.
El asma ocupacional (AO) es la enfermedad respiratoria de origen laboral más frecuente en los países desarrollados y representa, según diferentes registros de notificación voluntaria, entre el 30 y el 60% de todas las enfermedades respiratorias de origen ocupacional1-3. Según estos mismos registros, los isocianatos constituyen el agente más frecuentemente implicado en la génesis de esta afección, aunque cada vez cobran más importancia agentes como las harinas, el látex o los persulfatos4-6. En concreto, la exposición a sales de persulfato se estimó que podía estar implicada en el 12% de los casos de AO registrados en Cataluña, donde representa la segunda causa de AO5. A pesar de esta posible alta incidencia de AO por exposición a sales de persulfato, hasta la actualidad tan sólo se han publicado 4 series destinadas a conocer las características clínicas de esta entidad7-10 y únicamente una de ellas hace referencia al seguimiento clínico de estos pacientes tras el diagnóstico9.
En general, se acepta que el mejor tratamiento para el AO es que el paciente evite el contacto con el agente responsable11. Sin embargo, un estudio reciente, en el que se realiza una revisión sistemática de los artículos publicados con el objeto de evaluar la evolución de los pacientes con AO tras evitar el agente causal, ha puesto de manifiesto que tan sólo el 32% de los pacientes mejora clínicamente12. En los escasos estudios en los que se evalúa la hiperrespuesta bronquial tras el diagnóstico en relación con la evitación del agente causal, aquélla continúa siendo elevada en el 70-74% de los pacientes12.
En el caso del AO por persulfatos, al no existir ningún estudio en este sentido, se desconoce cómo evoluciona la hiperrespuesta bronquial tras el cese de la exposición. El principal objetivo del presente trabajo ha sido conocer los cambios que experimenta la hiperrespuesta bronquial en pacientes diagnosticados de AO por persulfatos en función de si evitan o no la exposición a dicho agente. Como objetivo secundario se ha evaluado también la evolución de la respuesta inmunológica en estos pacientes.
Pacientes y métodosPoblación de estudioDe 11 pacientes diagnosticadas de AO en la Unidad de Enfermedades Respiratorias de Origen Ocupacional de un hospital de tercer nivel durante los años 1997–2002, se estudió de forma prospectiva a 10 mujeres con una edad media±desviación estándar de 38±9,7 años (rango: 24–52) en el momento del diagnóstico, desde el cual habían transcurrido como mínimo 3 años. Tres pacientes eran empleadas de una fábrica de cosméticos, donde se dedicaban a mezclar las sales de persulfato con otros agentes químicos para producir decolorantes capilares, mientras las 7 restantes trabajaban en salones de belleza como peluqueras y la exposición a persulfatos se producía al mezclar estos productos decolorantes con agua oxigenada para formar una pasta que aplicaban en el cabello. Ninguna de ellas tenía asma ni otros antecedentes respiratorios al iniciar su trabajo habitual. Las características clínicas de 7 de estas pacientes se han publicado previamente9.
El Comité Ético de nuestro centro aprobó el estudio y todas las pacientes firmaron el consentimiento informado.
Diagnóstico de asma ocupacional por persulfatosEn todos los casos el diagnóstico de AO por persulfatos se basó en la prueba de provocación bronquial específica, que se realizó siguiendo las directrices propuestas por nuestro grupo para el diagnóstico de este tipo de AO13. Brevemente, el primer día del test se mezclaron 5g de persulfato con 150g de lactosa y la paciente intercambiaba la mezcla de una bandeja a otra en una cabina de provocación durante 10min. En días sucesivos, si el test era negativo, la cantidad de persulfato mezclada con lactosa era de 10; 15, y 30g, respectivamente. El volumen espiratorio forzado en el primer segundo (FEV1) se determinó cada 10min durante la primera hora tras la exposición y posteriormente cada hora. La prueba se consideró positiva cuando se constató un descenso del FEV1 mayor del 20% del valor basal, siempre y cuando no se hubieran evidenciado cambios en dicho parámetro cuando el paciente fue expuesto a lactosa un día previo al inicio de la prueba.
Además, en todos los casos se realizaron una historia clínica completa con una exhaustiva historia laboral, una espirometría forzada con prueba broncodilatadora, seguimiento del pico de flujo espiratorio máximo, determinación de inmunoglobulina (Ig) E total en sangre periférica, pruebas cutáneas a neumoalérgenos habituales y a persulfato amónico y potásico, y prueba de provocación bronquial inespecífica con metacolina.
Estudio evolutivoDe enero a julio de 2006 se realizó una visita de control a todas las pacientes que habían expresado su conformidad para participar en el estudio. En dicha visita se efectuaron: un interrogatorio clínico y laboral exhaustivo, una espirometría forzada, una prueba de provocación bronquial inespecífica con metacolina, determinación de las concentraciones séricas de IgE total y pruebas cutáneas a las distintas sales de persulfato.
Interrogatorio clínico y laboral. Se interrogó sistemáticamente sobre la presencia de sibilancias, tos, expectoración, disnea y tirantez torácica a todas las pacientes, que puntuaron de 0 a 5 cada uno de estos síntomas en función de las molestias que les habían ocasionado durante el último año. Tras realizar la media, una puntuación de 0 indicaba ausencia de síntomas de asma, mientras que una puntuación de 5 indicaba síntomas en muchas ocasiones invalidantes, tal como se ha descrito en otras enfermedades14. Además, en función de los síntomas, el uso de adrenérgicos β2 y los estudios de función pulmonar, se clasificó a las pacientes en distintos grupos de gravedad de acuerdo con las directrices propuestas por la Global Initiative for Asthma (GINA)15. También se les preguntó si presentaban o no rinitis, conjuntivitis, dermatitis, si continuaban o no expuestas a la inhalación de sales de persulfatos y, en caso negativo, el tiempo transcurrido entre el diagnóstico y la última exposición.
Espirometría forzada. La espirometría forzada se realizó con un espirómetro Datospir (Datospir 120 D, Sibel, Barcelona, España), de acuerdo con la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)16. Como valores teóricos se utilizaron los propuestos por Roca et al17 para la población mediterránea.
Prueba de metacolina. La prueba de metacolina se efectuó siguiendo las directrices propuestas por Chai et al18. Brevemente, para su realización se usó un dosímetro Mefar MB3 (Mefar MB3, Bovezzo, Italia) con un tiempo de inhalación de 0,6s y una pausa interinhalatoria variable en función de las características de la paciente. A intervalos de 3min se realizaron 5 inhalaciones de concentraciones crecientes de metacolina (desde 0,003 hasta 8mg/ml) desde volumen corriente hasta capacidad pulmonar total, hasta que se constató un descenso del FEV1 mayor del 20% del valor basal o hasta que la paciente hubiera inhalado la dosis máxima. Se calculó la concentración de metacolina (mg/ml) capaz de producir un descenso del FEV1 superior al 20% (PC20) y se consideró la prueba negativa si la PC20 era mayor de 8mg/ml, tal como propone la European Respiratory Society19. Se consideraron cambios significativos en la hiperrespuesta bronquial variaciones de la PC20 de 3,2 veces respecto al valor basal20.
Pruebas inmunológicas. Excepto en una paciente, que en el momento del diagnóstico había presentado una reacción anafiláctica grave9, a todas las demás se les realizó una prueba cutánea a sales de persulfato potásico y amónico (Sigma-Aldrich Corporation, San Luis, MO, EE.UU.) según el método propuesto por Pepys21, que se ha descrito antes9,22. Brevemente, la prueba se realizó usando soluciones al 5% (p/v) de persulfato amónico y potásico. Como diluyente se utilizó tampón fosfato salino con el fin de evitar la acidificación de la solución acuosa. Como control positivo se utilizó una solución de histamina, y como control negativo, tampón fosfato salino. La prueba, cuyos resultados se leyeron a los 15min, se consideró positiva cuando la suma de los diámetros mayor y menor de la induración dividida por 2 era igual o superior a 3mm del obtenido con el control negativo. El control positivo con histamina fue siempre superior a 3mm en todas las pacientes. Desde el punto de vista inmunológico, se entendió que se había producido un cambio significativo si una prueba cutánea previamente positiva pasó a ser negativa durante el seguimiento o viceversa.
En todas las pacientes se determinaron las concentraciones séricas de IgE total (UniCAP System Pharmacia AB, Uppsala, Suecia), que se consideraron elevadas cuando eran superiores a 150 U/ml.
Análisis estadísticoLos resultados se describen mediante medias, desviación estándar y porcentajes. Dado el escaso número de pacientes, no se han realizado comparaciones entre grupos. Para evaluar si en un mismo grupo había mejoría en las distintas variables analizadas se utilizó el test no paramétrico de Wilcoxon. Las correlaciones entre variables se estudiaron aplicando el coeficiente de correlación de Spearman.
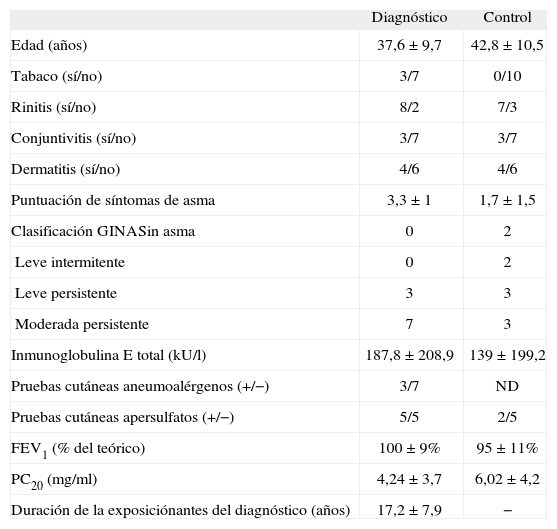
ResultadosEn la tabla I se resumen las características clínicas de las pacientes en el momento del diagnóstico y de la visita control. Tras el diagnóstico se aconsejó a todas las pacientes que evitaran la exposición a persulfatos y se les administró tratamiento para el asma con adrenérgicos β2 y corticoides inhalados en función de la gravedad de la enfermedad. El tiempo medio±desviación estándar transcurrido desde el diagnóstico hasta el control evolutivo fue de 62,8±19 meses (rango: 39–101). Siete pacientes cambiaron de trabajo, evitando totalmente la exposición a sales de persulfatos; el tiempo medio transcurrido desde el diagnóstico hasta el último contacto con las sales de persulfato fue de 3±3 meses (rango: 0–8). Tres pacientes siguieron trabajando como peluqueras en su lugar habitual, aunque evitando realizar las tareas que implicaban contacto con las sales de persulfato. El tiempo medio de seguimiento de estas 3 pacientes fue de 54,3±12,8 meses (rango: 45–69).
Características clínicas de los pacientes con asma ocupacional por exposición a sales de persulfato en el momento del diagnóstico y en el último control evolutivo
| Diagnóstico | Control | |
| Edad (años) | 37,6 ±9,7 | 42,8±10,5 |
| Tabaco (sí/no) | 3/7 | 0/10 |
| Rinitis (sí/no) | 8/2 | 7/3 |
| Conjuntivitis (sí/no) | 3/7 | 3/7 |
| Dermatitis (sí/no) | 4/6 | 4/6 |
| Puntuación de síntomas de asma | 3,3±1 | 1,7 ±1,5 |
| Clasificación GINASin asma | 0 | 2 |
| Leve intermitente | 0 | 2 |
| Leve persistente | 3 | 3 |
| Moderada persistente | 7 | 3 |
| Inmunoglobulina E total (kU/l) | 187,8±208,9 | 139 ±199,2 |
| Pruebas cutáneas aneumoalérgenos (+/−) | 3/7 | ND |
| Pruebas cutáneas apersulfatos (+/−) | 5/5 | 2/5 |
| FEV1 (% del teórico) | 100±9% | 95 ±11% |
| PC20 (mg/ml) | 4,24 ±3,7 | 6,02 ±4,2 |
| Duración de la exposiciónantes del diagnóstico (años) | 17,2 ±7,9 | − |
Valores expresados como media±desviación estándar o número de pacientes. FEV1: volumen espiratorio forzado en el primer segundo; GINA: Global Initiative for Asthma; ND: no determinado; PC20: concentración de metacolina capaz de producir un descenso del FEV1 superior al 20%.
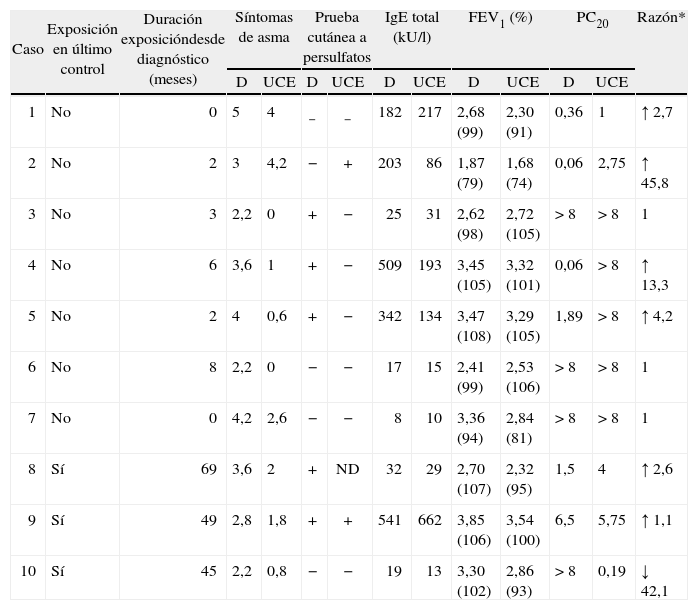
En la tabla II se detalla la evolución de los síntomas, de las pruebas cutáneas a persulfatos, de la IgE total sérica, del FEV1 y PC20 a metacolina en cada paciente. De las 7 que habían abandonado el trabajo, en 5 la PC20 fue superior a 8mg/ml en el momento del control evolutivo. Dos se consideraron curadas al no presentar síntomas de asma ni precisar tratamiento; 2 tenían asma leve intermitente y únicamente precisaban agonistas β2 a demanda de forma muy ocasional, y una paciente tenía una puntuación de síntomas de asma valorable y precisaba tratamiento habitual con corticoides inhalados. Las 2 pacientes con prueba de metacolina positiva a pesar de haber abandonado el trabajo tenían asma moderada persistente y precisaban tratamiento habitual con corticoides inhalados y agonistas β2 de larga duración.
Evolución de los síntomas clínicos, de las pruebas inmunológicas y de la hiperrespuesta bronquial en las pacientes con asma bronquial por exposición a sales de persulfatos
| Caso | Exposición en último control | Duración exposicióndesde diagnóstico (meses) | Síntomas de asma | Prueba cutánea a persulfatos | IgE total (kU/l) | FEV1 (%) | PC20 | Razón* | |||||
| D | UCE | D | UCE | D | UCE | D | UCE | D | UCE | ||||
| 1 | No | 0 | 5 | 4 | − | − | 182 | 217 | 2,68 (99) | 2,30 (91) | 0,36 | 1 | ↑ 2,7 |
| 2 | No | 2 | 3 | 4,2 | − | + | 203 | 86 | 1,87 (79) | 1,68 (74) | 0,06 | 2,75 | ↑ 45,8 |
| 3 | No | 3 | 2,2 | 0 | + | − | 25 | 31 | 2,62 (98) | 2,72 (105) | > 8 | > 8 | 1 |
| 4 | No | 6 | 3,6 | 1 | + | − | 509 | 193 | 3,45 (105) | 3,32 (101) | 0,06 | > 8 | ↑ 13,3 |
| 5 | No | 2 | 4 | 0,6 | + | − | 342 | 134 | 3,47 (108) | 3,29 (105) | 1,89 | > 8 | ↑ 4,2 |
| 6 | No | 8 | 2,2 | 0 | − | − | 17 | 15 | 2,41 (99) | 2,53 (106) | > 8 | > 8 | 1 |
| 7 | No | 0 | 4,2 | 2,6 | − | − | 8 | 10 | 3,36 (94) | 2,84 (81) | > 8 | > 8 | 1 |
| 8 | Sí | 69 | 3,6 | 2 | + | ND | 32 | 29 | 2,70 (107) | 2,32 (95) | 1,5 | 4 | ↑ 2,6 |
| 9 | Sí | 49 | 2,8 | 1,8 | + | + | 541 | 662 | 3,85 (106) | 3,54 (100) | 6,5 | 5,75 | ↑ 1,1 |
| 10 | Sí | 45 | 2,2 | 0,8 | − | − | 19 | 13 | 3,30 (102) | 2,86 (93) | > 8 | 0,19 | ↓ 42,1 |
D: diagnóstico; FEV1: volumen espiratorio forzado en el primer segundo; IgE: inmunoglobulina E; ND: no determinado; PC20: concentración de metacolina capaz de producir un descenso del FEV1 superior al 20%; UCE: último control evolutivo. (↑: incremento; ↓: descenso)
En las 3 pacientes que continuaban expuestas al agente causal, la PC20 aumentó en una, aunque no de forma significativa, mientras que en las 2 restantes disminuyó, descenso que fue significativo en una de ellas. Los síntomas de asma persistían en las 3; de ellas, 2 presentaban asma leve persistente y la restante, asma moderada persistente. Todas precisaban corticoides inhalados de forma habitual para su control.
Desde el punto de vista inmunológico, la prueba cutánea se negativizó en 3 pacientes que habían cambiado de puesto de trabajo. En una paciente con una prueba cutánea inicialmente negativa, ésta resultó positiva en el momento del control evolutivo, a pesar de que evitaba la exposición a sales de persulfato.
No hallamos diferencias significativas al comparar los resultados de IgE total, FEV1 y PC20 en el momento del diagnóstico y en el último control evolutivo, en ninguno de los 2 grupos. Sin embargo, sí se hallaron diferencias significativas en cuanto a mejoría de síntomas en el grupo de pacientes que evitaban la exposición tras el diagnóstico (p=0,042). Al analizar el grado de persistencia de los síntomas en función de la edad, tiempo de exposición, período de latencia y retraso diagnóstico, se observó una ligera correlación entre la persistencia de los síntomas y el retraso diagnóstico (r=0,413).
DiscusiónLos resultados obtenidos en este estudio podrían indicar que el pronóstico del AO por exposición a sales de persulfato es favorable si se evita la exposición. Éste es un hecho trascendente, ya que la exposición a sales de persulfato se está convirtiendo en una de las causas más frecuentes de AO4,5. Sin embargo, este pronóstico, en principio favorable, debe matizarse. Efectivamente, si bien, desde el punto de vista clínico, en el grupo de las pacientes que evitaron la exposición los síntomas mejoraron de forma significativa, tan sólo 2 pueden considerarse curadas, en el resto los síntomas de asma persistían con diferente intensidad. Es un hecho conocido que un importante número de pacientes con AO por distintos agentes persisten con asma muchos años después de haber abandonado la exposición23. Parece ser que los factores que contribuirían a perpetuar los síntomas podrían ser la larga duración de la exposición antes de la aparición de aquéllos; el retraso diagnóstico, con una prolongada duración de los síntomas antes de éste, y finalmente el grado de intensidad de los síntomas en el momento del diagnóstico24-26. El efecto del tabaco y de la edad en cuanto a la recuperación de los síntomas se refiere es dudoso, aunque diversos estudios señalan que los síntomas son más persistentes en pacientes de mayor edad27,28. En el presente estudio, aunque con un número escaso de pacientes, únicamente se ha evidenciado una ligera relación entre la persistencia de los síntomas y el retraso diagnóstico.
Aunque hay menos casos estudiados, la mayoría de los autores parecen estar de acuerdo en el hecho de que los pacientes diagnosticados de AO que siguen expuestos al agente causal no mejoran a pesar de recibir tratamiento médico29,30. En nuestro caso, en las 3 pacientes que permanecían en contacto con los persulfatos la puntuación de síntomas mejoró, aunque no de forma significativa, sin modificar la clasificación de su asma. En este sentido, 2 de ellas continuaron con asma leve persistente y la tercera con asma moderada persistente. Esta evolución contrasta con la que nuestro grupo había observado en pacientes con AO por isocianatos, en la que se constató un claro empeoramiento tanto clínico como funcional en todos aquellos pacientes que no abandonaban la exposición31, o la descrita por Paggiaro et al26 también en pacientes con AO por isocianatos.
En nuestra serie, en todas las pacientes que abandonaron la exposición se constató una mejoría de la hiperrespuesta bronquial, mejoría que fue significativa en 3 de ellas (aumento de la PC20 3,2 veces respecto al valor basal). En 2 de estas pacientes una prueba previamente positiva fue negativa en el último control. Si bien no se conocía la evolución de la hiperrespuesta bronquial en pacientes con AO por persulfatos cuando evitan la exposición, los resultados observados son similares a los obtenidos en otros tipos de AO. Efectivamente, una revisión sistemática de la literatura médica realizada por Rachiotis et al12 ha puesto de manifiesto que en torno al 26-30% de los pacientes con AO se negativiza la hiperrespuesta bronquial al abandonar la exposición al agente causal. Estudios recientes parecen evidenciar que la hiperrespuesta bronquial mejora a medida que aumenta el tiempo sin contacto con el antígeno, aunque esta mejoría es más rápida en los 2,5 primeros años tras el cese de la exposición32. Se desconoce qué factores determinan la persistencia y gravedad de la hiperrespuesta bronquial en pacientes con AO a pesar de abandonar el contacto con el agente causal. Algunos autores señalan que una buena función pulmonar y una PC20 a la metacolina elevada en el momento del diagnóstico se asocian a un mejor pronóstico33. Sin embargo, otros estudios parecen relacionar la mejoría de la hiperrespuesta bronquial con la duración de la exposición26,34-36. Recientemente se ha podido comprobar, mediante análisis celulares en esputo inducido, que en los pacientes en los que persiste una hiperrespuesta bronquial positiva existe un grado de inflamación bronquial superior al de aquéllos en quienes se ha negativizado, siendo probablemente esta inflamación la responsable de la perpetuación de los síntomas y de la hiperrespuesta bronquial37.
Al igual que ocurre con los estudios clínicos, también son escasos los estudios que evalúan la evolución de la hiperrespuesta bronquial cuando el paciente continúa en contacto con el agente causal. En nuestro caso, a pesar de constatar una mejoría en los síntomas, en 2 de 3 pacientes la hiperrespuesta bronquial empeoró, aunque sólo en una de forma significativa. Estos resultados son similares a los comunicados por Padoan et al33 en pacientes con AO por isocianatos, aunque difieren de los recientemente publicados por Vandenplas et al38 en pacientes con AO por látex. En este último caso se constató también una mejoría de la PC20 en los pacientes que, sin abandonar el contacto, disminuyeron la exposición al látex. Esta diferente respuesta observada podría guardar relación con el mecanismo inmunológico por el cual se origina el AO. En el caso del látex, al ser un agente de alto peso molecular, el mecanismo implicado probablemente sea dependiente de la IgE, mientras que en el caso de los persulfatos y de los isocianatos, al ser agentes de bajo peso molecular, puede haber otros mecanismos inmunológicos que condicionen que se perpetúe en mayor medida la hiperrespuesta bronquial a pesar de disminuir la exposición al antígeno causal y, además, que la respuesta al tratamiento farmacológico habitual no sea óptima.
Finalmente, desde el punto de vista inmunológico, si bien en general no hemos observado un descenso de las concentraciones de IgE total en las pacientes que habían abandonado el contacto con respecto a las que continuaban expuestas, resulta interesante el hecho de que en 3 pacientes con una prueba cutánea positiva a persulfatos ésta se negativizó en el control evolutivo. Este hecho ha sido también recientemente descrito por Park et al39 en pacientes con AO por exposición a colorantes. El significado que puede tener este hecho en cuanto a la evolución clínica y funcional es dudoso. Si bien en nuestro caso las pacientes en que se negativizó la prueba cutánea prácticamente no tenían síntomas en el momento del control evolutivo y la PC20 a la metacolina fue en todas ellas superior a 8mg/ml, no ocurrió lo mismo en los pacientes descritos por Park et al39, en quienes la evolución clínica y de la hiperrespuesta bronquial fue independiente de la negativización de la prueba cutánea. Resultados similares, pero referidos a valores de IgE específica, han comunicado Malo et al40 en trabajadores de la industria alimentaria y Barker et al41 en pacientes expuestos a anhídrido tetracloroptálico. En ambos estudios se observa una disminución de los valores de IgE específica especialmente acentuada durante los 2 primeros años tras evitar la exposición, aunque dicha disminución tampoco parece relacionarse con la evolución clínica y funcional de estos pacientes.
En una de nuestras pacientes con una prueba cutánea negativa a persulfatos ésta resultó positiva en el control evolutivo, cuando la paciente ya había abandonado la exposición a dicho agente. La explicación de este hecho resulta difícil. Una posibilidad podría ser que inicialmente se tratara de un falso negativo; otra posibilidad deriva del hecho de que para la producción continua de anticuerpos IgE específicos no es necesaria la exposición persistente al antígeno, tal como demostraron Bice et al42 en estudios inmunológicos realizados en perros. De hecho, llama la atención que la paciente en la que se positivizó la prueba cutánea a persulfatos es la única de la serie en la que se constató un empeoramiento clínico a pesar del tratamiento médico aplicado y del abandono absoluto de la exposición.
En conclusión, en el presente estudio se describe por primera vez la evolución de la hiperrespuesta bronquial y de las pruebas inmunológicas en los pacientes con AO por exposición a sales de persulfato. Aunque la población estudiada es escasa, parece que la evolución clínica y funcional de estos pacientes es favorable si abandonan la exposición. En general, la evolución no difiere de la descrita para otros agentes12, en el sentido de que tanto los síntomas de asma y la necesidad de tratamiento para el control de éstos como la hiperrespuesta bronquial persisten en aproximadamente el 70% de los pacientes diagnosticados de AO a pesar de evitar la exposición.
Trabajo financiado en parte por una beca FIS PI050100 (Instituto de Salud Carlos III. Madrid).