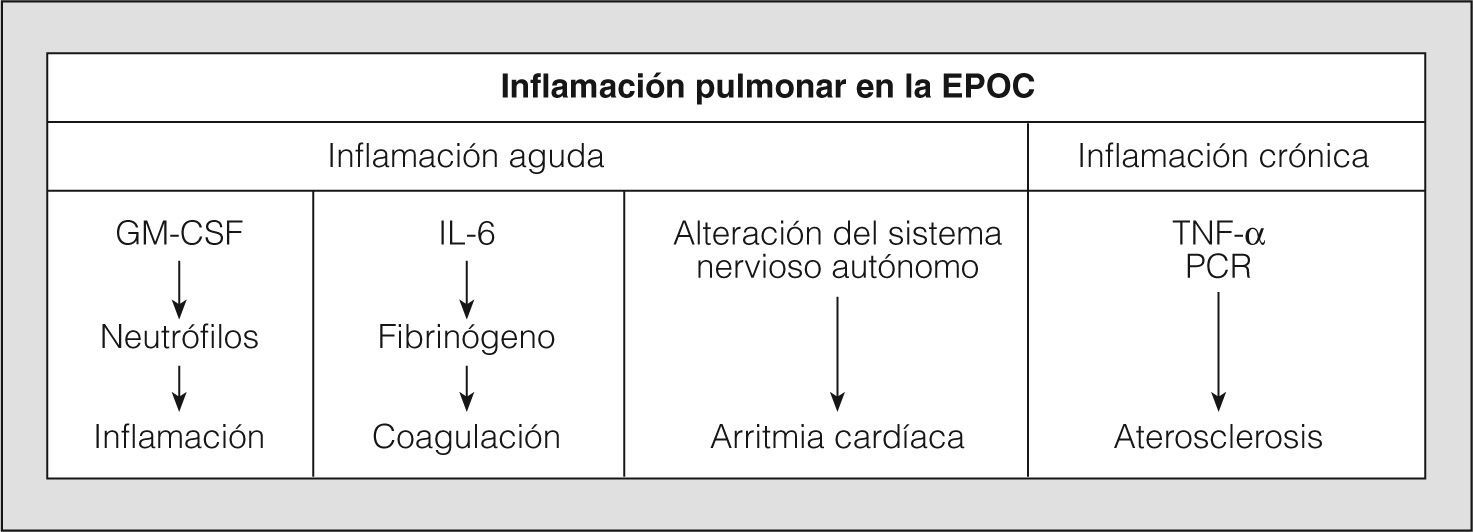
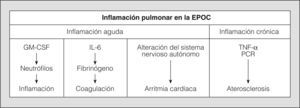
La enfermedad pulmonar obstructiva crónica (EPOC) es un proceso clínico caracterizado por una limitación al flujo aéreo que no es completamente reversible. Esta limitación es, por lo general, crónica y progresiva, y se asocia a una respuesta inflamatoria pulmonar anormal frente a partículas o gases nocivos, especialmente a los componentes del humo del tabaco1. El descenso de la función pulmonar en estos pacientes se relaciona con un mayor número de acontecimientos cardiovasculares y muertes de causa cardíaca, aunque los mecanismos responsables de esta asociación no son bien conocidos2. La relación entre la EPOC y las enfermedades cardiovasculares, ligada a un componente inflamatorio sistémico, se ha detectado incluso en los pacientes que presentan una obstrucción leve o moderada. De hecho, se ha evidenciado que pequeñas reducciones del flujo respiratorio pueden ya incrementar en 2 o 3 veces la morbimortalidad cardiovascular3. La inflamación no sólo es un factor etiológico primordial en el desarrollo de la EPOC, sino que también se reconoce como un elemento fisiopatológico importante en el origen de la aterosclerosis4 (fig. 1). Además del papel del tabaco como agente iniciador de la inflamación en los pacientes que tienen EPOC, otras circunstancias, como la dislipemia o la obesidad, están implicadas en el daño endotelial vascular por la vía del estrés oxidativo.
La inflamación pulmonar en la EPOC puede dar lugar a trastornos agudos y crónicos que, mediados por las citocinas circulantes, contribuyen a la aparición de acontecimientos cardiovasculares. GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; IL-6: interleucina-6; PCR: proteína C reactiva; TNF-α: factor de necrosis tumoral alfa.
Diferentes estrategias terapéuticas, entre las que se encuentran el abandono del consumo de tabaco y el tratamiento con estatinas, pueden actuar sobre el componente inflamatorio y el estrés oxidativo. Esta forma de aproximarse al tratamiento podría influir en el origen y la evolución de las complicaciones cardiovasculares de la EPOC y disminuir la mortalidad de los pacientes que la presentan4.
EpidemiologíaLa EPOC es la cuarta causa de morbimortalidad tanto en España como en el resto de los países desarrollados y es un problema sociosanitario de primera magnitud. Según la Organización Mundial de la Salud, la prevalencia mundial de esta enfermedad, que actualmente afecta a unos 52 millones de personas, se duplicará en 2020. De esta forma, la EPOC se convertirá en la tercera causa de muerte en el mundo5,6. En España la prevalencia estimada es, según los datos del estudio IBERPOC, del 9% en los varones mayores de 40 años, cifra que se eleva al 20% en los de edad superior a los 65 años. Además, se considera que su frecuencia va a seguir aumentando en las próximas décadas. Ante estos datos no resulta extraño que la EPOC se haya convertido en una de las enfermedades que más costes económicos ocasionan al sistema sanitario7,8.
Las enfermedades cardiovasculares y cerebrovasculares son la principal causa de muerte en los países desarrollados. A pesar de que la mortalidad global producida por estos trastornos está descendiendo, estas enfermedades son causa principal de muerte en los pacientes con EPOC9, incluso en sus fases iniciales10. Por ejemplo, Soriano e Izquierdo Alonso11 comprobaron, al analizar la supervivencia de un grupo de individuos con EPOC, que las causas de muerte más importantes en estos pacientes eran, después de las respiratorias (33,8%), las cardiovasculares (24,4%).
Factores de riesgoLos principales factores iniciadores de la inflamación en los pacientes con EPOC son el consumo de tabaco y la exposición a partículas aéreas nocivas. Otros factores, como la obesidad o la dislipemia, están implicados en el desarrollo de inflamación sistémica y, por tanto, en el daño endotelial vascular que lleva a la aparición de alteraciones cardiovasculares.
TabacoEl factor etiológico esencial en el desarrollo de la EPOC es el humo del tabaco. Esta noxa es también un factor de riesgo fundamental en la aparición de otras enfermedades, entre las que se incluyen las cardiovasculares. Repetidamente se ha demostrado que el humo del tabaco produce numerosos efectos que condicionan un aumento del riesgo cardiovascular: la activación plaquetaria, el descenso del activador tisular del plasminógeno, el incremento del inhibidor del activador del plasminógeno-1 y la tendencia a que en el organismo se establezca un "estado protrombótico". Además, desciende las concentraciones séricas del colesterol unido a lipoproteínas de alta densidad, aumenta las del colesterol unido a lipoproteínas de baja densidad, los triglicéridos y las lipoproteínas de muy baja densidad, y puede alterar la función endotelial en las paredes arteriales12.
El fibrinógeno y otros factores hemostáticos que intervienen en la formación de trombos se elevan en todos los estados inflamatorios, tanto vasculares como sistémicos. Esta inflamación, inducida por el daño pulmonar y las infecciones respiratorias, predispone en los individuos fumadores al desarrollo de lesiones coronarias13,14. Por otra parte, la proteína C reactiva (PCR), que se comporta como un marcador de inflamación sistémica, se asocia, cuando aumenta, con la presencia de otros factores de riesgo cardiovascular, como la edad, el tabaco, la hipertensión arterial, la obesidad y la dislipemia. De esta manera, es posible que un incremento de los valores séricos de la PCR pueda predecir la existencia de EPOC significativa o, incluso, la gravedad de esta enfermedad. De hecho, en los pacientes fumadores la elevación de la tasa sérica de esta proteína es más importante12,15,16.
El abandono del tabaco, además de ser la medida más eficaz y rentable para reducir el riesgo de presentar EPOC y detener su progresión17, se asocia con una disminución del número de accidentes cardíacos agudos que se presentan y con una mejoría de las lesiones vasculares arterioscleróticas que puedan existir18. No obstante, conviene señalar que, de acuerdo con el estudio de Sin y Man2, la relación existente entre los cambios que se suceden en el volumen espiratorio forzado en el primer segundo (FEV1) y la aparición de complicaciones aterotrombóticas se da con independencia de los efectos del tabaco.
Partículas aéreas nocivasDiversos mecanismos pueden explicar cómo las partículas aéreas de la polución pueden promover el desarrollo de una enfermedad cardíaca4. En primer lugar, la inflamación en el pulmón podría provocar una inestabilidad del sistema nervioso autónomo y facilitar la aparición de arritmias cardíacas19. En segundo lugar, la producción de algunas citocinas en el pulmón, como la interleucina (IL) 6, podría favorecer un estado de hipercoagulabilidad que predispondría a los fenómenos trombóticos20. Además, otras citocinas, como el factor estimulante de colonias de granulocitos y macrófagos, podrían ocasionar un incremento de la activación o de la circulación de los leucocitos, células que, a su vez, inducirían la rotura inflamatoria de las placas de ateroma21. Conviene recordar que las citocinas producidas en el pulmón estimulan la síntesis hepática de proteínas reactantes de fase aguda, como la PCR y el fibrinógeno, sustancias que también son protrombóticas. En realidad, la diátesis trombótica es el mecanismo que mejor se relaciona y predice, globalmente, la morbilidad y la mortalidad cardiovasculares22.
DislipemiaEn múltiples estudios se ha comprobado que el aumento de los valores séricos del colesterol unido a lipoproteínas de baja densidad se asocia a una elevación de las cifras sanguíneas de la PCR, así como a un incremento del riesgo de muerte cardiovascular, daño miocárdico, accidente isquémico transitorio y hospitalización por angina inestable23. Del mismo modo, en sucesivos trabajos también se han demostrado la eficacia y la seguridad de los fármacos inhibidores de la 3-hidroxi-3-metilglutaril coenzima A reductasa (estatinas) en la reducción de los valores séricos de la PCR y, con ello, del riesgo de presentar una enfermedad cardiovascular24. El tabaco disminuye, como se ha señalado antes, las concentraciones séricas del colesterol unido a lipoproteínas de alta densidad y aumenta las del colesterol unido a lipoproteínas de baja densidad, triglicéridos y lipoproteínas de muy baja densidad, con lo que favorece la aparición de accidentes cardiovasculares12.
Las estatinas, como fármacos inhibidores de la 3-hidroxi-3-metilglutaril coenzima A reductasa, se emplean para prevenir y tratar las enfermedades cardiovasculares25,26. Tienen, además, otros efectos importantes, entre los que se incluyen su capacidad para aumentar la síntesis del óxido nítrico y de las prostaciclinas, para inhibir la trombogenia y para reducir la respuesta inflamatoria.
ObesidadEs razonable suponer que la obesidad puede comprometer la eficacia de la mecánica respiratoria y aumentar así el trabajo que se requiere para realizar las actividades de la vida diaria. Sin embargo, en algunos estudios se ha comprobado que en los pacientes con EPOC la mortalidad es inferior si además son obesos27,28. La pérdida de peso en estos pacientes se ha atribuido a los efectos sistémicos de algunas citocinas de síntesis pulmonar, en particular los del factor de necrosis tumoral alfa (TNF-α)29. En numerosos trabajos se ha demostrado que las concentraciones séricas de esta sustancia están aumentadas en los pacientes que, teniendo EPOC, adelgazan4,30,31. No obstante, aún no se ha aclarado si estos factores pueden tener algún papel cuando hay alguna enfermedad cardíaca o si pueden ser relevantes en los pacientes con EPOC que simultáneamente tienen cierto sobrepeso.
Sí es evidente, por el contrario, que el tejido adiposo participa activamente en la regulación de los mecanismos fisiopatológicos que intervienen en la reacción inflamatoria y en la respuesta inmunitaria del organismo. Las adipocinas (principalmente la leptina y la adiponectina) desarrollan una función importante no sólo en la ateromatosis, sino también en la reacción inflamatoria que aparece en la EPOC y, quizá, en el vínculo que puede existir entre esta enfermedad y algunos trastornos cardiovasculares32.
AgudizacionesLas agudizaciones de la EPOC pueden acentuar los fenómenos inflamatorios. Las infecciones crónicas producidas por algunos microorganismos gramnegativos o por Chlamydia pneumoniae parece que favorecen la reacción inflamatoria que existe en la aterosclerosis9,33. Además, la inflamación sistémica, el estrés oxidativo, la hiperfibrinogenemia y el aumento del péptido vasoconstrictor endotelina-1, todo ello habitual en las agudizaciones de la EPOC, podrían contribuir al deterioro de la función endotelial y vascular y, por tanto, a la aparición de enfermedades cardio y cerebrovasculares9,34,35.
Función pulmonarSin y Man3, en un intento de demostrar que la reducción de la función pulmonar es un factor de riesgo para los acontecimientos cardiovasculares, llevaron a cabo un estudio en el que evidenciaron que por cada 10% de caída del FEV1 la mortalidad global aumentaba un 14%, la mortalidad cardiovascular un 28% y las complicaciones coronarias al menos un 20%. Observaron además que la disminución del cociente FEV1/capacidad vital forzada era un factor de riesgo independiente para el desarrollo de accidentes coronarios, cuya probabilidad aumentaba en un 30%. En los pacientes con EPOC que también tenían arritmias ventriculares el riesgo de enfermedad coronaria se duplicaba. En resumen, los datos expuestos parecen indicar que la EPOC es, por sí misma, un factor de riesgo independiente en lo que a la morbimortalidad cardiovascular se refiere. Es más, en el trabajo mencionado también se observó que el incremento de los valores séricos de la PCR era capaz de duplicar la probabilidad de lesiones cardíacas.
En sentido inverso, el aumento del trabajo respiratorio que se produce en la EPOC, sobre todo durante el ejercicio, momento en el que la musculatura respiratoria llega a necesitar un 50% del consumo total de oxígeno, puede ser un problema real en los individuos en los que la función cardíaca está comprometida36.
Hipertensión pulmonarLa hipertensión pulmonar que aparece en la EPOC puede producirse por varios mecanismos, entre los que la pérdida del lecho vascular pulmonar, la puesta en marcha del reflejo vasoconstrictor hipóxico, la microtrombosis capilar y la estasis circulatoria secundaria a la hiperviscosidad poliglobúlica son los más importantes4. La hipertensión pulmonar suele ocasionar cor pulmonale crónico, que se caracteriza por hipertrofia, dilatación y, finalmente, insuficiencia del ventrículo derecho37. La homeostasis de los fluidos y los electrolitos también se modifica, al alterarse la secreción de la hormona natriurética en respuesta a la hipoxia y la dilatación de las venas pulmonares y de las cavidades derechas38. No en balde a veces es difícil diferenciar, desde el punto de vista clínico, la exacerbación de la EPOC de la agudizacion de una insuficiencia cardíaca crónica. A este respecto puede ser útil la determinación de los valores séricos del péptido natriurético cerebral (BNP)39.
Marcadores biológicosLos numerosos trabajos epidemiológicos realizados hasta la fecha se han traducido, entre otras cosas, en la aparición de diversos marcados capaces de ofrecer posibilidades inéditas en el estudio de la enfermedad cardiovascular. Cabe suponer que la valoración de estos nuevos marcadores, en conjunción o no con la de los factores de riesgo tradicionales, puede servir para predecir, con mayor seguridad que hasta ahora, la probabilidad de que aparezcan o no los acontecimientos relacionados con la enfermedad referidos. Parece claro, además, que la EPOC puede tener utilidad como "marcador" biológico de la cardiopatía isquémica y viceversa. En este sentido, cada vez son más abundantes los trabajos que encuentran que en la EPOC es frecuente hallar un incremento de los valores séricos de diversos mediadores de la reacción inflamatoria. A este respecto, a continuación se analizan algunos de los marcadores que han adquirido mayor relevancia en la actualidad.
Péptido natriurético cerebralEl BNP es una hormona peptídica que se sintetiza principalmente en el ventrículo izquierdo y a la que se atribuyen propiedades vasodilatadoras y diuréticas40. El concepto de que el "corazón es un órgano endocrino secretor de hormonas al medio interno" ha llevado al estudio de esta sustancia como un marcador con valor diagnóstico y pronóstico en los pacientes que presentan insuficiencia cardíaca41. El BNP se sintetiza en el miocardiocito como una preprohormona (pre-proBNP), que se escinde luego en 2 moléculas, el proBNP y un péptido señal. El proBNP se divide a su vez en el propio BNP y en un péptido N-terminal sin actividad biológica (NTproBNP)42.
En la práctica clínica, cuando haya que valorar estas sustancias, debe tenerse en cuenta que en la insuficiencia cardíaca que se asocia con otros trastornos el aumento de las concentraciones séricas del BNP y del NTproBNP no permite asegurar que la disnea del paciente es de origen cardíaco, ya que otras enfermedades, como la EPOC, también pueden ser responsables de ella. Conviene saber asimismo que varios estudios han señalado que el incremento del BNP y del NTproBNP podría ser útil como marcador de la gravedad y, por tanto, como índice pronóstico de la EPOC y del cor pulmonale crónico, ya que expresaría la alteración del equilibrio hidroelectrolítico que se produce por la hipoxia y la distensión de las venas pulmonares y las cavidades cardíacas derechas37,43,44.
Dímero DEl dímero D es un fragmento que se desprende de la fibrina durante su degradación y que se libera por la acción de la plasmina. Se utiliza en la clínica como un marcador que habla de la existencia de fibrina y que sirve para detectarla. Se encuentra elevado siempre que la coagulación está activada y se genera fibrina, por lo que es útil en el diagnóstico de la trombosis venosa y de la embolia pulmonar. Es una de las variables hemostáticas más estudiadas por su asociación con las enfermedades cardiovasculares45, pero sus valores séricos también se elevan en los individuos fumadores en comparación con los no fumadores46.
Adipocinas o adipocitocinasLas adipocinas son sustancias segregadas por el tejido adiposo. Sin embargo, sólo la leptina y la adiponectina (quizá también la resistina, la adipsina y la visfatina) tienen su origen esencial en los adipocitos. Los estímulos infecciosos e inflamatorios aumentan las concentraciones de leptina, lo que activa a los monocitos e induce la respuesta de los linfocitos T cooperadores tipo 1 (T helper-1), con lo que se favorece la ateromatosis y se pone en marcha una acción proinflamatoria. Por el contrario, el estímulo inflamatorio disminuye los valores de la adiponectina, con lo que disminuyen las citocinas antiinflamatorias y las moléculas de adherencia del endotelio vascular. Se facilita también así la ateromatosis y la reacción inflamatoria47.
Bruno et al32 han evidenciado en diferentes trabajos que la leptina se encuentra sobreexpresada en la submucosa de pacientes con EPOC y que las células positivas a leptina se relacionan inversamente con los valores del FEV1 y del cociente FEV1/capacidad vital forzada. Además, la expresión de la leptina se relaciona con la gravedad de la EPOC según la clasificación de la Global Initiative for Chronic Obstructive Lung Disease (GOLD). Por tanto, la hiperleptinemia y la hipoadiponectinemia parecen asociarse con la respuesta inflamatoria y con los acontecimientos cardiovasculares que presentan los pacientes con EPOC.
FibrinógenoLa hiperfibrinogenemia incrementa el riesgo cardiovascular al favorecer la formación de fibrina y la agregación plaquetaria y al aumentar la viscosidad plasmática48. La síntesis y los valores de fibrinógeno dependen de polimorfismos genéticos heredados, pero también de circunstancias ambientales como el consumo de tabaco. A pesar de que los estudios realizados hasta la fecha son poco concluyentes, parece que el polimorfismo del gen fibrinógeno-β puede modificar el efecto del humo del tabaco sobre el fibrinógeno circulante49. Además, la hiperfibrinogenemia que aparece coincidiendo con las agudizaciones de la EPOC podría contribuir a la disfunción endotelial y, por tanto, a la génesis de enfermedades cardio y cerebrovasculares9,50.
Proteína C reactivaLa PCR es una proteína reactante de fase aguda sintetizada por el hígado en respuesta al estímulo inducido por la IL-6 (tabla I). Posee un efecto proinflamatorio y proaterógeno sobre las células endoteliales, al aumentar la expresión de moléculas de adherencia y quimiotácticas. Además, favorece la liberación por los monocitos de citocinas proinflamatorias como la IL-1b y el TNF-α. Parece que las acciones proinflamatorias están mediadas, al menos en parte, por la activación del factor de transcripción nuclear kappa B (NF-κB), aunque también puede que influyan en este sentido la lesión endotelial, la producción de radicales libres de oxígeno y la migración y activación de las células musculares lisas de la pared vascular51,52.
Mediadores y función de las diferentes citocinas producidas por los macrófagos en la EPOC
| Citocinas de monocitos y macrófagos | |
| Mediadores | Función |
| TNF-αIL-1bIL-4IL-6IL-8 | ↑ MMP, ↑ cascada oxidativa, ↑ Liberación de citocinas, ↑ actividad monocítica-quimiotáctica↑ MMP, ↑ TIMP, ↑ desgranulación de los neutrófilos, ↑ liberación de citocinas↓ TNF-α inducido por la apoptosis↑ síntesis de la PCR, ↑ fibrinógeno, ↑ en las exacerbaciones de la EPOC↑ desgranulación de los neutrófilos, ↑ leucotrieno B4 (principal factor quimiotáctico de los neutrófilos) |
IL: interleucina; MMP: metaloproteinasas; PCR: proteína C reactiva; TIMP: factor inhibidor tisular de las MMP; TNF-α: factor de necrosis tumoral alfa.
Varias líneas argumentales apuntan a que la inflamación contribuye al desarrollo de la aterosclerosis. Por ejemplo, la elevación de la PCR no sólo parece ser el principal factor de riesgo para el desarrollo de enfermedades cardiovasculares53,54, sino que también añade un valor pronóstico cuando se aplica al de la escala de Framinghan55. La EPOC es asimismo una enfermedad inflamatoria, por lo que en ella las concentraciones séricas de esta proteína suelen estar aumentadas, algo que también se observa en los fumadores activos que no presentan la enfermedad12. Tanto las estatinas24 como los corticoides56,57, con independencia de que se administren por vía oral o inhalada, reducen los valores séricos de la PCR en los pacientes con EPOC. Disminuyen así la inflamación sistémica y, con ello, el riesgo de presentar un accidente cardiovascular.
Factor de necrosis tumoral alfaEl TNF-α o caquectina es una proteína que desempeña un papel mediador en la respuesta inflamatoria, en la que interviene al iniciar la cascada de las citocinas. En las secreciones respiratorias de los pacientes con EPOC se encuentra a concentraciones elevadas, sobre todo en el transcurso de las agudizaciones58,59. También aumentan sus valores séricos y su producción por las células monocitarias de la sangre periférica en los pacientes con EPOC que pierden peso30 (tabla I). Además, el TNF-α inhibe la expresión de las proteínas del músculo esquelético mediante la activación del NF-κB60. Confirmados los hallazgos mencionados por diversos estudios31,61-63, y ya que la obesidad es un conocido factor de riesgo para la morbimortalidad cardiovascular, cabe pensar que la relación entre esta última y la EPOC podría estar mediada por el TNF-α, que podría actuar, por este motivo, como un marcador biológico de interés clínico. Qué duda cabe que deben realizarse nuevos trabajos para refrendar esta hipótesis.
MetaloproteinasasLas metaloproteinasas (MMP), sobre todo las MMP-1, MMP-2 y MMP-9, son colagenasas que regulan la homeostasis de la matriz pulmonar, constituida en su mayor parte por colágeno64. Algunas de ellas, en especial la MMP-9, se han considerado posibles marcadores de la remodelación, al observarse una sobreproducción local de la MMP-9 y una alteración en el equilibrio entre ésta y su inhibidor, el inhibidor tisular de la MMP tipo 1 (TIMP-1), en los pacientes con EPOC65. Por tanto, podría ser el equilibrio entre las proteasas y sus inhibidores el que mejor reflejase la intensidad de la enfermedad, equilibrio que mostraría un crecimiento progresivo desde la situación de los individuos sanos hasta la de los pacientes con EPOC66. Sin embargo, se necesitan más estudios para aclarar si estas enzimas tienen verdaderamente un papel en el pronóstico de la enfermedad.
En los vasos sanguíneos las MMP, al disminuir la cantidad de colágeno, hacen que la placa de ateroma sea más frágil, lo que, sumado a la inflamación arterial existente, facilitaría la rotura de la placa y, consiguientemente, la aparición de manifestaciones clínicas isquémicas67.
Marcadores de estrés oxidativoEl desequilibrio entre los agentes oxidantes exógenos y los antioxidantes endógenos provoca lesiones en la matriz extracelular y en el epitelio de la vía aérea, además de actuar como un factor inflamatorio mediado por citocinas68. Varios estudios69,70 han demostrado que la exposición al humo del tabaco puede inducir el desarrollo de estrés oxidativo y la liberación de mediadores inflamatorios en la vía aérea, provocando cambios estructurales en los individuos sensibles, lo que podría ocasionar un descenso progresivo de la función pulmonar. Además, cada vez son más los estudios que relacionan el estrés oxidativo inducido por el tabaco con las enfermedades cardiovasculares71,72.
Por tanto, las alteraciones genéticas de las enzimas antioxidantes presentes en el pulmón y en la vía aérea, como la superóxido dismutasa, la glutatión-S-transferasa, la hidrolasa epóxido microsómica o la hemooxigenasa-1, entre otras, pueden incrementar el estrés oxidativo y favorecer el daño pulmonar inducido por el tabaco73.
NeopterinaLa neopterina es un marcador de la activación del sistema monocítico-macrofágico y su liberación se relaciona con la capacidad de estas células para producir radicales libres de oxígeno. La neopterina modula el estado oxidativo intracelular y da lugar a translocaciones de subunidades del NF-κB al núcleo, lo que incrementa la expresión de los genes proinflamatorios que codifican citocinas como la IL-6 y el TNF-α. El interferón gamma, liberado por los linfocitos T cooperadores tipo 1 y por las células citolíticas, es la citocina más potente en la inducción de dicha sustancia y la que más aumenta la concentración de la neopterina en los fluidos corporales. La tasa de neopterina se correlaciona con los valores de interferón gamma, a su vez liberado por los linfocitos T activados, con lo que la neopterina se convierte así en un marcador sensible de la inmunidad celular74. Las concentraciones de neopterina reflejan, por tanto, el estado del estrés oxidativo que es secundario a la activación del sistema inmunitario75.
Se ha encontrado que las concentraciones de neopterina y de otros marcadores de la inmunidad celular son mayores en los pacientes con EPOC que en los controles sanos, lo que podría asociarse a una mayor susceptibilidad a las infecciones del aparato respiratorio en estos pacientes76. Además, cada vez son más los estudios que señalan que la tasa de neopterina es un buen índice pronóstico de la progresión de la aterosclerosis y de la aparición de acontecimientos adversos de causa cardiovascular en los pacientes hipertensos y en los que presentan una enfermedad coronaria77,78.
Otros marcadores de la respuesta inflamatoria y oxidativaDiversos mediadores inflamatorios participan en la patogenia de la EPOC. Es el caso de la IL-1b, que, además de actuar como un quimioatrayente de los neutrófilos y un estimulante de la respuesta de los linfocitos T, se relaciona con el proceso de reparación tisular, al incrementar el depósito de fibras colágenas79 (tabla I).
El factor transformador del crecimiento beta (TGF-β) interviene en el camino que va desde la respuesta inflamatoria hasta el proceso de remodelación y de reparación de la vía aérea, activando a la MMP-9 entre otras enzimas. En los pacientes con EPOC se ha encontrado sobreexpresión del TGF-β en el epitelio bronquial y en los macrófagos de la pequeña vía aérea80.
La detección de mediadores no volátiles y de marcadores inflamatorios, como el leucotrieno B4, la IL-8, el 8-isoprostano y el pH, mediante el estudio del condensado del aire exhalado, permite valorar de forma no invasiva las respuestas inflamatoria y oxidativa del pulmón81 (tabla I). Izquierdo et al82 han observado, en una población de pacientes con EPOC, que en aquellos en los que predominaba el enfisema pulmonar los valores de estos marcadores en el condensado de aire exhalado estaban disminuidos. Este hallazgo, unido al de la falta de correlación de estos valores con los encontrados en el suero, indica que las concentraciones de los marcadores inflamatorios y del estrés oxidativo pueden ser relativamente diferentes según la medición sea local o general.
Enzimas muscularesDesde hace varios años se viene observando que la limitación al ejercicio que presentan los pacientes con EPOC no sólo está condicionada por una alteración ventilatoria y del intercambio gaseoso, sino que otros factores, como la disfunción de los músculos esqueléticos, pueden contribuir a esta intolerancia. Los hallazgos bioquímicos e histoquímicos, resultado del estudio de las enzimas citrato sintetasa, β-hidroxiacil-coenzima A deshidrogenasa y lactato deshidrogensasa, apuntan a que existe un cambio en el metabolismo aeróbico, que derivaría hacia un metabolismo glucolítico anaeróbico83. Algunos trabajos han demostrado que el entrenamiento físico no sólo mejora las funciones ventilatoria y cardíaca84, sino que además incrementa la actividad de la citrato sintetasa y de la β-hidroxiacil-coenzima A deshidrogenasa, haciendo que la de las enzimas glucolíticas tienda a disminuir85,86.
ConclusionesDiversos indicios apuntan a la existencia de una asociación entre EPOC y aparición de enfermedades cardiovasculares, de tal forma que la primera puede ser, por sí misma, un factor de riesgo para las segundas. La inflamación sistémica pudiera tener un papel concurrente en la patogenia y en la historia natural en ambos casos. Como agentes iniciadores de la inflamación en la EPOC pueden ser importantes, además del tabaco y de la exposición a partículas inhaladas, otros factores como la dislipemia, la obesidad o las agudizaciones de la enfermedad. Todos ellos son capaces de lesionar el endotelio vascular por la vía del estrés oxidativo, contribuyendo así a la aparición de enfermedades cardio y cerebrovasculares. El desarrollo de estrategias terapéuticas capaces de actuar directamente sobre la respuesta inflamatoria y el estrés oxidativo podría aportar beneficios disminuyendo la morbimotalidad tanto de los acontecimientos cardiovasculares como de los respiratorios.
Múltiples trabajos han puesto de manifiesto que varios de los marcadores biológicos que traducen la existencia de daño vascular, como la PCR y el fibrinógeno plasmático, también están presentes en los pacientes con EPOC. La determinación de los valores séricos de estos marcadores pudiera ser útil, en asociación o no con la valoración de los factores de riesgo más conocidos, para predecir en estos pacientes la probabilidad y, en su caso, el pronóstico de las complicaciones cardiovasculares mencionadas.