Describir las diferencias clínicas, funcionales y radiográficas de la enfermedad respiratoria por micobacterias ambientales (MA) en pacientes con silicosis y sin silicosis.
MétodoEstudio observacional retrospectivo en pacientes a los que se les había aislado una micobacteria no tuberculosa en el laboratorio de Microbiología del hospital de O Meixoeiro (CHU de Vigo) desde enero 2007 hasta diciembre 2013. Se diferenció a los pacientes según presentaran o no silicosis y enfermedad pulmonar por MA utilizando los criterios de la American Thoracic Society.
ResultadosSe identificaron 156 casos con aislamiento respiratorio de al menos una especie de MA. El 71% eran varones, de los cuales 40 (25,6%) tenían silicosis. En 60 pacientes (38,5%), el 62,5% del grupo de silicosis y el 30,2% del grupo sin silicosis, se cumplían los criterios microbiológicos recomendados por la American Thoracic Society siendo las especies más comunes Mycobacterium avium complex, Mycobacterium genavense y Mycobacterium chelonae. En 34 pacientes (22,7%), 14 del grupo de silicosis y 20 del grupo sin silicosis, se cumplían los criterios de la American Thoracic Society de enfermedad pulmonar por MA. Se realizó tratamiento en 24 casos, con mayores niveles de erradicación bacteriológica en el grupo sin silicosis.
ConclusionesEn nuestros pacientes el antecedente de silicosis se relacionó con mayor incidencia de enfermedad por MA. La especie causante de la mayor parte de los casos de de enfermedad en nuestro medio por MA es Mycobacterium avium complex, seguido de Mycobacterium genavense. Los pacientes con silicosis presentaron menores niveles de curación tras el tratamiento.
To describe the clinical, functional and radiographic differences of respiratory disease caused by environmental mycobacteria (EM) in patients with and without silicosis.
MethodRetrospective, observational study in patients with nontuberculous mycobacteria isolated in the Hospital Meixoeiro (University Hospital of Vigo) microbiology laboratory between January 2007 and December 2013. Patients were grouped according to the presence or absence of silicosis and mycobacterial lung disease, using American Thoracic Society criteria.
ResultsIn 156 cases, at least one species of EM had been isolated from the respiratory culture. A total of 71% were identified in men, 40 (25.6%) of whom had silicosis. Sixty patients (38.5%) met American Thoracic Society microbiological criteria: 62.5% of the silicosis group and 30.2% of the non-silicosis group. The most common species were Mycobacterium avium complex, Mycobacterium genavense and Mycobacterium chelonae. American Thoracic Society criteria for environmental mycobacterial disease were met in 34 (22.7%) patients: 14 in the silicosis group and 20 in the non-silicosis group. Treatment was administered in 24 cases, with better bacteriological eradication levels in the non-silicosis group.
ConclusionsIn our series, a history of silicosis was related with a higher incidence of environmental mycobacterial disease. The causative species in the majority of cases in our setting was Mycobacterium avium complex, followed by Mycobacterium genavense. Patients with silicosis showed lower cure rates after treatment.
Las micobacterias ambientales (MA), también denominadas micobacterias no tuberculosas, son microorganismos ubicuos en el ambiente que pueden habitar en superficies corporales y secreciones, incluidas las procedentes del aparato respiratorio, sin causar enfermedad, por lo que hasta la segunda mitad del siglo pasado su presencia se consideraba pura colonización. Existe una importante variabilidad geográfica en la prevalencia de las diferentes especies de micobacterias1. La correcta identificación de la especie de MA es muy importante debido a diferencias en cuanto a su relevancia clínica. En países con bajas tasas de tuberculosis pulmonar (TBP) como EE. UU. la incidencia de MA (5 casos por 100.000 y hasta 15 por 100.000 en mayores de 50 años) supera a la de TBP (4 por 100.000)2. Entre los factores de riesgo conocidos para enfermedad pulmonar por MA está la fibrosis quística y otras patologías con bronquiectasias y estados de inmunosupresión tales como los asociados a terapia biológica (anti-TNF, rituximab), trasplante de órganos y sida, aunque cada vez mayor número de casos de MA están siendo detectados en pacientes sin enfermedad subyacente2. Un factor de riesgo menos estudiado es la enfermedad pulmonar por MA en silicosis. Aunque la relación entre silicosis y TBP es bien conocida3, lo es menos su papel como factor de riesgo para MA4. La enfermedad pulmonar crónica está considerada la forma más común de infección por MA y se caracteriza por 2 patrones radiográficos, uno fibrocavitario de lóbulos superiores que ocurre en personas con enfermedad respiratoria subyacente como enfermedad pulmonar obstructiva crónica y otro con bronquiectasias en LM o língula5. Para el diagnóstico de enfermedad pulmonar por MA se deben cumplir criterios clínicos, bacteriológicos y radiológicos6, estos últimos son de difícil determinación en silicosis debido a que la presencia de enfermedad pulmonar intersticial-nodular preexistente dificulta determinar si la MA aislada del esputo constituye enfermedad micobacteriana o mera colonización, obligando a una evaluación detallada de los síntomas y hallazgos radiológicos. Aunque existe un reconocimiento cada vez mayor del potencial patogénico de las MA, no conocemos la relevancia clínica de la presencia de MA en nuestro medio. Los objetivos de este trabajo son identificar las diferentes especies aisladas en los casos de infección y enfermedad por MA en nuestro medio en pacientes con y sin silicosis, y describir las características clínicas, los factores predisponentes y la evolución de los pacientes en ambos grupos.
Material y métodosEstudio observacional retrospectivo de pacientes con confirmación microbiológica de MA en el Laboratorio de Microbiología del hospital de O Meixoeiro (Complexo Hospitalario Universitario de Vigo) desde enero 2007 hasta diciembre 2013. Se identificó la especie, se constató la frecuencia del aislamiento y se diferenciaron 2 grupos según cumplieran o no criterios de diagnóstico de silicosis7. Se recogieron datos de edad, sexo, patología respiratoria subyacente, comorbilidades (diabetes, neoplasia sólida o hematológica, VIH, trasplante), uso de corticoides y otros fármacos inmunosupresores. Se consultó la historia de exposición a polvo de sílice y hallazgos radiológicos debidos a silicosis. Se consideró obstrucción al flujo aéreo si el cociente FEV1/FVC era menor de 0,78. Se evaluaron los síntomas y hallazgos en radiografía torácica y tomografía axial computarizada (TAC), si se hubieran realizado, especialmente la presencia de cavitación.
El diagnóstico de enfermedad pulmonar por MA se estableció en 3 niveles según las recomendaciones de la American Thoracic Society en base a datos clínicos, radiológicos y bacteriológicos, definiendo 3 tipos de categorías: enfermedad definitiva, infección clínicamente relevante (o posible enfermedad si se cumplían los criterios microbiológicos) y colonización si solo había un aislamiento6,9. Se consideró enfermedad definitiva en los casos de: a) existencia de síntomas compatibles (tos, fiebre, pérdida de peso, hemoptisis o disnea) no atribuibles a otras enfermedades; b) lesiones características en la radiografía de tórax (infiltrados, nódulos o cavitaciones) o en la tomografía computarizada de alta resolución (nódulos múltiples o bronquiectasias multifocales), y c) en esputo: 2 cultivos positivos separados en el tiempo; o en lavado broncoalveolar: un cultivo positivo; o en biopsias broncopulmonares: cualquier cultivo positivo; o bien la visión de bacilos si existe algún cultivo de esputo positivo. Los casos con 2 o más aislamientos microbiológicos se consideraron como infección clínicamente relevante, y colonización simple cuando se obtuvo un único aislamiento microbiológico sin cumplirse el resto de los criterios. Empleamos estos criterios microbiológicos al haberse previamente mostrado que eran altamente predictores de enfermedad9–11.
La identificación bacteriológica en las diferentes muestras se efectuó por métodos moleculares y radiométricos. La respuesta al tratamiento se valoró según la evolución clínica, radiológica y microbiológica. Se consideró conversión bacteriológica la presencia de 3 cultivos consecutivos negativos separados al menos 3 semanas tras el diagnóstico inicial de enfermedad.
Para el análisis de datos se realizó un análisis descriptivo, presentando la aparición de cada especie de micobacteria, enfermedad subyacente y silicosis como frecuencias y porcentajes, así como el resto de las variables relacionadas con el paciente. Se realizaron análisis univariantes, empleando test de Chi cuadrado, para determinar la asociación entre presencia de silicosis y características basales de los pacientes, tipo de micobacteria, prevalencia de enfermedad, infección y colonización, tratamiento y síntomas. La relación de la edad con presencia de silicosis se analizó mediante la t de Student para muestras independientes. Los análisis se efectuaron con el programa Statistical Package for Social Sciencies versión 15.0 (SPSS, Chicago,IL, EE. UU.).
ResultadosSe revisaron 156 historias clínicas, en las que existía al menos un registro de aislamiento microbiológico de MA en muestras respiratorias e información clínica y radiológica. La mayoría de las muestras eran de esputo, excepto en 20 casos que procedían del broncoaspirado o lavado broncoalveolar (en 10 casos el aislamiento era únicamente de estas muestras). En 3 pacientes se aisló en punción de ganglio cervical la misma MA que en la muestra respiratoria: en 2 casos Mycobacterium avium complex (M. avium complex) y en un caso Mycobacterium genavense (M. genavense). De los 156 pacientes, 111 (71,2%) eran hombres y 45 mujeres (28,8%), con una edad media de 62±17 años (rango: 26-97). En 97 pacientes (68,2%) se presentaba alguna enfermedad pulmonar subyacente: silicosis (25,6%), enfermedad pulmonar obstructiva crónica (14,1%), tuberculosis previa o activa (11%), bronquiectasias (10,3%) y otras enfermedades respiratorias (11,5%). Otras enfermedades representadas eran: tumores sólidos (7,6%), VIH (3,8%), cardiopatía (3,8%) y hepatopatía (3,2%). En 21 pacientes (13,4%) no se apreció enfermedad subyacente. El número de micobacterias identificadas en nuestro hospital fue 7 en 2007, 14 en 2008, 32 en 2009, 41 en 2010, 25 en 2010, 26 en 2011 y 11 en 2013.
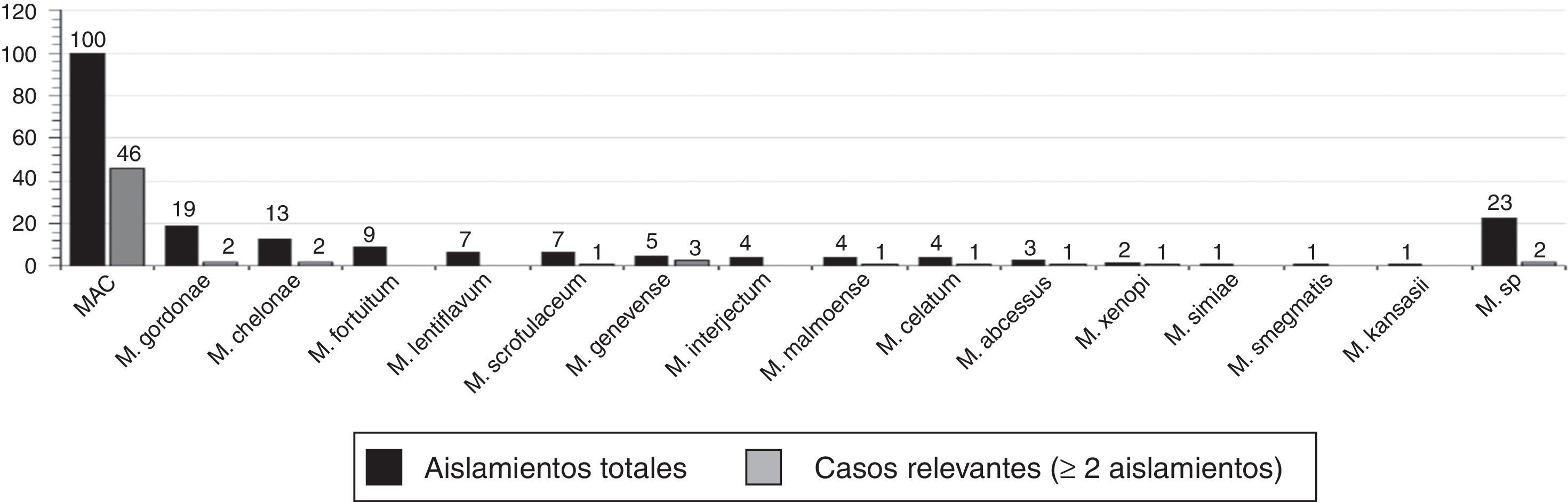
Las especies de micobacterias aisladas (fig. 1) con mayor frecuencia fueron M. avium complex (100), Mycobacterium gordonae (M. gordonae) (19) y Mycobacterium chelonae (M. chelonae) (13); 23 micobacterias no fueron identificadas (M.sp). En la figura 1 se muestra también la distribución de MA aisladas en los 60 casos clínicamente relevantes (≥2 aislamientos). La especie más frecuentemente aislada en este grupo de pacientes también fue M. avium complex, presente en el 76,7% de los casos.
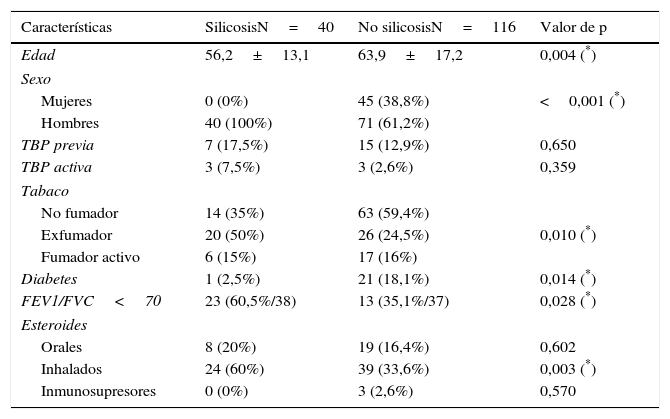
Se confirmó diagnóstico de silicosis en 40 (25,6%) pacientes frente a 116 (74,4%) sin silicosis. Del total de pacientes diagnosticados de silicosis, todos eran varones con edad media de 56,2 años (DE 13,1 y rango: 36-85). El grupo de pacientes sin silicosis tenía una edad media significativamente mayor (63,9 años) (DE 17,2 y rango: 26-94), de los cuales 71 eran varones (61,2%).
Las características principales de ambos grupos se muestran en la tabla 1, destacando mayor frecuencia de tabaquismo, obstrucción al flujo aéreo y toma de esteroides inhalados en el grupo con silicosis. Los pacientes con silicosis presentaban mayor prevalencia de obstrucción al flujo aéreo (60,5%) que los pacientes sin silicosis (35,1%), y el 100% de los pacientes con silicosis y enfermedad por MA presentaban obstrucción al flujo aéreo. La diabetes mellitus, sin embargo, era más frecuente en el grupo sin silicosis. En 22 pacientes (7 silicosis y 15 no silicosis) existía el antecedente de tuberculosis pleuropulmonar remota; en 6 (3 en cada grupo) tuberculosis activa, pulmonar (5) y ganglionar (1), todos ellos con MA concomitante en una única muestra de esputo e interpretados como MA colonizantes. En los pacientes sin enfermedad previa se trató de un aislamiento aislado y se interpretó como colonización.
Características de los pacientes con aislamientos de MA
| Características | SilicosisN=40 | No silicosisN=116 | Valor de p |
|---|---|---|---|
| Edad | 56,2±13,1 | 63,9±17,2 | 0,004 (*) |
| Sexo | |||
| Mujeres | 0 (0%) | 45 (38,8%) | <0,001 (*) |
| Hombres | 40 (100%) | 71 (61,2%) | |
| TBP previa | 7 (17,5%) | 15 (12,9%) | 0,650 |
| TBP activa | 3 (7,5%) | 3 (2,6%) | 0,359 |
| Tabaco | |||
| No fumador | 14 (35%) | 63 (59,4%) | |
| Exfumador | 20 (50%) | 26 (24,5%) | 0,010 (*) |
| Fumador activo | 6 (15%) | 17 (16%) | |
| Diabetes | 1 (2,5%) | 21 (18,1%) | 0,014 (*) |
| FEV1/FVC<70 | 23 (60,5%/38) | 13 (35,1%/37) | 0,028 (*) |
| Esteroides | |||
| Orales | 8 (20%) | 19 (16,4%) | 0,602 |
| Inhalados | 24 (60%) | 39 (33,6%) | 0,003 (*) |
| Inmunosupresores | 0 (0%) | 3 (2,6%) | 0,570 |
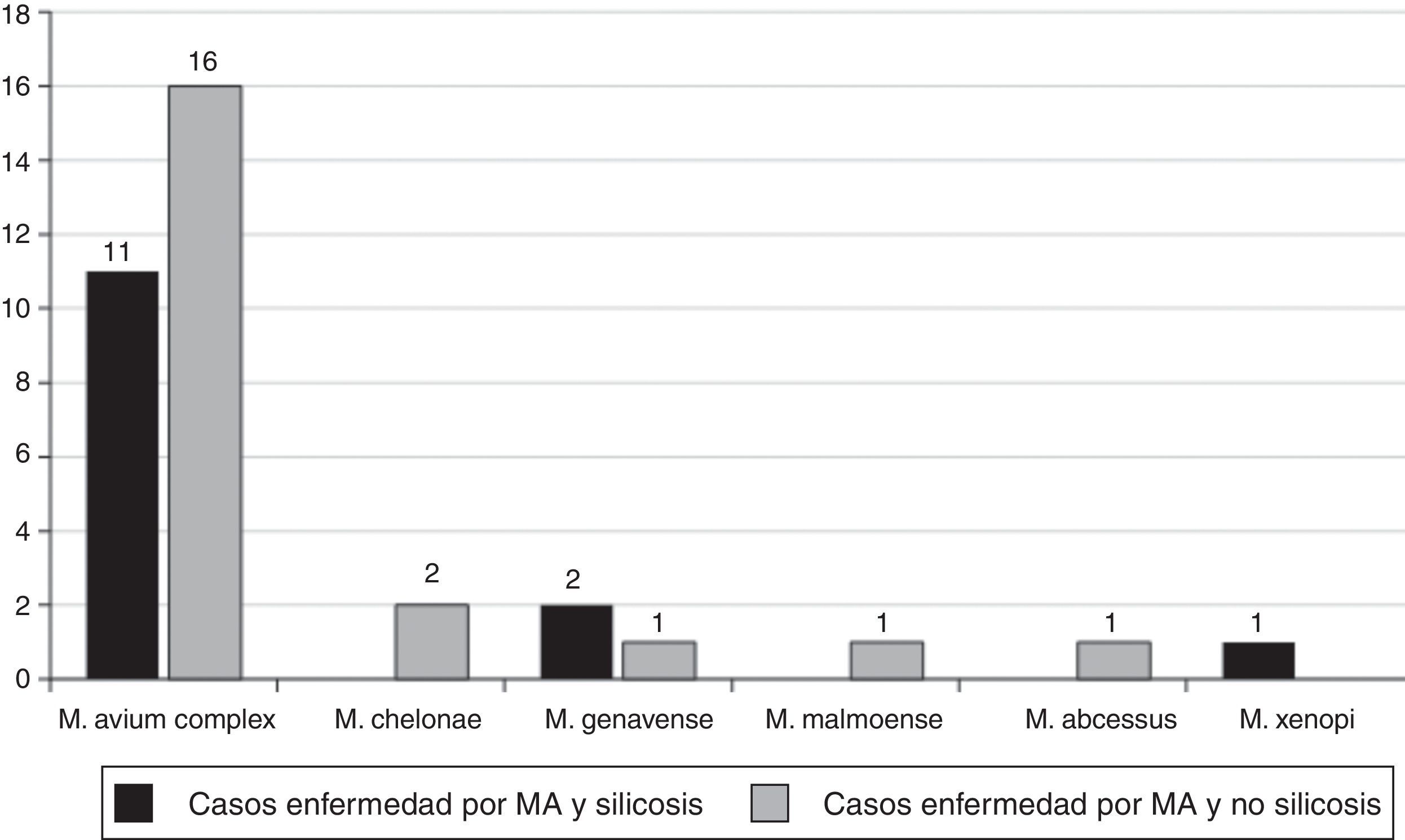
Los criterios recomendados por la American Thoracic Society para el diagnóstico de enfermedad pulmonar por MA se cumplían en 34 pacientes, el 21% de todos los casos, y el 56% de los que cumplían criterios microbiológicos (14 con silicosis y 20 sin silicosis).
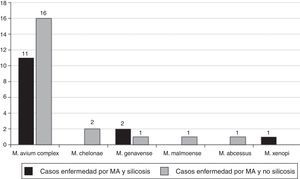
Las MA aisladas en los 14 pacientes con silicosis que cumplían los criterios microbiológicos recomendados por la American Thoracic Society fueron (fig. 2): M. avium complex (n=11; 71,4%), M. genavense (n=2) y Mycobacterium. xenopi (M. xenopi) (n=1), y las MA aisladas en los 20 pacientes no silicóticos fueron: M. avium complex (n=19; 95,0%), M. gordonae (n=1), M. genavense (n=1), Mycobacterium fortuitum (M. fortuitum) (n=1), Mycobacterium abscessus (M. abscessus) (n=1), Mycobacterium malmoense (n=1), M. chelonae (n=1) y Mycobacterium celatum (n=1); 2 micobacterias no fueron identificadas.
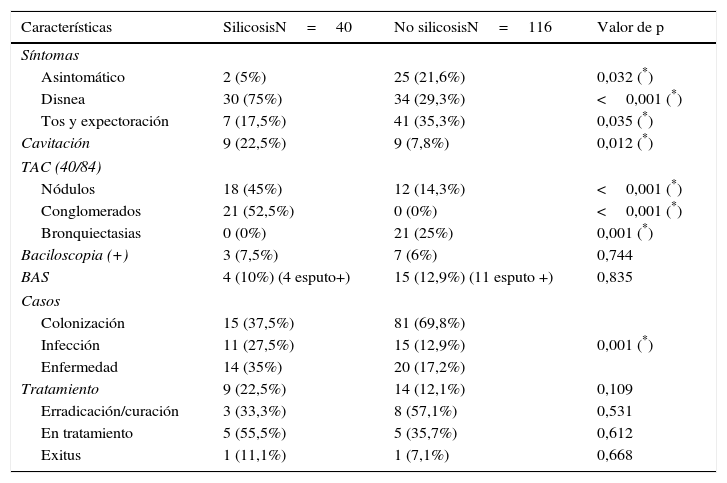
El síntoma predominante en los pacientes con silicosis fue la disnea, presente en 30 (75%); y en los paciente sin silicosis la tos y expectoración, presente en 41 (35,3%). La cavitación estaba presente en el 29% de los pacientes diagnosticados de enfermedad por MA (57% en el grupo de silicosis y 10% en el grupo sin silicosis). Los hallazgos en la TAC más frecuentes en silicosis eran nódulos y conglomerados (52,5%) y en los no silicosis bronquiectasias (60,0%) (tabla 2).
Características clínicas, radiológicas y microbiológicas. Evolución de los pacientes tratados
| Características | SilicosisN=40 | No silicosisN=116 | Valor de p |
|---|---|---|---|
| Síntomas | |||
| Asintomático | 2 (5%) | 25 (21,6%) | 0,032 (*) |
| Disnea | 30 (75%) | 34 (29,3%) | <0,001 (*) |
| Tos y expectoración | 7 (17,5%) | 41 (35,3%) | 0,035 (*) |
| Cavitación | 9 (22,5%) | 9 (7,8%) | 0,012 (*) |
| TAC (40/84) | |||
| Nódulos | 18 (45%) | 12 (14,3%) | <0,001 (*) |
| Conglomerados | 21 (52,5%) | 0 (0%) | <0,001 (*) |
| Bronquiectasias | 0 (0%) | 21 (25%) | 0,001 (*) |
| Baciloscopia (+) | 3 (7,5%) | 7 (6%) | 0,744 |
| BAS | 4 (10%) (4 esputo+) | 15 (12,9%) (11 esputo +) | 0,835 |
| Casos | |||
| Colonización | 15 (37,5%) | 81 (69,8%) | |
| Infección | 11 (27,5%) | 15 (12,9%) | 0,001 (*) |
| Enfermedad | 14 (35%) | 20 (17,2%) | |
| Tratamiento | 9 (22,5%) | 14 (12,1%) | 0,109 |
| Erradicación/curación | 3 (33,3%) | 8 (57,1%) | 0,531 |
| En tratamiento | 5 (55,5%) | 5 (35,7%) | 0,612 |
| Exitus | 1 (11,1%) | 1 (7,1%) | 0,668 |
De los 34 pacientes con criterios de enfermedad, se trataron 23 (67%) (9 silicosis y 14 no silicosis) (tabla 2). De los 9 casos que recibieron tratamiento específico se negativizaron los cultivos en 3 casos (33%) (2 M. avium complex y uno M. xenopi) y fracasó en 5 (3 M. avium complex y 2 M. genavense). En el grupo sin silicosis se obtuvo erradicación bacteriológica en 8 (57%), todos M. avium complex y fracaso en 5 (4 M. avium complex y uno M. abscessus). Se produjo un fallecimiento en cada grupo: en el grupo de silicosis un fallecimiento temprano en relación con neumotórax y en el grupo de no silicosis por hepatitis medicamentosa. En el grupo sin silicosis, se presentó un segundo caso de toxicidad, en forma de hepatitis colestásica con posibilidad de reintroducir los fármacos sin complicaciones. En 2 casos (uno con silicosis y uno con enfermedad pulmonar obstructiva crónica) se realizó tratamiento con éxito durante 12 meses antes del trasplante pulmonar. Al final del periodo estudiado se apreció un 76,4% de supervivencia, sin diferencias entre silicosis y no silicosis ni entre colonización, infección y enfermedad en los 113 pacientes de los que se conocía dicha información.
DiscusiónLa silicosis se asocia con el desarrollo de infección y enfermedad por MA, constituyendo la enfermedad predisponente para enfermedad por MA más frecuente en nuestro medio, con una cifra claramente superior a la referida en estudios clínico-epidemiológicos de MA realizados en nuestro país en los que se reconocen cifras desde el 0,9% hasta el 2,3% de silicosis como causa de enfermedad por MA12,13.
Estudios recientes14,15 resaltan el papel importante de MA en los pacientes con silicosis. Morita et al.16 encuentran tras una búsqueda sistemática un 39% de aislamientos de MA entre especies patogénicas y no patogénicas. La alta prevalencia de silicosis en nuestro entorno asociada a la importante industria de granito (canteras y talleres)17 podría ser la explicación del elevado porcentaje de silicosis hallado como causa de enfermedad por MA.
La incidencia de silicosis tiende a ser superior en enfermedad pulmonar por MA en comparación con la hallada en TBP. Publicaciones que han incluido todos los casos declarados en nuestra comunidad autónoma, en el mismo periodo de tiempo que este estudio muestran una prevalencia de silicosis en TBP del 0,5%18, muy inferior a la prevalencia de silicosis en esta serie que presentamos con enfermedad respiratoria por MA del 41%. Algo similar a lo mostrado en el trabajo de Corbett et al.14 donde la incidencia de neumoconiosis era más alta en los sujetos con MA que en los pacientes con Mycobacterium tuberculosis. El aumento de aislamientos de MA no parece debido exclusivamente a los mejores métodos de laboratorio sino que podrían contribuir otros factores como mayor exposición ambiental a MA (hay un aumento de la posibilidad de exposición a MA en relación con cambio climático, movimiento de tierras, aguas aerosolizadas, etc.), condiciones subyacentes del huésped (bronquiectasias, aspiración crónica, enfermedad pulmonar obstructiva crónica y su aumento en relación con el envejecimiento…) o características innatas del huésped que se asocian a MA (delgadez de la mujer, escoliosis, pectus excavatum y hábito marfanoide)2.
En nuestra institución, un alto porcentaje de pacientes (61,5%) presentaban un único aislamiento y se consideraron colonizados. Este porcentaje resultó relativamente elevado comparado con lo referido por otros autores, superior al 55% de Andréjak et al9 y al 42% de la revisión de Winthrop et al.10 y muy superior al 11,2% del estudio de Braun et al.19. Esta situación probablemente se deba a que en muchos de nuestros pacientes con un aislamiento no había evidencia en las historias clínicas de evaluaciones posteriores realizadas durante el periodo de estudio.
Las especies colonizadoras más frecuentes fueron M. avium complex, M. gordonae y M. chelonae, coincidiendo M. avium complex y M. gordonae como más frecuentes con unas series de nuestro entorno1, a diferencia de otras series donde predominan M. gordonae, M. xenopi, M. fortuitum, Mycobacterium terrae, Mycobacterium simiae entre otros, lo que se puede explicar por la diferente distribución de las especies según la región20,21.
Los casos de enfermedad por MA (14 casos de silicosis y 20 sin silicosis), que representan el 21% del total de aislamientos respiratorios, están por debajo de los porcentajes referidos en la literatura, de un tercio a la mitad de los aislamientos representando verdadera enfermedad9,10, pero similares a los resultados de Koh et al. del 17%20 y de Andréjak et al. del 26%9, y superiores al 9,8% de Braun et al.19. Es posible que un número superior de personas, ahora fuera del periodo de estudio, pudieran cumplir los criterios de enfermedad.
La especie aislada más habitual en pacientes que cumplían criterios de enfermedad por MA tanto en silicosis como en no silicosis fue M. avium complex. A diferencia de otros estudios, algunos realizados en nuestro país13,14, en los que Mycobacterium kansasii (M. kansasii) representaba la MA con mayor prevalencia, en nuestro caso M. kansasii estaba prácticamente ausente.
Reseñar, por ser poco frecuente en la literatura, que la segunda especie más frecuentemente aislada y asociada a enfermedad fue M. genavense, ausente en otras publicaciones9,10. Se asocia a VIH antes de la aparición del tratamiento antirretroviral (era pre-HAART) y situaciones de inmunosupresión severa y generalmente en forma de enfermedad diseminada22. Nuestra serie incluye a 2 pacientes con silicosis, uno con afectación pulmonar exclusivamente, estaba con dosis alta de esteroides (30mg de prednisona al día) y el otro presentaba además linfadenitis cervical sin inmunosupresión conocida. El otro paciente con enfermedad por M. genavense era un paciente VIH con presentación pulmonar y linfadenitis cervical.
El 57% de los pacientes que cumpliendo el componente microbiológico reunía los criterios de definición de enfermedad resultó inferior al mostrado por Winthrop et al.10 del 86%. Probablemente estemos infraestimando la verdadera prevalencia de la enfermedad pulmonar por MA al catalogar erróneamente como enfermedad no definitiva los casos de aislamientos de MA aisladas en algunos pacientes que cumplían criterios microbiológicos, que bien no disponían de TAC o que por su patología previa (silicosis o TBP) no quedaba claro si existían cambios asociados a enfermedad por MA.
El 40% (63 pacientes) de nuestros pacientes estaba en tratamiento con esteroides inhalados (el 60% del grupo silicosis y el 33% del grupo de no silicosis), diferencia significativa a favor del grupo de silicosis, reforzando el riesgo de enfermedad por MA asociado al uso de esteroides inhalados como evidenciaron Andréjak et al.23. A diferencia de lo referido por otros autores, no se presentó ningún caso en nuestra serie en relación con otro tipo de inmunosupresores como antagonistas TNF-α24 a pesar de su amplio uso ni tampoco en pacientes con fibrosis quística25.
La cavitación estaba presente en el 25% de los pacientes diagnosticados de enfermedad por MA similar a otras series recientes9, especialmente en silicosis, pero lejos de las cifras mostradas por Martínez-Moragón et al.12 con un 76% de infiltrados cavitados en pacientes VIH negativos.
La respuesta del 30% y del 57% de curación (erradicación bacteriológica) en silicosis y no silicosis respectivamente es inferior a los resultados descritos en nuestro país donde se describe una evolución clínica de los pacientes tratados en general favorable, con erradicación bacteriológica de hasta el 75% de los casos12 pero similar al 57,7% de Kobashi et al.26. Esta menor eficacia del tratamiento se podría relacionar con diversas causas descritas en la literatura como son la relativa frecuencia de cavitación en los pacientes con silicosis, el tratamiento previo para la enfermedad pulmonar por M. avium complex y una historia de enfermedad pulmonar obstructiva crónica o bronquiectasias6,27; aunque en nuestro estudio el resultado obtenido puede deberse al bajo número de pacientes tratados. Los fallecimientos en nuestra serie estuvieron relacionados con el estado patológico de base de los pacientes a diferencia de lo mostrado en la serie de Fujita et al.28 en la que 2 de los 11 pacientes tratados fallecieron por insuficiencia respiratoria atribuida a la infección por MA.
Nuestro estudio puede tener algunas limitaciones. La principal parece la naturaleza retrospectiva del mismo, de forma que no permite intervenir sobre aquellos aspectos dudosos en la historia clínica del paciente, que podrían permitir una mejor clasificación de los mismos.
Asimismo, en algunos pacientes se hubiera podido modificar el grupo de diagnóstico en el que están incluidos si se hubiera realizado un proceso diagnóstico más exhaustivo por los médicos responsables del paciente en ese momento.
En conclusión, en nuestro medio el antecedente de silicosis se relacionó con mayor incidencia de enfermedad por MA. La enfermedad de base no parece modificar los tipos de especies identificados, siendo la más frecuente el M. avium complex tanto en silicóticos como no silicóticos. Será de interés observar los datos de aislamientos de años sucesivos para ver si se confirma la relevancia en nuestro medio de M. genavense, excepcional en las revisiones existentes sobre MA. Finalmente, la tasa de curación alcanzada parece baja. Ante los resultados obtenidos parece necesario optimizar el manejo de estos pacientes, reforzando la sospecha diagnóstica de enfermedad MA para mejorar la precisión diagnóstica y las tasas de curación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.