La localización endobronquial del linfoma difuso de células grandes tipo B (LDCGB) es infrecuente. El diagnóstico histológico se realiza mediante la obtención de muestras de tejido pulmonar. En estos casos, la necesidad de realizar estudios inmunohistoquímicos para establecer el diagnóstico requiere la obtención de muestras de un tamaño y calidad adecuados, lo que, en ocasiones, implica la repetición de la exploración endoscópica y la realización de biopsias adicionales.
Presentamos el primer caso de un paciente diagnosticado de recidiva de LDCGB endobronquial mediante biopsia bronquial realizada con criosonda.
The bronchial involvement of diffuse large B-cell lymphoma (DLBCL) is an exceptional finding. Histological diagnosis is done with lung tissue samples. In these cases, the need for immunohistochemistry studies in order to establish the diagnosis requires obtaining tissue samples of adequate size and quality. Sometimes, endoscopic explorations may be repeated to obtain further biopsies.
We present the first documented case of recurrent endobronchial DLBCL that was diagnosed from a bronchial biopsy taken with a cryoprobe.
El linfoma difuso de células grandes tipo B (LDCGB) es un tipo histológico agresivo de linfoma no hodgkiniano (LNH). La localización pulmonar de estos linfomas es infrecuente y constituye menos del 1%1–3 de los casos. Además, la afectación endobronquial supone un hallazgo excepcional que, por sus implicaciones terapéuticas y pronósticas, requiere la obtención de muestras tisulares de tamaño y calidad suficiente para realizar un estudio histológico e inmunohistoquímico completo. Presentamos el caso de un paciente con una recidiva de LDCGB endobronquial que, tras realizarse varias biopsias bronquiales con pinzas de biopsia convencional, fue finalmente diagnosticado mediante biopsia bronquial con criosonda.
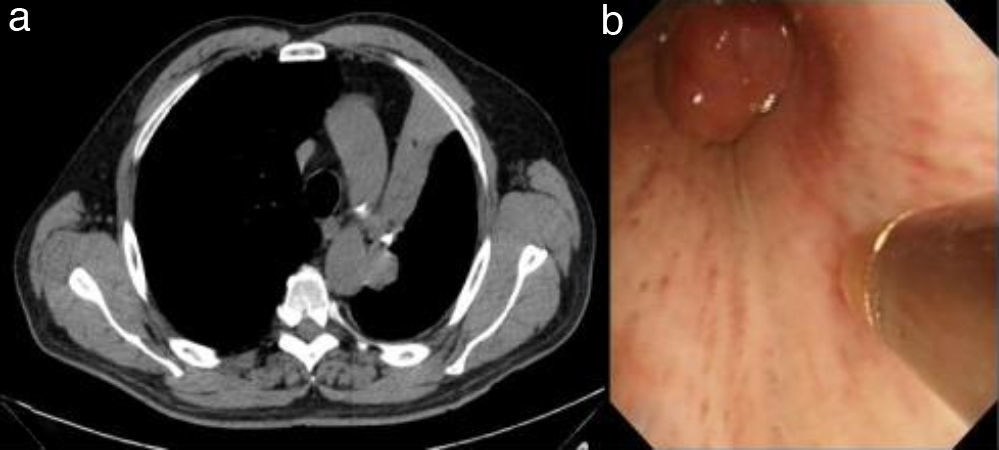
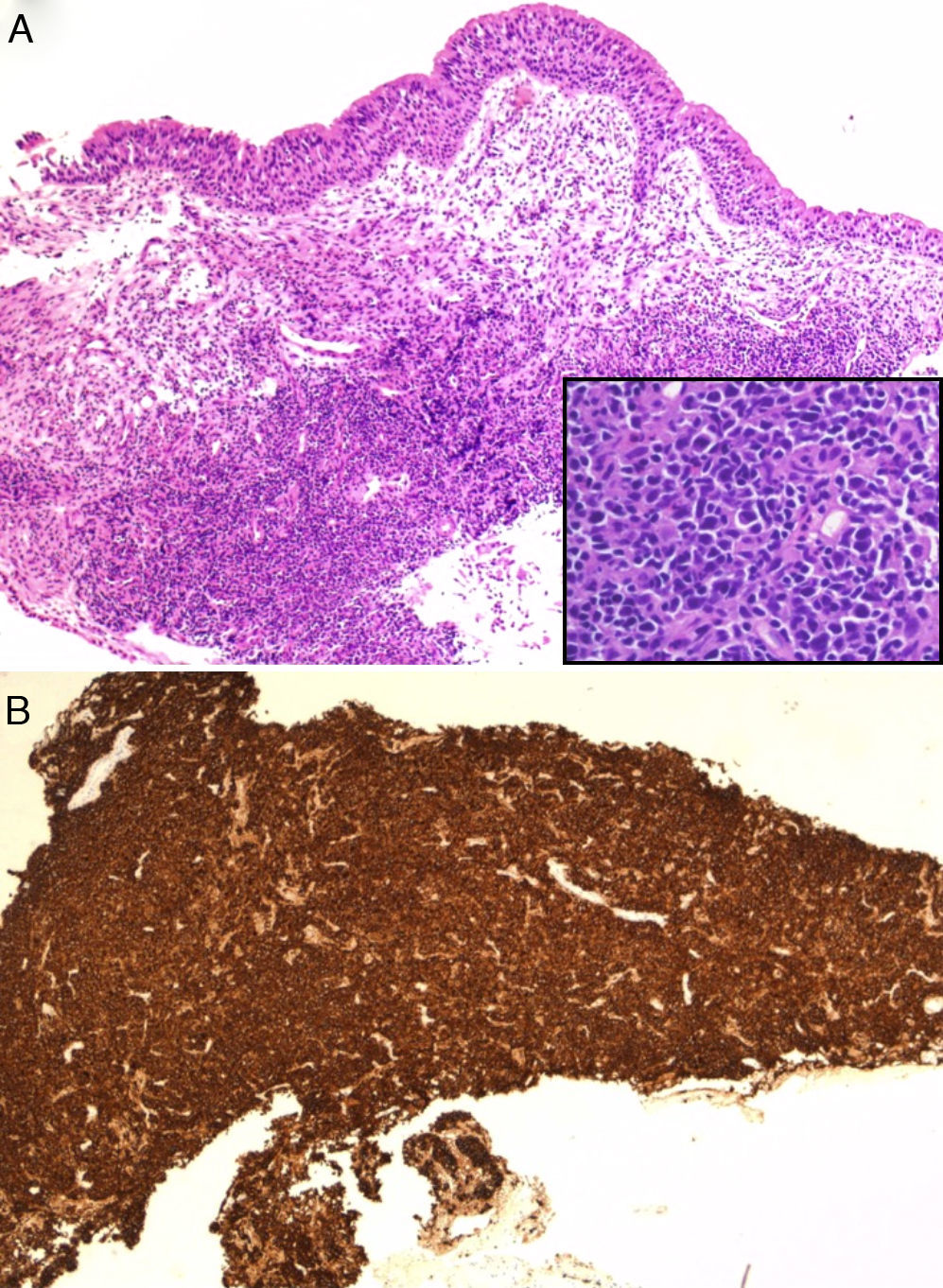
Observación clínicaVarón de 75 años, alérgico al contraste iodado, con antecedentes de hipertensión arterial en tratamiento médico, que en enero de 2004 presentó clínica de fiebre y dolor abdominal. En la exploración física destacaba dolor a la palpación en hipocondrio izquierdo. La tomografía computarizada (TC) del abdomen puso de manifiesto la presencia de una esplenomegalia con abundantes lesiones nodulares de características hipodensas y adenopatías infradiafragmáticas, en región celíaca mesentérica y plano perivascular de aorta abdominal. Se realizó una esplenectomía y la histología del bazo fue diagnóstica de linfoma difuso de células grandes B (LDCGB). El paciente fue tratado con el esquema de inmunoquimioterapia R-CHOP (rituximab, ciclofosfamida, adriamicina, vincristina y prednisona) alcanzando una respuesta completa. En junio de 2010 el paciente consultó por dolor pleurítico izquierdo y disnea de moderados esfuerzos. En la exploración física destacaba una hipofonesis en el campo pulmonar izquierdo. Se realizó una TC torácica que evidenció una estenosis del bronquio principal izquierdo y adenopatías hiliares ipsilaterales que condicionaban un colapso del lóbulo superior izquierdo (fig. 1a). Ante la sospecha de una neoplasia de pulmón se realizó una broncoscopia que objetivó la presencia de una masa endobronquial de superficie lisa que obstruía la entrada al lóbulo superior izquierdo. Se realizó una biopsia bronquial pero el material obtenido resultó insuficiente para establecer un diagnóstico definitivo. Se realizó una segunda biopsia que obtuvo material sospechoso para células malignas pero el tamaño de la muestra no permitió realizar técnicas inmunohistoquímicas por lo que se decidió realizar una biopsia bronquial con criosonda (fig. 1b) con la obtención de una nueva muestra de la lesión de mayor tamaño. El examen histológico mostró una infiltración difusa del corion por una proliferación linfoide de células grandes atípicas con numerosas mitosis sin infiltración del epitelio bronquial (fig. 2A). Se realizaron técnicas inmunohistoquímicas que mostraron una población neoplásica CD20 positiva (fig. 2B), con coexpresión de bcl-6 y CD10 y un índice proliferativo (ki-67) del 70%. De acuerdo con estos hallazgos el paciente fue diagnosticado de recidiva del LDCGB. Se inició tratamiento de segunda línea con R-ESHAP (rituximab, etopósido, metilprednisolona, cisplatino y citarabina) alcanzando una segunda remisión completa. Actualmente el paciente se encuentra pendiente de la realización de un trasplante autólogo de progenitores hematopoyéticos.
a) Imagen de TC torácica en la que se observa la estenosis del bronquio principal izquierdo y las adenopatías ipsilaterales que condicionan un colapso del lóbulo superior izquierdo. b) Imagen broncoscópica que muestra la criosonda y la lesión endobronquial en el bronquio principal izquierdo.
El término linfoma no hodgkiniano (LNH) abarca diversas neoplasias de origen linfoide que constituyen un grupo heterogéneo de enfermedades definidas por aspectos morfológicos, inmunofenotípicos y genéticos. El LDCGB de localización primaria pulmonar representa el 11-19% de todos los linfomas pulmonares primarios4–6 y entre el 0,5-1% de las neoplasias malignas pulmonares. Aunque es posible que su incidencia se encuentre infradiagnosticada por su rapidez de extensión al mediastino y a localizaciones extratorácicas7. Sin embargo, se desconoce la incidencia de recidivas de localización endobronquial en el LDCGB.
La sospecha diagnóstica se ha de establecer en pacientes con antecedentes de linfoma no hodgkiniano que presenten masas endobronquiales y/o atelectasias lobulares o pulmonares en la radiografía de tórax o TC torácica y plantea el diagnóstico diferencial con la neoplasia de pulmón, principalmente. El diagnóstico histológico se realiza mediante la obtención de muestras del tejido pulmonar, ya sean biopsias bronquiales o transbronquiales. Sin embargo, en muchas ocasiones, dado el alto grado de atipia celular encontrado, las biopsias realizadas mediante los métodos convencionales no permiten establecer el diagnóstico definitivo y se han de realizar nuevas biopsias de la zona o de nuevas localizaciones, tal y como ocurre en el caso presentado por Martínez et al.8. En este caso clínico presentamos un nuevo método para la realización de biopsias bronquiales mediante la utilización de criosondas. Clásicamente, la crioterapia es un procedimiento aplicado en broncoscopia, cuya indicación principal es el tratamiento y exéresis de lesiones endobronquiales, especialmente en los casos de obstrucción bronquial9,10. El contacto de la sonda con el tejido presenta un alto poder de congelación que, por las características de la sonda, resulta estable a la tracción. Estudios anteriores, que evaluaron el material histológico de biopsias bronquiales obtenido mediante criosondas en casos de tumores endobronquiales, encontraron que se trataba de muestras de mayor tamaño que las obtenidas con pinzas convencionales y que conservaban una histología preservada, lo que permitía aplicar con éxito técnicas de inmunohistoquímica11,12. Asimismo, nuestro grupo ha evaluado biopsias pulmonares transbronquiales mediante esta técnica obteniendo muestras tisulares de mayor tamaño y calidad que utilizando pinzas convencionales13.
En el caso que presentamos se realizaron en 2 ocasiones biopsias bronquiales de la lesión mediante pinzas convencionales, siendo las muestras obtenidas en ambos casos insuficientes para establecer un diagnóstico histológico específico. Además, en este caso coinciden varios aspectos que le confieren un especial interés: desde el punto de vista diagnóstico, la escasa frecuencia de esta enfermedad y la rara presentación al tratarse de una recidiva de un LDCGB endobronquial en un paciente diagnosticado previamente de un LDCGB de localización extranodal (esplénica) y tratado mediante quimioterapia y esplenectomía con remisión completa durante años y, por otro lado, la técnica diagnóstica utilizada para realizar el estudio histológico que permitió, además de la aplicación de técnicas inmunohistoquímicas, visualizar la integridad del epitelio bronquial (fig. 2) desestimándose otros diagnósticos más frecuentes como el linfoma de tejido linfoide asociado a mucosa (MALT).
De esta forma, ante la necesidad de realizar técnicas inmunohistoquímicas complejas para el diagnóstico de lesiones endobronquiales, deberíamos plantearnos la utilización de otras técnicas broncoscópicas que permitan la obtención de muestras tisulares de mejor calidad y tamaño a fin de mejorar el rendimiento diagnóstico y evitar la repetición de exploraciones complementarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.