En este artículo se presenta una revisión académica sobre la aplicabilidad de la medida de la fracción exhalada de óxido nítrico (FENO) en niños. De acuerdo con las normas conjuntas de la American Thoracic Society/European Respiratory Society, se describen los métodos de medida on-line en niños colaboradores y no colaboradores, los registros off-line sin control de flujo de exhalación y con control de flujo de exhalación mediante restrictor de flujo dinámico, y el registro off-line a respiración corriente en niños no colaboradores.
Se revisan los valores de normalidad, fundamentalmente con los analizadores de la FENO por quimioluminiscencia, mediante registro on-line de una única respiración (media geométrica: 9,7 ppb –partes por mil millones–; límite superior del intervalo de confianza del 95%: 25,2 ppb). Los valores de la FENO superiores a 17 ppb aportan un 81% de sensibilidad y un 80% de especificidad para predecir asma de fenotipo eosinofílico. Se analiza la respuesta de la FENO al tratamiento antiinflamatorio y al seguimiento del asma.
Por último, se comparan los resultados entre los analizadores por quimioluminiscencia y los electroquímicos, portátiles. Estos últimos ofrecen la posibilidad, en niños mayores de 5 años, de un seguimiento adecuado y universal del óxido nítrico exhalado como indicador emergente de la inflamación eosinofílica en la enfermedad asmática, de modo que facilitan el diagnóstico, el control evolutivo y el seguimiento terapéutico.
This article is an academic review of the application in children of the measurement of fractional exhaled nitric oxide (FENO).
We outline the joint American Thoracic Society/European Respiratory Society recommendations for online measurement of FENO in both cooperating children and children unable to cooperate, offline measurement with uncontrolled exhalation flow rate, offline measurement with controlled exhalation flow rate using a dynamic flow restrictor, and offline measurement during tidal breathing in children unable to cooperate.
This is followed by a review of the normal range of values for single-breath online measurements obtained with a chemiluminescence FENO analyzer (geometric mean, 9.7 parts per billion [ppb]; upper limit of the 95% confidence interval, 25.2 ppb). FENO values above 17 ppb have a sensitivity of 81% and a specificity of 80% for predicting asthma of an eosinophilic phenotype. We discuss the response of FENO values to anti-inflammatory treatment and the use of this marker in the management of asthma.
Results obtained with chemiluminescence and portable electrochemical analyzers are compared. The portable devices offer the possibility—in children over 5 years of age— of accurate and universal monitoring of exhaled nitric oxide concentrations, an emerging marker of eosinophilic inflammation in asthma that facilitates diagnosis, monitoring of disease progression, and assessment of response to therapy.
En 1987 un grupo de investigadores de la Universidad de California (Los Ángeles) advierte de que el denominado factor relajante derivado del endotelio de las venas y las arterias en realidad tiene idénticas propiedades biológicas y químicas que el óxido nítrico (NO).1 Cinco años después, en 1992, el NO recibe el apelativo de "molécula del año" por la revista Science.2 Las investigaciones sobre esta molécula conducen a Furchgott, Ignarro y Murad al Premio Nobel de Medicina en 19983, junto con una cierta polémica por parte de otros investigadores en NO4. Esta molécula posee una estructura atómica muy simple, se comporta como un radical libre, tiene una vida media muy corta y actúa como mensajero de multitud de procesos, tales como la regulación de la circulación periférica, las respuestas inmunitarias, la función plaquetaria y la neurotransmisión.
Durante los años noventa numerosos estudios señalan que la fracción espirada de NO (FENO) está aumentada en asmáticos frente a controles5,6, que disminuye en asmáticos tratados con esteroides inhalados7 y que se asocia estrechamente con la inflamación eosinofílica en estos pacientes8.
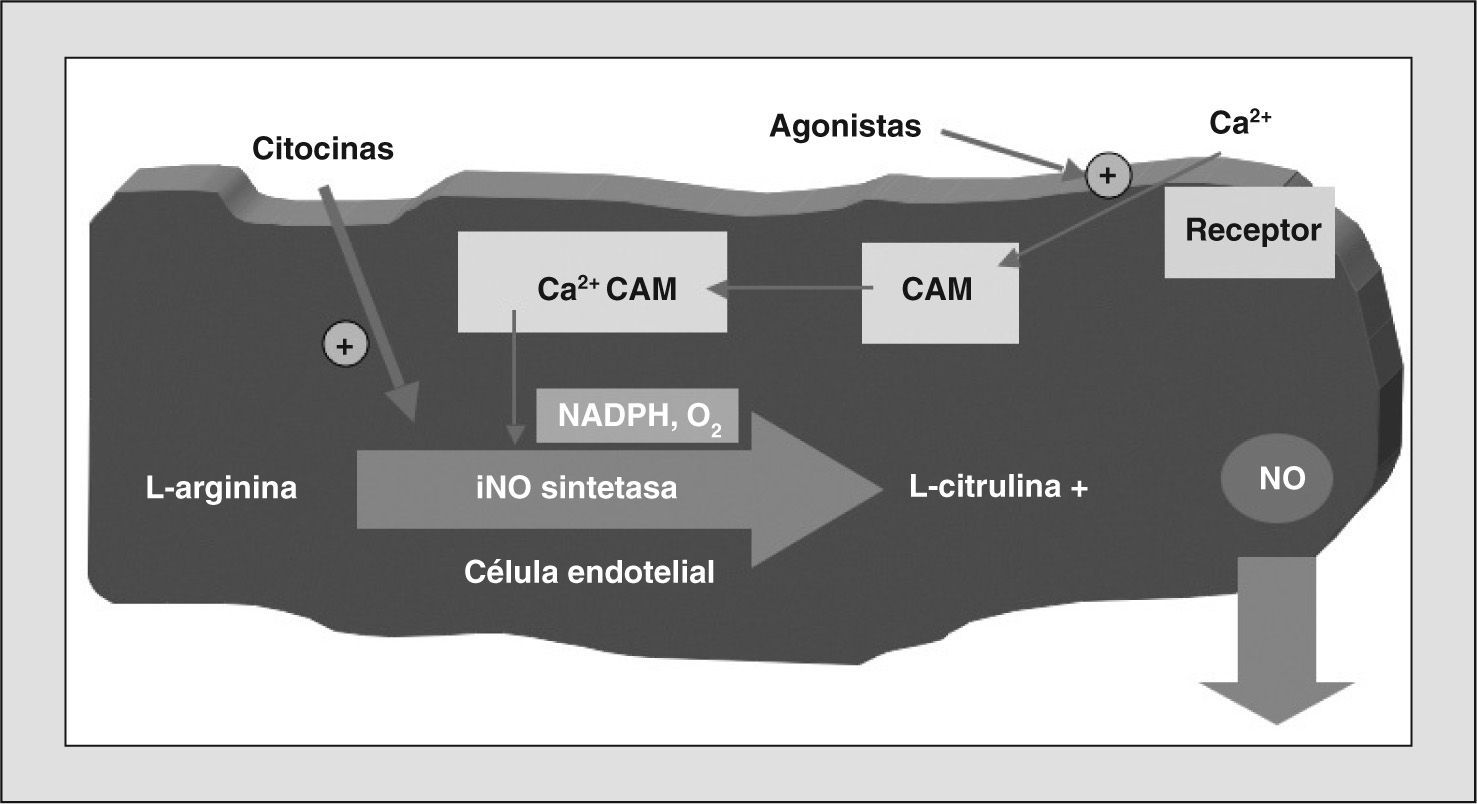
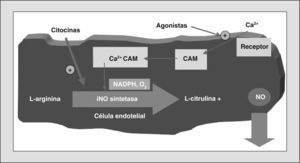
Síntesis del óxido nítricoEl NO es un radical libre endógeno, simple y difusible, que genera guanosinmonofosfato cíclico (GMPc). Los mamíferos sintetizan el NO mediante la enzima NO sintetasa (NOS), que convierte el aminoácido L-arginina en L-citrulina y NO (fig. 1). Se conocen 3 isoformas de la enzima NOS, según su actividad, localización celular y clonación molecular, 2 de ellas constitutivas y la tercera inducible.
Las 2 isoformas constitutivas son la neuronal (nNOS o NOS1) y la endotelial (eNOS o NOS3). Siendo ambas dependientes de calcio, producen pequeñas cantidades de NO en respuesta a agonistas que aumentan el calcio intracelular. La nNOS se identifica en células nerviosas y músculo esquelético, y la eNOS en los vasos sanguíneos y en las plaquetas. Ambas formas constitutivas se localizan también en el epitelio de la vía aérea y producen NO en concentraciones de picomoles.
La isoforma inducible (iNOS o NOS2) es independiente del calcio. Se expresa in vivo en las células epiteliales bronquiales, tanto de sujetos sanos como de asmáticos, y aumenta su actividad durante ciertos procesos inflamatorios. La iNOS también se expresa in vitro tras estimulación con citocinas, endotoxinas y lipopolisacáridos. La iNOS produce grandes cantidades de NO, del orden de nanomoles, y es bloqueada por los glucocorticoides, fármacos que no afectan a las isoformas constitutivas.
También se ha descrito una NOS que está presente en los senos paranasales de humanos. Se expresa constitutivamente, pero es independiente del calcio y no se inhibe por los glucocorticoides.
Las vías aéreas superiores producen gran cantidad de NO. La máxima concentración se observa en la mucosa de los senos paranasales, 3.000 partes por mil millones (ppb, del inglés parts per billion), mientras que las determinaciones en las vías aéreas mediante broncoscopia o en pacientes traqueotomizados muestran concentraciones de NO del orden de 5ppb.
Lane et al9 estudiaron la expresión de las distintas isoformas de la NOS en células epiteliales del árbol respiratorio y en macrófagos, en una población no preseleccionada de 41 niños de 6 a 16 años. Encontraron que el valor mediano de la FENO era de 15,5ppb (intervalo de confianza [IC] del 95%, 10-18,1) y significativamente mayor en sujetos atópicos que en niños sanos o asmáticos controlados (p < 0,05). Asimismo, documentaron una correlación positiva entre la FENO y la NOS2 (R = 0,672; p < 0,001), siendo mayor en niños asmáticos (R = 0,828; p = 0,006) que en atópicos asintomáticos (R = 0,752; p = 0,02) o en niños sanos (R = 0,525; p = 0,008). Las células del epitelio respiratorio expresarían la NOS2 y contribuirían a la totalidad del NO producido en la vía respiratoria distal. En los niños estudiados encontraron que los valores de la FENO se correlacionaban mayoritariamente con la presencia de atopia y de hiperrespuesta bronquial, más que con el diagnóstico de asma10. Sin embargo, no parece que existe correlación entre FENO, NOS1 y NOS3.
Recientemente Batra et al11 han estudiado, en 230 familias con 842 individuos asmáticos, la asociación de los distintos polimorfismos del gen de NOS2, situados en la región de agregación (cluster) de la quimiocina CC en el cromosoma 17q11.2-q12, con la atopia, la eosinofilia en sangre periférica y la gravedad del asma. Observaron una asociación estadísticamente significativa entre la gravedad del asma (p = 0,04) y la eosinofilia (p < 0,001) con el alelo 3 de M3 (repetición GT en el intrón 4), y entre las concentraciones séricas de inmunoglobulina E (p < 0,001) y la FENO (p = 0,03) con el alelo de M1 (repetición CCTTT en el alelo 4).
La edad, de acuerdo con lo comunicado por otros autores, era un predictor significativo para la FENO (p = 0,014) en niños sanos, pero no para la NOS2 (p = 0,402)12, quizá por la correlación de la FENO con el volumen de espacio muerto anatómico, que aumenta con la edad en niños sanos (r = 0,68; p < 0,01)11,12. Por tanto, propusieron que los valores normales de la FENO debían de guardar relación con la edad y el peso en niños escolares13.
Malmberg et al14 estudiaron a 114 niños escolares sanos y encontraron que la FENO se asociaba de forma significativa a la edad, la altura, el peso y el índice de masa corporal (p < 0,0001), y que la altura era el mejor predictor independiente. No hallaron diferencias significativas en relación con el sexo del paciente (p = 0,42).
Asimismo, Avital et al15 y Kissoon et al16 observaron que la FENO se incrementaba de forma significativa con la edad en asmáticos (p < 0,0001), aunque lo hacía en menor grado en niños preescolares (entre 2 y 5 años).
Funciones del óxido nítrico endógenoEl NO actúa en el sistema respiratorio como: a) broncodilatador débil; b) vasodilatador potente; c) neurotransmisor del sistema no colinérgico y no adrenérgico; d) antimicrobiano; e) modulador de la diferenciación celular, y f) amplificador de la inflamación en la vía aérea:
- 1.
Relaja la musculatura lisa bronquial a través del GMPc. La broncodilatación es mayor en las vías aéreas traqueobronquiales que en las pequeñas vías aéreas. Los estudios en humanos muestran que se comporta como un broncodilatador débil. En este sentido, la reversibilidad de la broncoconstricción inducida por metacolina a través de la administración de NO inhalado únicamente logra un ligero aumento del volumen espiratorio forzado en el primer segundo (FEV1).
- 2.
La concentración de NO en la región bronquial varía con relación a la fracción inspiratoria de oxígeno, de modo que la producción de NO disminuye en la hipoxia y se mantiene en la normo e hiperoxia. El NO producido en el epitelio broncoalveolar se difunde libremente hacia el músculo liso de los vasos pulmonares, activa la enzima guanilciclasa y produce GMPc, que activa los canales de Ca++, con lo que se origina relajación y, en consecuencia, vasodilatación, de modo que mejora la relación ventilación-perfusión.
- 3.
El NO es un neurotransmisor del sistema no adrenérgico y no colinérgico (NANC), siendo éste el único sistema neuronal broncodilatador. El NO induce una respuesta inhibidora (i-NANC) y, por lo tanto, broncodilatación. La activación del sistema e-NANC (excitación de las fibras c) induce broncoconstricción, vasodilatación, edema y secreción de moco. Dicha activación se produce mediante la neurocinina A y la sustancia P, taquicininas ambas que inducen la liberación de citocinas y el aumento de acetilcolina.
- 4.
El aumento de la producción de NO se asocia a un aumento de resistencia del huésped, mientras que el bloqueo de la síntesis de NO aumenta la replicación del agente infeccioso en los macrófagos infectados. El NO parece tener particular importancia en los sistemas de defensa contra patógenos intracelulares y puede actuar originando daño mediante la desaminación del ADN, inhibiendo enzimas, oxidando proteínas o peroxidando los lípidos de las membranas de estos microorganismos.
- 5.
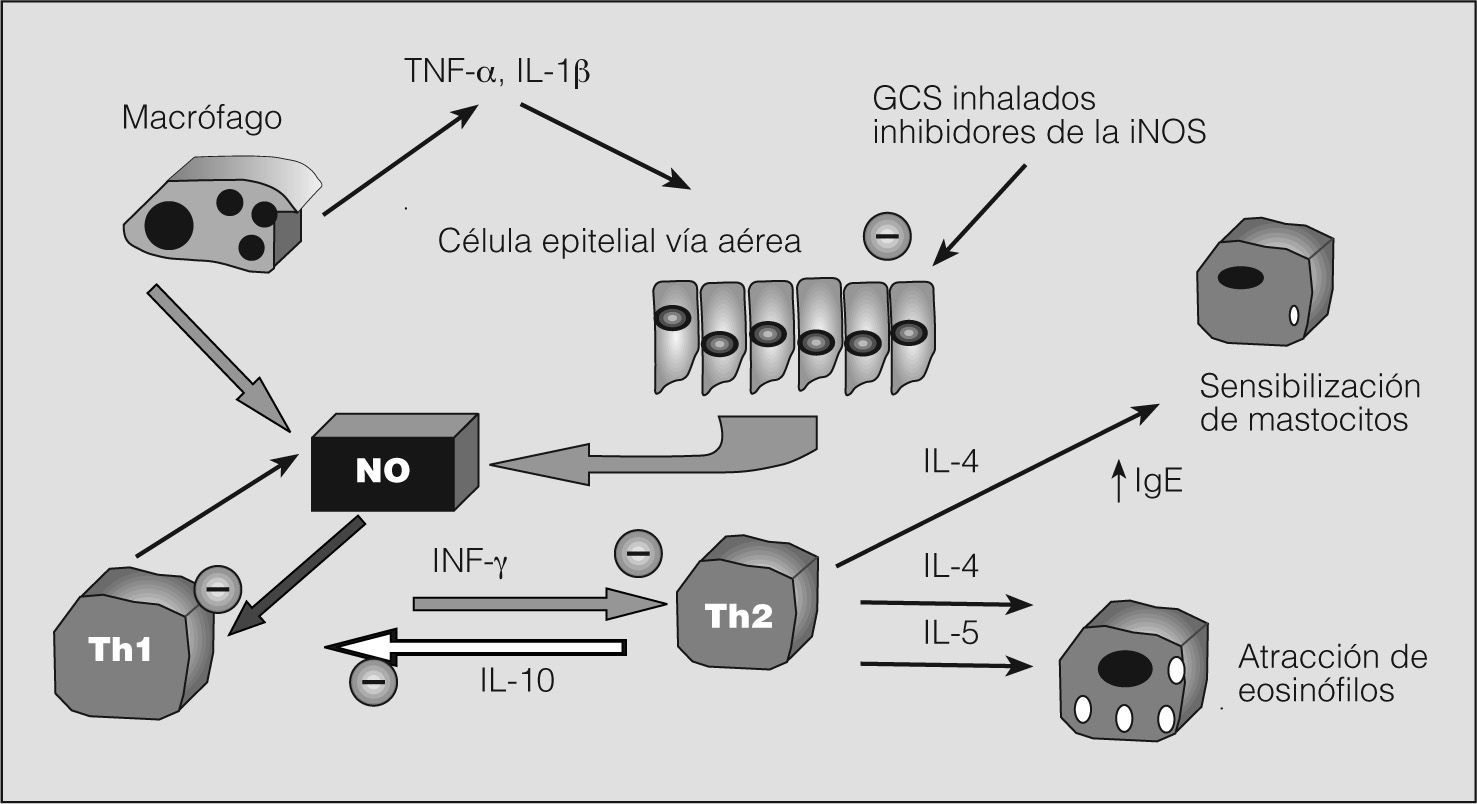
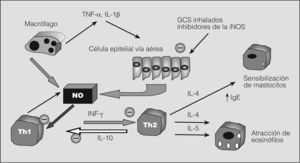
Las concentraciones locales altas de NO favorecen la inhibición de la diferenciación de las células CD4+ T helper (Th) en Th1 (productoras de interleucina-2 e interferón gamma) y el aumento de Th2 (secretoras de interleucinas-4, 5 y 10, que favorecen la producción de inmunoglobulina E, la adherencia y acumulación de eosinófilos). Es decir, desde el punto de vista inmunológico el aumento de la producción local de NO favorece y perpetúa un patrón celular y de mediadores de inflamación similar al encontrado en asmáticos tanto atópicos como no atópicos, por lo que la inhibición de la actividad de la iNOS podría dar lugar a una inhibición de la inflamación eosinofílica en el asma. Se sabe que los glucocorticoides son efectivos a la hora de inhibir la actividad de la iNOS, así como también para controlar el asma y eliminar la inflamación de la vía aérea.
En situaciones patológicas de estrés oxidativo, el NO inhibe los linfocitos Th1 y la producción de interferón gamma, regula a la baja la apoptosis de los eosinófilos y actúa como modulador en enfermedades como el asma ampliando la respuesta inflamatoria (fig. 2). En niños asmáticos aumenta la expresión de iNOS en células epiteliales, eosinófilos, neutrófilos y mastocitos, lo que da lugar a grandes cantidades de NO y metabolitos como el peroxinitrito, que generan hiperreactividad bronquial, daño epitelial e inhibición del surfactante17.
6. El NO favorece el aumento del edema, de la exudación plasmática y del despegamiento del epitelio bronquial. Además, se ha hallado una correlación entre el aumento de la FENO y el incremento del 8-epiisoprostano-F2a, que es un marcador de la peroxidación lipídica y un potente vasoconstrictor pulmonar; se ha planteado que esta sustancia sería un marcador del estrés oxidativo en el asma.
Medida del óxido nítricoEl NO se mide con exactitud mediante el principio de quimioluminiscencia. La reacción del NO con el ozono genera NO2 en una cámara servorrefrigerada. Esta reacción fotoquímica emite una luz en el rango del infrarrojo que es detectada por un tubo fotomultiplicador con una respuesta lineal.
TécnicaHay varias formas de medir la FENO: en pacientes colaboradores y en no colaboradores, mediante análisis on-line y off-line, respectivamente. Los fundamentos teóricos, los métodos y las características técnicas fueron publicados en la década anterior por la European Respiratory Society (ERS)18 y la American Thoracic Society (ATS)19. La principal diferencia entre ambas entidades era la tasa de flujo espirado a la que se realizaba la medición.
1. Registro on-line en niños colaboradores. Baraldi et al20, en colaboración con la ERS y la ATS, publicaron las recomendaciones para la medición de la FENO en niños. Recientemente la ATS ha publicado los criterios unificados ATS y ERS21.
El registro on-line de una única respiración (SBOL, single-breath on-line measurement) es la técnica de elección en el caso de que el niño sea capaz de colaborar. El niño debe inhalar aire libre de NO (NO < 5ppb) durante 2-3s mediante una pieza bucal y con ayuda de una pinza nasal en el caso de no poder evitar la inhalación y exhalación por dicha vía. Realizará una inspiración profunda hasta alcanzar la capacidad pulmonar total. A continuación debe realizar una exhalación completa a un flujo constante, hasta alcanzar una meseta mayor o igual a 3s para una espiración mayor o igual a 4s en menores de 12 años, y superior a 6s en mayores de 12 años. En general, un tiempo de espiración de 10s, recomendado en adultos, daría lugar a una meseta de mayor estabilidad. Luego se procede a la medida de la concentración de la FENO directamente del trazador. Durante la exhalación contra una resistencia, se crea una presión en la cavidad bucal que cierra el velo del paladar (presión % 5-20 cmH2O) y ayuda a disminuir la contaminación del NO procedente de las fosas nasales. Se recomienda una variabilidad inferior o igual al 10% de 3 mediciones realizadas, o del 5% de 2 realizadas.
Debido a que el asma es un síndrome inflamatorio con una obstrucción variable de la vía aérea, los flujos espiratorios menores resultarían más discriminativos y más sensibles para la determinación de la FENO ante cambios variables en el tiempo en el grado de la inflamación. La FENO es dependiente de la tasa de flujo a la que se realiza la medición y, por tanto, los métodos en los que se usen flujos más altos obtendrán tasas menores de FENO. Flujos de exhalación demasiado altos darían lugar a una rápida disminución del volumen pulmonar, y sería enormemente difícil mantener una exhalación durante el tiempo suficiente para alcanzar la meseta recomendada, sobre todo en niños pequeños. Flujos de exhalación demasiado bajos no serían posibles de mantener en pacientes afectados de asma grave22.
Kissoon et al23 estudiaron a 32 niños sanos de entre 15 y 18 años y realizaron mediciones de la FENO a flujos de 46; 31; 23; 15; 10; 7; 5, y 4ml/s. Encontraron que la FENO aumentaba a medida que disminuía el flujo, con una estrecha correlación para los primeros 4 valores más altos de flujo (0,85-0,93; p < 0,001). Documentaron que, en niños sanos, el flujo, la superficie corporal, la edad y el flujo mesoespiratorio forzado eran predictores significativos del valor final de FENO, y propusieron un flujo ideal para adolescentes sanos de entre 30 y 50ml/s. La ATS, en su recomendación del año 2005, ha propuesto un flujo de exhalación constante de 50ml/s21.
Kharitonov et al24 estudiaron a 40 niños de entre 7 y 13 años de edad y midieron la FENO durante 5 días seguidos y en 2 ocasiones cada día. Encontraron que el coeficiente de correlación era de 0,99 y que la FENO obtenida era significativamente mayor en asmáticos (32,9ppb) que en sujetos sanos (16,3ppb). No observaron variaciones significativas entre los distintos días en los que se realizó la medida, ni en relación con el aprendizaje de la técnica, y concluyeron que la medida de la FENO era una técnica sencilla, reproducible e independiente de variaciones en un mismo día o entre distintos días, por lo que constituía un parámetro recomendable para la práctica clínica diaria en el diagnóstico y seguimiento del asma infantil. Además, el registro on-line tendría la capacidad de valorar la presión y el flujo de cada medición y de seleccionar las mejores exhalaciones, descartando las que no fueran óptimas.
También se ha recomendado efectuar la medición de la FENO antes de aplicar otros métodos de valoración de la inflamación de las vías respiratorias, tales como el esputo inducido, la espirometría, la prueba de broncodilatación o la prueba de provocación bronquial, ya que varios autores han encontrado que las concentraciones obtenidas de la FENO eran significativamente menores (p < 0,05) si medían la FENO después de dichas pruebas25,26.
2. Registro on-line en niños no colaboradores. La medición de la FENO en niños preescolares (entre 2 y 5 años) resulta enormemente difícil si se realiza sin sedación y a respiración corriente, a pesar de utilizar técnicas de imagen y animación para la motivación de los niños pequeños.
Buchvald y Bisgaard27, que estudiaron a 51 preescolares de 2-5 años (14 sanos y 37 asmáticos), documentaron la posibilidad de realizar mediciones on-line válidas de la FENO a respiración corriente y a flujo constante (40-60ml/s) mediante el ajuste continuo de las resistencias espiratorias durante la exhalación, con un tiempo de exhalación requerido para un flujo de 50ml/s de aproximadamente 1s. Los datos obtenidos concordaban con los descritos para las medidas de la FENO realizadas en escolares (p < 0,05) mediante el método SBOL, y propusieron por tanto la posibilidad de utilizar la FENO como parámetro no invasivo capaz de realizar el seguimiento de la gravedad y la actividad de la enfermedad en niños preescolares asmáticos, en quienes es difícil efectuar una espirometría forzada con garantías28. Asimismo, hicieron hincapié en la necesidad de la definición y publicación de valores normales en niños preescolares sanos.
Otra modalidad, recientemente publicada, estriba en determinar la FENO a respiración corriente mediante mascarilla facial, tanto on-line como off-line, en niños de 2 a 7 años, con muy buenos resultados29.
3. Registro off-line sin control de flujo de exhalación. Jobsis et al30 estudiaron la FENO en niños escolares de 8 a 13 años de edad, mediante registro off-line, recogiendo el aire exhalado en un reservorio de Tedlar® o Mylar® y analizando los resultados obtenidos antes de las 12h siguientes, sin controlar el flujo y la presión exacta de exhalación. Observaron que el registro offline de la FENO era un método simple y fiable, capaz de discriminar entre distintas enfermedades pulmonares en niños escolares (asma, alergia respiratoria, infecciones víricas) con un NO en aire ambiente menor de 10ppb. La contaminación nasal se evita con el cierre del velo del paladar mediante una presión de exhalación en la cavidad bucal de 5 cmH2O, y la pinza nasal, en principio, no estaría recomendada.
El registro off-line tiene ventajas sobre la técnica online, principalmente en niños que no sean capaces de mantener una tasa de flujo espiratorio constante y uniforme, por lo que puede utilizarse con garantías en niños menos colaboradores31,32. Los resultados de la FENO que se obtienen con ambas técnicas (on-line y off-line) se correlacionan entre sí, pero hay diferencias significativas que no permiten la comparación de resultados, sobre todo si no se controla el flujo de exhalación en la técnica off-line.
4. Registro off-line con control de flujo de exhalación mediante restrictor de flujo dinámico. Se considera la modalidad de registro off-line de elección, ya que la estandarización del flujo mediante el restrictor de flujo dinámico (dynamic flow restrictor o biofeedback) permite mejorar la reproducibilidad de la técnica y así poder compararla con el registro on-line a flujo constante de niños escolares33.
Jobsis et al34 estudiaron a 101 niños con una media de edad de 14 años y encontraron que, excluyendo el espacio muerto en la técnica off-line con control de flujo (se eliminaron los primeros 220ml de la exhalación y se analizó el resto del volumen exhalado), los valores obtenidos mediante el registro off-line (FENO media ± desviación estándar: 17,7 ± 1ppb) y on-line (16 ± 1,2ppb) eran similares si se realizaban a un flujo constante de 50ml/s. Había un alto grado de acuerdo entre los 2 registros a un flujo de 50ml/s (0,95ppb; IC del 95%, 0,63-1,27) y, además, el registro off-line fue capaz de discriminar de forma significativa (p < 0,0001) entre individuos sanos (13,6 ± 1ppb) y afectados de asma o rinitis alérgica (33,3 ± 1,1ppb).
5. Registro off-line a respiración corriente en niños no colaboradores. La respiración a volumen corriente (aire inspirado con NO < 10ppb) puede realizarse a través de una pieza bucal o mascarilla facial, unidas a un sistema de 2 válvulas que impiden respirar el aire exhalado y que lo almacenan en un reservorio para poder analizar la FENO en las horas siguientes. Permite una cooperación pasiva y puede realizarse con garantías en preescolares, recién nacidos y pacientes con enfermedades neuromusculares35,36.
En 2004 Silkoff et al37 proponen un sistema de seguimiento de la FENO utilizando el método SBOL (NIOX®, Aerocrine, Solna, Suecia), con el objetivo de facilitar la estandarización de los procedimientos de medida recomendados por las distintas guías ATS/ERS20,21, y con una metodología aprobada en 2003 por la Food and Drug Administration estadounidense para su aplicación en la práctica clínica diaria en niños afectados de asma. El tiempo de exhalación requerido es de al menos 6s, el rango de flujo de exhalación oscila entre 45 y 55ml/s, y la presión de exhalación entre 10 y 20 cmH2O. El grado de precisión oscila entre ± 2,5ppb para valores inferiores a 50ppb y un ±5% para valores iguales o superiores a 50ppb. Las mediciones de la FENO realizadas con NIOX® están basadas en analizadores de quimioluminiscencia estacionarios (calibración necesaria cada 14 días) y se considera la técnica de elección para la medición de la FENO en la infancia.
Napier y Turner38 estudiaron a 91 niños (edad media: 5,3 años) con el analizador NIOX® y encontraron que la medición obtenida de la FENO era válida y reproducible en niños de edad igual o superior a 5 años, pero no en niños de 4 años. Buchvald et al39, que estudiaron a 522 niños sanos de 4 a 17 años, observaron que la media de la FENO era de 9,7ppb y que se incrementaba de forma significativa con la edad, en mayor medida en niños con edad igual o superior a 10 años. Era una medida reproducible, con una variabilidad en 3 mediciones consecutivas de 1,6ppb (IC del 95%, 1,49-1,64). La mayoría de los sujetos sanos tenía valores inferiores a 15-25ppb, dependiendo de la edad y los síntomas de atopia en los días previos.
Sin embargo, el acceso de algunos centros sanitarios a dichos analizadores de quimioluminiscencia es limitado y, por tanto, se ha propuesto un nuevo analizador portátil de FENO (NIOX-MINO®), basado en analizadores electroquímicos, que cumpliría las recomendaciones de la ATS19,21 y simplificaría enormemente el manejo de la medición del FENO en la práctica clínica diaria, tanto en atención especializada como en atención primaria. El tiempo de exhalación requerido oscila entre 3 y 6s, y la presión necesaria de exhalación, que va de 10 a 20 cmH2O, permite establecer un flujo entre 45 y 55ml/s, controlado por un regulador de flujo-presión que está guiado por imágenes interactivas de luz y sonido, las cuales incentivan al niño a alcanzar el flujo óptimo deseado. El tiempo total requerido para la medición es inferior a 2min.
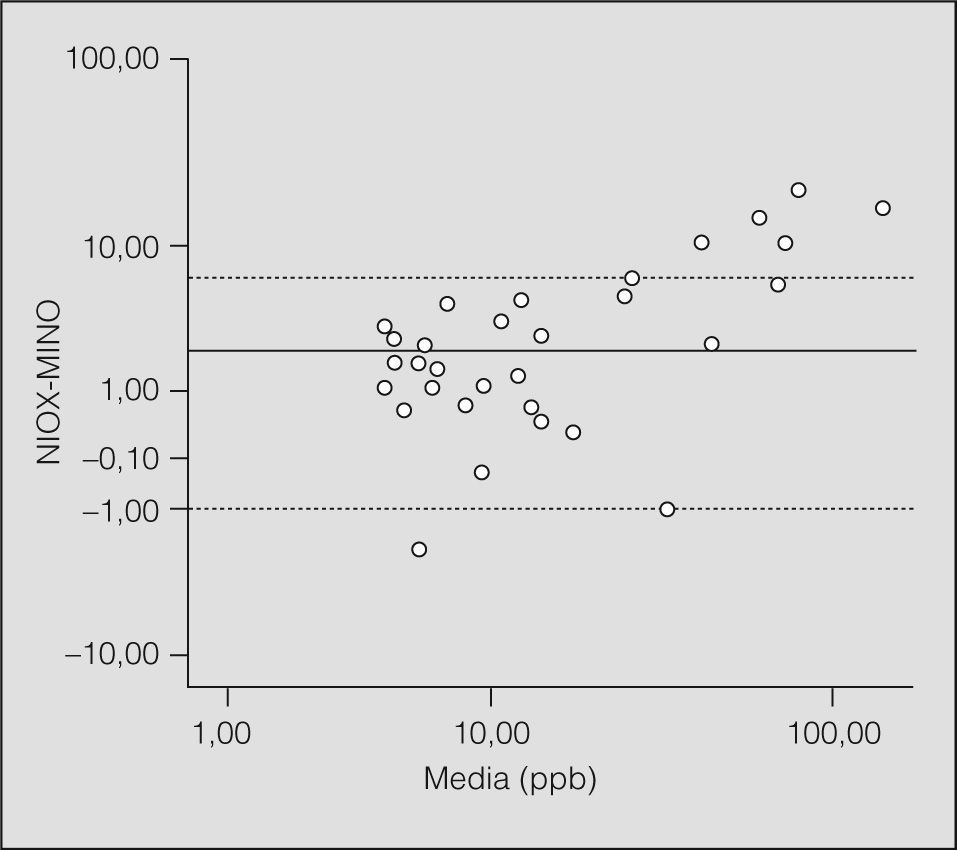
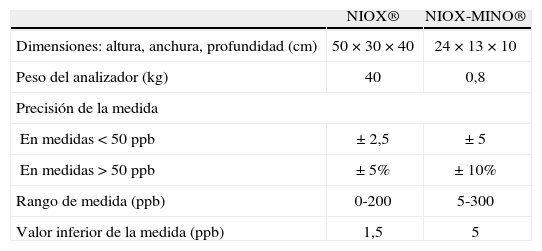
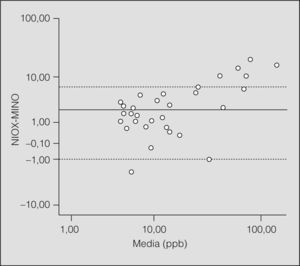
McGill et al40 estudiaron a 55 niños de 4 a 15 años (media de edad: 9 años), a quienes realizaron mediciones de la FENO con analizadores NIOX® (técnica de referencia) y con analizadores portátiles (NIOX-MINO®), con el objetivo de validar estos últimos (tabla I y fig. 3). El 61% de los niños fue capaz de realizar ambas técnicas con garantías y, al igual que en estudios previos efectuados en adultos41, los resultados obtenidos reflejaban una buena correlación entre ambos analizadores (coeficiente de correlación = 0,98). Los resultados obtenidos con el analizador NIOX-MINO® eran discretamente superiores a los obtenidos con el sistema NIOX® (p < 0,01), diferencia que resultaba más evidente para valores más elevados de la FENO, aunque no era clínicamente significativa para el diagnóstico ni para el manejo de los niños afectados de asma42. Los analizadores NIOX® serían algo más precisos (± 2,5ppb para valores inferiores a 50ppb, frente a ±5ppb del NIOX-MINO® o el ± 10% para valores iguales o superiores a 50ppb) y alcanzarían un rango de medidas de 0 a 200ppb frente al rango de 5 a 300ppb del analizador NIOX-MINO® (tabla I). No obstante, una de las principales desventajas del sistema portátil sería la incapacidad de reproducir la gráfica de la morfología de la FENO para obtener la meseta correspondiente a la fracción bronquial exhalada de NO, ya que el sistema NIOX-MINO® emite únicamente el valor final de la FENO de forma digital.
Comparación entre 2 dispositivos de medida del óxido nítrico exhalado: NIOX® y NIOX-MINO®
| NIOX® | NIOX-MINO® | |
| Dimensiones: altura, anchura, profundidad (cm) | 50 × 30 × 40 | 24 × 13 × 10 |
| Peso del analizador (kg) | 40 | 0,8 |
| Precisión de la medida | ||
| En medidas < 50ppb | ±2,5 | ±5 |
| En medidas > 50ppb | ±5% | ± 10% |
| Rango de medida (ppb) | 0-200 | 5-300 |
| Valor inferior de la medida (ppb) | 1,5 | 5 |
ppb: partes por mil millones.
Representación gráfica, mediante el método de Bland-Altman, de las medidas obtenidas con los 2 dispositivos de medida de la fracción espirada de óxido nítrico (FENO) respecto a la diferencia entre ambas. ppb: partes por mil millones. (Modificada de McGill et al40.)
Los niños con una edad igual o superior a 5 años eran capaces de realizar la medición de la FENO utilizando el sistema portátil (NIOX-MINO®)40. Por otro lado, el coeficiente de variación intrasujeto de los analizadores NIOX-MINO® (11%) era inferior al de los NIOX®; por lo tanto, no había diferencias entre la primera medida efectuada y las posteriores, y sería suficiente una única medición, tal como recomiendan los fabricantes. Sin embargo, las guías existentes (ATS/ERS) proponen la obtención de al menos 2 mediciones sucesivas21.
Los niños tienen una capacidad pulmonar total menor que los adultos, lo que podría impedirles, en ocasiones, exhalar de forma correcta durante un tiempo superior a 6s. En este sentido, se ha validado el período de exhalación de 6s con el analizador portátil NIOX-MINO®40, como indicaba la ATS/ERS, que señalaba la posible validez de 6s en el tiempo espiratorio para las edades comprendidas entre 6 y 12 años21.
Recientemente, Menzies et al43 han validado los resultados del medidor portátil MINO (Aerocrine AB, Smidesvagen, Suecia) con el NIOX en 101 niños asmáticos y 50 controles sanos, obteniendo una excelente correlación entre ambos sistemas tanto en asmáticos como en sanos (r = 0,94 y 0,96, respectivamente). Del mismo modo, Fortuna et al44 han estudiado a 28 adultos sanos, no fumadores, y han comparado los resultados obtenidos con un medidor de quimioluminiscencia tradicional (N-6008®, SIR, Madrid, España) y el medidor portátil NIOX-MINO®, siguiendo en ambos casos las recomendaciones internacionales21. Han encontrado una correlación directa y estadísticamente significativa entre la determinación de FENO efectuada en ambos equipos (r = 0,92; p = 0,001). Sin embargo, al igual que lo publicado por otros autores40,45, los valores obtenidos con el sistema portátil NIOX-MINO® han sido significativamente superiores a los obtenidos con el N-6008®, y dichos autores han propuesto un factor de corrección entre los valores de los 2 equipos (×1,5 +10) para cada valor de FENO obtenido con el equipo N-6008®. Asimismo, han descrito valores de referencia de normalidad concordantes con la literatura médica -media geométrica de la FENO para el sistema N-6008® de 7 ±5ppb (rango: 1-19ppb), y de 20 ± 7ppb (rango: 8-41) para NIOX-MINO®– y han propuesto como punto de corte 20ppb para el medidor de quimioluminiscencia y 35ppb para el sistema portátil.
En conclusión, los resultados obtenidos por ambos métodos de medición son comparables y, además, los 2 son válidos y reproducibles. Asimismo, mientras que los niños escolares eran capaces de realizar ambas técnicas con garantías, los preescolares obtenían mejores resultados con el NIOX®.
Valores de referenciaCon analizadores de quimioluminiscencia, registro SBOL y flujo espiratorio de 45-55ml/s, los valores de la FENO en adultos sanos se sitúan en un rango de 5-15 ppb44. Los mismos valores de referencia se encuentran en niños de más de 5 años de edad, como se observa en las siguientes publicaciones:
- −
Jobsis et al34, en 73 niños, FENO de 10,5 ± 1,1ppb.
- −
Kharitonov et al24, en 20 niños, Feno de 15,6 ± 9,2ppb.
- −
Pedroletti et al46, en 15 niños, FENO de 12,5 ± 3,2ppb.
- −
Scollo et al47, en 23 niños, FENO de 10,1 ±4,1ppb.
- −
Malmberg et al48, en 62 niños, FENO de 5,3 ± 0,4ppb
Buchvald et al39 han establecido, en un estudio multicéntrico con 405 niños sanos de 4 a 7 años, los valores de normalidad de la FENO. La media geométrica es 9,7ppb (aumenta con la edad) y el límite superior del IC del 95% es de 25,2ppb.
En 2007 Daniel et al49 han publicado valores de referencia con niños de 2-7 años midiendo la FENO a respiración corriente con mascarilla facial on-line (concentración media geométrica: 3,9ppb; IC del 95%, 3,5-4,2) y off-line (concentración media geométrica: 3,0ppb; IC del 95% 2,7-3,3).
Si se mide el NO mediante analizadores electroquímicos siguiendo las recomendaciones ATS-ERS12,14, los valores de la FENO son discretamente superiores (rango: 20-30ppb) a los obtenidos con analizadores de quimioluminiscencia.
Aplicación clínica de la determinación del óxido nítrico exhalado en enfermedades respiratorias en niñosAsmaEn el diagnóstico. Se han descrito valores elevados de la FENO en niños asmáticos y en otras enfermedades inflamatorias pulmonares (tabla II), y se ha considerado que su determinación es una técnica no invasiva válida y reproducible para el seguimiento y manejo de la inflamación de la vía aérea, y que posee capacidad discriminativa para diagnosticar el asma. En este sentido, Cobos Barroso et al50 comunicaron en 1998 los resultados del primer estudio europeo pediátrico de la FENO y del NO nasal sobre 73 niños escolares, distribuidos en 36 asmáticos y 37 controles, bajo flujo espirado de 250ml/s. Observaron diferencias entre el grupo control y el de afectados de asma (p < 0,0001), tanto en el subgrupo de asma leve intermitente (sin tratamiento) como en el subgrupo que seguía tratamiento con esteroides inhalados. Cuatro años después, Balboa de Paz et al51 comunicaron resultados similares (estudio de 79 niños asmáticos frente a 105 controles; flujo espirado de 250ml/s) y concluyeron que la FENO puede ser útil para el seguimiento de la inflamación bronquial y la valoración de la respuesta antiinflamatoria de los tratamientos instaurados.
Enfermedades y factores que modifican la fracción espirada de óxido nítrico (FENO)
| Aumentan FENO | Disminuyen FENO | FENO variable |
| AsmaExposición a neumoalérgenosPoluciónApneaBroncodilatadores (transitorio)Infección vírica respiratoriaTuberculosis pulmonarRinoconjuntivitis alérgica. Poliposis nasalBronquiolitis postrasplanteEnfermedad intestinal inflamatoria crónicaSíndrome hepatopulmonarCirrosis hepática | Fibrosis quísticaDiscinesia ciliar primariaHipertensión arterial pulmonarNeumoníaReflujo gastroesofágicoLaringotraqueomalaciaInducción de esputoBroncoconstricciónEspirometría forzada (transitorio)Infección por el VIHTabaquismoAlcoholCafeínaMenstruaciónNebulización de agua destilada | EPOCBronquiectasiasAlveolitis fibrosanteSarcoidosisEsclerosis sistémica |
EPOC: enfermedad pulmonar obstructiva crónica; VIH: virus de la inmunodeficiencia humana.
Avanzando en la investigación de la FENO y el asma en niños, Warke et al52 compararon los valores de la FENO en niños sanos y asmáticos con los datos obtenidos por lavado broncoalveolar. Encontraron que la FENO en niños asmáticos se correlacionaba positivamente con la cantidad de eosinófilos (r = 0,78; p < 0,001) y la proteína catiónica del eosinófilo (r = 0,53; p < 0,01), pero no con otras células inflamatorias recogidas en el lavado broncoalveolar. La FENO superior a 17ppb tenía una sensibilidad del 81% y una especificidad del 80% para predecir inflamación asmática. Por tanto, la FENO sería un marcador no invasivo válido y reproducible para medir la inflamación eosinofílica en las vías aéreas53.
Asimismo, Malmberg et al54 observaron que valores elevados de la FENO (≥ 3 desviaciones estándar) se correlacionaban con asma clínica (odds ratio = 16,3; IC del 95%, 5,4-49,7; p < 0,0001) y con la eosinofilia en esputo (odds ratio = 12; IC del 95%, 4,1-35; p < 0,0001), siendo el asma clínica y la eosinofilia en esputo los mejores predictores de la elevación de la FENO, seguidas de la atopia y de la hiperrespuesta bronquial. Estos autores concluyen que la FENO es un marcador primario de la eosinofilia de la vía aérea y que su elevación significativa tendría utilidad en la identificación de pacientes con posible asma, independientemente de la atopia.
Al comparar distintas pruebas de función pulmonar (espirometría forzada, resistencias por oscilación y prueba de broncodilatación) y el esputo inducido con la FENO en niños con sospecha de asma, concluyeron que la sensibilidad diagnóstica de la espirometría forzada era menor (del 47%) que la de la FENO (88%) y la del esputo inducido (86%)54. Asimismo, la FENO ofrecía una especificidad del 92%, lo cual reflejaba su mayor capacidad discriminativa entre los niños preescolares afectados de asma y los sanos, y la capacidad de detectar la presencia de inflamación en estadios tempranos de la enfermedad. La combinación de un incremento de la FENO igual o superior a 33ppb y una espirometría anormal (FEV1 < 80% del teórico) refleja una sensibilidad del 94% y una especificidad del 93% para el diagnóstico de asma48,55.
Sin embargo, hay que recordar que existen distintos fenotipos de asma y que, por tanto, una FENO normal no excluye el diagnóstico de la enfermedad, sobre todo en el asma de fenotipo no eosinófilo56. Además, en la infancia, a diferencia de lo que ocurre en adultos, los distintos fenotipos de asma no están claramente definidos, sobre todo en aquellos fenotipos de asma grave en los cuales persisten los síntomas y el deterioro de la función pulmonar, a pesar del tratamiento. Se considera que en el asma grave de la infancia, a pesar de ser un grupo heterogéneo, predomina el patrón de inflamación crónica de la vía aérea mediada por Th2. Sin embargo, quedaría sin responder la pregunta de si es posible la evolución hacia distintos fenotipos de asma en un mismo individuo a lo largo de la vida57,58.
En el seguimiento del tratamiento. La FENO se ha utilizado satisfactoriamente para el seguimiento del tratamiento antiinflamatorio con corticoides inhalados en niños asmáticos, debido a su gran sensibilidad y rapidez para detectar cambios en respuesta a las dosis de corticoides inhalados o deterioro de la función pulmonar. Jones et al59 estudiaron a 78 sujetos con asma moderada-grave en tratamiento con corticoides inhalados y compararon la FENO, el esputo inducido y la hiperrespuesta bronquial como método para diagnosticar y predecir el deterioro de la función pulmonar o la pérdida de control del asma. Encontraron que la FENO guardaba una mayor correlación con los síntomas respiratorios indicativos de la pérdida de control de la enfermedad (p < 0,0001) que el FEV1 obtenido por espirometría forzada (p < 0,002) y el esputo inducido (p < 0,0002). El incremento de la FENO superior al 60% de la cifra basal tenía un valor predictivo positivo entre el 80 y el 90% para predecir la pérdida de control de la enfermedad. Además, la FENO ofrece la posibilidad de ajustar el tratamiento a la mínima dosis eficaz, manteniendo el control del proceso inflamatorio, y posee la capacidad de identificar a los pacientes con buena respuesta a los corticoides inhalados que se encuentran todavía asintomáticos60. El valor predictivo positivo de la respuesta a los corticoides que tiene la FENO para un valor igual o superior a 47ppb en pacientes asintomáticos era superior al obtenido por la espirometría forzada, la prueba broncodilatadora o la hiperrespuesta bronquial, lo cual ofrece garantías para el correcto manejo del asma en la práctica clínica diaria61,62.
También se ha estudiado la función pulmonar y la FENO en niños de 2-5 años de edad diagnosticados de asma63. En este sentido, la intervención con montelukast (4mg/día) disminuye la FENO de 33,1 a 11,6ppb de media geométrica, mejorando la resistencia de la vía aérea por interrupción con obturador único, sin cambios en la prueba broncodilatadora.
Del mismo modo, Pijnenburg et al64 estudiaron la FENO como marcador de la inflamación eosinofílica de la vía aérea en 40 niños de 12 años de edad media, en tratamiento con budesonida inhalada o corticoide equivalente (dosis media de 400μg; rango: 100-400). La determinación de la FENO después de interrumpir el tratamiento con corticoides inhalados es un indicador eficaz de agudización o de estabilidad del asma a las 2 semanas (35,3 frente a 15,7ppb; ratio: 2,6; IC del 95%, 1,2-4,1; p = 0,01) y a las 4 semanas (40,8 frente a 15,9ppb; ratio: 2,6; IC del 95%, 1,3-5,1). Estos resultados muestran que una FENO de 49ppb, a las 4 semanas de retirar los corticoides inhalados, muestra una sensibilidad del 71% y especificidad del 93% para estimar que el asma está en remisión.
Lactante con sibilancias recurrentesTambién la FENO resulta útil en el diagnóstico diferencial de los niños preescolares con sibilancias recurrentes, edad donde la espirometría forzada y el esputo inducido son más complejos de realizar. Moeller et al65 estudiaron a 31 niños con sibilancias recurrentes e historia familiar de atopia, a quienes realizaron espirometría forzada y determinación de la FENO antes y después de que recibieran tratamiento con corticoides inhalados o placebo durante 4 semanas. Encontraron que el tratamiento con dosis moderadas de corticoides inhalados disminuía significativamente los valores de la FENO (de 35 a 16,5ppb, en comparación con de 35,2 a 30,2ppb; p < 0,05), lo cual refleja el potencial de la FENO como marcador de la inflamación bronquial indicativa de tratamiento, aun en ausencia de clínica respiratoria y sin cambios significativos en la función pulmonar. Así, un valor de FENO inferior a 20ppb, en un paciente con síntomas indicativos de asma, deberá hacer pensar en asma de fenotipo neutrófilo, enfermedad por reflujo gastroesofágico, rinosinusitis con goteo nasal posterior, disfunción ventricular izquierda, discinesia ciliar primaria, disfunción de cuerdas vocales, etc., como muestran Gabriele et al66 tras estudiar a 118 lactantes de entre 4 y 25 meses de edad: la media geométrica de la FENO es distinta en sanos (10,4ppb; IC del 95%, 9,1-12,0), afectados de sibilantes recurrentes (18,6ppb; IC del 95%,15,6-22,2), de displasia broncopulmonar (11,7ppb; IC del 95%, 8,2-16,8) y de fibrosis quística (6,9ppb; IC del 95%, 3,4-10,1). Aquellos con sibilancias recurrentes presentan valores más altos de FENO que los controles (p = 0,009), los afectados de displasia broncopulmonar (p = 0,038) y de fibrosis quística (p < 0,001). Además, los lactantes atópicos con episodios recurrentes de sibilancias tienen valores más elevados de FENO que aquéllos con sibilancias no atópicos (p = 0,04).
Straub et al67, en un estudio prospectivo, doble ciego y controlado con 24 casos asignados aleatoriamente a recibir montelukast (4mg/día) o placebo, en lactantes de 10-26 meses de edad con sibilancias recurrentes, no encuentran que la FENO discrimine quiénes van a presentar episodios recurrentes de sibilancias.
En este sentido, hay investigadores que estudian la FENO en recién nacidos sanos para observar si puede ser un marcador de desarrollo de enfermedades respiratorias recurrentes. Latzin et al68, tras observar una cohorte de 164 recién nacidos sanos, concluyen que los neonatos de madres atópicas con valores elevados de FENO tienen riesgo de desarrollar síntomas respiratorios (riesgo relativo = 7,5; IC del 95%, 1,7-32,4; p = 0,007). Asimismo, la FENO elevada y los síntomas respiratorios están asociados con el tabaquismo materno (riesgo relativo = 6,6; IC del 95%, 2,3-19,3; p < 0,001). Por tanto, la detección de un estado "preasmático" en recién nacidos hijos de madres fumadoras o atópicas inicia el desarrollo de una hipótesis muy sugerente para intervenciones farmacológicas dirigidas a modificar la historia natural del asma en alguno de sus fenotipos69.
AtopiaEn la rinitis alérgica se describe un aumento del NO nasal, que disminuye tras el tratamiento con glucocorticoides orales o tópicos, lo cual parece explicarse por la sobreexpresión o inhibición de la iNOS del epitelio de la vía aérea superior, que se relaciona estrechamente con la inflamación eosinofílica. Jouaville et al70 estudiaron a 149 niños (53 asmáticos sin tratamiento y 96 sanos), a quienes realizaron la determinación de la FENO y la prueba de punción. Encontraron que aquéllos con asma atópica tenían valores superiores a los afectados de asma no atópica (28,9 ± 9,1 frente a 17,1 ± 13,1ppb; p < 0,0004). Los no asmáticos pero atópicos (2 positivos por prick test) con rinitis alérgica presentaban valores mayores que los no atópicos (20,7 ±13 frente a 11,7 ± 6,7ppb; p < 0,003) y que los atópicos sin rinitis alérgica ni asma (12,5 ± 6,4ppb), mientras que en los niños asmáticos la FENO se incrementaba en atópicos independientemente de la rinitis alérgica. Concluyeron que, además del asma y la atopia, la rinitis alérgica era un parámetro que debía tenerse en cuenta a la hora de interpretar la FENO en la práctica clínica diaria.
En el prematuroUn grupo de recién nacidos muy prematuros requiere oxígeno suplementario más allá de las 36 semanas posmenstruales. Una vez dados de alta, presentan enfermedades respiratorias, atención en urgencias y reingresos por enfermedades respiratorias diversas durante los 2 primeros años de edad. Agrupada esta enfermedad como displasia broncopulmonar o como enfermedad pulmonar crónica del lactante relacionada con la prematuridad, se conoce como un proceso inflamatorio, donde el seguimiento de la FENO podría resultar de interés.
Cuando se han investigado la función pulmonar y los valores de la FENO de forma prospectiva y con medidas repetidas71, la FENO no aparece como una variable predictiva del desarrollo de enfermedad pulmonar crónica asociada a prematuridad. En cambio, el peso neonatal y la función pulmonar son las variables que se asocian más estrechamente con dicha enfermedad.
Fibrosis quísticaTambién en la fibrosis quística se obtienen valores bajos de la FENO, a pesar de existir inflamación crónica en estos pacientes. En parte se debe a la disminución de la expresión de la NOS2 en las vías aéreas de los niños afectados y a la elevada cantidad de nitratos encontrados en las secreciones de los pacientes con fibrosis quística, indicativos del metabolismo del NO que se produce en dicho lugar72.
Un trabajo novedoso llevado a cabo por Mahut et al73 estudia un modelo bicompartimental que permite analizar por separado la producción de NO en el área alveolar y en las vías de conducción, para poder diferenciar las zonas de inflamación y conocer mejor su distribución. La FENO alveolar era mayor en la alveolitis (por hipersensibilidad y fibrosis pulmonar idiopática) que en el asma y se correlacionaba inversamente con la capacidad de difusión pulmonar y con el grado de restricción.
Discinesia ciliar primariaEn la discinesia ciliar primaria se detectan cifras bajas de la FENO. Corbelli et al74 publicaron que la medición del NO nasal según las recomendaciones de la ATS/ERS ayudaría a diferenciarla. Los valores obtenidos de NO nasal en la discinesia ciliar primaria son extremadamente bajos en pacientes de cualquier edad (13,7ppb) comparados con los sujetos sanos (223,7ppb). Asimismo documentaron que el valor predictivo positivo del diagnóstico de discinesia ciliar primaria para un valor de NO nasal inferior a 105ppb era del 89% y la especificidad del 88%. Por tanto, constituye una de las técnicas de cribado de elección para la discinesia ciliar primaria.
Otros procesos respiratoriosLa FENO no aumenta en enfermedades obstructivas crónicas estables, pero en ocasiones puede elevarse si se inestabilizan75. La mayoría de las publicaciones refieren que la FENO es menor en los sujetos con bronquiectasias que en la población normal, mientras que la FENO alveolar es similar en ambos grupos76.
ConclusionesLa FENO es un marcador no invasivo de inflamación eosinofílica de la vía aérea, válido, reproducible y estable, por lo que resulta de utilidad en el diagnóstico diferencial de las distintas enfermedades pulmonares en la práctica clínica diaria77 y como complemento a la función pulmonar en el diagnóstico de asma y en el control del tratamiento en niños78. Un valor superior a 20ppb en un equipo analizador por quimioluminiscencia, o superior a 35ppb si se trata de un método electroquímico, con monitores portátiles, indica un incremento de la actividad inflamatoria en las vías aéreas. De esta forma se puede ajustar mejor la dosis de fármacos antiinflamatorios, avisar de un teórico incumplimiento del tratamiento o incluso plantear la retirada de éste79.