En 2007 el estudio EPISCAN actualizó los resultados de IBERPOC en 1997. Debido a los cambios demográficos y en la exposición a factores de riesgo, es importante actualizar los datos de prevalencia y determinantes de la EPOC de forma periódica. El presente artículo resume el protocolo y las herramientas de EPISCAN II.
Material y métodosEl objetivo principal de EPISCAN II es estimar la prevalencia de la EPOC en la población general residente en España de 40 años o más en las 17 comunidades autónomas. El tamaño muestral requiere 600 participantes (300 hombres y 300 mujeres) por centro, seleccionando a 10.200 participantes en visita corta (cuestionario más espirometría forzada posbroncodilatador) y de entre ellos a 800 (400 con EPOC y 400 sin EPOC) que también realizarán una visita larga (prueba de la marcha, sangre, difusión, pulsioximetría, bioimpedancia y TC de baja radiación).
ResultadosEl primer participante se reclutó el 28 de febrero del 2017. A fecha de 22 de noviembre del 2017, contamos con un total de 3.581 participantes incluidos, de los cuales 422 ya han realizado la visita larga. Se estima que el trabajo de campo terminará alrededor de diciembre de 2018. La nueva información de imagen, biomarcadores y nuevas exposiciones, como el cigarrillo electrónico o contaminación ambiental, entre otros, permitirán una nueva cuantificación del problema de la EPOC.
ConclusionesEPISCAN II actualizará la prevalencia y los determinantes de la EPOC en España y permitirá comparar resultados espirométricos y otros aspectos de la EPOC entre las 17 comunidades autónomas.
The EPISCAN study, published in 2007, was an update of the results of the 1997 IBERPOC study. Changes in demographics and exposure to risk factors demand the periodic update of prevalence and determining factors in COPD. This article is a summary of the protocol and tools used in EPISCAN II.
Materials and methodsThe primary objective of EPISCAN II is to estimate the prevalence of COPD among the general population aged 40 years or more in the 17 autonomous communities of Spain. The sample size requires 600 participants (300 men and 300 women) per center, selected by screening 10,200 participants in a short visit (questionnaire plus forced post-bronchodilator spirometry). Of these, 800 (400 with COPD and 400 without COPD) will also perform a long visit (including a walking test, blood tests, determination of diffusion, pulse oximetry and bioimpedance, and low radiation CT).
ResultsThe first participant was recruited on 28 February 2017. As of 22 November 2017, a total of 3,581 participants had been included, of whom 422 had already performed the long visit. It is estimated that the field work will be completed by December 2018. The new imaging data, biomarkers, and information on new exposures, such as electronic cigarettes and environmental pollution, will help us re-quantify the burden of COPD.
ConclusionsEPISCAN II will provide updated information on prevalence and determinants of COPD in Spain, allowing for the comparison of spirometric results and other factors associated with COPD among the 17 autonomous communities.
La enfermedad pulmonar obstructiva crónica (EPOC) es una causa importante de morbimortalidad en España, con un elevado impacto económico, en parte debido a su infradiagnóstico que hace que la mayoría de los pacientes llegue a estadios avanzados de la enfermedad sin diagnóstico previo ni tratamientos adecuados. Actualmente, está ampliamente reconocido que la EPOC es un síndrome heterogéneo y complejo, con afectación pulmonar y extrapulmonar1. En la práctica clínica, el diagnóstico de EPOC se fundamenta en la evaluación de la exposición al tabaco u otros gases nocivos, la presencia de síntomas respiratorios y la identificación de una limitación crónica al flujo aéreo, documentada mediante una espirometría posbroncodiltador. La gravedad de la limitación al flujo aéreo, medida por el porcentaje del FEV1 posbroncodilatador con respecto a su valor predicho proporciona una información importante para optimizar el manejo de la enfermedad y establecer su gravedad1,2.
El cribado de la EPOC debe considerarse en cualquier persona que presente los síntomas característicos de la enfermedad, además de una exposición a factores de riesgo, el más importante de los cuales es el tabaquismo3.
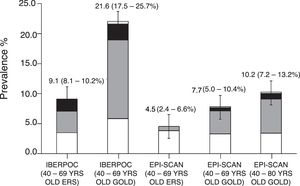
Dos estudios previos realizados en España, el IBERPOC y el EPISCAN, determinaron una prevalencia de la EPOC en la población general española de 40 a 69 años de un 9,1%4, y entre los 40 y 80 años del 10,2%5, respectivamente, con 10 años de diferencia. Otros estudios, como el PLATINO, estimaron prevalencias incluso superiores (14,3%) también en población mayor de 40 años pero en diferentes países de Latinoamérica6,7. Pese a estas cifras, la EPOC sigue siendo una enfermedad con elevados índices de infradiagnóstico, con porcentajes del 78% en 1997 y del 73% en 2007 en España, teniendo como consecuencia que los diagnósticos se producen en estadios más avanzados, donde existe un mayor riesgo de exacerbaciones y mortalidad8.
Las estimaciones globales de mortalidad indicaban que la EPOC era la quinta causa de muerte en 1990, mientras que en 2010 ya se consideraba la tercera causa de mortalidad9,10, por lo que un diagnóstico temprano es de vital importancia.
Por todo ello, se planteó realizar un nuevo estudio epidemiológico que actualice la prevalencia y los determinantes de la EPOC en España, con representatividad de todas las comunidades autónomas (CC. AA.) y ampliando la valoración, no solamente al valor espirométrico, sino contemplando otras dimensiones más allá del pulmón, con cuestionarios de síntomas respiratorios y no respiratorios, una evaluación funcional más amplia y, en algunos casos, pruebas biológicas como marcadores inflamatorios y de imagen como la tomografía computarizada (TC) de baja radiación.
El objetivo principal de EPISCAN II es estimar la prevalencia de la EPOC en la población general residente en España mayor de 40 años de edad. Todos los objetivos secundarios se describen en la tabla 1.
Objetivos del estudio EPISCAN II
| 1. Objetivo principal |
| Estimar la prevalencia de EPOC en población residente en España mayor de 40 años de edad |
| 2. Objetivos secundarios |
| a. Describir las características sociodemográficas y clínicas de la muestra del estudio |
| b. Describir la evolución de la prevalencia de la EPOC respecto a estudios previos |
| c. Describir la variabilidad geográfica de la prevalencia de la EPOC |
| d. Comparar la prevalencia de EPOC en los diferentes grupos de edad y sexo según el cociente FEV1/FVC posbroncodilatador <0,70 o menor del límite inferior de la normalidad |
| e. Evaluar la tasa de infradiagnóstico y sobrediagnóstico de la EPOC |
| f. Describir la comorbilidad de la población con y sin EPOC: se utilizarán los índices de Charlson y COTE, que relacionan la mortalidad a largo plazo con la comorbilidad del paciente y se completará con una lista cerrada de otras enfermedades concomitantes |
| g. Describir la distribución de la población analizada según clasificación de la gravedad GOLD y según fenotipos y la estratificación del riesgo de GesEPOC |
| h. Analizar los factores de riesgo de la EPOC: nivel de actividad física, tabaquismo (incluyendo el grado de tabaquismo mediante una cooximetría en una submuestra del estudio), exposición profesional, exposición a humo de biomasa |
| i. Evaluar la relación entre el diagnóstico de EPOC, sus síntomas, el nivel de actividad física y el nivel de tabaquismo. |
| j. Valorar si el tratamiento recibido en la población con EPOC se adecua a las normativas vigentes y describir la tasa de infratratamiento y sobretratamiento |
| k. Describir la prevalencia de tabaquismo en población de 40 años o más en España y según sexo y grupos de edad |
| l. Determinar el grado de dependencia a la nicotina entre los fumadores mediante el test de Fagerström, así como la fase del proceso de cesación tabáquica en la que se encuentran según el modelo transteórico de Prochaska y DiClemente |
| m. Describir la prevalencia de síntomas respiratorios en la población del estudio |
| n. Evaluar la calidad de vida relacionada con la salud con el cuestionario CAT (COPD Assessment Test) |
| o. Evaluar el posible deterioro cognitivo entre la población de 60 o más años de edad con el cuestionario sobre el estado mental MEC (mini-examen cognoscitivo o examen cognoscitivo Mini-Mental) |
| p. Evaluar la presencia de ansiedad y depresión en la población del estudio mediante la escala Hospital Anxiety and Depression Scale |
| q. Realizar una valoración multidimensional de la EPOC de acuerdo con los índices BODE y BODEX: IMC, grado de disnea (MMRC), función pulmonar (FEV1), capacidad respiratoria (prueba de la marcha) y número de exacerbaciones graves |
| r. Comparar el índice de masa magra entre pacientes con EPOC y sujetos no EPOC mediante una bioimpedancia |
| s. Comparar la tolerancia al ejercicio, mediante la prueba de la marcha, en los distintos niveles de gravedad de la EPOC y en sujetos no EPOC |
| t. Comparar la actividad física cotidiana, evaluada mediante el cuestionario Yale Physical Activity Survey entre pacientes con EPOC y sujetos no EPOC |
| u. Comparar la densidad de atenuación pulmonar y el grosor del calibre de las vías aéreas obtenidos mediante una TC entre los distintos niveles de gravedad de la EPOC, fumadores sin limitación al flujo aéreo y no fumadores sin limitación al flujo aéreo |
| v. Comparar la intensidad de la disnea y otros síntomas respiratorios, calidad de vida relacionada con la salud, tolerancia al ejercicio, actividad física e inflamación sistémica entre sujetos no EPOC y pacientes con EPOC, según el valor de su capacidad de difusión pulmonar |
| w. Determinar la prevalencia poblacional de una capacidad de difusión pulmonar reducida en sujetos sin limitación al flujo aéreo |
| x. En sujetos sin evidencia de limitación al flujo aéreo, comparar la repercusión de una capacidad de difusión reducida frente a una capacidad de difusión normal sobre la calidad de vida relacionada con la salud, tolerancia al ejercicio, inflamación sistémica y atenuación del parénquima pulmonar |
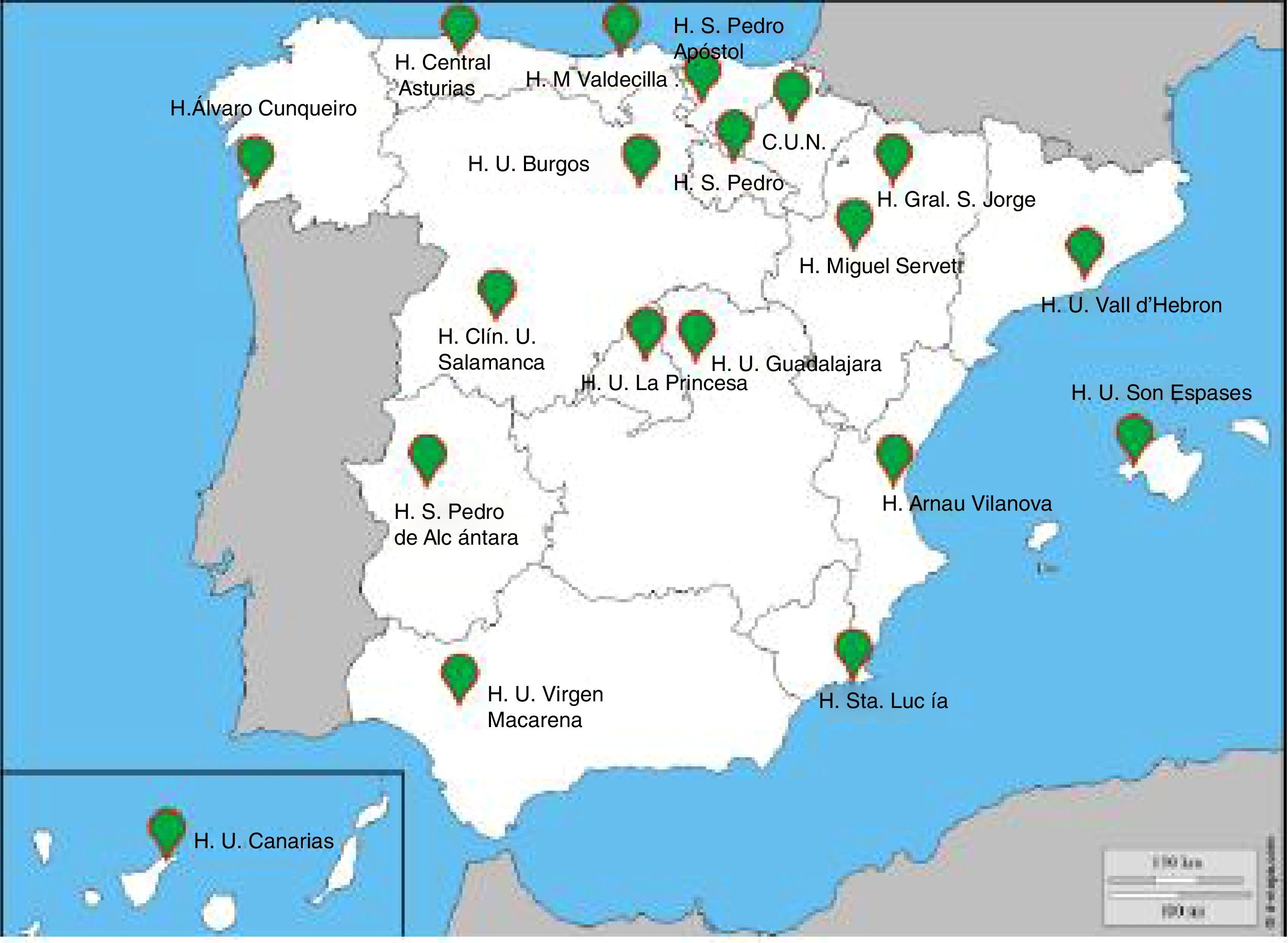
Es un estudio observacional epidemiológico de base poblacional, transversal, multicéntrico y de ámbito nacional. Los participantes se seleccionarán a partir de la población general residente en España en los códigos postales más cercanos a los hospitales participantes. Los 19 centros hospitalarios participantes se seleccionaron abarcando todas las CC. AA. (fig. 1).
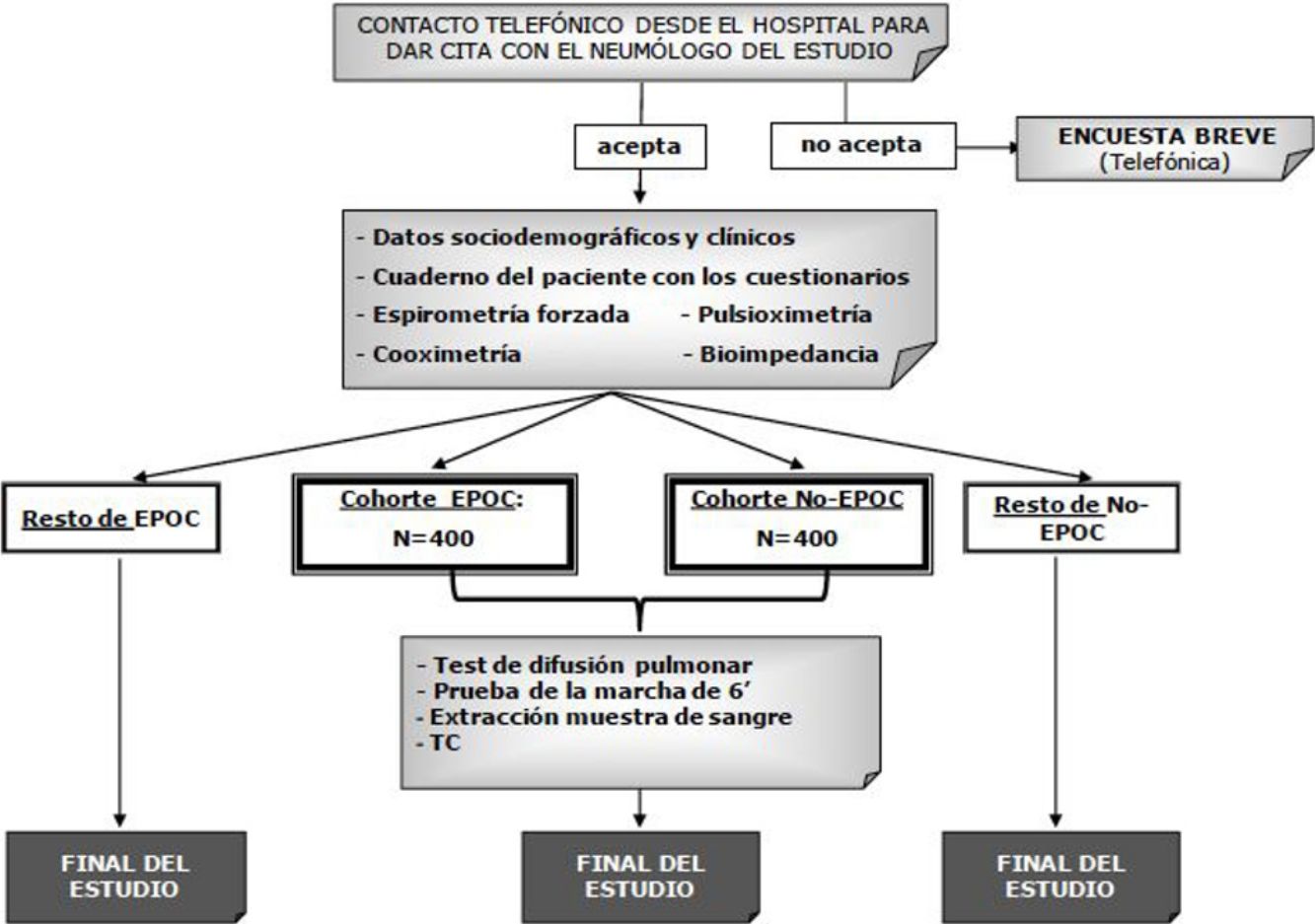
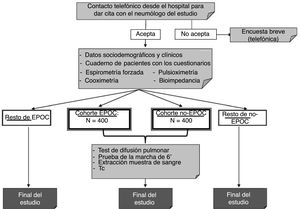
Los criterios de inclusión son los siguientes: varones o mujeres de 40 años o más, residentes en España y que no tengan dificultades físicas o cognitivas que les impidan la realización de alguna prueba del estudio. Serán contactados mediante una llamada telefónica realizada por una empresa especializada y, si aceptan, realizarán la visita corta en el centro hospitalario. El contenido de esta visita corta se recoge en la tabla 2. En 12 centros, se realizarán también las visitas largas, cuyo contenido se recoge en la tabla 3.
Listado de pruebas y procedimientos de la visita corta
| Obtención del consentimiento informado |
| Información sociodemográfica |
| Espirometría basal y post-broncodilatador |
| Pulsioximetría |
| Cooximetría |
| Bioimpedancia |
| Cuaderno del participante |
| CAT |
| Escala HADS |
| Cuestionario YPAS |
| Cuestionario de la CECA |
| Cuestionario de exposición profesional |
| Mini-Mental (a los mayores de 60 años) |
| Test de Fagerström (a los fumadores activos) |
| Modelo de cesación tabáquica de Prochaska y DiClemente (solo en fumadores) |
CAT: COPD Assessment Test; HADS: Hospital Anxiety and Depression Scale; YPAS: Yale Physical Activity Survey; CECA: Comunidad Europea del Carbón y del Acero.
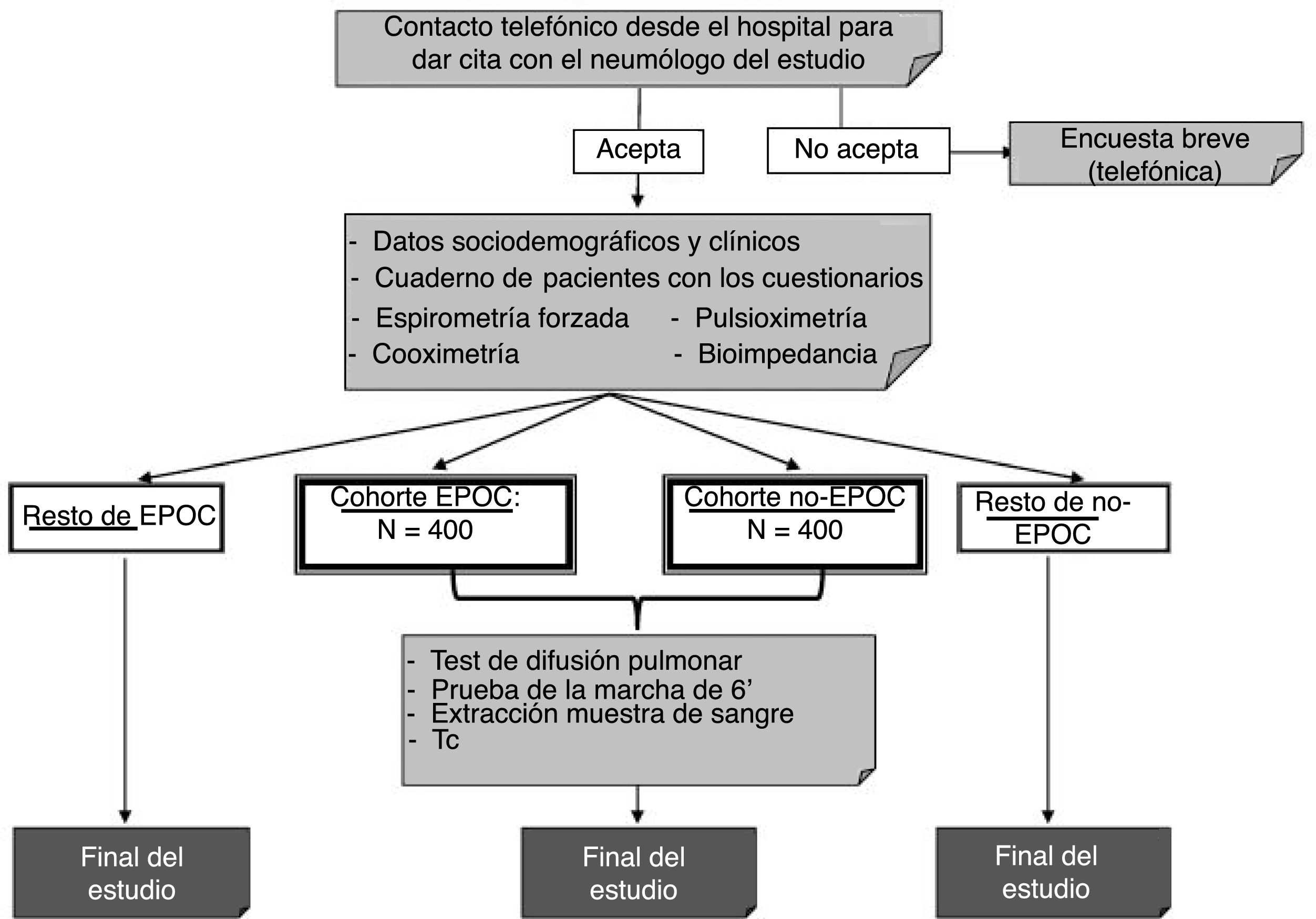
El esquema del estudio se muestra en la figura 2. Según los resultados de la espirometría posbroncodilatador, la población en estudio se distribuirá en 2cohortes: pacientes con EPOC (FEV1/FVC <0,7) e individuos no EPOC (FEV1/FVC ≥ 0,7).
Selección de participantesEl muestreo del estudio se efectúa en 2etapas y será realizado por una empresa externa (IPSOS) a partir de una preselección por los códigos postales más próximos a cada hospital. Se obtendrá un listado de números de teléfono aleatorios estratificados de acuerdo con dichos códigos postales y cuotas de sexo y grupos de edad7. En la segunda etapa, tras contactar telefónicamente con los potenciales participantes y realizarles unas breves preguntas sobre su salud, se solicitará su consentimiento para que sean llamados desde el hospital y citados a una visita médica, que incluirá la visita corta en todos los casos y la larga en algunos centros. En caso de no aceptar la visita, se procurará administrar durante la llamada telefónica una encuesta breve de 12 preguntas acerca de la presencia de síntomas respiratorios como un requisito STROBE para estudios observacionales11.
La población final de estudio estará formada por unos 10.200 participantes de 40 años o más. En cada centro se deberán incluir entre 300 y 600 participantes (150-300 hombres y 150-300 mujeres, dependiendo de que haya un centro o 2en cada CC. AA.). Los participantes que finalmente acudan al hospital constituirán la muestra final del estudio. El estudio ha sido aprobado por el comité de ética de cada uno de los centros participantes, siendo el Hospital Universitario La Princesa el CEI de referencia. El protocolo EPISCAN II está registrado en https://clinicaltrials.gov con el n.° NCT03028207 y en www.gsk-clinicalstudyregister.com/study/205932.
Organización del estudioPara la preparación y el asesoramiento se estableció un comité científico formado por 10 neumólogos y un epidemiólogo. El trabajo de campo está previsto que finalice en 2018. En cada uno de los hospitales participará un neumólogo como investigador principal del estudio y un equipo de colaboradores formado por médicos, personal de enfermería y coordinadores de investigación clínica. Las pruebas funcionales así como las analíticas se realizarán por médicos o personal de enfermería entrenado adecuadamente. La prueba de imagen se realizará en el propio centro o en otros centros siempre según protocolo establecido.
Variables y procedimientosEn el primer contacto telefónico por parte de una empresa externa, tras haber informado sobre la confidencialidad y protección de datos, si el individuo acepta responder, se le realizarán preguntas sobre personas que conviven con él, confirmación del código postal para asignarle el hospital del estudio más cercano, diagnósticos previos de enfermedades respiratorias (bronquitis crónica, enfisema, EPOC o asma), hábito tabáquico (fumador y número de cigarrillos, no fumador, exfumador y número de cigarrillos) y presencia de tos o expectoración. En el segundo contacto telefónico, realizado por parte del investigador desde el hospital, se les administrará una encuesta que contendrá preguntas sobre diagnóstico previo de enfermedades respiratorias, hábito tabáquico y explorará la presencia de otros síntomas relacionados con la EPOC. Durante la visita del estudio con el profesional sanitario, las variables que se recogerán proporcionarán un extenso perfil tanto de los individuos no EPOC que sean seleccionados para la realización de la visita del estudio como, sobre todo, de los participantes del grupo EPOC.
Variables sociodemográficas (para toda la muestra)Se recogerá información relativa a edad, sexo, nivel de estudios, condiciones familiares, peso y talla, y consumo de tabaco convencional (cigarrillo, pipa, puro) o bien a través de otro tipo de dispositivos (cigarrillo electrónico, tabaco de mascar, etc.).
Variables clínicas básicas para el total de la muestraSe recogerá información básica acerca del estado de salud que incluirá: enfermedades concomitantes: índice de Charlson (19 comorbilidades)12; índice COTE (12 comorbilidades)13; diagnóstico previo de otras enfermedades respiratorias; presencia de exacerbaciones en el último año; presencia de disnea (escala del Medical Research Council modificada [mMRC]14, que indica el grado subjetivo de disnea valorando qué tareas habituales puede desarrollar el individuo sin que aparezca la disnea), y tratamiento actual para enfermedades respiratorias.
Pruebas médicas (para toda la muestra)Espirometría: se realizará una espirometría forzada (Vyntus Spiro, Carefusion, Alemania) siguiendo las indicaciones de la SEPAR15.
Prueba de broncodilatación: la prueba se realizará mediante la inhalación de 400μg de salbutamol. Según las guías de la ATS/ERS16, se consideran criterios de broncodilatación un incremento de la FVC o del FEV1> 200ml y superior al 12% con respecto al valor basal.
Clasificación según criterio del límite inferior de la normalidad (LIN): clasificación que minimiza tanto los posibles falsos negativos según la clasificación espirométrica en la población relativamente más joven facilitando así la detección precoz de la EPOC, como los falsos positivos en la población de más edad debido a la disminución de los volúmenes pulmonares, especialmente en el FEV1, relacionada con la edad y evitar así el sobrediagnóstico.
Pulsioximetría basal, mediante un equipo Pulsox 300i (Konica-Minolta, Japón).
Cooximetría: se determinará la fracción de monóxido de carbono en el aire espirado (Modelo MicroCO, Carefusion, Reino Unido).
Bioimpedancia: se medirá la composición corporal sobre la base de las propiedades eléctricas de los tejidos biológicos (SC240-MA, Tanita, Japón). Se recogerán: el porcentaje de masa libre de grasa, el porcentaje de masa grasa y el porcentaje de agua corporal.
Para una muestra en 12 centros preseleccionados de 400 EPOC y 400 no EPOCPrueba de difusión pulmonar del CO por respiración única (Modelo MasterScreen difusión, Carefusion, Alemania): se recogerán los valores absolutos y porcentaje de capacidad de difusión pulmonar de monóxido de carbono (DLCO) y de volumen alveolar, según las recomendaciones ATS/ERS17.
Parámetros inflamatorios: además de realizar una analítica de rutina, se determinarán distintos biomarcadores de inflamación, reparación y otros (tabla 4) en sangre venosa, tras recoger 20ml de sangre de cada participante para determinar las concentraciones de alfa-1-antitripsina, proteína C reactiva, factor de crecimiento tumoral alfa, interleucinas 6 y 8, eosinófilos, fibrinógeno, albúmina, nitritos y nitratos. El procedimiento de recogida será estandarizado y cada centro debe mantener las muestras obtenidas a –80° C.
Listado inicial de biomarcadores en sangre a explorar en EPISCAN II
| Hemograma (con hemoglobina, hematocrito, RDW y fórmula leucocitaria) |
| Bioquímica básica: perfil lipídico, HbA1c, PCR de alta sensibilidad |
| Alfa-1-antitripsina |
| Fibrinógeno |
| Albúmina |
| Procalcitonina |
| hs-ctnT (troponina de alta sensibilidad), troponina i, NT-proBNP (péptido natriurético NTPB) |
| IL-1β, IL-1RA, IL-8, IL-6, TNF-α, TNFR I y TNFR-II, IL-13, IL-17A, IL-6R |
| CCL26 (eotaxin-3), CCL17 (TARC), CCL18 (PARC), CCL2 (MCP-1), CCL4 (MIP-1β) |
| IFNγ |
| CXCL10 (IP-10), CXCL11 (I-TAC), CCL3 (MIP-1α), CCL13 (MCP-4) |
| CSF2 (GMCSF), CCL5 (RANTES) |
| Amiloide sérica A1 (SAA) |
| Proteína D del surfactante (SFTPD) |
| Copeptina |
| Adiponectina |
| Cistatina C |
| Homocisteína CC-16 |
| sRAGE |
| BAFF |
| p16 / 21 |
| Ku70 / 80 |
| TERF2 |
| klotho total (Tklotho) y klotho soluble (Sklotho) |
| sirtuin-1 |
| WNT-5ª |
Prueba de la marcha de 6 min: se seguirán las indicaciones establecidas en las guías de la ATS para la prueba de la marcha de 6 min, con la variación de realizar una única caminata para no sobrecargar de pruebas a los participantes. Se medirán la distancia recorrida en metros y el motivo de la parada, la frecuencia cardíaca inicial y final, y la saturación de oxihemoglobina (SpO2) inicial y final. La sensación subjetiva de esfuerzo y sensación de fatiga de extremidades inferiores al final de la prueba se evaluarán con la escala Borg modificada18, que consta de 12 niveles numéricos de disnea.
TC: la adquisición de imágenes se realizará en inspiración, sin contraste y con baja radiación. Las imágenes obtenidas serán tratadas mediante un posprocesado semiautomático para determinación de porcentaje de enfisema, áreas de extensión, grosor de la vía aérea, diámetro de la arteria aorta frente al de la arteria pulmonar, atrapamiento aéreo, calcificaciones coronarias, bronquiectasias y fibrosis, entre otros parámetros de atenuación del parénquima pulmonar y grosor de la pared de las vías aéreas19-22.
Variables centradas en el paciente (para toda la muestra)Cuestionario COPD Assessment Test (CAT)23: cuestionario de calidad de vida relacionada con la salud (CVRS) desarrollado para evaluar el estado de salud de los pacientes con EPOC y validado en castellano para población española. Consta de una única dimensión con 8 ítems, cada uno de ellos con una escala de respuesta de 0 (ninguna limitación) a 5 (mucha limitación). Los ítems evalúan la intensidad de la tos, la presencia de mucosidad, la presión torácica, la disnea, la limitación en actividades domésticas, la limitación social y la limitación del sueño y la energía.
Escala hospitalaria de ansiedad y depresión (HADS)24,25: escala genérica de ansiedad y depresión diseñada para evaluar estos 2constructos en consultas externas hospitalarias no psiquiátricas y validada en población española. Se trata de una herramienta de 14 ítems de respuesta tipo Likert con valores del 0 al 3, que se agrupan en 2subescalas de 7 ítems cada una, escala de ansiedad y escala de depresión.
Cuestionario de actividad física de Yale (YPAS)26,27, validado en población española y en población de edad avanzada. Refleja el volumen, la frecuencia y la intensidad de la actividad física, expresada como equivalentes metabólicos (MET) de tarea, es decir, MET-h/semana, que permite estimar los efectos de la actividad física como un parámetro continuo incluso en los niveles más bajos de actividad como es previsible en la EPOC.
Cuestionario de la Comunidad Europea del Carbón y el Acero de síntomas respiratorios (versión validada al castellano)28: consta de 6 secciones (tos y expectoración, disnea, silbidos y opresión intratorácica, crisis de asma y tratamiento [inhaladores, supositorios, medicamentos por vía oral o inyección]) y 26 ítems en total. Es el cuestionario de referencia para estudios epidemiológicos de prevalencia de síntomas respiratorios crónicos en población adulta.
Preguntas sobre exposición profesional: permitirán realizar una estimación semicuantitativa de la exposición laboral a polvos, gases o humos, entre otros, incluyendo humo de biomasa.
Cuestionario de estado mental Mini-Mental (versión adaptada y validada en español29, del Mini-Mental State Examination)30. Se trata de un test rápido de cribado de demencias y para el seguimiento evolutivo de las mismas. Proporciona un análisis breve y estandarizado del estado mental. Sus ítems exploran 5 áreas cognitivas: orientación, fijación, concentración y cálculo, memoria y lenguaje. Este cuestionario se administrará tan solo a los participantes de 60 o más años de edad.
Test de Fagerström31,32: administrado a la población fumadora. Evalúa el nivel de la dependencia a la nicotina de los fumadores. Formado por 6 ítems con 2o 4opciones de respuesta. Aunque no existen puntos de corte estandarizados, los autores de la versión española han utilizado en diversas publicaciones una puntuación a partir de 6 para indicar una alta dependencia33.
Fases de deshabituación de Prochaska34: modelo que clasifica a los fumadores según su mayor o menor inclinación para realizar un intento serio de abandono del hábito tabáquico.
Cálculo del tamaño muestralEl objetivo principal del estudio, sobre el que se calcula el tamaño de la muestra, es conocer la prevalencia de EPOC en la población residente en España de 40 años o más. Según datos del Censo de Población y Viviendas de 2011 publicado por el Instituto Nacional de Estadística, esta franja asciende a 23.957.645 personas.
Teniendo en cuenta la prevalencia de EPOC del 10,2% hallada en el primer estudio EPISCAN, se estima, con una precisión de±0,6% y un 10% de pérdidas, que el número necesario de individuos válidos a incluir en el estudio será de aproximadamente 10.200. De acuerdo con estos cálculos, se estima que el grupo de pacientes con diagnóstico de EPOC tras las pérdidas ascienda como mínimo a 936 individuos y los 8.244 sujetos restantes pertenecerán al grupo de población no EPOC.
Se ha establecido que la visita larga se realizará en 12 centros, por razones logísticas. Considerando un error alfa del 5% y una potencia del 80%, para la comparación de porcentajes entre 2muestras de participantes, es decir, EPOC frente a no EPOC, el tamaño muestral de 400 sujetos por grupo sería suficiente para detectar un riesgo relativo de 1,25 o superior para la mayoría de comparaciones.
Análisis estadísticoPara la descripción de variables continuas se utilizará la media, desviación estándar, mínimo y máximo, y, en función de la distribución no gaussiana, de la variable analizada se presentarán también la mediana y sus cuartiles. Para la descripción de variables categóricas se utilizarán el número y el porcentaje de pacientes por categoría de respuesta.
Se utilizarán técnicas estadísticas para asegurar el cumplimiento de los supuestos estadísticos, previas a la realización de las pruebas paramétricas correspondientes para comparar medias y proporciones. En caso de que no se cumplan los supuestos establecidos, se utilizarán las pruebas no paramétricas correspondientes.
Los análisis comparativos se realizarán mediante la prueba de la t de Student de variables continuas, o su equivalente no paramétrico, dependiendo de las características inherentes a las variables recogidas, y la prueba de la chi al cuadrado al analizar variables de tipo categórico. En el caso de comparar más de 2 grupos se utilizará ANOVA. En las comparaciones post hoc, se utilizará la prueba de Bonferroni, basada en el estadístico t de Student. En todas las pruebas estadísticas realizadas con las variables de resultado se utilizará un nivel de significación estadística de 0,05.
Se considerarán evaluables todos los sujetos que acudan al centro hospitalario a realizar la visita del estudio y que dispongan de datos de espirometría, que es la variable principal del estudio. Los sujetos que no dispongan de valores espirométricos o maniobras válidas no se incluirán en el cómputo del cálculo de la prevalencia de EPOC.
La prevalencia de EPOC, con su intervalo de confianza del 95% se calculará de acuerdo con los criterios espirométricos tras broncodilatación, considerándose que un paciente presenta EPOC cuando su FEV1/FVC obtenido en su espirometría posbroncodilatador sea inferior a 0,7. También se presentará la prevalencia por sexo y grupo de edad para el total de la muestra evaluada, y por CC. AA: Posteriormente, los pacientes del grupo EPOC se clasificarán según su gravedad según los criterios GesEPOC y GOLD 2017.
Adicionalmente, y con fines descriptivos, se determinará la prevalencia de EPOC, general y según grupos de edad y sexo en función del LIN, calculado como el quinto percentil de la distribución normal en una población sana, lo que permitirá realizar una comparativa de ambos criterios diagnósticos. Se utilizarán los valores de referencia de Global Lung Function Iniciative (GLI)35.
Se realizará un análisis descriptivo de las características sociodemográficas (edad, sexo, nivel de estudios, estado civil, tabaquismo) y de las variables clínicas (comorbilidades, exacerbaciones, disnea, otra sintomatología respiratoria, etc.) de la población de estudio. Se describirá el resultado de los parámetros antropométricos (peso, talla, índice de masa corporal), escala mMRC de disnea, espirometría, pulsioximetría y las pruebas complementarias realizadas (parámetros inflamatorios, prueba de imagen, prueba de la marcha, etc.), y de los cuestionarios cumplimentados por los participantes.
La descripción de las características de los participantes se realizará para el total de la muestra de estudio y estratificando según la presencia o no de diagnóstico de EPOC.
A nivel descriptivo, se compararán los resultados obtenidos en el presente estudio con los de estudios previos como IBERPOC o EPISCAN, para valorar las diferencias en la prevalencia de EPOC y su evolución en el tiempo. Las prevalencias se darán en global, por área, sexo y grupo de edad.
Para conocer el riesgo de presentar EPOC en función del sexo y la edad, así como de otras variables que pudieran estar relacionadas con esta enfermedad respiratoria, se realizará un análisis multivariante mediante regresión logística, tomando la presencia de EPOC como variable dependiente y la edad, el sexo, nivel de estudios, tabaquismo, comorbilidades y otras como variables independientes, ajustado por centro de procedencia.
Para evaluar el infradiagnóstico, se presentará una tabla 2×2 entre el conocimiento previo de la presencia o no de EPOC y el diagnóstico de EPOC en el estudio y se analizará la concordancia entre ambas variables mediante el índice Kappa y otros.
Se realizará una amplia evaluación de posibles comorbilidades, así como de la presencia y la prevalencia de enfermedades respiratorias específicas, tales como bronquitis crónica, enfisema, EPOC previa y asma.
Se describirá la CVRS según el cuestionario CAT, estratificando por diagnóstico de EPOC. Se compararán los índices de CVRS entre los 2grupos del estudio.
Se valorará si el tratamiento recibido en la población con EPOC se adecua a la normativa vigente y se describirá la tasa de infratratamiento.
Entre los objetivos secundarios del estudio se describirá la prevalencia de tabaquismo y el uso de cigarrillo electrónico en población de 40 años o más en España y según sexo, así como la relación entre el diagnóstico de EPOC, el nivel de actividad física y el tabaquismo según cohortes del estudio.
En la subpoblación de sujetos fumadores, se describirá la puntuación obtenida en el test de Fagerström, así como la fase de deshabituación en la que se encuentran, según la valoración de Prochaska.
Por otro lado, se describirán los hallazgos de la TC realizada a una submuestra del estudio.
DiscusiónDesde 2007, los datos sobre prevalencia de la EPOC en la población general en España son escasos. De hecho, desde el estudio EPISCAN, publicado en 2009, no se tiene constancia de ninguna publicación sobre prevalencia con una muestra amplia de pacientes en España, salvo un estudio realizado en las Islas Canarias (Gran Canaria y Tenerife), que mostró una prevalencia de EPOC del 7,3% (IC del 95%: 5,5-9,5), con un infradiagnóstico del 71,6% y un infratratamiento del 63,5%36. Sin embargo, sí existen estudios que confirman el infradiagnóstico de EPOC por una estrategia de hallazgo de casos en poblaciones seleccionadas37,38. Por estos motivos, se planteó el estudio EPISCAN II, con el objetivo principal de actualizar los datos del primer estudio EPISCAN a 2017.
Aprovechando la amplia muestra de individuos con EPOC que se espera evaluar en este estudio, se plantea de forma secundaria describir el nivel de actividad física según la gravedad de la EPOC, así como realizar una descripción y análisis de diversos aspectos asociados a esta enfermedad, como son la presencia de ansiedad o depresión, por ser síntomas frecuentes en la EPOC pero escasamente diagnosticados y con tasas de prevalencia variables39, y que ofrecen una novedad respecto al primer estudio. También en este estudio se evaluará el impacto de la EPOC en síntomas y CVRS, que ya fueron evaluados en 2007, donde los resultados mostraron una importante afectación debida al alto nivel de discapacidad que produce la EPOC a causa de los síntomas y de la disminución de la capacidad física40, y ahora además se usará el cuestionario CAT. El deterioro de la CVRS constituye un marcador importante en estos pacientes puesto que refleja el impacto que tiene la enfermedad en sus vidas y porque aporta información complementaria a la valoración clínica respiratoria, que puede ser de utilidad añadida en el manejo y evaluación de los pacientes con EPOC. Las dimensiones relacionadas con el sueño, la movilidad y la función física de la CVRS aparecen como las más afectadas en la mayoría de estudios, limitadas en gran parte por la presencia de disnea41; además, la función física y las actividades sociales son aspectos que tienden a empeorar cuanto más grave es la EPOC según la clasificación GOLD42.
La espirometría se realizará según las recomendaciones ATS/ERS16, con verificación diaria del equipo mediante una jeringa certificada de 3 l y utilizando un filtro antibacteriano desechable. Se considerará que las maniobras obtenidas son aceptables cuando el volumen de extrapolación retrógrado sea menor de 0,15 l, o del 5% de la FVC, la duración de la espiración alcance al menos 6s y la finalización de la misma genere un cambio de volumen inferior a 0,025 l durante al menos 1 s15,16.Tanto la aceptabilidad como la repetibilidad de las espirometrías pre y posbroncodilatador serán clasificadas según su nivel de calidad (2). Para el presente análisis, solo se aceptarán las pruebas de calidad A (3 maniobras aceptables y con una diferencia entre los 2mejores FVC y FEV1 igual o inferior a 0,15 l), B (3 maniobras aceptables y con una diferencia entre los 2mejores FVC y FEV1 igual o inferior a 0,2 l) o C (2 maniobras aceptables y entre los 2mejores FVC y FEV1 una diferencia igual o inferior a 0,2 l)15. Para la interpretación de la exploración se utilizarán los valores de referencia GLI35 y, siguiendo las directrices ATS/ERS, la prueba de broncodilatadores será considerada positiva cuando el FEV1 o la FVC aumenten más de 200ml y más del 12% con respecto a su valor previo16.
El control de calidad en la medición es esencial para la obtención de resultados válidos y reproducibles en cualquier estudio, incluyendo los estudios observacionales de prevalencia como EPISCAN II. Diversos elementos constituyen fuentes de variabilidad de los resultados: el paciente, el técnico (y su entrenamiento) y la calidad y mantención de los equipos de medición. Todos deben ser controlados según la normativa STROBE11. Como ejemplos, debe asegurarse seguir: 1) las indicaciones previas al examen (p. ej., no fumar y evitar el uso de medicación broncodilatadora antes de realizar la espirometría), con el fin de disminuir las fuentes de variabilidad dependientes de la colaboración del paciente; 2) ejecución de la prueba de acuerdo con el protocolo y las normas internacionales (p. ej., impedancia, etc.); 3) interpretación de los resultados utilizando ecuaciones de referencia apropiadas (varias ecuaciones descritas posteriormente); 4) calibración de los equipos (volumen y analizadores), y 5) control de calidad de los analizadores (controles biológicos, simulador).
Las limitaciones de EPISCAN II son las propias de un diseño transversal, que permitirá estimar la prevalencia de EPOC a nivel poblacional y hacer una descripción de la enfermedad, pero no permitirá analizar cómo evolucionan los pacientes con relación a la enfermedad ni con relación a variables como la CVRS, entre otras. Otra de las limitaciones del diseño transversal es que, aunque permite realizar estimaciones de prevalencia como las referidas en este estudio, así como relaciones entre determinados factores, no permite establecer asociaciones de causalidad con otras variables. Pese a estas limitaciones, se ha optado por este diseño para facilitar la participación de individuos que no forman parte de la población hospitalaria, sino de la población general, y su comparación con IBERPOC, EPISCAN y otros43.
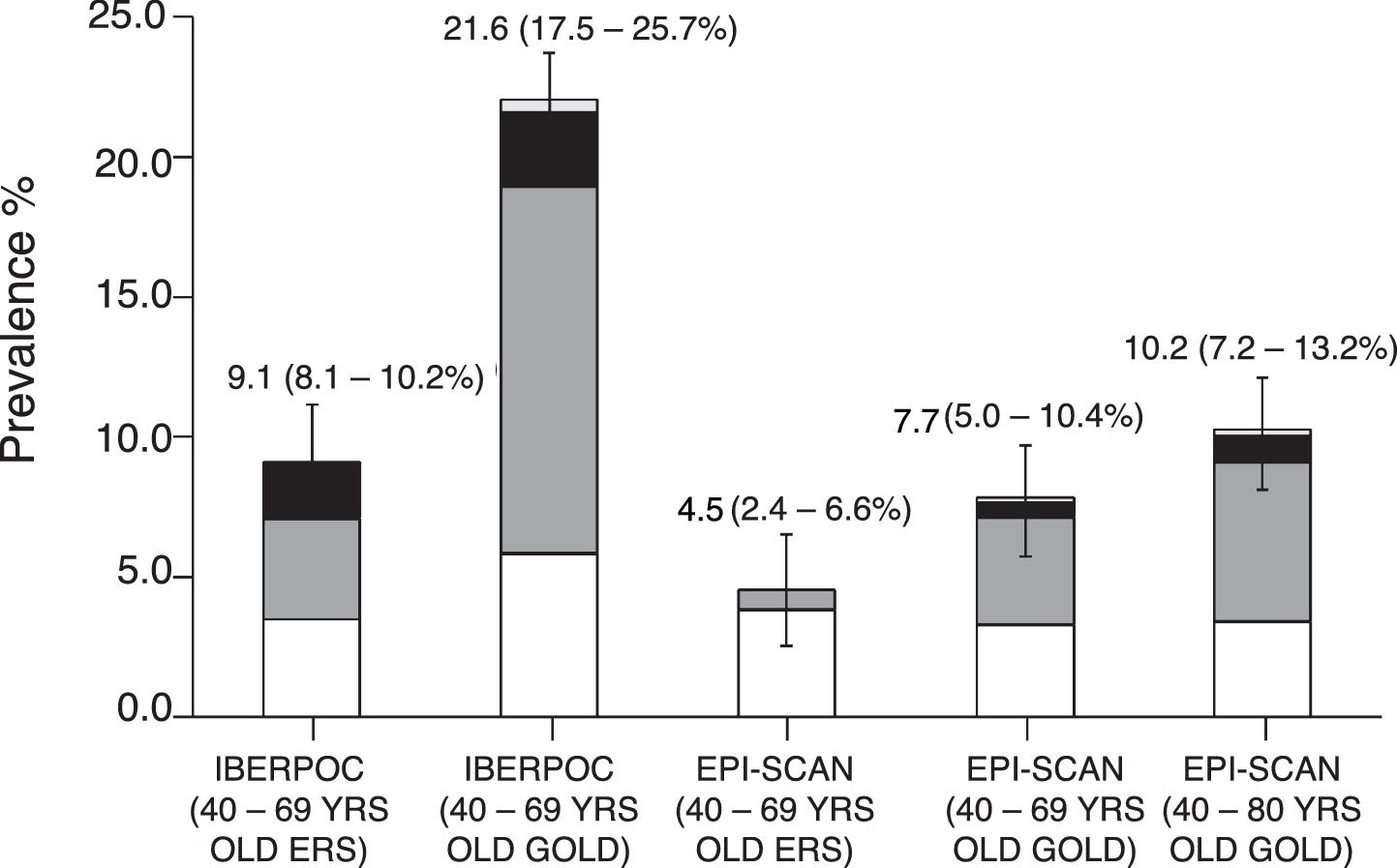
Tal como se ha mencionado antes, se han realizado 2estudios previos de ámbito nacional con una diferencia de 10 años, IBERPOC6 y EPISCAN7. Aunque la diferencia en la prevalencia de EPOC en estos 2estudios parece aparentemente menor, un 9,1 y un 10,2%, respectivamente, su comparación formal indica un descenso objetivo de la EPOC si es definida según los mismos criterios espirométricos44 (fig. 3) que se acompaña también a un descenso generalizado de la mortalidad por EPOC a nivel nacional, europeo45 y mundial11.
Cambios en la prevalencia de EPOC entre IBERPOC (1997) y EPISCAN (2007) según diferentes criterios espirométricos.
Reproducido con permiso de Soriano et al.44.
Las variaciones en la prevalencia de la EPOC son un reflejo en nuestro medio de la exposición acumulada al consumo de tabaco. Durante la última década, las políticas sanitarias han cambiado con la vigencia de la ley antitabaco Ley 28/2005 de 2006 y la posterior modificación de 2011 por la Ley 42/201046. Muy probablemente, estas medidas sanitarias de prevención primaria son una importante causa contribuyente a la disminución en la prevalencia de la EPOC, puesto que el tabaco en nuestro medio sigue siendo la principal causa de la EPOC. Otro hallazgo destacado que detectaron ambos estudios fue el infradiagnóstico, fenómeno prácticamente universal en la EPOC45. Sería deseable que en este nuevo estudio nos encontráramos con un descenso de este infradiagnóstico y sin sobrediagnóstico47. El diagnóstico de EPOC en estadios tempranos permite realizar medidas terapéuticas y de prevención, impidiendo que la enfermedad progrese hacia estadios más avanzados que conllevan mayor discapacidad y gasto económico sanitario1,2.
Por otra parte, desde el primer estudio EPISCAN han aparecido formas de consumo de tabaco sin combustión como el cigarrillo electrónico y será interesante valorar el impacto que ha tenido este dispositivo en el tabaquismo de la población y en el desarrollo de enfermedad pulmonar.
Tal como se realizó en un anterior análisis entre IBERPOC y el primer EPISCAN44, una futura comparación de los cambios en los nuevos resultados EPISCAN II con respecto a los de IBERPOC y EPISCAN no puede realizarse directamente, y conllevará un proceso de traducción e interpretación de todos los datos, pues los umbrales de edad en cada estudio, algunos cambios de protocolo en la realización de maniobras de espirometría y prueba broncodilatadora, y las ecuaciones de referencia, son diferentes en los 3estudios.
Una antigua quimera de los neumólogos y otros especialistas en EPOC siempre ha sido hallar un marcador biológico. Aunque los marcadores sanguíneos no han sido de utilidad hasta el momento, tal vez haya que explorar nuevos parámetros o bien buscar biomarcadores de imagen como pueden ser las alteraciones de la vía aérea o la presencia precoz de enfisema con exploración funcional normal.
Si bien la EPOC es una importante causa de mortalidad, no lo es menos el cáncer de pulmón, cuyo diagnóstico sigue realizándose en estadios demasiado avanzados, lo que implica opciones terapéuticas no curativas. Por ello, dado que los factores de riesgo son comunes y que el tener EPOC incrementa el riesgo de cáncer de pulmón comparado con fumadores sin EPOC, utilizar en este estudio las técnicas de imagen puede permitirnos detectar neoplasias de pulmón en estadios iniciales.
Como conclusión, EPISCAN II actualizará la prevalencia, distribución y determinantes de la EPOC en nuestro país, y por primera vez permitirá comparar resultados espirométricos y otros aspectos de la EPOC en las 17 CC. AA: de España.
Puntos destacados- 1.
Es importante actualizar los datos de prevalencia y determinantes de la EPOC de forma periódica.
- 2.
EPISCAN II estimará la prevalencia de EPOC en la población de 40 años o más en las 17 CC. AA.
- 3.
El tamaño muestral estimado de 10.200 participantes permitirá medir el problema y sus determinantes.
EPISCAN II está financiado por GSK (GSK ID: 205932; NCT03028207).
Conflicto de interesesInmaculada Alfageme declara haber participado en conferencias, comités asesores y consultorías durante el período 2014-2018 patrocinado por AstraZeneca, Boehringer Ingelheim, Esteve, GEBRO, Grifols, GSK, Novartis, Pfizer, Roche y TEVA.
Pilar de Lucas declara no tener ningún conflicto de intereses en los últimos 3 años.
Julio Ancochea declara haber recibido honorarios por impartir conferencias, moderaciones, asesoría científica o participación en estudios clínicos durante el período 2014-2018, por parte de Air Liquide, Almirall, AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Ferrer, GSK, Linde Healthcare, Menarini, Mundipharma, Novartis, Roche, Rovi, Sandoz y Teva.
Marc Miravitlles ha recibido honorarios como ponente de Boehringer Ingelheim, Chiesi, Cipla, Menarini, Rovi, Bial, CSL Behring, Grifols, Novartis y Zambón; honorarios de consultoría de Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Bial, Gebro Pharma, CSL Behring, Laboratorios Esteve, Mereo Biopharma, Verona Pharma, pH Pharma, Novartis, Grifols y Teva; y ayudas para la investigación de GlaxoSmithKline and Grifols.
Juan José Soler-Cataluña declara haber recibido honorarios por impartir conferencias, asesoría científica o participación en estudios clínicos por parte de Air Liquide, AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Ferrer, GSK, Menarini, Mundipharma, Novartis, Rovi, Sandoz, Teva y Zambón.
Francisco García-Río declara haber recibido honorarios, desde 2014 hasta la fecha, por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones de (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, GEBRO, GlaxoSmithKline, Linde, Menarini, Novartis, Rovi y Teva.
Ciro Casanova, en los últimos tres años, ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Gebro, GlaxoSmithKline, Menarini, Novartis, Rovi y Teva.
José Miguel Rodríguez González-Moro declara que, en los últimos tres años, ha recibido honorarios por impartir conferencias, asesoría científica y participación en estudios clínicos para (orden alfabético): AstraZeneca,Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Menarini, Novartis, Orion, Rovi, Teva y Zambón
Borja G. Cosío, en los últimos tres años, ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Menarini, Novartis, Rovi, Teva y Zambón.
Guadalupe Sánchez es empleada por GSK.
Joan B. Soriano declara haber recibido financiación de investigación desde 2014 hasta la fecha de Linde a través del Hospital Universitario de La Princesa, y que ha participado en conferencias, comités asesores y consultorías durante el período 2014-2018 patrocinado por Almirall, AstraZeneca, Boehringer Ingelheim, CHEST, Chiesi, ERS, Esteve, GEBRO, Grifols, GSK, Linde, Lipopharma, Mundipharma, Novartis, Pfizer, RiRL, Rovi, Sandoz, SEPAR y Takeda.
Debe agradecerse la participación voluntaria de todas las personas elegidas aleatoriamente en el muestreo de EPISCAN II. Se agradece explícitamente la colaboración de Mónica Sarmiento de IQVIA, y de Maria Victoria Pardo, Miguel Pascual y David Banas de GSK. EPISCAN II está financiado por GSK.
Comité científico: Inmaculada Alfageme, Pilar de Lucas, Julio Ancochea, Marc Miravitlles, Juan José Soler-Cataluña, Francisco García Río, Ciro Casanova, José Miguel Rodríguez González-Moro, Borja Cosio, Guadalupe Sánchez y Joan B Soriano
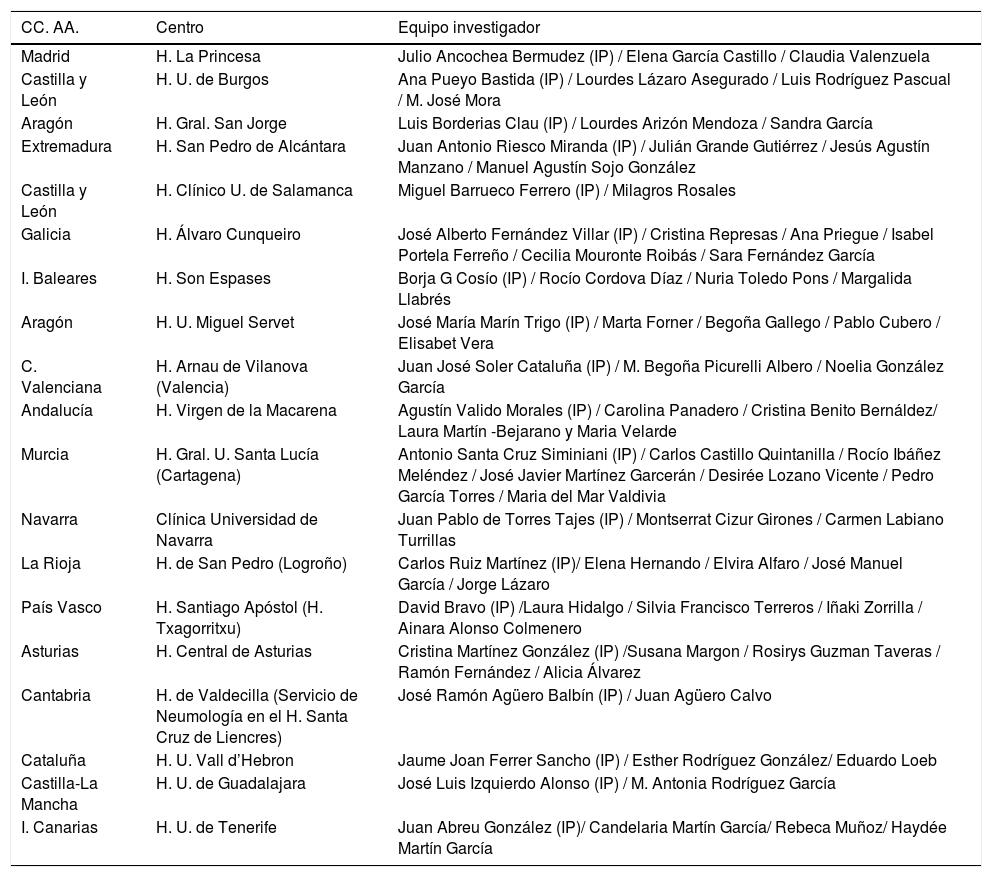
Investigadores principales, colaboradores y centros participantes
| CC. AA. | Centro | Equipo investigador |
|---|---|---|
| Madrid | H. La Princesa | Julio Ancochea Bermudez (IP) / Elena García Castillo / Claudia Valenzuela |
| Castilla y León | H. U. de Burgos | Ana Pueyo Bastida (IP) / Lourdes Lázaro Asegurado / Luis Rodríguez Pascual / M. José Mora |
| Aragón | H. Gral. San Jorge | Luis Borderias Clau (IP) / Lourdes Arizón Mendoza / Sandra García |
| Extremadura | H. San Pedro de Alcántara | Juan Antonio Riesco Miranda (IP) / Julián Grande Gutiérrez / Jesús Agustín Manzano / Manuel Agustín Sojo González |
| Castilla y León | H. Clínico U. de Salamanca | Miguel Barrueco Ferrero (IP) / Milagros Rosales |
| Galicia | H. Álvaro Cunqueiro | José Alberto Fernández Villar (IP) / Cristina Represas / Ana Priegue / Isabel Portela Ferreño / Cecilia Mouronte Roibás / Sara Fernández García |
| I. Baleares | H. Son Espases | Borja G Cosío (IP) / Rocío Cordova Díaz / Nuria Toledo Pons / Margalida Llabrés |
| Aragón | H. U. Miguel Servet | José María Marín Trigo (IP) / Marta Forner / Begoña Gallego / Pablo Cubero / Elisabet Vera |
| C. Valenciana | H. Arnau de Vilanova (Valencia) | Juan José Soler Cataluña (IP) / M. Begoña Picurelli Albero / Noelia González García |
| Andalucía | H. Virgen de la Macarena | Agustín Valido Morales (IP) / Carolina Panadero / Cristina Benito Bernáldez/ Laura Martín -Bejarano y Maria Velarde |
| Murcia | H. Gral. U. Santa Lucía (Cartagena) | Antonio Santa Cruz Siminiani (IP) / Carlos Castillo Quintanilla / Rocío Ibáñez Meléndez / José Javier Martínez Garcerán / Desirée Lozano Vicente / Pedro García Torres / Maria del Mar Valdivia |
| Navarra | Clínica Universidad de Navarra | Juan Pablo de Torres Tajes (IP) / Montserrat Cizur Girones / Carmen Labiano Turrillas |
| La Rioja | H. de San Pedro (Logroño) | Carlos Ruiz Martínez (IP)/ Elena Hernando / Elvira Alfaro / José Manuel García / Jorge Lázaro |
| País Vasco | H. Santiago Apóstol (H. Txagorritxu) | David Bravo (IP) /Laura Hidalgo / Silvia Francisco Terreros / Iñaki Zorrilla / Ainara Alonso Colmenero |
| Asturias | H. Central de Asturias | Cristina Martínez González (IP) /Susana Margon / Rosirys Guzman Taveras / Ramón Fernández / Alicia Álvarez |
| Cantabria | H. de Valdecilla (Servicio de Neumología en el H. Santa Cruz de Liencres) | José Ramón Agüero Balbín (IP) / Juan Agüero Calvo |
| Cataluña | H. U. Vall d’Hebron | Jaume Joan Ferrer Sancho (IP) / Esther Rodríguez González/ Eduardo Loeb |
| Castilla-La Mancha | H. U. de Guadalajara | José Luis Izquierdo Alonso (IP) / M. Antonia Rodríguez García |
| I. Canarias | H. U. de Tenerife | Juan Abreu González (IP)/ Candelaria Martín García/ Rebeca Muñoz/ Haydée Martín García |