El presente estudio se realizó con los siguientes objetivos: a) valorar la fiabilidad de la poligrafía respiratoria domiciliara (PRD) para el diagnóstico de síndrome de apneas-hipopneas durante el sueño (SAHS), y b) comparar los costes derivados de la realización de PRD con los de la polisomnografía nocturna (PSG) efectuada en el laboratorio de sueño.
Pacientes y métodosSe trata de un estudio prospectivo y ciego. La población de estudio estuvo constituida por una selección aleatoria de pacientes con sospecha clínica de SAHS. A todo paciente incluido en el estudio se le realizaron PRD y PSG sin conocer el resultado de la primera. Para el cálculo de costes se utilizó una población teórica de 1.000 personas. Para el análisis estadístico se emplearon la prueba de la t de Student para muestras emparejadas, el coeficiente de correlación de Pearson y el cálculo de las curvas de eficacia diagnóstica.
ResultadosSe estudió a 45 pacientes, con una edad media (± desviación estándar) de 52,3±11 años, de los que se diagnosticó de SAHS (índice de apneas-hipopneas ≥10 en la PSG) a 21 (46,6%). Al comparar los valores obtenidos en la PRD y la PSG, las correlaciones fueron significativas para todos los pares relacionados. El punto de corte óptimo en nuestra población fue un índice de acontecimientos respiratorios de 13,7 o mayor, con un área bajo la curva de eficacia diagnóstica del 87,5% (intervalo de confianza del 95%, 74,2-95,4%). La realización de una PRD en un paciente con sospecha de SAHS supone un coste medio de 69 €, mientras que el de una PSG es de 179 €.
ConclusionesLa PRD es un método fiable para el diagnóstico de SAHS. Su realización de forma protocolizada supone un ahorro respecto a la realización de PSG a todos los pacientes con sospecha de SAHS. Por último, los resultados dudosos de la PRD requieren la realización de PSG.
To evaluate the reliability of home respiratory polygraphy for the diagnosis of sleep apnea-hypopnea syndrome (SAHS) and to compare the cost of this technique with that of nighttime polysomnography performed in a sleep laboratory.
Patients and methodsThis was a prospective study of a random sample of patients with clinically suspected SAHS in which the participants who underwent both home respiratory polygraphy and nighttime polysomnography were blinded as to the results of their first test. Costs were calculated based on a theoretical population of 1000 individuals. A t test for paired samples, the Pearson correlation coefficient, and a receiver operator characteristic curve were used for the statistical analysis.
ResultsThe study population was composed of 45 patients with a mean (SD) age of 52.3 (11) years of whom 21 (46.6 %) were diagnosed with SAHS, defined by an apnea-hypopnea index greater than 10 in nighttime polysomnography. Comparison of the results obtained in both recordings revealed statistically significant correlations for all comparisons. The optimal cutoff in this population was a respiratory disturbance index of 13.7 or more, for which the area under the receiver operating characteristic curve was 87.5% (95% confidence interval, 74.2%-95.4%). The mean cost of home respiratory polygraphy in a patient with suspected SAHS was €69, whereas that of polysomnography was €179.
ConclusionsHome respiratory polygraphy is a reliable technique for the diagnosis of SAHS. Using this technique routinely in patients suspected of SAHS will be more economical than using nighttime polysomnography. Uncertain results must be verified by nighttime polysomnography.
El síndrome de apneas-hipopneas durante el sueño (SAHS) es una enfermedad prevalente1 en la población general y se asocia a importante morbimortalidad2. La presencia de un índice de apneas-hipopneas (IAH) superior a 10 por hora de sueño3 o un índice de alteración respiratoria de 5 o superior4, junto con síntomas clínicos, se considera anormal. La polisomnografía nocturna convencional (PSG) constituye la prueba diagnóstica de elección5. Sin embargo, en la práctica diaria el número de pacientes diagnosticados de SAHS depende de la disponibilidad de medios técnicos adecuados, del número de laboratorios de sueño y de la accesibilidad a ellos6-8, lo cual hace que el SAHS esté infravalorado e inadecuadamente diagnosticado.
Es necesaria la búsqueda de alternativas diagnósticas menos costosas y de eficacia comparable con la de la PSG, que permitan el adecuado diagnóstico y tratamiento del SAHS. En este sentido, la poligrafía respiratoria (PR) se ha desarrollado para su utilización fuera del laboratorio de sueño, en el propio domicilio del paciente, lo cual permite comodidad y familiaridad con el entorno. La validación de estos sistemas de PR generalmente se realiza en laboratorios de sueño, en presencia de técnicos de sueño, es decir, de forma vigilada9-15, y son pocos los estudios de validación efectuados en el domicilio del paciente, sin vigilancia16-19. Por ello planteamos la validación del sistema de PR Edentec Monitoring System, modelo 3711 (Edentrace II, Minnesota, EE.UU.), en el domicilio del paciente, para el diagnóstico del SAHS, comparada con la PSG efectuada en el laboratorio de sueño. Los objetivos principales del presente estudio han sido: a) determinar si la PR domiciliaria (PRD) es fiable (sensible y específica) para establecer el diagnóstico de SAHS, y b) comparar los costes derivados de la realización de PRD con los de la PSG efectuada en el laboratorio de sueño
Pacientes y métodosSe ha realizado un estudio de evaluación, independiente, ciego. Los pacientes incluidos en el estudio fueron seleccionados de forma aleatoria de una población de pacientes con sospecha clínica de SAHS remitidos a la Unidad de Trastornos Respiratorios del Sueño (UTRS) de Burgos. Ciertos días de la semana fueron designados para seleccionar los pacientes por medio de una tabla de número aleatorios. Se incluyó a pacientes de ambos sexos, de entre 15 y 75 años de edad, con domicilio habitual en el área urbana de Burgos y con condiciones domiciliarias suficientes para permitir la realización de estudios domiciliarios, con signos y síntomas indicativos de SAHS, que dieron su consentimiento. Se excluyó a los pacientes con enfermedad concomitante grave, ya fuera médica o psiquiátrica, síntomas indicativos de otras enfermedades del sueño diferentes del SAHS y con profesiones de riesgo o clínica invalidante que requiriera tratamiento urgente. El protocolo del estudio fue revisado y aprobado por el Comité Ético de Investigación Clínica del Hospital General Yagüe de Burgos antes de su inicio.
A todo paciente incluido en el estudio se le realizaron: historia clínica, donde se valoró fundamentalmente la presencia de ronquido nocturno, somnolencia diurna -medida mediante la escala Epworth20– y pausas respiratorias nocturnas observadas; exploración física, incluido examen otorrinolaringológico; exploración funcional respiratoria, que incluyó la realización de la curva flujo/volumen mediante el espirómetro Datospir 200 (Sibelmed, Barcelona, España); PRD, e, independientemente de su resultado, en un plazo no superior a 15 días, PSG en la UTRS.
Poligrafía respiratoria domiciliariaEl polígrafo Edentec Monitoring System modelo 3711 (Edentrace II, Minnesota, EE.UU.) permite el registro de flujo oronasal por termistor, movimientos torácicos mediante banda, posición corporal mediante sensor de posición, ronquido mediante micrófono, frecuencia cardíaca y saturación de oxígeno arterial (SaO2) mediante pulsioximetría. Una enfermera entrenada en las técnicas del sueño acudió al domicilio del paciente para colocarle el polígrafo la noche del estudio, de manera que el registro se llevó a cabo de forma no vigilada. A la mañana siguiente el paciente se retiraba el polígrafo y lo devolvía a la UTRS junto con un diario nocturno. En la UTRS se realizó la corrección tanto automática como manual del registro obtenido.
Se definió apnea como el cese del flujo aéreo, medido mediante termistor, de al menos 10 s de duración, y la hipopnea como el descenso de al menos el 50% de la amplitud del flujo respiratorio, medido mediante termistor, durante al menos 10 s, asociado a una caída de la SaO2 de cuando menos un 4%.
Polisomnografía nocturnaSe efectuó en el laboratorio de sueño (UTRS), de forma vigilada, una o 2 semanas después de la realización de la PRD, mediante polisomnógrafo modelo Somnotrac 4250 de Sensormedics, con seguimiento de 2 canales de electroencefalograma (C3/A2; C4/A1; O2/A1; O1/A2), electromiograma tibial y submentoniano, electrocardiograma, flujo oronasal mediante termistor, movimientos torácicos y abdominales mediante bandas, posición corporal y SaO2 mediante pulsioximetría. Para considerar válida una PSG se requirió un mínimo de 180 min de sueño efectivo nocturno. Para la valoración de los diferentes estadios del sueño se siguieron los criterios convencionales de Rechtschaffen y Kales21, y para la valoración de los microdespertares (arousals) se siguieron los criterios de la American Sleep Disorders Association.22 La PSG fue corregida de forma manual y ciega por una persona diferente de la que había efectuado la corrección manual de la PRD y sin conocer los resultados de ésta.
Se definió la apnea como el cese del flujo aéreo en la boca y/o nariz, medido mediante termistor, de duración superior a 10 s, y la hipopnea como la disminución del flujo aéreo en la boca y/o nariz de duración superior a 10 s que se acompaña de microdespertar y/o desaturación de la oxihemoglobina de al menos un 4%.
Estimación de costesPara el cálculo de los costes se utilizaron las estimaciones en tiempo y costes por hora del personal de la UTRS del año 2003, así como el número de pruebas realizadas y gastos en fungible y mantenimiento de los equipos de PSG y de PR.
En 2003, el coste de un polígrafo tipo Edentec se situaba en torno a 6.010 € y su vida media se estimaba en 5 años. Al coste de la PR se le añadiría el coste del desplazamiento de la enfermera al domicilio del paciente, considerándose el desplazamiento medio por noche de 8 km; así pues, el coste estimado de la PRD sería de 69 €.
El coste de un polisomnógrafo en el año 2003 era de alrededor de 30.050 €, y su vida media estimada, de 5 años. El coste estimado de la PSG en el año 2003 era de 179 €.
El coste del tratamiento con presión positiva continua de la vía aérea (CPAP) era en el año 2003 de 1,50 €/día, lo que supone un gasto medio anual de 548 €/año por paciente tratado con CPAP.
Análisis estadísticoEl análisis estadístico se llevó a cabo con el programa SPSS para Windows, versión 10.0. Previa depuración de los datos, se calcularon las frecuencias absolutas y relativas (porcentajes) para las variables cualitativas, y para las cuantitativas, la media y desviación estándar. Para la comparación de las medias se utilizó la prueba de la t de Student para muestras emparejadas. La determinación de la correlación existente entre el índice de acontecimientos respiratorios (RDI, de respiratory disturbance index) en la PRD y el IAH en la PSG se realizó mediante el coeficiente de correlación de Pearson.
Se efectuó el cálculo de la curva de eficacia diagnóstica (curva ROC, de receiver operating characteristics), para lo que se eligieron diferentes valores de RDI y se consideró diagnóstico de SAHS un IAH igual o mayor de 10 en la PSG nocturna. Se determinaron la sensibilidad, la especificidad, los valores predictivos positivo y negativo, y la razón de verosimilitud positiva y negativa de la PRD de acuerdo con los puntos de corte elegidos en la curva ROC. Se define la razón de verosimilitud positiva como aquella que expresa cuántas veces es más probable un resultado positivo en los pacientes con enfermedad respecto a quienes no la tienen, y la razón de verosimilitud negativa como aquella que expresa cuántas veces es más probable que el resultado negativo sea negativo en los pacientes con enfermedad con respecto a quienes no la presentan. Las probabilidades diagnósticas pretest y postest de la PRD para el diagnóstico de SAHS, utilizando la odds pretest (prevalencia) para los puntos de corte elegidos, se calcularon manualmente mediante las fórmulas referidas por Sackett y Haynes23. Se construyó un modelo de regresión logística para predecir el diagnóstico de SAHS. El nivel de significación estadística establecido fue del 5% y los intervalos de confianza se construyeron al 95%.
ResultadosSe estudió a 45 pacientes de entre 29 y 75 años (edad media ± desviación estándar: 52,3 ±11 años), de los que 39 (86,7%) eran varones. Ocho (17,7%) pacientes presentaban antecedentes de hipertensión arterial, 5 (11,1%) alteraciones del ritmo cardíaco, 3 (6,6%) cardiopatía, 2 (4,4%) accidente cerebrovascular, uno (2,2%) enfermedad pulmonar obstructiva crónica y uno (2,2%) asma bronquial. Del conjunto de pacientes, 44 (97,8%) referían ronquidos nocturnos; 35 (77,7%) referían la presencia de pausas respiratorias nocturnas, objetivadas por el/la compañero/a de cama; 27 (60%) presentaban sensación de falta de descanso nocturno, y 20 (44,4%) mencionaban sensación de ahogos nocturnos o sobresaltos. No hubo modificaciones en los hábitos de consumo de alcohol y tabaco entre la realización de la PRD y la de la PSG.
La comparación de la situación basal de los pacientes antes de la poligrafía (pre-PRD) y de la PSG (pre-PSG) se muestra en la tabla I. Aunque se observaron diferencias de medias estadísticamente significativas entre el estudio pre-PRD y pre-PSG en la somnolencia diurna, valorada mediante la escala Epworth, y el diámetro de cuello, estas diferencias no fueron clínicamente relevantes y pudieron deberse a la homogeneidad de la muestra. En cuanto a la somnolencia diurna media, medida por escala Epworth, fue de 8,9 ± 3 y 8,3 ± 3 pre-PRD y pre-PSG, respectivamente, y los coeficientes de variación fueron similares, de 0,40 y 0,45, respectivamente, lo que muestra la homogeneidad de ambas medidas.
Características de los pacientes estudiados (n = 45) antes de la realización de la poligrafía domiciliaria (pre-PRD) y de la polisomnografía (pre-PSG)
| Pre-PRD | Pre-PSG | |
| Diámetro del cuello (cm) | 40,2 ± 2 | 40 ± 2 |
| Peso (kg) | 80,4 ± 9 | 79,8 ± 9 |
| Índice de masa corporal (kg/m2) | 28,7 ± 4 | 28,5 ± 4 |
| Escala Epworth | 8,9 ±3 (0-19) | 8,3 ± 3 (1-22) |
Valores expresados como media ± desviación estándar.
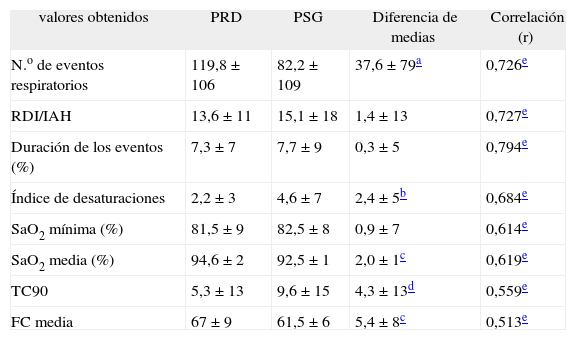
De los 45 pacientes estudiados, 21 (46,6%; intervalo de confianza del 95%, 32-60%) fueron diagnosticados de SAHS (IAH ≥ 10 en la PSG). Al comparar los valores registrados en la PRD y la PSG, las correlaciones obtenidas fueron significativas para todos los pares relacionados (tabla II).
Resultados de la poligrafía domiciliaria (PRD) y de la polisomnografía (PSG) en los pacientes estudiados (n = 45)
| valores obtenidos | PRD | PSG | Diferencia de medias | Correlación (r) |
| N.o de eventos respiratorios | 119,8 ±106 | 82,2 ±109 | 37,6 ± 79a | 0,726e |
| RDI/IAH | 13,6 ±11 | 15,1 ± 18 | 1,4 ± 13 | 0,727e |
| Duración de los eventos (%) | 7,3 ± 7 | 7,7 ± 9 | 0,3 ± 5 | 0,794e |
| Índice de desaturaciones | 2,2 ± 3 | 4,6 ± 7 | 2,4 ± 5b | 0,684e |
| SaO2 mínima (%) | 81,5 ±9 | 82,5 ± 8 | 0,9 ± 7 | 0,614e |
| SaO2 media (%) | 94,6 ± 2 | 92,5 ± 1 | 2,0 ± 1c | 0,619e |
| TC90 | 5,3 ±13 | 9,6 ±15 | 4,3 ± 13d | 0,559e |
| FC media | 67 ± 9 | 61,5 ±6 | 5,4 ± 8c | 0,513e |
Valores expresados como media ± desviación estándar.
FC: frecuencia cardíaca; IAH: índice de apneas-hipopneas; RDI: índice de acontecimientos respiratorios; SaO2: saturación de oxígeno; TC90: porcentaje de tiempo con SaO2 menor del 90%.
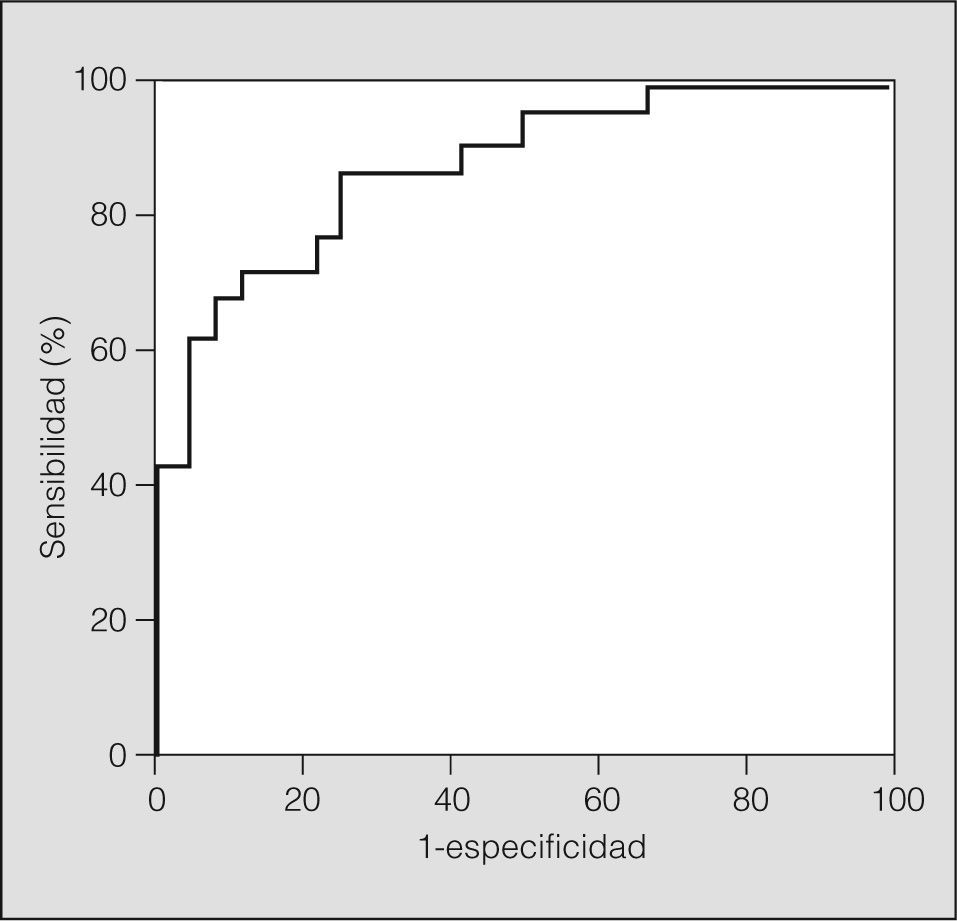
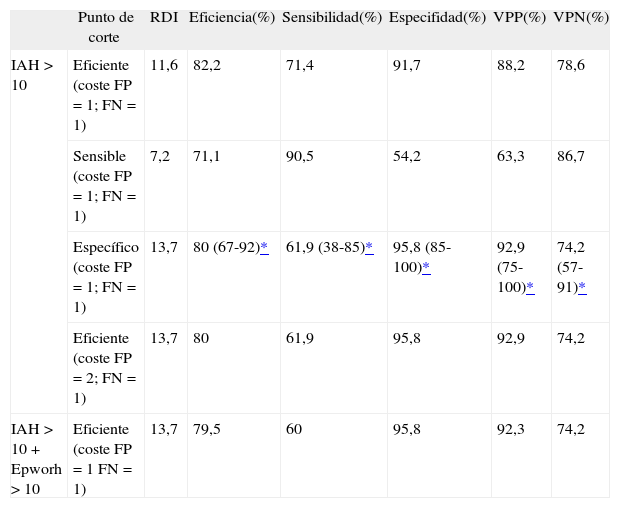
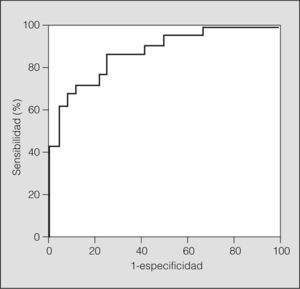
Considerando diagnóstico de SAHS un IAH de por lo menos 10 en la PSG, se calculó la curva ROC y se identificaron diferentes valores de RDI (fig. 1) (tabla III). El punto más eficiente, para un coste igual de los falsos positivos (FP) que de los falsos negativos (FN) (coste de FP = 1; coste de FN = 1) fue un RDI de 11,6. Considerando 2 puntos de corte, uno sensible y otro específico, para un coste igual de los FP que de los FN, el punto de corte con la especificidad más adecuada fue un RDI de 13,7, y el punto de corte con la sensibilidad más adecuada fue de 7,2. El punto más eficiente para un coste de los FP doble (coste FP = 2) que el de los FN (coste FN = 1) fue un RDI de 13,7. El punto más eficiente para un coste igual de los FP y de los FN, pero considerando un IAH de al menos 10 y una puntuación de la escala Epworth de 10 o más, fue un RDI de 13,7, es decir, el mismo punto que si consideramos doble coste de los FP respecto a los FN.
Puntos seleccionados en la curva de eficacia diagnósitca (curva ROC)
| Punto de corte | RDI | Eficiencia(%) | Sensibilidad(%) | Especifidad(%) | VPP(%) | VPN(%) | |
| IAH > 10 | Eficiente (coste FP = 1; FN = 1) | 11,6 | 82,2 | 71,4 | 91,7 | 88,2 | 78,6 |
| Sensible (coste FP = 1; FN = 1) | 7,2 | 71,1 | 90,5 | 54,2 | 63,3 | 86,7 | |
| Específico (coste FP = 1; FN= 1) | 13,7 | 80 (67-92)* | 61,9 (38-85)* | 95,8 (85-100)* | 92,9 (75-100)* | 74,2 (57-91)* | |
| Eficiente (coste FP = 2; FN = 1) | 13,7 | 80 | 61,9 | 95,8 | 92,9 | 74,2 | |
| IAH > 10 + Epworh > 10 | Eficiente (coste FP = 1 FN = 1) | 13,7 | 79,5 | 60 | 95,8 | 92,3 | 74,2 |
FN: falsos negativos; FP: falsos positivos; IAH: índice de apneas-hipopneas; RDI: índice de acontecimientos respiratorios; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La probabilidad pretest en nuestra población fue de 0,46, originando las probabilidades postest siguientes: si consideramos 2 puntos de corte, uno sensible y otro específico, estableciendo como umbral de diagnóstico un RDI de 7,2 (punto de corte sensible), la probabilidad postest de un resultado negativo (RDI < 7,2) es del 13,6%. Considerando como umbral de tratamiento un RDI de 13,7 (punto de corte específico), la probabilidad postest de un resultado positivo (RDI ≥ 13,7) es del 92,8%.
En nuestra población, consideramos punto de corte óptimo el obtenido de considerar que el coste de los FP dobla al de los FN (FP = 2; FN = 1), es decir, RDI de 13,7 o superior, que obtiene un área bajo la curva ROC del 87,5%, con un intervalo de confianza del 95% del 74-95%, una probabilidad postest de resultado positivo del 92,8% y una probabilidad postest de resultado negativo del 25,9%.
Análisis de regresión logísticaSe realizó un modelo de regresión logística para predecir la presencia de SAHS a partir de los valores de RDI (sin SAHS, RDI < 13,7; con SAHS, RDI ≥ 13,7) y las covariables siguientes: a) presencia de somnolencia diurna, si la puntuación de la escala Epworth es de 10 o superior; b) sensación de falta de descanso nocturno, y c) obesidad -en la mujer, índice de masa corporal > 25,9 kg/m2 (25-26); en el varón, índice de masa corporal > 27,9 kg/m2 (27-28). Dicho modelo obtuvo una eficiencia del 77,7%, una sensibilidad del 61,9% y una especificidad del 91,6%.
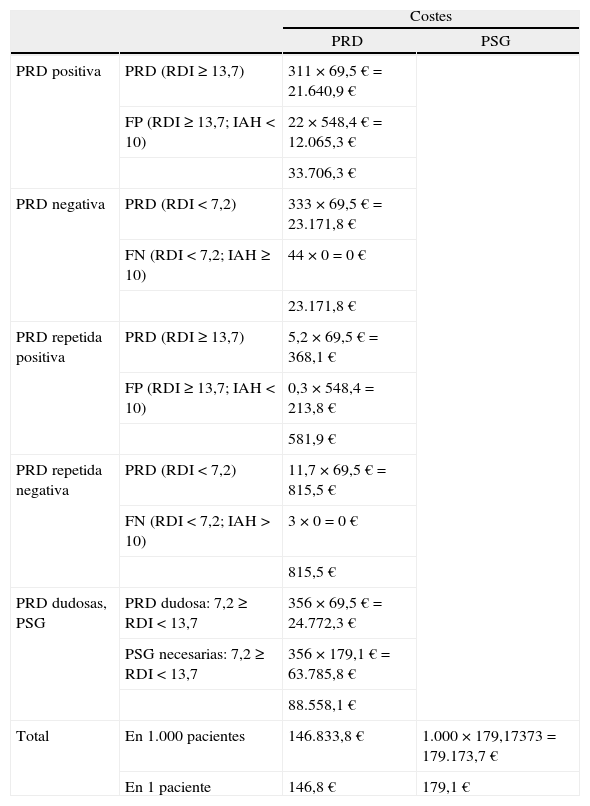
Cálculo de costesPara el cálculo de costes se utilizó una población teórica de 1.000 personas y se aplicaron las características de la PRD, con los puntos de corte elegidos y los costes por prueba utilizada calculados previamente: prevalencia de la enfermedad del 46,6% (prevalencia obtenida en nuestra población de estudio); punto umbral de diagnóstico: un RDI inferior a 7,2 indica que no hay SAHS; punto umbral de tratamiento: un RDI de 13,7 o superior indica la presencia de SAHS; entre ambos valores queda una zona dudosa en la cual sería necesario la realización de PSG. Para el cálculo de los costes de los FP, se consideró el coste añadido que supondría el tratamiento con CPAP en estos pacientes inadecuadamente diagnosticados de SAHS por la PRD, y para los costes de los FN asumimos que serían SAHS leves o posicionales, en los que fundamentalmente estarían indicadas medidas higiénico-dietéticas, por lo cual no representarían ningún gasto adicional en cuanto a tratamiento (coste = 0 €). Aunque en el presente estudio no fue necesaria la repetición de ninguna PRD, para el cálculo de costes en la población teórica, y utilizando los datos de la UTRS en el año 2003, se consideró el supuesto de necesidad de repetición del 1,6% de las PRD.
Al comparar los costes entre la realización de PSG y PRD en esta población teórica, la diferencia de costes sería de -32.339,8 € en 1.000 pacientes (tabla IV). Por tanto, la realización de una PRD en un paciente con sospecha de SAHS supone un ahorro de 32,3 € con respecto a la realización de PSG, incluso cuando haya que realizar PSG en los casos de PRD dudosas y repetir la PRD cuando ésta no sea válida, y asumiendo gasto adicional de los FP resultantes de la PRD que fueran tratados con CPAP.
Comparación de costes: poligrafía domiciliaria (PRD) frente a polisomnografía (PSG) en una población teórica de 1.000 personas
| Costes | |||
| PRD | PSG | ||
| PRD positiva | PRD (RDI ≥ 13,7) | 311 × 69,5 € = 21.640,9 € | |
| FP (RDI ≥ 13,7; IAH < 10) | 22 × 548,4 € = 12.065,3 € | ||
| 33.706,3 € | |||
| PRD negativa | PRD (RDI < 7,2) | 333 × 69,5 € = 23.171,8 € | |
| FN (RDI < 7,2; IAH ≥ 10) | 44 × 0 = 0 € | ||
| 23.171,8 € | |||
| PRD repetida positiva | PRD (RDI ≥ 13,7) | 5,2 × 69,5 € = 368,1 € | |
| FP (RDI ≥ 13,7; IAH < 10) | 0,3 × 548,4 = 213,8 € | ||
| 581,9 € | |||
| PRD repetida negativa | PRD (RDI < 7,2) | 11,7 × 69,5 € = 815,5 € | |
| FN (RDI < 7,2; IAH > 10) | 3 × 0 = 0 € | ||
| 815,5 € | |||
| PRD dudosas, PSG | PRD dudosa: 7,2 ≥ RDI < 13,7 | 356 × 69,5 € = 24.772,3 € | |
| PSG necesarias: 7,2 ≥ RDI < 13,7 | 356 × 179,1 € = 63.785,8 € | ||
| 88.558,1 € | |||
| Total | En 1.000 pacientes | 146.833,8 € | 1.000 × 179,17373 = 179.173,7 € |
| En 1 paciente | 146,8 € | 179,1 € | |
FN: falsos negativos; FP: falsos positivos; RDI: índice de acontecimientos respiratorios.
Los estudios de validación de PR9-19 se han realizado con diferentes sistemas y métodos, pero son escasos los llevados a cabo en el domicilio del paciente16-19,24,25. En el presente estudio, donde se ha validado el sistema de PR Edentec Monitoring System, modelo 3711, en el domicilio del paciente, se observó que la PRD es eficaz y eficiente como método diagnóstico en la población estudiada respecto a la prueba diagnóstica de referencia, la PSG. Se han determinado puntos de corte de la PRD con adecuados índices de sensibilidad, especificidad y razones de verosimilitud positiva y negativa, que la hacen útil para la toma de decisiones diagnósticas y terapéuticas.
El diagnóstico de SAHS se establece a partir de criterios clínicos y polisomnográficos. La variabilidad de los síntomas clínicos, también encontrada en este estudio, y el hecho de que éste se haya realizado en pacientes con sospecha clínica de SAHS derivados desde atención primaria, y posteriormente desde la consulta externa de neumología, hacen que sean pacientes muy seleccionados y con alta probabilidad de presentar SAHS, como demuestra la prevalencia hallada en el estudio (46,6%). Todo ello hace que el valor de la clínica, cuando estos pacientes llegan a la UTRS, sea pequeño, debido al “agotamiento” de su valor en el trayecto23, como parece corroborar la escasa aportación de la clínica en el modelo de regresión logística construido y valorado en este trabajo.
La selección aleatoria de los pacientes incluidos en el estudio evita los posibles sesgos de selección y permite obtener una muestra representativa de la población atendida en la UTRS de Burgos, cuyo funcionamiento es similar al de los centros de referencia del resto de España.
Las diferencias de medias fueron significativas entre los estudios pre-PRD y pre-PSG en el número de eventos respiratorios totales. Es necesario tener en cuenta la variabilidad noche a noche, ya que los estudios se efectuaron en 2 noches diferentes, variabilidad que se ha constatado previamente, incluso con la PSG estándar26. También se encontraron diferencias estadísticamente significativas en el índice de desaturaciones, la SaO2 media y el porcentaje de tiempo con SaO2 menor del 90%. En estos casos, aunque puede influir la variabilidad noche a noche, es necesario considerar sobre todo que, mientras que la PSG permite la diferenciación de sueño y vigilia, la PRD no permite dicha diferenciación y, por tanto, en la PSG son valores referidos al tiempo de sueño, en tanto que en la PRD son valores referidos al tiempo total de estudio, incluida la vigilia. La SaO2 es siempre mayor en vigilia; durante el sueño, y fundamentalmente durante el sueño REM27, tiene lugar un descenso de la SaO2. Así pues, en la PRD estas desaturaciones podrían estar infraestimadas, al no diferenciar la prueba el sueño de la vigilia, y lo mismo sucede con la frecuencia cardíaca.
De los estudios de validación realizados en el domicilio, algunos se han efectuado con el sistema Edentec16,18; dichos trabajos han encontrado tasas de acuerdo de 0,916 y sensibilidades y especificidades que varían, según el punto de corte elegido del RDI, entre el 63 y el 95% y entre el 33 y el 93%, respectivamente18. Otros estudios realizados en el domicilio con sistemas diferentes del Edentec encontraron sensibilidades que variaban del 78 al 94%, y especificidades que oscilaban entre el 41 y el 92%17,19. Por tanto, nuestros resultados son comparables a los publicados en la literatura médica de validación de los sistemas de PR en el domicilio del paciente, tanto los realizados con el sistema portátil Edentec como con otros sistemas de PR.
La validación no se llevó a cabo simultáneamente en el laboratorio de sueño porque ya se había realizado en otros trabajos publicados y con este mismo sistema de PR (Edentec)16, y el objetivo fundamental del estudio era la utilización de la PR en el domicilio del paciente. No es lo mismo la utilización de una prueba como cribado que como prueba de diagnóstico y de aplicación de tratamiento. En nuestra población se necesitaba fundamentalmente una prueba específica que no supusiera un número importante de FP (es decir, pacientes diagnosticados de SAHS sin que presentaran la enfermedad) y, por tanto, el uso de un tratamiento de forma inadecuada, lo que implicaría también un aumento de costes. Al seleccionar una prueba específica asumimos la posibilidad de mayor número de FN, considerando que serían SAHS leves, en los cuales estarían indicadas medidas higiénico-dietéticas3, que no supondrían un aumento de costes en cuanto al tratamiento ni privar al paciente de un tratamiento adecuado. En este sentido, obtuvimos mayor especificidad al dar doble coste a los FP que a los FN (FP = 2; FN = 1), siendo el punto de corte más eficiente un RDI de 13,7 o superior. Este punto de corte fue el mismo que obtuvimos si considerábamos criterio diagnóstico de SAHS un IAH de 10 o mayor, una puntuación en la escala Epworth de 10 o mayor20,28 e igual coste para los FP que para los FN.
En este estudio realizamos el cálculo de las probabilidades diagnósticas, de forma que el paciente que acude a nuestra unidad (UTRS) tiene una probabilidad pretest de presentar SAHS del 46,6%; si se le realiza una PRD y el RDI es inferior a < 7,2 (punto sensible), la probabilidad postest de que presente un SAHS se reduce hasta el 13,60%, y si el resultado es positivo, es decir, el RDI es igual o mayor de 13,70 (punto específico), la probabilidad postest de que tenga SAHS sería del 92,8%. No fue necesario repetir ninguna PRD y no hubo ningún caso de datos no válidos, fundamentalmente porque en nuestro estudio la colocación de la PRD corrió a cargo de un técnico de sueño en el domicilio de los pacientes, a diferencia de otros estudios18 en los que el mismo paciente se colocaba el sistema en su domicilio.
En 6 del total de los pacientes hubo discrepancias entre la PRD y la PSG. Todos ellos habrían estado localizados en la zona dudosa (7,2 > RDI < 13,7), eran SAHS leves y con eventos en decúbito supino, y correspondían a FN en los que se hubieran instaurado medidas higiénico-dietéticas29. De estos 6 pacientes, tan sólo se habría modificado la actitud terapéutica en 2, en uno por somnolencia diurna y en el restante por factores de riesgo cardiovascular.
En el presente estudio realizamos un análisis de costes en un algoritmo de diagnóstico que incluyera la PRD, teniendo en cuenta no sólo los costes derivados del material y fungible necesarios, sino también los derivados del consumo de tiempo por parte del personal médico y técnicos de sueño. La realización de la PRD no supondría un aumento de costes, sino que en el presente estudio implicaría un ahorro de 32,3 € por paciente. En los estudios en los que se han analizado costes19, la PRD representaba un ahorro respecto a la realización de la PSG, pero en ninguno de ellos se había considerado el gasto adicional de los FP.
En nuestra opinión, la limitación más importante de este estudio es el posible sesgo de selección, al haberse estudiado a pacientes con sospecha de SAHS y no a población general, motivo por el que en el análisis se ha buscado un punto de corte de alta especificidad.
En definitiva, en el presente estudio se demuestra que la PRD es un método eficaz para el diagnóstico de SAHS, que puede realizarse en el propio domicilio del paciente y que no supone un aumento de los costes. Es necesario recalcar que su empleo facilita el acceso al diagnóstico del SAHS en lugares diferentes de las unidades de sueño complejas orgánica y tecnológicamente. Por lo tanto, es indispensable su incorporación en todos los servicios de neumología30.