En el artículo “Normativa sobre el tratamiento farmacológico de la fibrosis pulmonar idiopática” publicado en Arch Bronconeumol. 2017;53:263-9, se han detectado varios errores en las tablas 1 y 5, en la figura 1 y en el texto.
Las tablas correctas son las siguientes:
Características metodológicas y clínicas de los pacientes con fibrosis pulmonar idiopática incluidos en los ensayos clínicos CAPACITY-1 y 2, y ASCEND
| CAPACITY-1 y 2 (n= 779) | ASCEND (n= 555) | |
|---|---|---|
| Edad (años) | 40-80 | 40-80 |
| FVC (criterio inclusión) | ≥ 50-90% | 50-90% |
| DLCO (criterio inclusión) | ≥ 35-90% | ≥ 30-90% |
| Fase | III | III |
| Tiempo estudio (semanas) | 72 | 52 |
| TCAR NIU | 92% | 95,7% |
| FVC al inicio (media) | 74,1% | 67,8% |
| DLCO al inicio (media) | 47% | 43,7% |
DLCO: capacidad de transferencia del monóxido de carbono; FVC: capacidad vital forzada; NIU neumonía intersticial usual; TCAR: tomografía axial computarizada de alta resolución.
Características metodológicas y clínicas de los pacientes con fibrosis pulmonar idiopática incluidos en los ensayos clínicos TOMORROW e INPULSIS
| TOMORROW (n=422, 85 a dosis 150mg/12h) | INPULSIS-1 y 2 (n=1.066) | |
|---|---|---|
| Edad (años) | >40 | >40 |
| FVC (criterio inclusión) | ≥50% | ≥50% |
| DLCO (criterio inclusión) | 30-79% | 30-79% |
| Fase | II | III |
| Tiempo estudio (semanas) | 52 | 52 |
| TCAR NIU | 38,8% | 76% |
| FVC al inicio (media) | 78,1% | 79,5% |
| DLCO al inicio (media) | – | 47% |
DLCO: capacidad de transferencia del monóxido de carbono; FVC: capacidad vital forzada; NIU neumonía intersticial usual; TCAR: tomografía axial computarizada de alta resolución.
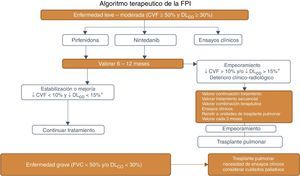
La figura 1 correcta es la siguiente:
El texto correcto es el siguiente:
- -
Página 3, apartado “Nintedanib (Ofev®)”, línea 57. Donde dice: “En los estudios INPULSIS, los pacientes con riesgo cardiovascular fueronexcluidos y, por tanto, no se conoce con certeza la seguridad (tabla 3). En la tabla 4 se especifican las interacciones medicamentosas denintedanib.”, debe decir: “En la tabla 4 se especifican las interacciones medicamentosas denintedanib.”
- -
Página 5, apartado “Fármacos antifibróticos en fase de ensayo clínico”, línea 31. Donde dice “Entre estas combinaciones están: pirfenidona±lebrikizumab (estudio RIFF), pirfenidona o ninteda-nib±PRM-151 (estudio PROMEDIOR), pirfenidona±vismodegib (estudio GB29764), pirfenidona±sildenafilo”, debe decir: “Entre estas combinaciones están:pirfenidona±lebrikizumab (estudio RIFF), pirfenidona o ninteda-nib±PRM-151 (estudio PROMEDIOR), pirfenidona±vismodegib(estudio GB29764), pirfenidona±sildenafilo, nintedabid+/- sildefanilo (estudio INSTAGE y otros estudios en marcha NCT02606877 (nintedanib+pirfenidona o el estudio INMARK.”
- -
Página 5, el título del apartado “Enfisema pulmonar” debe sustituirse por: “Síndrome combinado de fibrosis pulmonar con enfisema (CPFE)”.
- -
Página 5, apartado “Enfisema pulmonar”, línea 1. Donde dice: “En la actualidad, no existen tratamientos eficaces para el síndrome CPFE (coexistencia de enfisema y FPI)35,36, de tal manera que parece lógico tomar decisiones terapéuticas basadas en las recomendaciones por separado para el enfisema y la FPI.”, debe decir: “En la actualidad, no existen tratamientos eficaces para el síndrome CPFE35,36, de tal manera que parece lógico tomar decisiones terapéuticas basadas en las recomendaciones por separado para el enfisema y la FPI.”