La embolización arterial (EA) es útil en el tratamiento de la hemoptisis amenazante. El objetivo de este trabajo es describir la experiencia de un centro universitario terciario con la EA como tratamiento de la hemoptisis amenazante, caracterizar los hallazgos angiográficos cuando hay recidivas, y analizar los factores asociados con estos hallazgos.
Material y métodosEstudio observacional retrospectivo en el que se incluyeron todos los pacientes con una EA debido a hemoptisis amenazante durante un periodo de 13años. Los efectos de: a)tiempo hasta recurrencia; b)uso de coils, y c)número de arterias embolizadas sobre la probabilidad que el sangrado tuviera el mismo origen vascular que en el episodio previo fueron analizados.
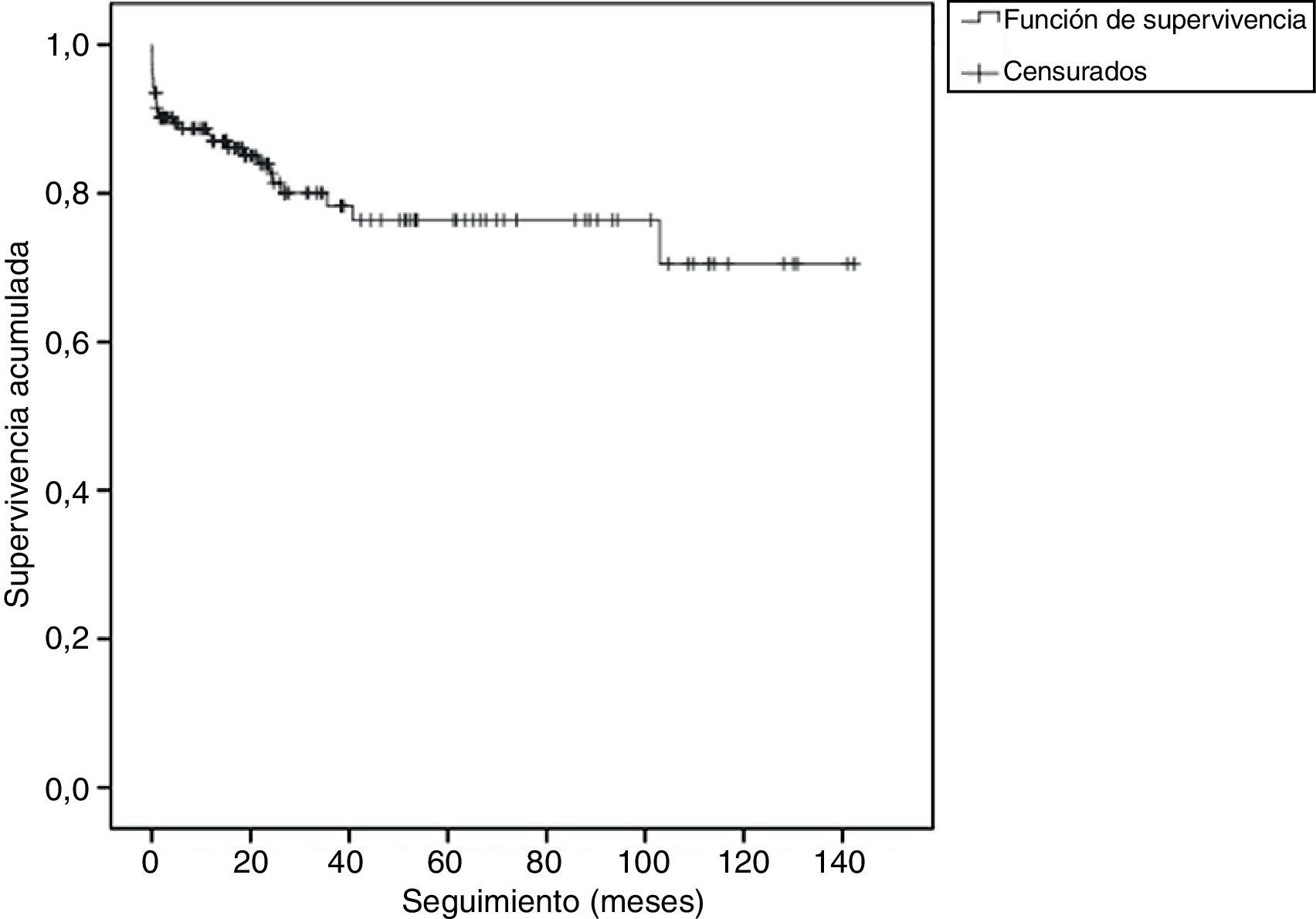
ResultadosSe incluyeron 176pacientes en el estudio. Murieron por hemoptisis 22pacientes (12,5%). La probabilidad de sobrevivir libre de recidiva al mes fue de 0,91 (IC95%: 0,87 a 0,95), a los 12 meses de 0,85 (IC95%: 0,79 a 0,91) y a los 3años de 0,75 (IC95%: 0,66 a 0,83). La probabilidad de que la recurrencia fuera debida a una afectación de la misma arteria dependía del tiempo hasta la recurrencia (estimado=0,0157, valor de z=2,41, valor de p=0,016).
ConclusiónLa EA es efectiva en el tratamiento de la hemoptisis, pero las recidivas no son infrecuentes. La recidiva del sangrado por recanalización de la arteria embolizada está relacionada con el tiempo transcurrido hasta la recidiva, pero no con el uso de coils ni con el número de arterias embolizadas.
Artery embolization (AE) is a safe and useful procedure in the management of massive hemoptysis. The objective of our study was to describe the experience of AE in a tertiary referral center, to characterize angiographic findings at the time of recurrence, and to analyze factors associated with these findings.
Material and methodsObservational retrospective study of patients presenting with life-threatening hemoptysis. All consecutive patients with at least one episode of hemoptysis that required AE during a 13-year period were included. The effects of i)time to recurrence; ii)use of coils, and iii)number of arteries embolized on the likelihood that the recurrence was secondary to recanalization were assessed.
ResultsOne hundred seventy-six patients were included in the study. Twenty-two patients (12.5%) died due to hemoptysis. Probability of recurrence-free survival at one month was 0.91 (95%CI: 0.87 to 0.95), at 12months was 0.85 (95%CI: 0.79 to 0.91), and after 3 years was 0.75 (95%CI: 0.66 to 0.83). A longer time to recurrence was associated with a higher probability that the hemorrhage affected the same artery (estimate=0.0157, z-value=2.41, p-value=0.016).
ConclusionAE is a safe and useful technique in the management of massive and recurrent hemoptysis. Nevertheless, recurrence after embolization is not uncommon. Recurring hemoptysis due to recanalization is related to time to recurrence, but not to the use of coils or number of arteries embolized.
Desde la descripción inicial por Remy et al.1, la embolización arterial (EA) se ha convertido en un procedimiento ampliamente utilizado en el tratamiento de la hemoptisis amenazante y recurrente. Diversos estudios han analizado su eficacia, su seguridad y su utilidad2–10. No obstante, la recidiva de la hemoptisis puede ocurrir incluso después de la embolización en el 9,25-50% de los casos11–24. Cuando esto ocurre, se asocia con un mayor riesgo de mortalidad20,22.
Se ha descrito que la recurrencia del sangrado tras una EA puede deberse a una embolización incompleta de los vasos, a la recanalización de vasos previamente embolizados, a la revascularización de la circulación colateral o a la progresión de la patología pulmonar subyacente12,17,19,23. Ningún estudio ha analizado la relación entre las características técnicas del procedimiento y el riesgo de recidiva por recanalización.
El objetivo de este trabajo es describir la experiencia de nuestro centro con la EA como tratamiento de la hemoptisis amenazante, analizar las características técnicas de la EA e identificar los factores asociados a la recidiva por recanalización.
Material y métodosPoblaciónSe trata de un estudio observacional retrospectivo de 176pacientes que acudieron a un hospital terciario universitario por hemoptisis amenazante a los que se practicó una EA. De forma consecutiva, se incluyeron todos los pacientes con al menos un episodio de hemoptisis amenazante durante un periodo de 13años (enero 1999-diciembre 2011) y que hubieran sido embolizados. Se consideró hemoptisis amenazante un sangrado de al menos 200ml en 24h, de 100ml al día durante 3días consecutivos, o bien una hemoptisis menor pero que comportara peligro para la vida del paciente. Se revisó la historia clínica de estos pacientes y se recogieron los siguientes datos para el análisis: edad, sexo, etiología de la hemoptisis, hallazgos de la EA, datos relativos al procedimiento (arterias embolizadas, número de arterias embolizadas, uso de coils) y tiempo transcurrido entre embolizaciones. El diagnóstico de enfermedad pulmonar obstructiva crónica (EPOC) o bronquiectasias se basó en la presencia de enfisema o de bronquiectasias en la tomografía computarizada (TC) de tórax, respectivamente, en ausencia de otro diagnóstico más específico. El diagnóstico en el momento de la segunda embolización se asumió que era el mismo que en la embolización previa en ausencia de un nuevo diagnóstico.
Embolización arterial bronquialTodos los procedimientos fueron realizados por 2radiólogos intervencionistas expertos. La metodología se ha descrito previamente4. En resumen, se revisaron sistemáticamente las arterias bronquiales de ambos hemitórax y las arterias sistémicas no bronquiales del hemitórax patológico y se realizó una aortografía torácica. Si tras el estudio de las arterias bronquiales y de las ramas sistémicas que pudieran irrigar el parénquima pulmonar no se encontraba el origen de la hemoptisis, se realizaba un estudio de las arterias pulmonares. El material utilizado para la embolización era reabsorbible, como partículas de espongostán, y no reabsorbibles, como partículas de polivinilo alcohol (PVA), embosferas y espirales metálicos o coils. Para la embolización del lecho arterial distal se utilizaron sistemáticamente partículas de PVA o embosferas, mientras que para la embolización proximal, cuando el cateterismo fue estable y la morfología y el tamaño de la arteria lo permitían, se utilizaron espirales metálicas. Cuando no fue posible embolizar proximalmente con coils se emplearon partículas de espongostán.
Se embolizaron todos los vasos anómalos que irrigaban la zona afectada si fue técnicamente posible. Si no había afectación pulmonar detectable, se embolizaron todas las arterias que pudieron ser cateterizadas. Contraindicaciones para la embolización fueron la visualización de la rama espinal anterior o la inestabilidad del catéter. No se realizó angiografía pulmonar de rutina.
RecidivaSe definió recurrencia como un nuevo episodio de hemoptisis amenazante que requiriera EA en un paciente con antecedente de EA previa. Los hallazgos angiográficos y los factores relacionados con la reembolización fueron recogidos. Los hallazgos angiográficos en el momento de la recidiva fueron comparados con los del episodio anterior. En pacientes con más de una recurrencia se comparó cada episodio con el inmediatamente anterior. Se consideró que una recidiva era debida a recanalización cuando sangraba de la misma arteria embolizada en el procedimiento previo.
Análisis estadísticoSe utilizó el paquete estadístico SPSS, versión 19.0 (SPSS, Chicago, IL), para el análisis descriptivo y el estudio de la supervivencia. En el caso de variables cuantitativas los resultados se expresan como media y desviación estándar, y en el caso de las cualitativas, como valores absolutos y porcentajes. La curva de supervivencia se construyó según el método de Kaplan-Meier. La probabilidad de supervivencia se expresa con su intervalo de confianza del 95%.
Se analizaron mediante 4modelos logísticos mixed-effects separados con el paquete «lme4»25 para R26 la relación de: a)tiempo hasta la recurrencia; b)uso de coils, y c)número de arterias embolizadas, con la probabilidad de que el sangrado se debiera a recanalización. El regresor de interés (tiempo hasta la recurrencia) se introdujo como efecto fijo, mientras que la identificación del paciente fue introducida como efecto aleatorio. Con esta aproximación, el hecho de que la hemorragia proviniera o no de la misma arteria se modeló como un resultado binario, y la naturaleza de medidas repetidas de los datos fue tenida en cuenta.
El protocolo del estudio fue aprobado por el Comité de Ética de nuestro centro.
ResultadosEtiología de la hemoptisisLas características de los 176pacientes incluidos en el estudio se muestran en la tabla 1. La patología más frecuentemente causante de hemoptisis fueron las bronquiectasias, seguidas de neoplasias (primarias pulmonares o metástasis desde otros órganos) y de la bronquitis crónica/EPOC. De los 39pacientes con neoplasia el diagnóstico fue establecido con prioridad a la embolización en 23casos (59%).
Características de los 176 pacientes incluidos en el estudio
| Edad, años | |
| Media (DE) | 58,7 (14,6) |
| Sexo, n (%) | |
| Hombre | 132 (75) |
| Mujer | 44 (25) |
| Tabaquismo, n (%) | |
| Nunca | 46 (26,1) |
| Exfumador | 64 (36,4) |
| Fumador activo | 66 (37,5) |
| Patología de base, n (%) | |
| Bronquiectasias | 57 (32,4) |
| Neoplasia | 40 (22,7) |
| EPOC | 33 (18,8) |
| Idiopática | 18 (10,2) |
| Tuberculosis activa | 10 (5,7) |
| Aspergiloma | 7 (4,0) |
| Otras | 6 (3,0) |
| Recidiva, n (%) | |
| No | 145 (82,4) |
| Sí | 31 (17,6) |
| Bronquiectasias | 11 (35,5) |
| Neoplasia | 7 (22,6) |
| EPOC | 7 (22,6) |
| Otras | 6 (19,3) |
| Mortalidad por hemoptisis, n (%) | |
| No | 154 (87,5) |
| Sí | 22 (12,5) |
| Neoplasia | 13 (59,1) |
| EPOC | 3 (13,6) |
| Aspergiloma | 3 (13,6) |
| Otras | 3 (13,6) |
| Duración del seguimiento en meses, media (rango) | 28 (0-142) |
EPOC: enfermedad pulmonar obstructiva crónica.
Se consiguió control inmediato (sin recidiva en la primera semana) del sangrado en 169pacientes (96%). La mortalidad por hemoptisis a pesar de la EA fue del 12,5% (22pacientes) (tabla 1). De ellos, 4habían precisado una segunda embolización. Las causas más frecuentes de sangrado en los pacientes que fallecieron fueron neoplasia (59,1%), seguida de aspergiloma y EPOC, con 3casos cada grupo (13,6%).
Un paciente (0,6%) presentó isquemia medular. No hubo otras complicaciones graves.
Recidiva de la hemoptisis a lo largo del seguimientoDurante el periodo de tiempo estudiado, 31pacientes presentaron recidiva del sangrado. A estos 31pacientes se les practicaron un total de 77arteriografías con EA. Las características de los pacientes y de las recidivas pueden verse en la tabla 2. Los hallazgos angiográficos presentes durante la segunda EA, así como las características de la embolización previa, se describen en la tabla 3.
Características de los 31 pacientes con recidiva incluidos en el estudio y características de los 44 pares de embolizaciones
| Pacientes | |
| Edad, años | |
| Media (DE) | 56,44 (15,1) |
| Sexo, n (%) | |
| Hombre | 21 (67,7) |
| Mujer | 10 (32,3) |
| Patología de base, n (%) | |
| Bronquiectasias | 11 (35,5) |
| Neoplasia | 7 (22,6) |
| EPOC | 7 (22,6) |
| Aspergiloma | 2 (6,5) |
| Tuberculosis activa | 2 (6,5) |
| Idiopática | 2 (6,5) |
| Embolizaciones | |
| Tiempo entre embolizaciones, semanas | |
| Media (DE) | 57,2 (90,6) |
| En las primeras 80 semanas, n (%) | 33 (75) |
| A partir de las 80 semanas, n (%) | 11 (25) |
| Arterias embolizadas en la primera embolización | |
| Media (DE) | 1,89 (0,97) |
| Coils en la primera embolización, n (%) | |
| Sí | 11 (25) |
| No | 33 (75) |
| Arterias embolizadas en la segunda embolización, n (%) | |
| Mismas que en la primera | 17 (38,6) |
| Distintas que en la primera | 27 (61,4) |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica.
Hallazgos angiográficos durante la segunda embolización arterial, así como las características de la embolización arterial previa
| Caso | Diagnóstico | EAB inicial | Tiempo hasta recidiva | EAB en la recidiva | ||
| Arterias | Número | Coils | ||||
| 1 | Bronquiectasias | TBB | 2 | No | 12,1meses | ASUBESCAI |
| ASUBESCAI | 1 | No | 6,5 meses | ATLI | ||
| ATLI | 1 | No | 19 días | AMII | ||
| AMII | 1 | No | 3,1 años | AMII | ||
| AMII | 2 | Sí | 15,2 meses | TBB | ||
| 2 | EPOC | ABD | 2 | No | 21,6 meses | ABD |
| 3 | EPOC | TICBD; ABI | 2 | Sí | 0 días | AICD |
| 4 | EPOC | TBBI | 2 | No | 12,9 meses | ABD |
| 5 | Bronquiectasias | ABD | 1 | No | 1 días | AMID |
| 6 | Bronquiectasias | TICBD | 3 | No | 5,9 años | TICBD |
| 7 | Bronquiectasias | TBB | 3 | No | 2 años | TBB |
| 8 | EPOC | TBB | 1 | Sí | 3 días | TBB |
| 9 | Bronquiectasias | ABI | 2 | Sí | 8,4 años | ABI |
| 10 | Cáncer | ABI | 1 | No | 5,9 semanas | ABI |
| 11 | Bronquiectasias | ABI | 3 | Sí | 2,9 años | ABI |
| 12 | Cáncer | TBB; TICBD | 2 | No | 3,9 semanas | ABI |
| 13 | EPOC | AMID | 2 | No | 3,3 años | AMID |
| AMID | 1 | No | 4 días | ABD | ||
| 14 | Bronquiectasias | AMII | 2 | Sí | 2 años | AICI |
| AICI | 4 | No | 23,1 meses | AICI | ||
| 15 | Cáncer | AP | 1 | Sí | 5,4 meses | ASUBESCAI |
| 16 | EPOC | TBB; LBA | 5 | No | 1 días | AMID |
| 17 | Idiopática | TBB | 1 | Sí | 9 días | AICD |
| 18 | Cáncer | ABI | 1 | No | 5,9 semanas | ABI |
| 19 | Cáncer | ABI | 1 | No | 7,7 meses | ABD |
| 20 | Bronquiectasias | TICBD | 3 | No | 1 días | ABI |
| 21 | Bronquiectasias | TICBD | 2 | No | 11,5 meses | TICBD |
| TICBD | 3 | No | 10 días | AICD | ||
| AICD | 1 | No | 4,2 años | TBBD | ||
| TBBD | 1 | No | 15 días | AICD | ||
| 22 | Aspergilosis | TBB | 1 | No | 4,5 meses | TICBD |
| TICBD | 3 | Sí | 2 días | ATLD | ||
| 23 | Bronquiectasias | ABD | 3 | Sí | 15,4 meses | ABD |
| 24 | Cáncer | TICBD; ABI | 2 | No | 5,6 meses | TBB |
| 25 | EPOC | TICB | 1 | No | 3,9 semanas | TICB |
| 26 | Idiopática | TICBD | 1 | No | 2,4 semanas | TBB |
| 27 | Cáncer | TICBD | 2 | No | 4,7 semanas | ATLD |
| ATLD | 2 | Sí | 15,5 meses | TICBD | ||
| TICBD | 1 | No | 2,9 semanas | AMID | ||
| 28 | Aspergilosis | ABD | 1 | No | 2,2 años | ABD |
| ABD | 1 | No | 2 meses | ABD | ||
| 29 | TB activa | TICBD; ABI | 3 | No | 2 días | AICI |
| 30 | TB activa | TICBD; ABI | 3 | No | 4 días | AMII |
| 31 | Bronquiectasias | ABI | 2 | No | 3,4 meses | ABI |
ABD: arteria bronquial derecha; ABI: arteria bronquial izquierda; AICD: arteria intercostal derecha; AICI: arteria intercostal izquierda; AMID: arteria mamaria interna derecha; AMII: arteria mamaria interna izquierda; AP: arteria pulmonar; ASUBESCAI: arteria subescapular izquierda; ATLD: arteria torácica lateral derecha; ATLI: arteria torácica lateral izquierda; EAB: embolización arterial bronquial; EPOC: enfermedad pulmonar obstructiva crónica; TB: tuberculosis; TBB: tronco bibronquial; TBBD: tronco bibronquial derecho; TBBI: tronco bibronquial izquierdo; TICB: tronco intercostobronquial; TICBD: tronco intercostobronquial derecho; TICBI: tronco intercostobronquial izquierdo.
La función de supervivencia (sin recidiva) de los pacientes a lo largo del seguimiento puede verse en la figura 1. La probabilidad de sobrevivir libre de recidiva al mes de seguimiento fue de 0,91 (IC95%: 0,87 a 0,95). A los 12meses esta probabilidad fue de 0,85 (IC95%: 0,79 a 0,91). La probabilidad de sobrevivir libre de recidiva a los 3años de seguimiento fue de 0,75 (IC95%: 0,66 a 0,83).
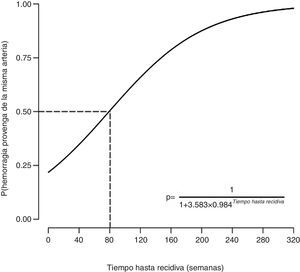
La probabilidad de que la recurrencia fuera debida a recanalización (es decir, que se debiera a una afectación de la misma arteria) dependía del tiempo hasta la recurrencia (estimado=0,0157, valor de z=2,41, valor de p=0,016). Específicamente, un mayor tiempo hasta la recurrencia se asociaba con una mayor probabilidad de que la hemorragia proviniera de la misma arteria ya embolizada previamente (fig. 2). Se encontró que cuando había una recidiva de la hemoptisis antes de las 80semanas, la probabilidad de que el sangrado procediera de una arteria no embolizada anteriormente era superior al 50%. Cuando la recidiva ocurría a partir de las 80semanas, la probabilidad de que el sangrado procediera de una arteria no embolizada previamente era inferior al 50%.
La utilización de coils o el número de arterias embolizadas no mostraron asociación significativa con los hallazgos angiográficos (p=0,268-0,846).
DiscusiónEste trabajo describe la experiencia de un hospital terciario universitario en el tratamiento de la hemoptisis amenazante mediante EA. Nuestros datos demuestran que la recidiva de la hemoptisis debida a recanalización se asocia con el tiempo hasta la recurrencia, y no con el uso de coils o el número de arterias embolizadas. De acuerdo con este modelo, la recidiva de la hemoptisis en las primeras 80semanas tras la EA sería debida a una embolización incompleta, mientras que la recurrencia pasadas 80semanas sería mayoritariamente secundaria a recanalización.
Entre las causas descritas de recidiva se incluye la progresión de la enfermedad subyacente, la recanalización o revascularización, la embolización incompleta y la aparición de una nueva circulación procedente de colaterales sistémicas. El resangrado precoz se ha relacionado con una embolización incompleta, mientras que el tardío se debe generalmente a la progresión de la enfermedad2,12,14,17,19,20. Así, nuestro estudio confirma los hallazgos de estos otros grupos, que incluyen menos casos de recidivas, y añade el límite de las 80semanas. Este límite de 80semanas podría ser importante para guiar al angiorradiólogo en caso de realizar una EA en un paciente con recidiva. Si bien es cierto que es absolutamente recomendable revisar todos los territorios vasculares susceptibles de estar sangrando, consideramos que este dato podría orientar al angiorradiólogo a revisar inicialmente un territorio vascular en concreto. Esta información sería especialmente útil en pacientes en situación de riesgo vital debido a la hemoptisis, ya que ayudaría a priorizar qué arterias deben estudiarse en primer lugar. En segundo lugar, el conocimiento del lugar de sangrado podría ayudar a reducir la dosis de radiación, el tiempo operatorio y el volumen de contraste necesario para realizar el procedimiento27.
La etiología de la hemoptisis se ha asociado con la tasa de recurrencia tras embolización arterial13,14,20. Así pues, la hemoptisis debida a neoplasia presenta mayores tasas de recurrencia, tanto a corto como a largo plazo14,20. No obstante, algún grupo ha descrito unos resultados inmediatos razonablemente buenos en pacientes neoplásicos23.
Diversos estudios han investigado la probabilidad de recidiva en relación con el procedimiento. Kim et al.21 también compararon los resultados de las embolizaciones en función del material utilizado, y no encontraron diferencias estadísticamente significativas en el uso de gelfoam, coils, o ambos, entre pacientes con o sin recidiva. Mal et al.17 analizaron los resultados de la EA en función del radiólogo intervencionista, o por el material utilizado para la embolización. Brinson et al.16 describieron que, en caso de recidiva, la incidencia de sangrado procedente de vasos colaterales sistémicos no bronquiales era mayor que en la primera embolización (75% vs 8%). Esto también ocurre en nuestro estudio, aunque sin tanta disparidad (42% vs 29%). Otros autores han analizado la relación entre los hallazgos angiográficos (grado de vascularización) durante la embolización, y los resultados de esta, sin diferencias significativas13,18,19.
Hubo recidiva en el 17,6% de nuestros pacientes. La causa más frecuente de hemoptisis fueron las bronquiectasias, seguidas de la EPOC, la tuberculosis activa y el micetoma. Entre los pacientes que presentaron recidiva de la hemoptisis, en el 37,5% la hemoptisis fue debida a bronquiectasias, en el 25% a enfermedad neoplásica, y en el 18,8% a EPOC. Al comparar nuestros hallazgos con series previas en nuestro país9,10, encontramos alguna diferencia. En primer lugar, nuestro porcentaje de recidivas (17,6%) es mayor que en el trabajo de Orriols et al.10, pero parecido al de De Gregorio et al.9. Las etiologías más frecuentemente asociadas con recidiva del sangrado en el trabajo de Orriols et al.10 fueron la neoplasia y el micetoma, lo cual coincide en parte con los hallazgos en nuestra serie. En otras series11-18, los hallazgos son parecidos. Estos grupos coinciden en afirmar que la probabilidad de recurrencia es elevada, oscilando entre el 9,2511 y el 50%18. El aspergiloma está asociado con mal pronóstico tanto en lo que respecta a la probabilidad de recidiva21-23 como a la mortalidad23.
En nuestro estudio el 75% de las recidivas ocurrieron antes de las 80semanas, y el 61,4% de las arterias embolizadas en el segundo procedimiento fueron distintas a las embolizadas inicialmente. Esto ocurrió cuando la embolización de los vasos afectados no es completa, bien por la naturaleza infiltrativa de la enfermedad, o bien porque no se localizaron todas las arterias afectadas. Si se conoce el sitio de sangrado, todas las arterias bronquiales anómalas de la región deberían ser embolizadas. Si no se conoce el sitio de sangrado, todas las arterias bronquiales deberían tratarse. Si no se detectan arterias bronquiales anómalas, se debe realizar una búsqueda exhaustiva de arterias bronquiales aberrantes y arterias sistémicas no bronquiales. No tratar todas las arterias afectadas aumenta el número de procedimientos necesarios para resolver el sangrado28, como ocurre en nuestra serie. Cuando existe recurrencia, la tasa de mortalidad aumenta22. Por lo tanto, es imprescindible realizar una embolización completa, así como tratar la causa para evitar recidiva secundaria a la progresión de la enfermedad.
En nuestra serie la mortalidad fue del 12,5%. De los pacientes que fallecieron, en el 59,1% la etiología del sangrado era neoplásica. La mortalidad en el trabajo de Orriols et al.10 fue del 12,3%, parecida a la nuestra, y en el trabajo de De Gregorio et al.9 la mortalidad a los 3días fue del 1,7%, claramente inferior a los 2otros trabajos.
La principal limitación de nuestro estudio es que se trata de un análisis retrospectivo de los pacientes de un único centro, lo cual hace difícil la generalización de los resultados. Además, no ha sido posible obtener el volumen ni la duración del sangrado en todos los pacientes, por lo que es un dato importante que no ha sido incluido en el análisis. Sin embargo, dentro de las fortalezas del estudio está el hecho de que todos los pacientes han realizado seguimiento clínico en nuestro centro tras el episodio de embolización, con lo cual no ha habido nuevos episodios de sangrado ni EA que no hayan sido incluidos en el presente estudio.
En resumen, la EA es una técnica efectiva en el tratamiento de la hemoptisis amenazante, pero las recidivas no son infrecuentes. La recidiva de la hemoptisis por recanalización de la arteria embolizada está relacionada con el periodo de tiempo transcurrido hasta la recidiva, pero no con el uso de coils ni con el número de arterias embolizadas.
Contribución de cada uno de los autoresDiseño del estudio: IGO, JRM.
Recogida de datos clínicos: CC, JSS, FA, ZS.
Revisión angiografías: JS, JM, JMM.
Análisis estadístico: IGO, JR.
Lectura crítica del manuscrito: IGO, JSS, CC, JR, FA, JS, JM, JMM, ZS, JRM.
Conflicto de interesesLos autores declaran no tener ninguna relación económica o personal con personas u organizaciones que puedan afectar de forma inapropiada su trabajo en el presente artículo.