La sepsis grave se acompaña en un alto porcentaje de casos de insuficiencia respiratoria aguda, donde la debilidad de los músculos respiratorios desempeña un papel importante. Los músculos respiratorios debilitados y sometidos a una carga mecánica aumentada pueden evolucionar a fatiga muscular con agravamiento de la insuficiencia respiratoria. Los fármacos adrenérgicos β2, al mejorar la fuerza de contracción muscular, podrían ser de utilidad en la prevención y el manejo de la insuficiencia respiratoria de pacientes con sepsis. El objetivo de este trabajo ha sido estudiar los efectos del salbutamol en la función diafragmática en un modelo animal de sepsis peritoneal.
Material y métodosSe estudiaron 3 grupos de animales: a) grupo control (n=7), al que se realizó laparotomía mediana sin abordaje visceral; b) grupo sepsis (n=10), al que se indujo sepsis peritoneal por ligadura y punción cecal (LPC), y c) grupo salbutamol (n=7), en el que la sepsis peritoneal se trató con salbutamol (LPC + salbutamol). Los parámetros hemodinámicos y los gases sanguíneos se midieron in vivo. La función diafragmática se evaluó in vitro.
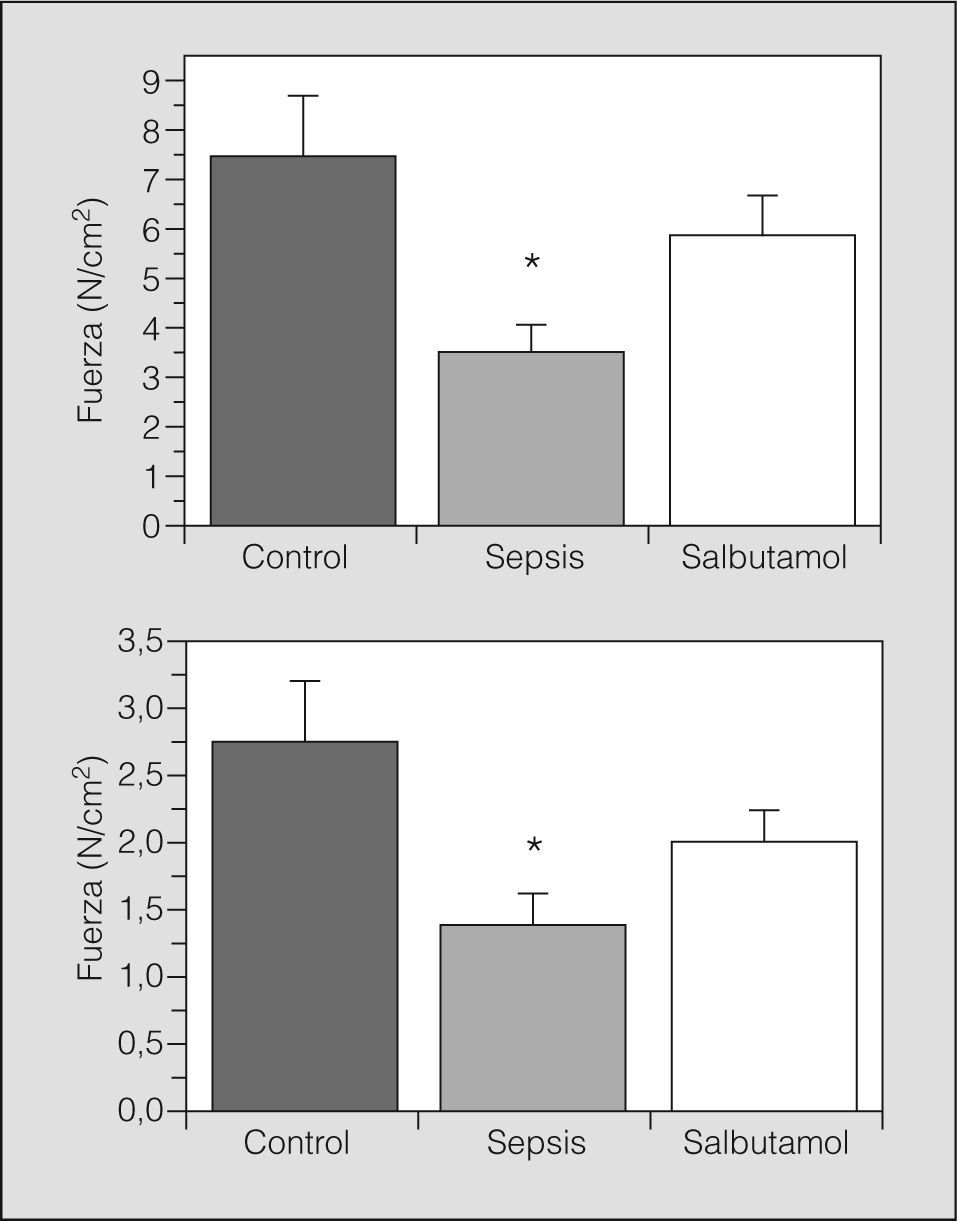
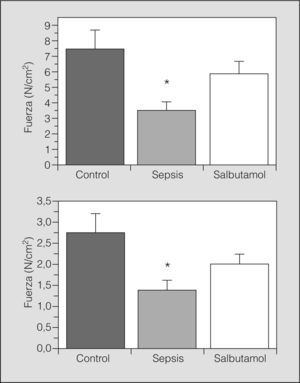
ResultadosEl salbutamol aumentó el flujo aórtico y la frecuencia cardíaca a la vez que disminuyó la presión arterial media en la sepsis peritoneal (p<0,05). La sepsis determinó una caída significativa de la fuerza diafragmática tanto antes como después de un protocolo de fatiga muscular. El tratamiento con salbutamol mejoró la fuerza de contracción muscular en ambos casos (p<0,05).
ConclusionesEl uso de agentes adrenérgicos β2 como el salbutamol mejora la función diafragmática durante la sepsis experimental. Los mecanismos de esta mejoría deben estudiarse en mayor profundidad.
In a high percentage of cases, severe sepsis is accompanied by acute respiratory failure, in which weakness of the respiratory muscles plays an important role. Weakened respiratory muscles that are subjected to an increased mechanical load may develop muscle fatigue, with exacerbation of the respiratory failure. Because β2-adrenergic drugs increase muscle contraction force, they may play a role in preventing and managing respiratory failure in septic patients. Our aim was to study the effects of salbutamol on diaphragm function in an animal model of peritoneal sepsis.
Material and methodsThe study included 3 groups of animals: a) a control group (n=7), in which the animals underwent a median laparotomy without visceral manipulation; b) a septic group (n=10), in which peritoneal sepsis was induced by cecal ligation and puncture (CLP); and c) a salbutamol group (n=7), in which peritoneal sepsis (CLP) was treated with salbutamol. Hemodynamic parameters and blood gases were measured in vivo. Diaphragm function was evaluated in vitro.
ResultsSalbutamol increased aortic blood flow and heart rate while it reduced mean arterial pressure in the animals with peritoneal sepsis (P<.05). Sepsis produced a significant drop in diaphragmatic force both before and after the application of a muscle-fatigue protocol. Treatment with salbutamol improved muscle contraction force before and after application of the protocol (P<.05).
ConclusionsThe use of β2-adrenergic drugs such as salbutamol improves diaphragm function in experimental sepsis. The mechanisms that produce this improvement require further study.
La sepsis grave continúa siendo una de las principales causas de muerte en la población de pacientes críticos1. En un alto porcentaje de los casos se acompaña de insuficiencia respiratoria aguda, con grados variables de alteración del intercambio gaseoso en los pulmones por lesión pulmonar aguda/síndrome de distrés respiratorio agudo. El edema pulmonar determina importantes cambios en la mecánica respiratoria, con disminución de la capacidad residual funcional y de la distensibilidad pulmonar, que aumenta el trabajo de los músculos respiratorios y puede conducir a fatiga muscular2. Estas situaciones se ven agravadas por debilidad muscular, que se manifiesta por disminución de la fuerza de contracción de los músculos respiratorios. Se ha demostrado de diversas maneras la depresión de la función muscular durante la sepsis. Así, la debilidad muscular disminuye la resistencia a la fatiga y contribuye a agravar la insuficiencia respiratoria. En tanto no mejore el cuadro séptico, los pacientes podrán requerir ventilación mecánica para mantener la función de intercambio gaseoso y poner en reposo los músculos respiratorios3. Se han discutido las causas que determinan esta disfunción, que se ha atribuido a mecanismos similares a los que provocan las demás insuficiencias orgánicas.
Algunos investigadores han evidenciado que los agonistas adrenérgicos β2 mejoran la fuerza de los músculos respiratorios4-8. Puede conjeturarse que una mejor función muscular podría ayudar a mantener la ventilación espontánea en los cuadros sépticos en que la función de bomba muscular está amenazada. Además, una intervención farmacológica de este tipo podría contribuir a preservar o restablecer las fuerzas musculares, con vistas a acortar los tiempos de ventilación mecánica o a facilitar su retirada.
El objetivo de este trabajo ha sido estudiar los efectos del tratamiento con salbutamol, administrado tanto in vivo como in vitro, sobre la función diafragmática en un modelo animal de sepsis peritoneal.
Material y métodosEl protocolo experimental se condujo de acuerdo con las recomendaciones de la Comisión Honoraria de Experimentación Animal de la Universidad de la República. Se estudiaron ratas Wistar Kyoto con un peso de 300–400g. Se anestesió a los animales con pentobarbital sódico a dosis de 50mg/kg por vía intraperitoneal. La sepsis se indujo por la técnica de ligadura y punción cecal (LPC)9. Brevemente, se exterioriza el ciego a través de una laparotomía mediana y se liga distalmente respecto a la válvula ileocecal. Luego el ciego se punciona 2 veces con una aguja (16 gauge), presionando suavemente hasta exteriorizar el contenido fecal. Por último se reintroduce el intestino en la cavidad peritoneal y se sutura la pared abdominal en 2 planos. En el postoperatorio inmediato se inyecta solución salina a razón de 3ml/100g de peso por vía subcutánea, como medida de soporte hemodinámico inicial y para cubrir posibles pérdidas de volumen durante el tiempo quirúrgico. Se deja despertar a los animales en jaulas individuales con agua y comida ad líbitum durante 48h.
Los animales se asignaron de forma aleatorizada a uno de los 3 grupos siguientes:
- 1.
Grupo control (n=7). Se realizó únicamente laparotomía y exploración del ciego.
- 2.
Grupo sepsis (n=10). Se realizó laparotomía seguida de LPC según se ha descrito.
- 3.
Grupo salbutamol (n=7). En estos casos, además de la LPC, se realizó tratamiento con salbutamol, que se administró por vía intravenosa a las 48h de evolución del cuadro séptico, a dosis de 25μg/kg, después de la instrumentación invasiva.
Para poder efectuar la evaluación final, se anestesió nuevamente a las ratas con pentobarbital, seguido de traqueostomía con anestesia local (xilocaína al 1%, vía subcutánea). Para permitir la respiración espontánea se colocó una cánula traqueal conectada a un tubo en T con aporte suplementario de oxígeno. La vena cava superior se cateterizó a través de la vena yugular. Se colocó otro catéter en la arteria femoral para el seguimiento hemodinámico y la obtención de muestras de sangre arterial. En todos los casos se midieron la frecuencia cardíaca y la presión arterial media con un monitor hemodinámico (Nihon Kodhen, Life Scope 8, Tokio, Japón). Para medir el flujo aórtico se colocó un sensor ultrasónico de flujo alrededor de la aorta abdominal, tras disección cuidadosa, por encima de la arteria renal izquierda (Transonic Systems Inc., T206, Ithaca, NY, EE.UU.). Todas estas medidas se efectuaron tras un período de estabilización de 20–30min una vez terminados los abordajes vasculares. La impedancia aórtica se calculó como el cociente de presión arterial sistólica/flujo aórtico (mmHg/ml/s). Se obtuvieron muestras de sangre arterial para análisis de gases sanguíneos (ABL 520 Radiometer Copenhagen, Brønshøj, Copenhague, Dinamarca). Finalmente, los animales se sacrificaron con una sobredosis de pentobarbital.
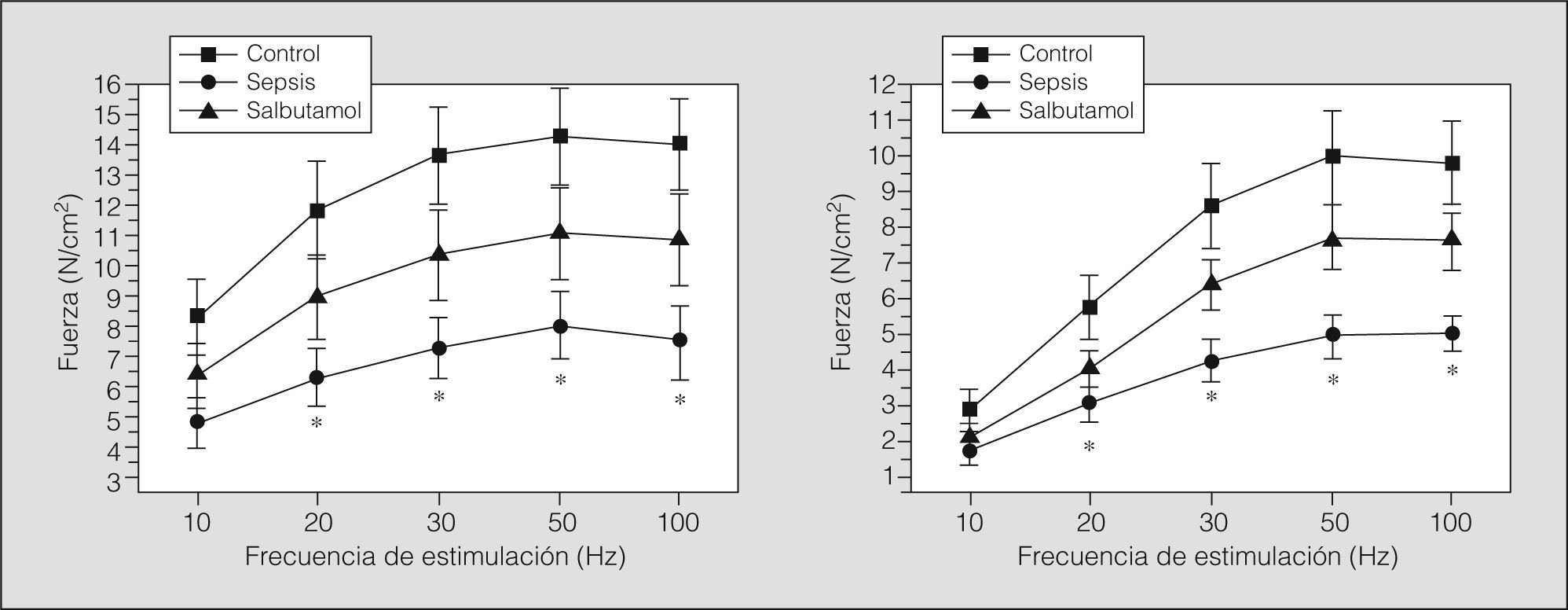
Para estudiar las propiedades mecánicas del diafragma, inmediatamente después de sacrificar a los animales se extrajo el hemidiafragma izquierdo, del que se cortaron bandas de tejido muscular, que se fijaron en una cámara de vidrio. El diafragma se perfundió con solución de Krebs en la que se burbujeaba una mezcla gaseosa de oxígeno al 95% y anhídrido carbónico al 5%, mientras la temperatura β7 °C) y el pH (7,40) se mantenían constantes (Myobath, World Precision Instruments Inc., Sarasota, FL, EE.UU.). En los animales del grupo salbutamol se agregó salbutamol al baño de suspensión hasta obtener una concentración aproximada de 20μg/l. Las bandas diafragmáticas se fijaron por uno de sus extremos a un transductor de fuerza (Fort 100, World Precision Instruments Inc., Sarasota, FL, EE.UU.) y se estimularon eléctricamente con electrodos de platino (Somatosensory Stimulator, S10DSLMA, Grass Instruments Co., Quincy, MA, EE.UU.). La función contráctil se evaluó por medio de la medida del pico de tensión máxima desarrollada (PTM) y por el estudio de las características de la curva fuerza-frecuencia. Estos parámetros se registraron con un sistema de adquisición de datos (CVMS Data Acquisition System, World Precision Instruments Inc., Sarasota, FL, EE.UU.). Las curvas fuerza-frecuencia se obtuvieron por una secuencia de estímulos de 1s de duración con trenes de 10; 20; 30; 50, y 100Hz. Se hicieron curvas fuerzafrecuencia antes y después de aplicar un protocolo de fatiga muscular. Se asumió la presencia de fatiga diafragmática cuando la fuerza desarrollada por el músculo disminuyó a un 50% del valor inicial por efectos de un tren de estímulos supramáximos a una frecuencia de 20Hz. El PTM -expresado en newtons/centímetros cuadrado (N/cm2)- se midió como la respuesta a un estímulo único, antes y después de la inducción de fatiga muscular. Las medidas de las fuerzas musculares se indexaron por área de sección transversal de las bandas musculares y se expresan en N/cm2.
Análisis estadísticoTodas las variables analizadas mostraron una distribución normal. Los valores de cada parámetro de la población se expresaron como media±error estándar. Las diferencias entre los grupos se determinaron por medio de análisis de la variancia para comparaciones múltiples. El análisis post hoc se realizó por el test de Scheffé. Los valores de p<0,05 se consideraron estadísticamente significativos. El análisis estadístico se realizó utilizando el programa informático SPSS versión 12.0.1.
ResultadosDurante la reintervención abdominal se documentaron los hallazgos macroscópicos de la cavidad peritoneal. Los animales de ambos grupos sépticos (grupo sepsis y grupo salbutamol) presentaron una cantidad moderada de exudado purulento, sin observarse diferencias de significación entre ambos. El grupo control no mostró elementos de actividad inflamatoria en la región peritoneal.
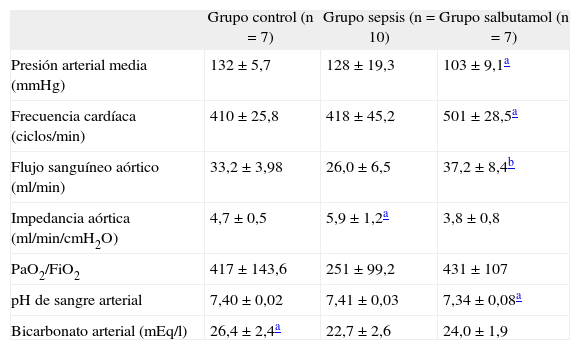
Parámetros fisiológicosEn la tabla I se resumen los valores medios±error estándar de los principales parámetros hemodinámicos y de los gases sanguíneos. El grupo sepsis presentó una impedancia aórtica significativamente más elevada que los otros grupos (p<0,05). La relación presión parcial de oxígeno arterial/fracción inspiratoria de oxígeno tendió a disminuir en el grupo sepsis, aunque este descenso careció de significación estadística. Desde el punto de vista metabólico, el bicarbonato arterial fue significativamente menor tanto en el grupo sepsis como en el grupo salbutamol cuando se los comparó con el grupo control (p<0,05). En el grupo salbutamol la presión arterial media fue significativamente menor y la frecuencia cardíaca significativamente mayor, cuando se compararon ambos parámetros con los de los otros grupos (p<0,05). El flujo aórtico fue significativamente mayor en el grupo salbutamol respecto al grupo sepsis (p<0,05).
Variables fisiológicas en los grupos de estudio
| Grupo control (n=7) | Grupo sepsis (n=10) | Grupo salbutamol (n=7) | |
| Presión arterial media (mmHg) | 132 ±5,7 | 128±19,3 | 103±9,1a |
| Frecuencia cardíaca (ciclos/min) | 410 ±25,8 | 418 ±45,2 | 501±28,5a |
| Flujo sanguíneo aórtico (ml/min) | 33,2 ±3,98 | 26,0 ±6,5 | 37,2±8,4b |
| Impedancia aórtica (ml/min/cmH2O) | 4,7 ±0,5 | 5,9±1,2a | 3,8 ±0,8 |
| PaO2/FiO2 | 417 ±143,6 | 251 ±99,2 | 431±107 |
| pH de sangre arterial | 7,40±0,02 | 7,41 ±0,03 | 7,34±0,08a |
| Bicarbonato arterial (mEq/l) | 26,4±2,4a | 22,7±2,6 | 24,0 ±1,9 |
Valores expresados en media±error estándar.
PaO2/FiO2: índice presión parcial de oxígeno/fracción inspiratoria de oxígeno.
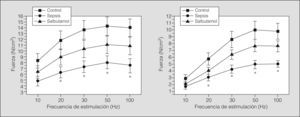
En la figura 1 se muestra el PTM en los 3 grupos estudiados, antes y después del tren de fatiga muscular. La fuerza diafragmática desarrollada fue significativamente menor en el grupo sepsis cuando se comparó con los demás grupos (p<0,05). En el grupo salbutamol los valores de PTM fueron comparables con los del grupo control. Las curvas fuerza-frecuencia antes y después de la fatiga diafragmática se muestran en la figura 2. La curva se encontró significativamente descendida en los animales del grupo sepsis (p<0,05), mientras que la curva del grupo salbutamol no fue significativamente distinta de la del grupo control.
La administración de salbutamol determinó cambios hemodinámicos característicos, vinculados a estímulos de receptores β2, al tiempo que se demostró una franca mejoría de la función muscular tanto antes como después de la fatiga muscular en nuestro modelo de sepsis experimental.
Los efectos de los fármacos con acción adrenérgica β2 sobre las fuerzas musculares se han estudiado en diferentes situaciones o contextos clínicos y experimentales. El salbutamol incrementa la fuerza diafragmática in vitro6,7. La administración oral de salbutamol en atletas determinó una mayor resistencia muscular a la fatiga10. Otros agonistas betaadrenérgicos como el isoproterenol4 y la terbutalina8 mejoran la contractilidad diafragmática en la sepsis peritoneal.
En nuestro modelo experimental hemos encontrado, al igual que otros investigadores, que la sepsis peritoneal compromete gravemente la función diafragmática. En la génesis de esta alteración se ha implicado a las especies reactivas derivadas del oxígeno y del nitrógeno, a la disfunción mitocondrial y a la afectación de los mecanismos intracelulares de producción de energía, así como al complejo ubicuitina-proteasoma11-17. Los cambios hemodinámicos inducidos por el salbutamol fueron evidentes en el actual modelo dado que su administración sistémica aumentó la frecuencia cardíaca y el flujo aórtico, al tiempo que disminuyó la presión arterial media y la impedancia aórtica. Estos cambios ponen de manifiesto sus efectos inotrópicos y cronotrópicos sobre el miocardio y sus efectos vasodilatadores sobre la circulación sistémica. Al mismo tiempo, se observó una mejoría del estado funcional del diafragma, medido tanto por aumento del PTM como de las curvas fuerza-frecuencia. En el grupo sepsis, desde el punto de vista sistémico, la tendencia al descenso de la presión arterial, del flujo aórtico y de la oxigenación arterial careció de significación estadística. De esta manera, estos cambios difícilmente podrían explicar la depresión de la fuerza muscular diafragmática encontrada en dicho grupo. Por otra parte, el salbutamol por vía sistémica mejoró significativamente el flujo aórtico y la oxigenación arterial. Probablemente el aporte sistémico de oxígeno se vio favorecido por la intervención farmacológica, aunque ello no asegura que al mismo tiempo se produjera una mejora de la perfusión y oxigenación tisulares en el diafragma. Dado el diseño experimental, no podemos establecer si la mejoría de la fuerza muscular fue producto de los cambios cardiovasculares inducidos por el fármaco o de sus efectos directos sobre el tejido muscular. Si bien hubo una asociación entre la mejoría hemodinámica y de la fuerza diafragmática, deben estudiarse otros posibles mecanismos.
Se ha descrito un efecto ergogénico de los adrenérgicos P2 sobre el músculo esquelético, provocando un aumento de la síntesis y una disminución del catabolismo proteico5,10 e hipertrofia de las fibras diafragmáticas18,19. El clembuterol restaura la pérdida de fuerza y masa muscular diafragmática que se asocia al envejecimiento20 y al tratamiento con glucocorticoides21. Otros autores han planteado que el efecto inotrópico del salbutamol está mediado por una elevación del adenosinmonofosfato cíclico y de la liberación de calcio del retículo sarcoplásmico6,7.
Hay numerosos estudios, tanto in vitro como in vivo, que han comprobado que el estrés oxidativo y nitrosativo ejercen importantes efectos sobre la contractilidad diafragmática. Supinski et al22 demostraron que la administración in vivo de atrapadores de radicales libres reduce la fatiga diafragmática a bajas frecuencias. En el mismo sentido, Barreiro et al14 han demostrado que se puede prevenir el daño estructural y funcional diafragmático que se observa en la sepsis con intervenciones orientadas a prevenir el estrés oxidativo y nitrosativo.
El salbutamol fue capaz de atenuar la depresión de la contractilidad antes y después de la fatiga diafragmática in vitro. Efectos similares a éstos se han observado al utilizar un atrapador de especies activas derivadas del oxígeno12. Dado que los agonistas β2 mejoran la contractilidad diafragmática al igual que los atrapadores de las especies reactivas derivadas del oxígeno y del nitrógeno, podría conjeturarse que estos fármacos comparten alguna vía metabólica común. De hecho, en la literatura médica ya se ha señalado la actividad antioxidante de los fármacos agonistas adrenérgicos23-25. También se ha comprobado un efecto inhibitorio sobre la producción de especies reactivas derivadas del oxígeno por parte de células inflamatorias mediado por el receptor β226.
Si bien el mecanismo por el cual los agonistas adrenérgicos β2 intervienen en el equilibrio del metabolismo proteico no se conoce del todo, hay evidencias de que pueden inhibir la vía del complejo ubicuitina-proteasoma, responsable de la degradación de proteínas musculares27,28. Finalmente, el efecto de los agonistas adrenérgicos P2 sobre la respuesta inflamatoria puede ser otro de los mecanismos implicados en los resultados obtenidos. En este sentido, estos fármacos disminuyen la producción de citocinas proinflamatorias como el factor de necrosis tumoral alfa y la interleucina-18 inducida por la sepsis29,30.
Los efectos antioxidantes y antiinflamatorios de los agonistas adrenérgicos β2, así como su capacidad de inhibir la proteólisis muscular a través de una acción sobre la vía del complejo ubicuitina-proteasoma, deben seguir investigándose.
En resumen, hemos puesto en evidencia que el salbutamol mejora la contractilidad diafragmática in vitro durante la sepsis peritoneal. Si bien esta mejoría de la función muscular está asociada a cambios hemodinámicos y de la oxigenación arterial, no podemos asegurar que ello haya provocado una mejora de la oxigenación tisular. Los mecanismos implicados en estos cambios funcionales deben estudiarse con mayor profundidad.