La relación existente entre la presencia de inflamación sistémica y los diferentes parámetros de gravedad en pacientes con bronquiectasias no ha sido descrita. El objetivo del estudio ha sido analizar la relación entre las concentraciones plasmáticas de factor de necrosis tumoral alfa (pTNF-α), como marcador de inflamación sistémica, y algunos criterios de gravedad comúnmente utilizados en pacientes con bronquiectasias, en fase de estabilidad clínica, no debidas a fibrosis quística.
Pacientes y métodosSe incluyó en el estudio a 68 pacientes con bronquiectasias clínicamente estables y 19 controles sanos ajustados según edad y sexo. Se recogieron datos referentes a antecedentes patológicos, síntomas, extensión, variables funcionales, volumen de esputo y aspectos microbiológicos, analíticos y evolutivos. Las concentraciones de pTNF-α se analizaron utilizando un método de enzimoinmunoanálisis de alta resolución.
ResultadosSe observó una mayor concentración de pTNF-α en los pacientes que en los controles (8,28 frente a 5,67pg/ml; p=0,001), que se correlacionó con otros parámetros de inflamación sistémica como la velocidad de sedimentación globular (r=0,42; p=0,001), la proteína C reactiva (r=0,45; p=0,001) y el porcentaje de neutrófilos periféricos (r=0,45; p=0,001). Los pacientes con concentraciones elevadas de pTNF-α (> 8,1pg/dl) presentaron mayor extensión de la enfermedad (5,19 frente a 3,21; p=0,001), mayor probabilidad de presentar insuficiencia respiratoria (el 37,5 frente al 8,3%; p=0,003) y mayor porcentaje de colonizaciones por Pseudomonas aeruginosa (el 34,3 frente al 8,3%; p=0,008).
ConclusionesLas concentraciones elevadas de pTNF-α se asocian a varios parámetros comúnmente utilizados para valorar la gravedad en pacientes con bronquiectasias clínicamente estables y no debidas a fibrosis quística.
The relationship between systemic inflammation and different measures of bronchiectasis severity has not been described. The objective of this study was to analyze the relationship between plasma concentrations of tumor necrosis factor α (TNF-α), as a marker of systemic inflammation, and some commonly used criteria for quantifying bronchiectasis severity in clinically stable patients whose disease was not caused by cystic fibrosis.
Patients and methodsSixty-eight clinically stable patients with bronchiectasis and 19 age- and sex-matched healthy control subjects were included in the study. Data on disease history, symptoms, severity, functional variables, sputum volume, and microbiological cultures, laboratory findings, and other indicators of disease course were collected. Plasma concentrations of TNF-α were measured using high-resolution enzyme-linked immunoabsorbent assay.
ResultsPlasma concentrations of TNF-α were higher in patients than controls (8.28 vs 5.67pg/mL; P=.001). This observation correlated with other markers of systemic inflammation such as erythrocyte sedimentation rate (r=0.42; P=.001), Creactive protein (ρ=0.45; P=.001), and percentage of peripheral blood neutrophils (ρ=0.45; P=.001). Patients with high plasma concentrations of TNF-α (>8.1pg/dL) had more severe disease (5.19 vs 3.21; P=.001), were more likely to have respiratory failure (37.5% vs 8.3%; P=.003), and a higher rate of Pseudomonas aeruginosa colonization (34.3% vs8.3%;P=.008).
ConclusionsHigh plasma concentrations of TNF-α were associated with several criteria usually used to assess severity of bronchiectasis in clinically stable patients with disease not caused by cystic fibrosis.
Las bronquiectasias suelen describirse como una enfermedad pulmonar crónica que se caracteriza por la dilatación bronquial irreversible, consecuencia del círculo vicioso patogénico compuesto por la alteración del sistema de aclaramiento mucociliar, la inflamación y la infección de la mucosa bronquial.1 Los pacientes afectados suelen presentar una producción crónica de esputo generalmente de aspecto purulento, múltiples agudizaciones y un patrón ventilatorio obstructivo con poca respuesta a los broncodilatadores. En fases finales de la enfermedad la disnea progresiva domina el cuadro clínico deteriorando de forma importante la calidad de vida de los pacientes2,3.
La inflamación bronquial presente en las bronquiectasias es fundamentalmente mononuclear y neutrofílica4,5. Se han documentado altas concentraciones de algunas citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) y las interleucinas (IL) 6 y 8 tanto en el esputo6,7 como en el lavado broncoalveolar de pacientes con bronquiectasias8,9. Aunque se acepta que la respuesta inflamatoria en las bronquiectasias está compartimentalizada en el pulmón8,9, algunos estudios han observado un incremento significativo de la concentración periférica de algunos marcadores de inflamación sistémica, como reactantes de fase aguda o mediadores inflamatorios, incluso en fases de estabilidad clínica8,10. Se ha postulado que la presencia de inflamación sistémica existente en algunas enfermedades pulmonares podría ser el resultado de un "desbordamiento" de marcadores inflamatorios locales en pacientes con un mayor grado de inflamación bronquial o pulmonar, lo que ha llevado a algunos autores a plantear que el compartimiento periférico podría reflejar de manera fidedigna las formas más graves de estas enfermedades11-13.
El TNF-α es una citocina proinflamatoria sintetizada y secretada por monocitos y macrófagos14. Posee diversas propiedades, como la de ser quimioatrayente para neutrófilos al lugar de inflamación o la de incrementar la expresión de otras quimiocinas con función similar como la IL-815. Se reconoce ampliamente que el TNF-α es un mediador fundamental en la cascada inflamatoria de diversas enfermedades pulmonares y que es capaz de marcar la progresión o el pronóstico de algunas de ellas16, como la neumonía11,12 o la fibrosis quística (FQ)13. No existe un único marcador de gravedad en las bronquiectasias, por lo que se han utilizado diversos criterios clínicos, funcionales o de extensión17,18. La relación entre la gravedad y el perfil de citocinas inflamatorias circulantes no se ha establecido en pacientes con bronquiectasias.
El objetivo del presente estudio ha sido analizar la relación existente entre las concentraciones plasmáticas de TNF-α (pTNF-α), como marcador de inflamación sistémica, y diversos criterios de gravedad habitualmente utilizados en un amplio grupo de pacientes afectados de bronquiectasias, no debidas a FQ, en fase de estabilidad clínica.
Pacientes y métodosPoblación de estudioInicialmente se incluyó en el estudio a todos los pacientes diagnosticados en nuestro centro de bronquiectasias, no debidas a FQ, extendidas en más de un lóbulo pulmonar, o de bronquiectasias quísticas independientemente de su extensión. Fueron criterios de inclusión: pacientes clínicamente estables, es decir, fuera de un período de agudización durante al menos 4 semanas desde el inicio del estudio, y con hábito tabáquico pasado inferior a 10 paquetes-año. Los criterios de exclusión fueron los siguientes: pacientes con bronquiectasias por tracción debidas a fibrosis avanzada, tabaquismo activo, pacientes con antecedentes de alguna enfermedad, además de las bronquiectasias, capaz de hacer variar de forma sustancial los valores de pTNF-α, como insuficiencia renal, enfermedades tumorales, infecciones activas, insuficiencia cardíaca u otras enfermedades inflamatorias sistémicas; pacientes con asma, definida según los criterios de la Global Initiative for Asthma (GINA)19; pacientes incapaces de seguir con el protocolo del estudio por presentar algún tipo de déficit físico o psíquico importante, y pacientes en tratamiento crónico con inmunodepresores o corticoides orales. Veintitrés pacientes (33,8%) estaban recibiendo tratamiento con corticoides inhalados (dosis de 500-1.000μg de fluticasona al día o dosis equivalentes de budesonida). Ningún paciente estaba recibiendo tratamiento crónico con macrólidos.
El grupo control estaba compuesto por 19 voluntarios sanos, cuya distribución por edad y sexo no fue estadísticamente diferente de la de los pacientes. Consideramos controles sanos a los individuos sin antecedentes patológicos de interés, que nunca habían fumado, sin clínica respiratoria, sin tratamiento broncodilatador o corticoide y con una espirometría y radiología de tórax sin hallazgos patológicos.
Nuestro comité ético local dio el consentimiento pertinente para la realización del presente estudio y se informó del propósito de éste a todos los pacientes.
Diagnóstico de bronquiectasiasEn todos los casos el diagnóstico de bronquiectasias se estableció mediante la realización de una tomografía axial computarizada de tórax de alta resolución con secciones de 1-1,5mm cada 10mm y posterior reconstrucción digital de la imagen siguiendo los criterios descritos por Naidich et al20. En el caso de que la última tomografía se hubiera realizado más de 24 meses antes del inicio del estudio, se repitió para actualizar la extensión de las bronquiectasias. La extensión y las características radiológicas de las bronquiectasias se valoraron mediante una versión simplificada de la puntuación descrita por Bhalla, ya utilizada por nuestro grupo en otros estudios2,21.
Valoración de la gravedad de las bronquiectasiasNo existe un parámetro único para valorar la gravedad de las bronquiectasias. En el presente estudio consideramos que había un mayor nivel de gravedad en presencia de alguna de las siguientes circunstancias: mayor obstrucción bronquial al flujo aéreo, colonización crónica por Pseudomonas aeruginosa, presencia de insuficiencia respiratoria, mayor extensión pulmonar, peores parámetros de calidad de vida, mayor número de agudizaciones o mayor gravedad de la clínica (mayor disnea o mayor cantidad de esputo producido al día).
Protocolo de estudioAdemás de los datos generales y antropométricos, antecedentes patológicos de interés y hábito tabáquico, los siguientes datos se recogieron el día de la visita médica de forma prospectiva durante el año 2003:
- 1.
Variables clínicas. Se calculó la cantidad media (ml) de esputo producido al día según un procedimiento ya utilizado en otros estudios por nuestro grupo2. La disnea basal se cuantificó según la escala propuesta por el Medical Research Council y modificada por la American Thoracic Society22. Se valoraron los resultados de un diario de síntomas donde los pacientes recogieron el número de días con tos y sibilancias, así como el número de inhalaciones diarias de adrenérgicos β2 a demanda utilizadas en el mes previo a la visita. Se definió tos o sibilancias habituales como la presencia de estos síntomas en más del 50% de los días (valoradas como variables dicotómicas).
- 2.
Calidad de vida relacionada con la salud. Se cuantificó con el St. George's Respiratory Questionnaire validado en español2,3.
- 3.
Variables funcionales. Se determinó la saturación de oxihemoglobina (SaO2) y se realizó una espirometría forzada con medición del volumen espiratorio forzado en el primer segundo (FEV1) y de la capacidad vital forzada (FVC), así como de estos valores 15min después de broncodilatación con 200μg de salbutamol (test broncodilatador). Se definió obstrucción al flujo aéreo como la presencia de un cociente FEV1/FVC menor del 70%, e insuficiencia respiratoria como la presencia de una SaO2 inferior al 90%. Todas las pruebas funcionales fueron realizadas a primera hora de la mañana por personal cualificado.
- 4.
Variables analíticas. Se recogió una muestra de sangre periférica, tanto en pacientes como en controles sanos, entre las 8 y las 10 de la mañana para el recuento de neutrófilos y determinación de la velocidad de sedimentación globular (VSG; mm) en la primera hora, concentración de fibrinógeno (mg/dl), valores séricos de proteína C reactiva (PCR; mg/dl), concentraciones de inmunoglobulina A y G (g/l) y valores plasmáticos de pTNF-α e IL-8 (pg/ml).
- 5.
Agudizaciones. Se recogieron asimismo los datos referentes al número de agudizaciones aparecidas en los 6 meses previos a la visita. La exacerbación se definió como la presencia de al menos 3 síntomas respiratorios (tos, disnea, hemoptisis, aumento del volumen o la purulencia del esputo o dolor torácico), de cuando menos 24h de evolución, independientemente de la presencia de fiebre, alteraciones radiológicas o manifestaciones sistémicas.
- 6.
Variables microbiológicas. Por último, se recogieron 6 pares de esputos en los 6 meses previos a la visita (2 esputos por mes) para su valoración microbiológica, que incluyó tinción de Gram y cultivo en medios estándar o especiales según sospecha de algún microorganismo específico. Se consideró que había colonización crónica por P. aeruginosa cuando en esputos válidos (< 10 células epiteliales y > 25 leucocitos por campo) se observaban al menos 105 unidades formadoras de colonias/ml en al menos 3 esputos correspondientes a diferentes meses fuera de un período de agudización.
En el caso de la aparición de alguna agudización durante las 4 semanas previas a la inclusión del paciente en el estudio, se esperó al menos 4 semanas tras el término del tratamiento de la agudización para recuperar al paciente para el mismo.
Determinación de la concentración plasmática de factor de necrosis tumoral alfa e interleucina-8Las concentraciones plasmáticas de TNF-α e IL-8 se analizaron por duplicado mediante un método de enzimoinmunoanálisis de alta resolución (ELISA) siguiendo las instrucciones del fabricante (Bender MedSystems Inc., Burlingame, CA, EE.UU.). Las curvas estándar se construyeron a partir de los datos aportados por las muestras estándar y de plasma de referencia. Esta curva sirvió como base para el cálculo de las concentraciones de TNF-α y de IL-8 de los pacientes y del grupo control mediante un software adecuado. Se consideró concentración válida la obtenida del cálculo de la media aritmética simple de ambas mediciones realizadas por individuo simultáneamente. La sensibilidad de los análisis fue de menos de 3pg/ml para el TNF-α y de 0,7pg/ml para la IL-8. Los coeficientes de variación para el TNF-α fueron del 8,5 y el 9,8% (intraensayo e interensayo), y para la IL-8, de menos del 5% y menos del 10% (intraensayo e interensayo).
Análisis estadísticoSe utilizó el paquete estadístico SPSS versión 9.0 (SPSS, Chicago, IL, EE.UU.) para Windows. Todos los datos se tabularon mediante la media y la desviación estándar para las variables cuantitativas, y mediante el valor absoluto y su porcentaje respecto al total en el caso de variables cualitativas o dicotómicas. Se verificó la normalidad de todas las variables mediante la prueba de Kolmogorov-Smirnov. En ausencia de una distribución normal se utilizaron las correspondientes pruebas no paramétricas. Se aplicaron las pruebas de la t de Student o de la U de Mann-Whitney para la comparación de 2 medias, y la prueba de la χ2 con la corrección de Yates para la comparación de 2 variables dicotómicas o cualitativas. La correlación entre variables se analizó mediante el coeficiente de Spearman. Dado que en los controles sanos los valores de pTNF-α siguieron una distribución normal, se consideró valor anormalmente elevado de pTNF-α en los pacientes aquel que excedía el límite superior del intervalo de confianza del 95% (media + 1,96 desviaciones estándar) de la distribución de concentraciones de los controles sanos (8,1pg/ml). En los pacientes o controles en los que las concentraciones de pTNF-α o IL-8 estuvieron por debajo de los valores de sensibilidad del ensayo (valores indetectables), se consideró válido para cálculos posteriores el valor de la concentración mínima calculada por el ensayo. Se utilizó un análisis de regresión logística para determinar las variables relacionadas de forma independiente (variables independientes) con una concentración elevada de pTNF-α (variable dependiente). El grado de asociación se analizó mediante la odds ratio (OR) y su intervalo de confianza del 95%. Se incluyeron como variables independientes en el modelo logístico aquellas que resultaron estadísticamente diferentes en el estudio bivariado que comparó al grupo de pacientes con una concentración elevada de pTNF-α (> 8,1pg/ml) con aquéllos con una concentración por debajo de dicho valor. Se consideraron significativos los valores de p < 0,05.
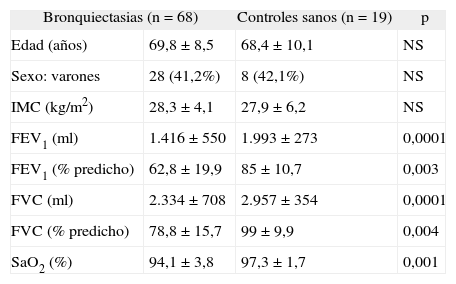
ResultadosDe los 106 pacientes con hábito tabáquico inferior a 10 paquetes-año, se excluyó a: un paciente con artritis reumatoide, 3 pacientes en tratamiento antiinflamatorio crónico, 2 pacientes con otras enfermedades sistémicas inflamatorias, 2 pacientes con insuficiencia renal, 23 pacientes con sospecha de asma y 5 pacientes incapaces de seguir con el protocolo de estudio debido a su grave deterioro físico o psíquico. Dos pacientes rechazaron formar parte del estudio. Las características de los 68 pacientes finalmente incluidos y de los 19 controles sanos aparecen en la tabla I. Catorce pacientes (20,1%) presentaron colonización crónica por P. aeruginosa. El global de pacientes presentó por término medio una obstrucción moderada al flujo aéreo (FEV1: 62,8%) y un descenso significativo de la SaO2 (94,1%). Los sujetos sanos presentaron valores normales de FVC, FEV1 y SaO2.
Características basales del grupo de pacientes con bronquiectasias y del grupo de controles sanos
| Bronquiectasias (n = 68) | Controles sanos (n = 19) | p | |
| Edad (años) | 69,8 ±8,5 | 68,4 ±10,1 | NS |
| Sexo: varones | 28 (41,2%) | 8 (42,1%) | NS |
| IMC (kg/m2) | 28,3 ±4,1 | 27,9 ± 6,2 | NS |
| FEV1 (ml) | 1.416 ±550 | 1.993 ±273 | 0,0001 |
| FEV1 (% predicho) | 62,8 ± 19,9 | 85 ± 10,7 | 0,003 |
| FVC (ml) | 2.334 ± 708 | 2.957 ± 354 | 0,0001 |
| FVC (% predicho) | 78,8 ±15,7 | 99 ± 9,9 | 0,004 |
| SaO2 (%) | 94,1 ±3,8 | 97,3 ± 1,7 | 0,001 |
Valores expresados como media ± desviación estándar o número de sujetos (porcentaje).
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; NS: no significativo; SaO2: saturación de oxígeno.
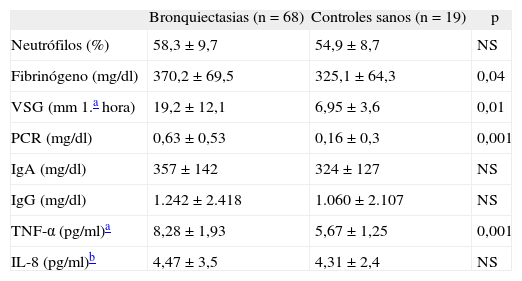
Las concentraciones de algunos marcadores de inflamación sistémica, como la VSG, la PCR y el fibrinógeno, estuvieron significativamente más elevadas en los pacientes que en los controles. No hubo diferencias en el porcentaje de neutrófilos o en las concentraciones de inmunoglobulinas A y G o IL-8 entre ambos grupos (tabla II). Once pacientes (16,2%) y un control sano (5,3%) presentaron valores indetectables de pTNF-α (valores por debajo de la sensibilidad del ensayo). Treinta y seis pacientes (53%) y 6 controles (31,6%) presentaron valores indetectables de IL-8.
Marcadores de inflamación sistémica en pacientes y controles sanos
| Bronquiectasias (n = 68) | Controles sanos (n = 19) | p | |
| Neutrófilos (%) | 58,3 ± 9,7 | 54,9 ± 8,7 | NS |
| Fibrinógeno (mg/dl) | 370,2 ± 69,5 | 325,1 ± 64,3 | 0,04 |
| VSG (mm 1.a hora) | 19,2 ± 12,1 | 6,95 ± 3,6 | 0,01 |
| PCR (mg/dl) | 0,63 ± 0,53 | 0,16 ± 0,3 | 0,001 |
| IgA (mg/dl) | 357 ± 142 | 324 ± 127 | NS |
| IgG (mg/dl) | 1.242 ± 2.418 | 1.060 ± 2.107 | NS |
| TNF-α (pg/ml)a | 8,28 ± 1,93 | 5,67 ± 1,25 | 0,001 |
| IL-8 (pg/ml)b | 4,47 ± 3,5 | 4,31 ± 2,4 | NS |
Valores expresados como media ± desviación estándar.
IgA: inmunoglobulina A; IgG: inmunoglobulina G; IL-8: interleucina-8; NS: no significativo; PCR: proteína C reactiva; TNF-α: factor de necrosis tumoral alfa; VSG: velocidad de sedimentación globular.
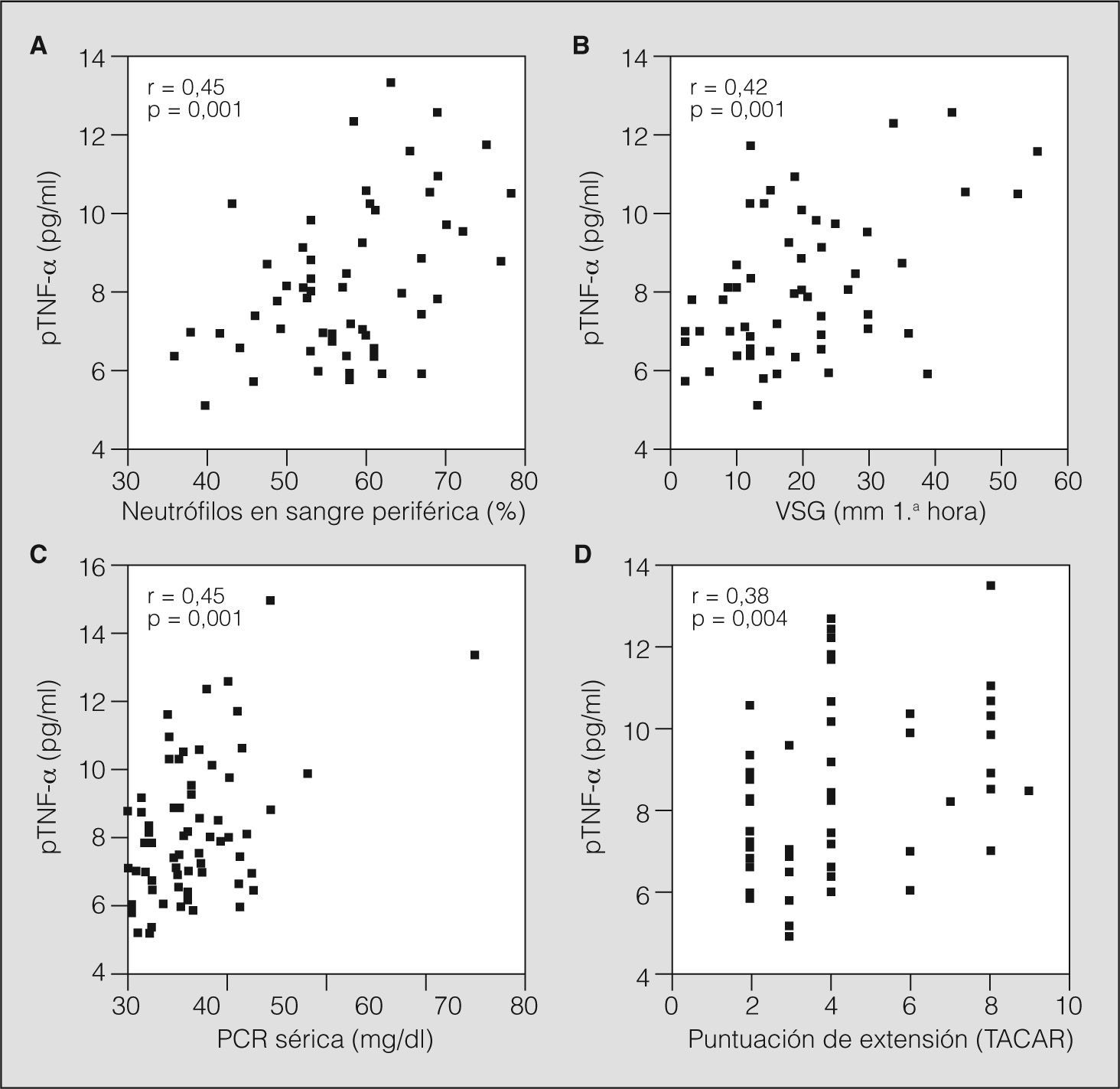
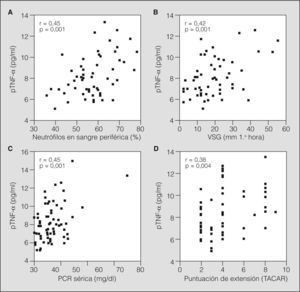
En el grupo de pacientes, los valores de pTNF-α se relacionaron de forma significativa con otros parámetros de inflamación sistémica como la VSG (r = 0,42; p = 0,001), la PCR (r = 0,45; p = 0,001) y el porcentaje de neutrófilos (r = 0,45; p = 0,001), así como con la puntuación de extensión de las bronquiectasias (r = 0,38; p = 0,004) (fig. 1).
Correlación entre las concentraciones plasmáticas de factor de necrosis tumoral alfa (pTNF-α) y otros parámetros de inflamación sistémica o extensión de la enfermedad en pacientes con bronquiectasias (n = 68). Correlación (Spearman) entre los valores de pTNF-α y el porcentaje de neutrófilos periféricos (A), la velocidad de sedimentación globular (VSG) (B), la concentración de proteína C reactiva (PCR) (C) y la extensión de las bronquiectasias según la puntuación obtenida en la tomografía axial computarizada de alta resolución (TACAR) (D).
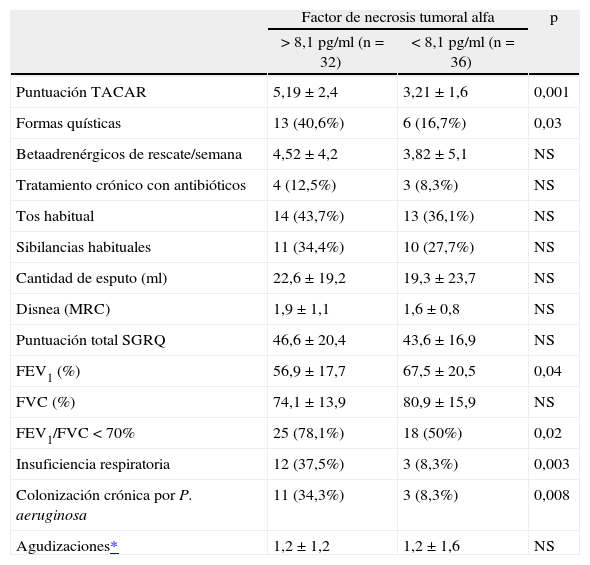
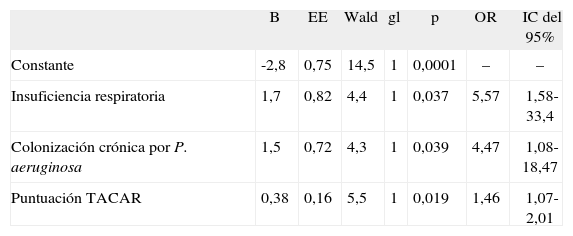
La concentración de pTNF-α estuvo anormalmente elevada (> 8,1pg/ml) en 32 de los 68 pacientes (47,1%). Estos pacientes presentaron una mayor obstrucción al flujo aéreo (FEV1 un 56,9 frente a un 67,5%; p = 0,04), mayor extensión de las bronquiectasias (5,19 frente a 3,21; p = 0,001), así como un mayor porcentaje de formas quísticas (el 40,6 frente al 16,7%; p = 0,04); presencia de insuficiencia respiratoria (el 37,5 frente al 8,3%; p = 0,003) y mayor porcentaje de colonización crónica por P. aeruginosa (el 34,3 frente al 8,3%; p = 0,008) que el resto de pacientes (tabla III). Sin embargo, tan sólo la presencia de insuficiencia respiratoria (OR = 5,57), la colonización crónica por P. aeruginosa (OR = 4,47) y la extensión de las bronquiectasias (OR = 1,46) se relacionaron de forma independiente con valores elevados de pTNF-α tras el ajuste multivariado realizado mediante un modelo de regresión logística (tabla IV). No hubo diferencias significativas en relación con la edad, el sexo, el índice de masa corporal, parámetros clínicos, parámetros de calidad de vida, uso de adrenérgicos β2 a demanda ni número de exacerbaciones.
Comparación entre los pacientes con concentraciones plasmáticas elevadas de factor de necrosis tumoral alfa (> 8,1pg/ml) y concentraciones normales o bajas (< 8,1pg/ml)
| Factor de necrosis tumoral alfa | p | ||
| > 8,1pg/ml (n = 32) | < 8,1pg/ml (n = 36) | ||
| Puntuación TACAR | 5,19 ±2,4 | 3,21 ± 1,6 | 0,001 |
| Formas quísticas | 13 (40,6%) | 6 (16,7%) | 0,03 |
| Betaadrenérgicos de rescate/semana | 4,52 ±4,2 | 3,82 ± 5,1 | NS |
| Tratamiento crónico con antibióticos | 4 (12,5%) | 3 (8,3%) | NS |
| Tos habitual | 14 (43,7%) | 13 (36,1%) | NS |
| Sibilancias habituales | 11 (34,4%) | 10 (27,7%) | NS |
| Cantidad de esputo (ml) | 22,6 ± 19,2 | 19,3 ±23,7 | NS |
| Disnea (MRC) | 1,9 ±1,1 | 1,6 ±0,8 | NS |
| Puntuación total SGRQ | 46,6 ± 20,4 | 43,6 ± 16,9 | NS |
| FEV1 (%) | 56,9 ±17,7 | 67,5 ± 20,5 | 0,04 |
| FVC (%) | 74,1 ± 13,9 | 80,9 ± 15,9 | NS |
| FEV1/FVC < 70% | 25 (78,1%) | 18 (50%) | 0,02 |
| Insuficiencia respiratoria | 12 (37,5%) | 3 (8,3%) | 0,003 |
| Colonización crónica por P. aeruginosa | 11 (34,3%) | 3 (8,3%) | 0,008 |
| Agudizaciones* | 1,2 ±1,2 | 1,2 ±1,6 | NS |
Valores expresados como media ± desviación estándar o número de pacientes (porcentaje).
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; MRC: Medical Research Council; NS: no significativo; SGRQ: St. George's Respiratory Questionnaire; TACAR: tomografía axial computarizada de alta resolución.
Análisis de regresión logística: factores asociados de forma independiente con valores plasmáticos elevados de factor de necrosis tumoral alfa (> 8,1pg/ml) en pacientes con bronquiectasias
| B | EE | Wald | gl | p | OR | IC del 95% | |
| Constante | -2,8 | 0,75 | 14,5 | 1 | 0,0001 | – | – |
| Insuficiencia respiratoria | 1,7 | 0,82 | 4,4 | 1 | 0,037 | 5,57 | 1,58-33,4 |
| Colonización crónica por P. aeruginosa | 1,5 | 0,72 | 4,3 | 1 | 0,039 | 4,47 | 1,08-18,47 |
| Puntuación TACAR | 0,38 | 0,16 | 5,5 | 1 | 0,019 | 1,46 | 1,07-2,01 |
EE: error estándar; gl: grados de libertad; IC: intervalo de confianza; OR: odds ratio; TACAR: tomografía axial computarizada de alta resolución.
Por otra parte, se observó que la concentración de fibrinógeno se relacionó de forma débil pero significativa con la extensión de las bronquiectasias (r = 0,21; p = 0,04), y que tanto la VSG como la PCR se relacionaron con la presencia de colonización crónica por P. aeruginosa (r = 0,23; p = 0,03, y r = 0,27; p = 0,03, respectivamente), pero no lo hicieron con ningún otro parámetro clínico, funcional o evolutivo. Los valores plasmáticos de IL-8 no se relacionaron con ninguna de las variables estudiadas.
DiscusiónSegún nuestros resultados, los pacientes con bronquiectasias en fase de estabilidad clínica presentaron una elevación de los valores periféricos de algunos marcadores de inflamación sistémica respecto a los controles sanos. Las concentraciones de pTNF-α se correlacionaron con otros parámetros de inflamación sistémica como la PCR, la VSG o el porcentaje de neutrófilos circulante, así como con una mayor extensión de la enfermedad. Por otra parte, los pacientes con valores anormalmente elevados de pTNF-α presentaron una mayor extensión pulmonar de las bronquiectasias, mayor obstrucción al flujo aéreo y mayor probabilidad de tener una colonización crónica por P. aeruginosa o insuficiencia respiratoria. Sin embargo, otros marcadores de inflamación sistémica como el fibrinógeno, la PCR o la VSG sólo se correlacionaron de forma ligera (o no se correlacionaron, como en el caso de la IL-8) con estos parámetros en las bronquiectasias.
Aunque hay evidencias de que la respuesta inflamatoria en las bronquiectasias está compartimentalizada en el pulmón8,9, algunos autores han observado un incremento de la concentración periférica de algunos marcadores inflamatorios, reflejo de inflamación sistémica, en pacientes con bronquiectasias incluso fuera de un período de agudización. Angrill et al8 observaron que tan sólo el 53 y el 63% de sus pacientes con bronquiectasias clínicamente estables presentaron valores periféricos normales de IL-6 e IL-1b, y que tan sólo el 37% tuvo concentraciones séricas normales de TNF-α, con una concentración media de 20pg/ml, si bien no evaluaron si estos pacientes presentaban algunas características que los diferenciaran del resto. Por otra parte, Wilson et al10 observaron un incremento de la concentración periférica de algunos reactantes de fase aguda como la VSG, la PCR o algunas inmunoglobulinas en el 35-40% de los pacientes con bronquiectasias clínicamente estables, si bien no utilizaron ningún grupo de controles sanos en su estudio. Los resultados del presente estudio coinciden con los previos en este sentido.
En efecto, encontramos que algunos reactantes de fase aguda como, la VSG, la PCR o el fibrinógeno, estuvieron anormalmente elevados en el suero de los pacientes con bronquiectasias respecto al grupo control. Por su parte, las concentraciones de pTNF-α fueron detectables en la mayoría de los pacientes (83,8%) y de los controles (94,7%). Este alto porcentaje de detección podría explicarse fundamentalmente por la extensa enfermedad de nuestros pacientes, dado que no se incluyó a individuos con bronquiectasias localizadas en un único lóbulo pulmonar, y por la alta sensibilidad de la técnica de ELISA utilizada. La concentración de pTNF-α fue mayor en los pacientes con bronquiectasias que en los controles sanos y se relacionó de forma significativa con otros marcadores inflamatorios sistémicos. Por otra parte, de los pacientes con bronquiectasias, el 47,1% presentó una concentración anormalmente elevada de pTNF-α según el punto de corte establecido de 8,1pg/ml. Este hecho podría estar en relación con la persistencia de una inflamación local importante aun en fase de estabilidad clínica de la enfermedad, que podría explicar la progresiva destrucción del parénquima pulmonar observada en ocasiones en estos pacientes a lo largo de la evolución de la enfermedad13. Hay que comentar, en cualquier caso, que el escaso número de controles incluidos en el presente estudio podría introducir un error en la determinación del límite superior de normalidad establecido. Sea como fuere, el potencial papel de la presencia de una mayor o menor inflamación sistémica en la gravedad o evolución de las bronquiectasias sigue siendo desconocido. Se ha postulado que la presencia de marcadores de inflamación sistémica podría deberse a un desbordamiento de marcadores locales en situaciones de gran inflamación bronquial11,13, por lo que se piensa que la expresión sistémica de la inflamación local podría reflejar de forma fiable la gravedad global de la enfermedad producida por las bronquiectasias, como parece ocurrir en otras afecciones pulmonares como la neumonía o el síndrome del distrés respiratorio del adulto23,24. En este sentido, algunos autores han hallado que en los pacientes con bronquiectasias existen interesantes correlaciones entre algunos parámetros de inflamación sistémica, como la PCR, la VSG, la endotelina-1, la E-selectina o la molécula de adherencia intercelular, y algunos parámetros clínicos, funcionales o de extensión de las bronquiectasias10,25,26. Nosotros hemos preferido la cuantificación de la concentración de pTNF-α, dado que es conocido que se trata de una molécula clave en el desarrollo y mantenimiento de la inflamación de un gran número de enfermedades inflamatorias o infecciosas pulmonares15, e incluso ha sido relacionada con formas graves de bronquiectasias debidas a FQ colonizadas por P. aeruginosa13. En efecto, según nuestros resultados, hubo una correlación positiva entre los valores de pTNF-α y la presencia de algunos parámetros comúnmente utilizados en la estadificación de la gravedad de las bronquiectasias no debidas a FQ, como la extensión de la enfermedad, la presencia de formas quísticas, la presencia de obstrucción al flujo aéreo, la presencia de colonización crónica por P. aeruginosa o la presencia de insuficiencia respiratoria. Además, estas correlaciones fueron superiores a las encontradas para otros marcadores de inflamación sistémica como el fibrinógeno, la PCR o la VSG. En cualquier caso, de todas estas variables, tan sólo la presencia de insuficiencia respiratoria, la colonización crónica por P aeruginosa y la extensión de la enfermedad fueron variables pronósticas independientes de una mayor concentración de pTNF-α tras el ajuste multivariado. Probablemente la exclusión de la ecuación del resto de variables, como las formas quísticas o la presencia de obstrucción al flujo aéreo, responda a la presencia de colinealidad con otras variables de mayor peso estadístico, como la presencia de colonización crónica por P. aeruginosa o la extensión de la enfermedad.
Algunos autores han observado que la hipoxia puede activar la síntesis de TNF-α y cerrar un círculo vicioso que explicara la relación encontrada entre la presencia de insuficiencia respiratoria y los valores elevados de pTNF-α27. Por otra parte, algunos estudios han correlacionado ciertos parámetros de inflamación sistémica, como la endotelina-1, la E-selectina y la molécula de adherencia vascular25,26, con la extensión de las bronquiectasias. En este sentido, nuestro estudio es el primero en mostrar que esta relación también existe con los valores periféricos de TNF-α. Por último, nuestros resultados coinciden con los encontrados en otros estudios sobre la relación existente entre un mayor grado de inflamación sistémica, cuantificada mediante la concentración de IL-628, endotelina-125 y el propio TNF-α13, en pacientes con bronquiectasias debidas a FQ y la presencia de colonización crónica por P. aeruginosa.
Por otra parte, también observamos que los pacientes con un mayor deterioro tanto clínico como de la calidad de vida y con un mayor número de agudizaciones tendían a presentar valores más elevados de pTNF-α, si bien no se alcanzó en ningún caso la significación estadística. Es posible que este hecho venga condicionado sobre todo por la subjetividad, por parte del paciente, en la interpretación de la clínica y de la calidad de vida, influenciada por otros muchos factores externos o por la naturaleza retrospectiva de la recogida de los datos referentes al número de agudizaciones en los 6 meses previos al inicio del estudio. Por último, es importante señalar que en nuestra muestra un 33,8% de los pacientes estaba tomando dosis medias-altas de corticoides inhalados, lo cual podría modificar a la baja la concentración de pTNF-α en ellos, dado el potente carácter antiinflamatorio de este tratamiento. En cualquier caso, si ello fuera así, probablemente serían aún mayores las diferencias en la concentración de pTNF-α entre los pacientes y los controles de nuestro estudio. Es necesario comentar que el presente estudio no está diseñado para determinar una relación de causalidad entre los parámetros valorados en relación con las bronquiectasias y los valores de TNF-α, sino que establece una asociación entre ambas circunstancias con la que se puede generar una hipótesis de trabajo que sirva de base para estudios futuros que exploren una posible relación causa-efecto.
Concluimos que, según nuestros resultados, los valores de pTNF-α se asocian de forma más estrecha que otros marcadores de inflamación sistémica con diferentes parámetros comúnmente utilizados en la valoración de la gravedad de los pacientes afectados de bronquiectasias no debidas a FQ en fase de estabilidad clínica. Recientemente se ha publicado que una enfermedad inflamatoria de la vía aérea como el asma se ha beneficiado del tratamiento con bloqueadores del TNF-α, sobre todo en sus formas más graves29. Son necesarios, en este sentido, nuevos estudios para evaluar el potencial clínico y terapéutico del papel del TNF-α en la gravedad y evolución de las bronquiectasias.
Estudio realizado en parte gracias a una beca concedida por la Red Respira (ISCIII-TRIC-03/11), así como a la aportación de la empresa Glaxo SmithKline (GSK) para la adquisición de los reactivos de factor de necrosis tumoral alfa e interleucina-8 necesarios para su realización.