Introducción
En la actualidad se desconoce en la práctica clínica cuál es el tiempo de isquemia máximo del injerto pulmonar y, aunque se acepta que está entre las 6 y 8 h1, no es de extrañar que tolere tiempos de isquemia superiores2. Mientras que para algunos autores la isquemia superior a las 5 h determina una peor supervivencia de los pacientes trasplantados2, para otros los tiempos de isquemia de hasta 6 h no influyen de forma significativa en la supervivencia. Algunos autores constataron que era posible una buena preservación durante 4 h y que un mayor tiempo de isquemia (hasta 6 h) determinaba una respuesta del implante aceptable pero peor3. Los tiempos de isquemia superiores (8 h) se han relacionado con una peor función pulmonar en el período postoperatorio inmediato4.
Estos hallazgos, sin embargo, no han tenido un refrendo unánime, y autores como Novick et al5 han relacionado la supervivencia tras el trasplante pulmonar (TP) con otros parámetros como la edad del donante. Estos autores comprobaron que la mortalidad precoz después del trasplante estaba relacionada con la conjunción de la edad del donante y el tiempo de isquemia mayor de 6 h. Por otro lado, Glanville et al6 comprobaron, al comparar 20 trasplantes unipulmonares de donante único (pulmones compartidos), en los que el tiempo de isquemia fue significativamente menor en el primer pulmón implantado media ± desviación estándar de 164 ± 53 min que en el segundo (377 ± 53 min), que éste no condicionó el tiempo de intubación, el intercambio gaseoso precoz, la estancia hospitalaria ni la supervivencia a un año. Sin embargo, encontraron un mayor número de episodios de rechazo agudo (RA) en los primeros 3 meses en el grupo con menor tiempo de isquemia, así como un mayor número de infecciones.
Dada la falta de acuerdo entre los autores que han estudiado el tiempo de isquemia del pulmón donante y su relación con complicaciones como la lesión de isquemia-reperfusión (LIR) y RA, es difícil tener una visión clara del problema. En los grupos trasplantadores, no obstante, continúa existiendo la lucha contra el tiempo. Este trabajo pretende dar alguna respuesta a la implicación del tiempo de isquemia en los fenómenos de LIR y RA.
Material y métodos
Se han utilizado 30 ratas macho de la cepa Sprague-Dawley, 15 donantes y 15 receptores, con pesos entre 300 y 400 g. Las condiciones de humedad, temperatura, luz y ventilación fueron constantes y controladas en todo momento en el bioterio. Los animales se dividieron aleatoriamente en 3 grupos en función del tiempo de isquemia del injerto: grupo 1, con tiempo de isquemia de 4 h; grupo 2, con tiempo de isquemia de 6 h, y grupo 3, con tiempo de isquemia de 10 h. Cada grupo estuvo constituido por 5 animales donantes y 5 receptores.
Se realizaron 15 TP izquierdos con la técnica del manguito (cuffs)7, 5 TP por grupo. Todos los experimentos, manipulaciones e intervenciones quirúrgicas se llevaron a cabo de acuerdo con la guía para el manejo y cuidados del animal de experimentación (Real Decreto 223/1988) y la guía para el cuidado y uso de los animales de laboratorio del Consejo Nacional de Investigación de EE.UU., 1996.
Extracción del pulmón donante
Se anestesió al animal donante con tiopental sódico (60 mg/kg) intraperitoneal. Se realizó una traqueostomía y se ventiló al animal con un volumen corriente de 1 ml/100 g. A través de laparotomía media se inyectaron 100 U/100 g de heparina sódica en la vena cava inferior y a continuación se realizó una esternotomía media. Tras extirpar el timo se seccionaron la aorta abdominal, la vena cava inferior torácica y ambas aurículas. En ese momento se produjo la parada cardiorrespiratoria del animal donante y se inició el tiempo de isquemia. A través de la arteria pulmonar se perfundieron los pulmones con suero fisiológico a 4 °C. Como último paso de esta fase se ligó y seccionó la tráquea con el pulmón en semiinsuflación y se extrajo el bloque cardiopulmonar. En éste se disecaron la arteria, la vena y el bronquio izquierdo con sección distal al hilio de éstos. A continuación se colocaron los manguitos y catéteres de venopunción (Abbocath®, Sligo, República de Irlanda) cortados en cilindros de 3 mm con una base y una lengüeta posterior de 1,5 mm. Se mantuvo el pulmón a 4 °C en suero fisiológico frío hasta el momento del implante.
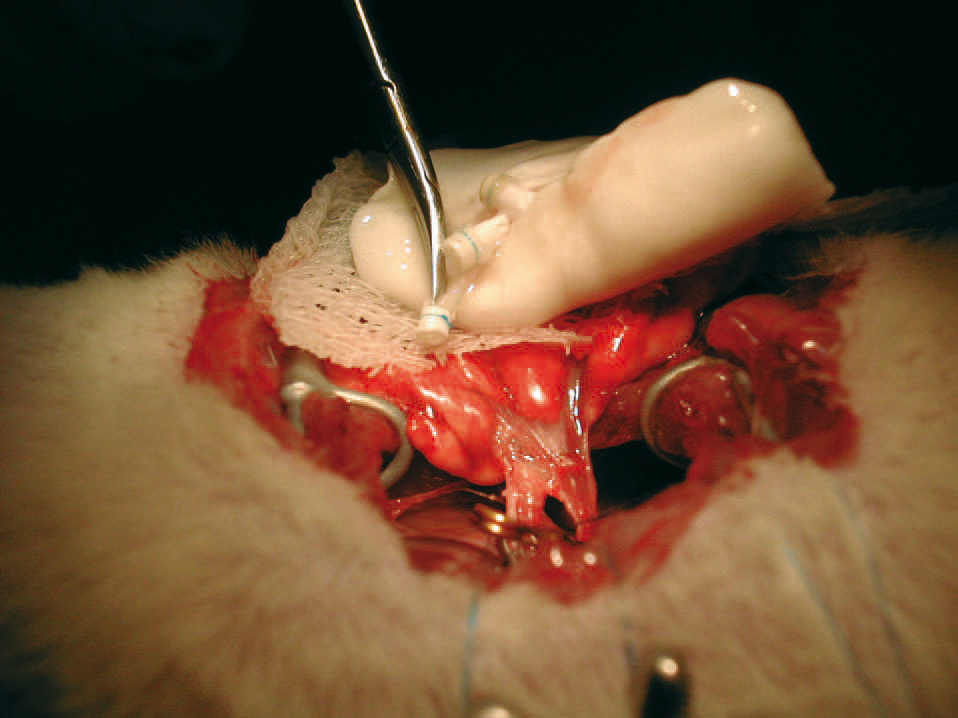
Implante en el receptor
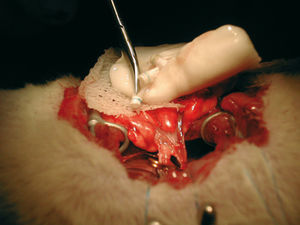
Se anestesió al receptor con medetomidina (0,25 mg/kg) subcutánea, ketamina (50 mg/kg) intraperitoneal y atropina (0,7 mg/kg) intramuscular. Mediante intubación orotraqueal se ventiló al animal con el mismo volumen corriente que en la extracción. A través de una toracotomía posterolateral izquierda se disecó el hilio pulmonar y se identificaron la arteria, el bronquio y las venas pulmonares. Se colocaron ligaduras y pinzas microvasculares, se seccionaron los vasos y se realizó un lavado intravascular con suero heparinizado. Con posterioridad se cortó el bronquio y se llevaron a cabo las anastomosis con los manguitos (fig. 1). Por último, tras ventilar y reperfundir de forma lenta el pulmón implantado, se colocó un drenaje pleural y se cerró la toracotomía. Se administraron atipamezol intramuscular (1,25 mg/kg), antagonista de la medetomidina y buprenorfina intramuscular (0,05 mg/kg). Se aspiró a través del drenaje para devolver a la cavidad pleural su presión negativa y, cuando el animal presentó respiración espontánea, se procedió a retirarlo.
Fig. 1. Anastomosis con manguitos y fijación con ligaduras de 6/0.
Determinaciones
Todos los animales se sacrificaron a las 48 h. Se extrajo el bloque cardiopulmonar, que se perfundió con formaldehído al 1% a través de la tráquea. El pulmón se incluyó en parafina y se realizaron cortes longitudinales que se tiñeron con hematoxilina-eosina. Se observaron al microscopio óptico las muestras y se determinó la presencia de signos de LIR edema peribronquial y perivascular, congestión vascular, infiltrado inflamatorio agudo (neutrófilos) y hemorragia, así como la presencia de RA mediante la clasificación internacional del rechazo pulmonar postrasplante.
Desde el punto de vista clínico se valoró por inspección durante el período postoperatorio la presencia de taquipnea (> 100 respiraciones/min), vocalizaciones o estridor, posturas anómalas u ortopneicas, hemoptisis e infección de la herida quirúrgica. Se realizó en todos los casos una radiografía de tórax (Mobilett II, Siemens, Madrid; 55 KV y 3,2 mAs) inmediatamente después de la intervención y a las 48 h, antes del sacrificio de los animales.
Análisis estadístico
Los resultados se analizaron mediante el programa informático SPSS. Se aplicaron el test de la χ2 y el test exacto de Fisher para el cálculo de probabilidades.
Resultados
Efecto del tiempo de isquemia sobre la evolución clínica
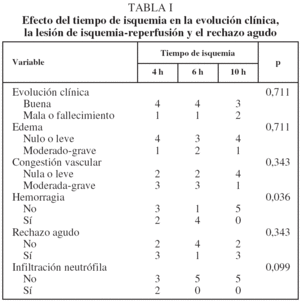
Todos los animales del grupo 1 (tiempo de isquemia de 4 h) presentaron una evolución clínica satisfactoria hasta el momento del sacrificio, salvo uno que presentó taquipnea y estridor. Un animal del grupo 2 (tiempo de isquemia de 6 h) tuvo taquipnea y hemoptisis aislada, que atribuimos a una deficiente preservación del injerto durante la perfusión, pero sobrevivió hasta el momento del sacrificio. El resto de los animales de dicho grupo tuvo una buena evolución clínica. Un animal del grupo 3 (tiempo de isquemia de 10 h) presentó taquipnea y estridor tras el implante, que también relacionamos con una deficiente preservación del pulmón donante, y otro animal presentó una taquipnea bien tolerada. Ambos animales sobrevivieron hasta el momento del sacrificio. El resto de los animales del grupo 3 evolucionó de forma satisfactoria (tabla I). No observamos ninguna infección de la herida quirúrgica.
Efecto del tiempo de isquemia sobre la lesión pulmonar
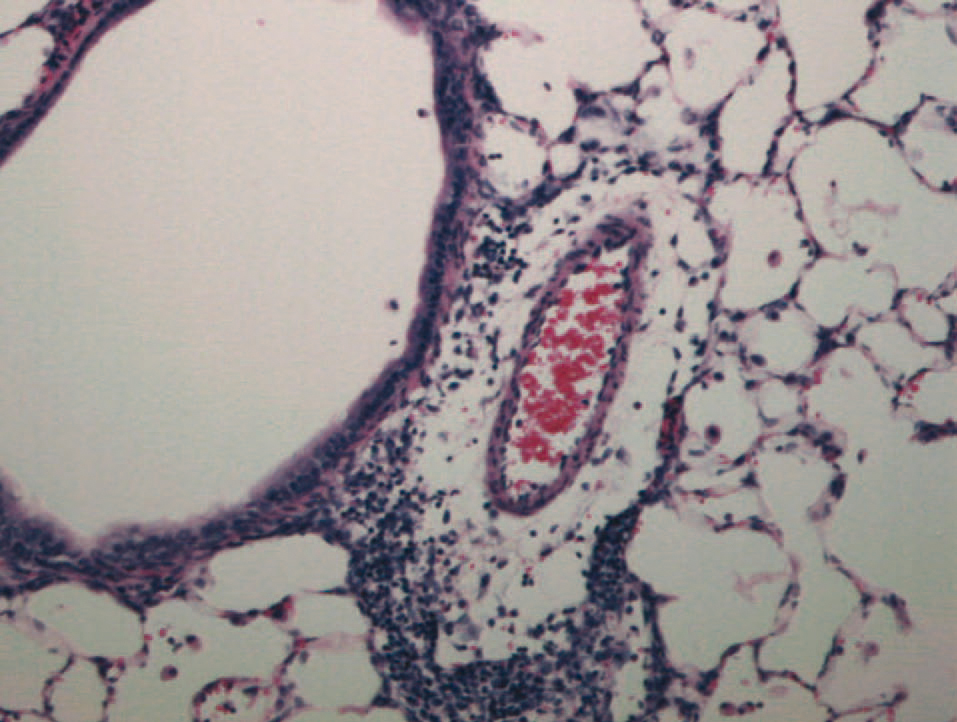
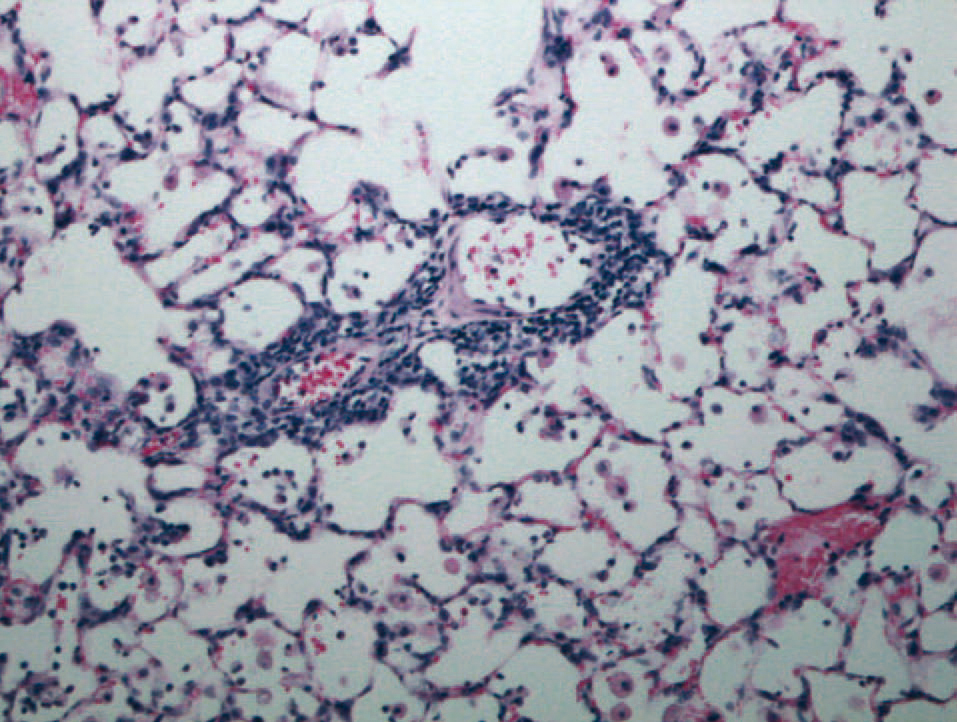
No se observaron diferencias significativas entre los valores de los parámetros histológicos indicadores de lesión pulmonar con los distintos tiempos de isquemia 4 h (fig. 2), 6 y 10 h (fig. 3) a los que se sometieron los pulmones a implantar (tabla I).
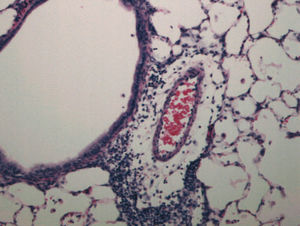
Fig. 2. Infiltrado inflamatorio linfocitario perivascular (rechazo agudo A2) en un pulmón trasplantado con 4 h de isquemia y con escaso edema.
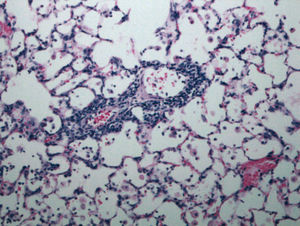
Fig. 3. Infiltrado inflamatorio linfocitario peribronquiolar y perivascular (rechazo agudo A2) en un pulmón trasplantado con 10 h de isquemia y con edema moderado.
Los pulmones implantados con un tiempo de isquemia de 10 h se asociaron a una tendencia menor, no estadísticamente significativa, a presentar hemorragia pulmonar e infiltrado inflamatorio agudo. No presentaron LIR y RA más graves. En cuanto a la afectación del pulmón contralateral, hallamos un infiltrado inflamatorio agudo en el animal del grupo de 4 h con mala evolución clínica y con edema pulmonar grave en el pulmón trasplantado.
Hubo 5 casos de RA tipo A2 (2 animales del grupo 1; uno del grupo 2, y 2 del grupo 3) y 2 casos de RA tipo A1 (un animal del grupo 1 y otro del grupo 3).
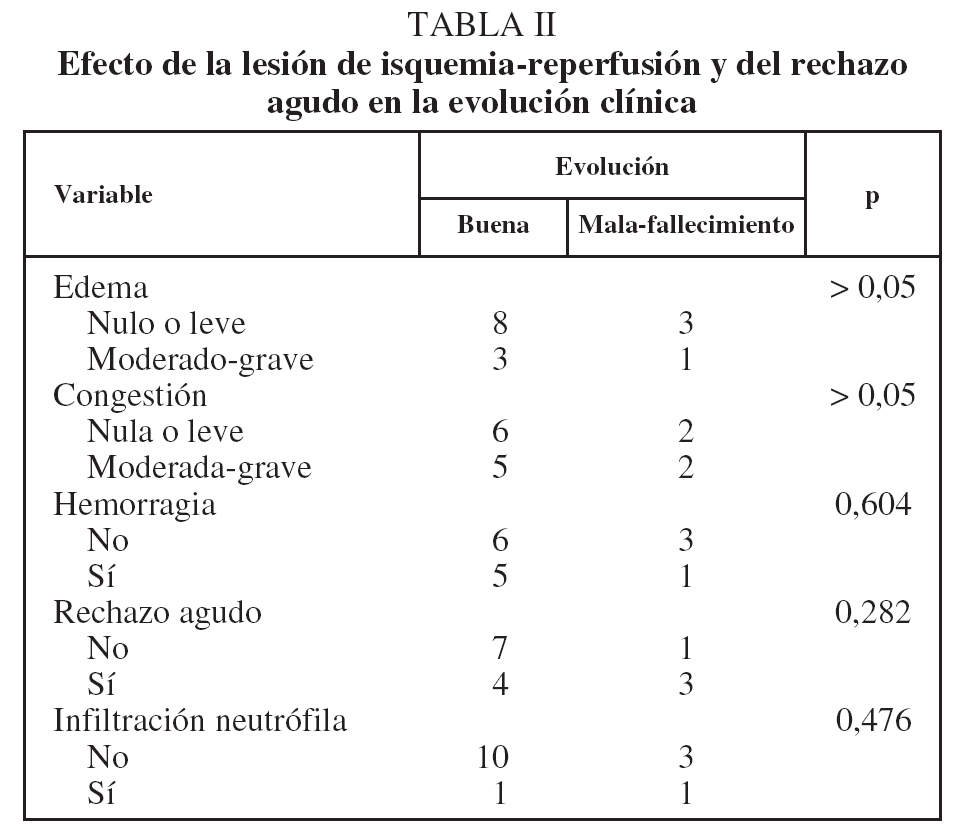
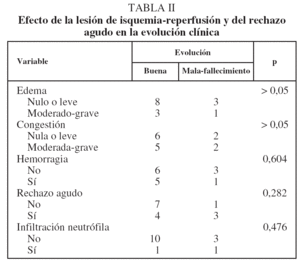
Efecto de la lesión de isquemia-reperfusión y del rechazo agudo en la evolución clínica
No hubo modificaciones significativas en la evolución clínica de los animales trasplantados por la gravedad del edema ni por la presencia y gravedad de los otros signos de LIR y RA (tabla II).
En el estudio radiológico observamos un caso de neumotórax izquierdo basal en el animal del grupo 3 con taquipnea leve. En todos los casos apreciamos un aumento de densidad difuso del pulmón trasplantado, no presente en el pulmón derecho, que relacionamos con una LIR.
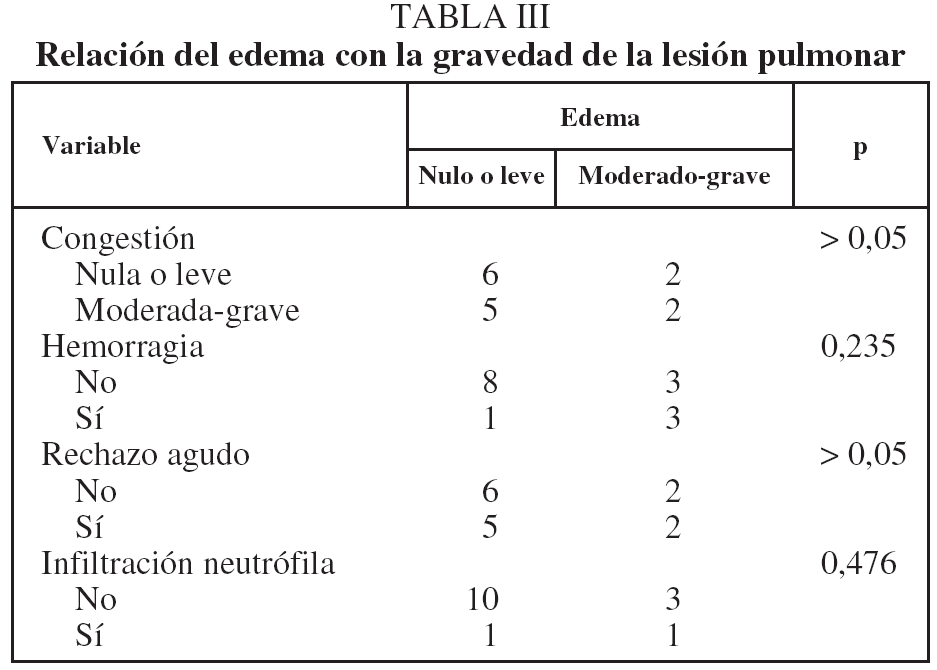
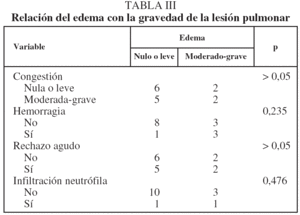
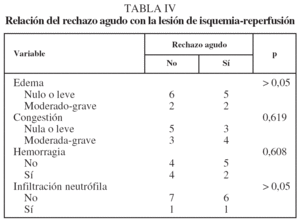
Relación de la lesión de isquemia-reperfusión y del rechazo agudo
No observamos que la gravedad del edema se relacionara significativamente con un grado más grave de congestión vascular, infiltrado inflamatorio y RA, aunque se apreció una tendencia no significativa a acompañarse de hemorragia (tabla III). El RA no se relacionó con la presencia y gravedad del resto de los parámetros indicadores de LIR (tabla IV).
Discusión
El daño pulmonar ocasionado por la LIR y el RA sigue siendo una causa significativa de morbilidad y mortalidad precoces tras el TP2,8. Uno de los aspectos más controvertidos del TP en la clínica humana es el tiempo de isquemia máximo que puede soportar el órgano hasta ser trasplantado2,6. En la actualidad se acepta que éste debe estar entre las 6 y 8 h1,3-6. No obstante, existen dudas razonables de que estos valores no puedan ser superados2,5,6. Los datos que aquí presentamos, si bien los calificamos de preliminares, indican que el pulmón podría soportar tiempos de isquemia superiores a los considerados en la actualidad como límites. Al igual que en otros estudios, hemos realizado TP experimentales con éxito sin que hayamos evidenciado una LIR y un RA más graves9,10.
El edema pulmonar se considera el máximo exponente del daño tisular producido por la LIR. Es el responsable de la disfunción del pulmón trasplantado, y la evolución clínica tras el TP se relaciona con el tiempo de isquemia. En estudios experimentales en ratas, a partir de las 48 h del TP puede observarse un grado variable de edema y congestión alveolar, infiltrado leucocitario de predominio mononuclear, hemorragia y necrosis, además de los correspondientes signos de RA11.
En nuestro estudio no observamos que la gravedad de la LIR se haya relacionado con una peor evolución clínica de los animales trasplantados. Esto podría deberse a que hemos realizado trasplantes unilaterales izquierdos, y el pulmón derecho tiene una importante reserva funcional respiratoria en estos animales. Esta circunstancia podría ser una limitación a la hora de valorar los aspectos clínicos de nuestro trabajo.
La rata es un buen modelo para el estudio del RA y su relación con la LIR, dado que el RA aparece de forma más precoz que en otros mamíferos11, como el perro o el humano. Se ha descrito reiteradamente que la presencia y el grado de RA podían estar relacionados con la gravedad de la LIR. En el estudio de Shiraishi et al12 se observó que, si bien la LIR predispone a la aparición del RA, la gravedad de éste no se relaciona con la LIR. Nuestros datos apoyan estas afirmaciones, puesto que no hemos hallado una relación entre la LIR y la presencia y gravedad del RA. La tendencia a acompañarse de hemorragia indica que la lesión tisular en estos casos de LIR grave es importante y se asocia a una alteración vascular del coeficiente de filtración capilar13,14.
La afectación del pulmón contralateral es un hallazgo frecuente en los TP unilaterales o en los estudios de reperfusión unilateral15. Nosotros no hemos hallado esa relación en nuestra serie. Sólo hemos podido observar que, cuando se presenta esta afectación contralateral, hay un edema grave en el pulmón trasplantado.
Los pulmones implantados con un tiempo de isquemia prolongado (10 h) no sólo no han presentado un mayor grado de lesión pulmonar, sino que además se han asociado a una tendencia menor, aunque no estadísticamente significativa, a presentar hemorragia pulmonar e infiltrado inflamatorio agudo.
Concluimos que, en nuestro estudio, el tiempo de isquemia pulmonar prolongado, de 10 h, no se asocia a LIR ni RA más graves, ni a una peor evolución clínica. El RA no se relaciona con la presencia y la gravedad de la LIR. Serán necesarios más estudios que determinen cuál es el tiempo de isquemia máximo que pueden soportar los pulmones. Esto podría ayudar a aumentar la oferta de donantes de regiones periféricas a centros trasplantadores de referencia.
Agradecimientos
Nuestro agradecimiento al Dr. José Carlos Rodríguez, jefe de la Unidad de Investigación del Hospital Universitario de Gran Canaria Dr. Negrín; a D. Heriberto Grosso, técnico del bioterio de dicho hospital; a Dña. Clara Martel, secretaria de la Unidad de Investigación, y a D. Juan Ramírez y D. Ramón Saavedra, del Servicio de Ilustración e Iconografía del mismo hospital, por su ayuda técnica.
Este proyecto se ha llevado a cabo gracias a la financiación del Fondo de Investigación Sanitaria Español (FIS), de la Fundación Canaria de Investigación y Salud (FUNCIS, proyecto 1.104), del Instituto Canario de Investigación del Cáncer (ICIC) y de la fundación MMA de Madrid.
Correspondencia: Dr. N. Santana Rodríguez.
Unidad de Cirugía Torácica. Unidad de Investigación.
Hospital Universitario de Gran Canaria Dr. Negrín.
Barranco de la Ballena, s/n. 35010 Las Palmas de Gran Canaria. Las Palmas. España.
Correo electrónico: norbesr@terra.es
Recibido: 24-4-2006; aceptado para su publicación: 26-9-2006.