Para predecir el pronóstico del cáncer de pulmón se han investigado varios marcadores. En el presente estudio, mediante inmunohistoquímica se investigaron los valores pronósticos de la expresión del receptor del factor de crecimiento epitelial (EGFR), factor de crecimiento endotelial vascular (VEGF), E-cadherina y p120 catenina en pacientes con un carcinoma de pulmón no microcítico (CPNM) sometidos a resección quirúrgica.
Pacientes y métodosSe determinó prospectivamente la expresión de EGFR, VEGF, E-cadherina y p120 catenina en muestras resecadas de pacientes con CPNM que se habían sometido a cirugía entre 2003 y 2007. Se registraron las características generales de los pacientes y relacionadas con la enfermedad y la tasa de supervivencia.
ResultadosEn el estudio se incluyeron 170 pacientes con una edad media de 61,3 años. Después de un seguimiento medio de 27,5 meses, se determinó que la supervivencia mediana era de 44,0 meses y la tasa de supervivencia a 5 años era del 46,2%. En los grupos con una tinción negativa y positiva, la tasa de supervivencia a los 5 años fue la siguiente: 32 y 66,7% para la expresión de EGFR (p=0,02), 37,8 y 50,7% para la de VEGF (p=0,5), 41 y 66% para la de E-cadherina (p=0,19), 46 y 50% para la de p120 catenina (p=0,27). El grado de diferenciación del tumor, estado de N, estadio y tinción de EGFR fueron variables que afectaron significativamente a la supervivencia (p=0,001, 0,006, 0,03 y 0,02, respectivamente). En el análisis multivariante de Cox, el nivel de tinción de EGFR y el estado de N fueron las variables que afectaron significativamente a la supervivencia (p=0,021 y p=0,010).
ConclusionesAunque la tinción negativa de EGFR se relacionó con una supervivencia desfavorable, la tinción de VEGF, E-cadherina y p120 catenina no se ha relacionado con la supervivencia en pacientes con CPNM resecado.
Several markers have been investigated to predict the prognosis of lung cancer. In the present study, the prognostic values of epithelial growth factor receptor (EGFR), vascular endothelial growth factor (VEGF), E-cadherin, and p120 catenin expression were investigated by immunohistochemistry in patients with a surgically resected non-small cell lung carcinoma (NSCLC).
Patients and methodEGFR, VEGF, E-cadherin, and p120 catenin expression were prospectively determined in resected specimens from patients with NSCLC who had undergone surgery between 2003 and 2007. Patients’ and disease-related general characteristics and survival rate were recorded.
ResultsOne hundred seventeen patients with a mean age of 61.3 years were included in the study. After a mean follow-up of 27.5 months, the median survival was determined to be 44.0 months and the 5-year survival was 46.2%. The 5-year survival in negative and positive staining groups were as follows; 32% and 66.7% for EGFR (p=0.02), 37.8% and 50.7% for VEGF (p=0.5), 41% and 66% for E-cadherin (p=0.19), 46% and 50% for p120 catenin (p=0.27). The differentiation, N status, stage and EGFR staining were variables significantly affecting survival (p=0.001, 0.006, 0.03 and 0.02 respectively). In multivariate Cox analysis, the EGFR staining level and N status were variables those significantly affecting survival (p=0.021 and p=0.010).
ConclusionsWhile negative staining of EGFR was related with poor survival, staining of VEGF, E-cadherin, and p120 catenin were not related with survival in patients with resected NSCLC.
Los marcadores tumorales se utilizan para determinar la diseminación tumoral orgánica, predecir el pronóstico y monitorizar el tratamiento más que para establecer el diagnóstico1. Para el cáncer de pulmón no se ha identificado un marcador tumoral específico de órgano o ideal2. En la actualidad se han estudiado numerosos marcadores tumorales para la valoración de los tumores malignos, incluido el cáncer de pulmón.
Recientemente se han definido numerosas moléculas diana, que afectan al curso del tumor maligno o lo detienen. El receptor del factor de crecimiento epitelial (EGFR) es una glucoproteína transmembrana con actividad de tirosincinasa activada por el receptor de superficie. El EGFR desempeña un papel en la motilidad, la adhesión, la invasión celular y la angiogénesis tumoral3–5. El crecimiento del tumor depende de la neoangiogénesis, que, a su vez, también facilita el progreso y las metástasis tumorales y, por lo tanto, la magnitud de la neoangiogénesis intratumoral guarda relación con el pronóstico, que es uno de los aspectos polémicos de los estudios de investigación en curso. Las células tumorales pueden liberar numerosos factores reguladores positivos que contribuyen a la microangiogénesis, entre los que se ha prestado una atención considerable al factor de crecimiento endotelial vascular (VEGF)6–8.
La E-cadherina, una molécula de adhesión celular dependiente del calcio, desempeña un papel clave en el mantenimiento de la integridad tisular. En parte, la función de esta molécula está mediada por las cateninas9,10.
Tratamos de valorar el papel apenas investigado de la E-cadherina y la catenina junto con el del EGFR y el VEGF, que han sido objeto habitual de la investigación, en el cáncer de pulmón no microcítico (CPNM).
En el presente estudio en pacientes con CPNM sometidos a resección quirúrgica, mediante inmunohistoquímica, determinamos la expresión del receptor del factor de crecimiento epitelial (EGFR), el factor de crecimiento de la célula endotelial vascular (VEGF), la E-cadherina y la p120 catenina con el objetivo de revelar sus efectos sobre el pronóstico.
Materiales y métodosSelección de pacientesEn el estudio se incluyeron los pacientes que habían sido sometidos a lobectomía o neumonectomía debido a CPNM en el Dr Suat Seren Chest Diseases and Thoracic Surgery Training and Research Hospital de la Thoracic Surgery Clinic entre 2003 y 2007. Los anatomopatólogos valoraron prospectivamente todas las muestras quirúrgicas. Se excluyó del estudio a los pacientes que recibieron tratamiento neoadyuvante, a los sometidos a una exéresis incompleta, a aquellos en los que se observó mortalidad en el período precoz (3 primeros meses), a los evaluados por otro anatomopatólogo, a los sometidos a una resección menor que una lobectomía y a los que no pudieron someterse a seguimiento. El estudio fue aprobado por el comité de investigación del Dr Suat Seren Chest Diseases and Thoracic Surgery Training and Research Hospital. Se obtuvo el consentimiento informado de cada paciente.
Historia clínica de los pacientesTodos los pacientes se examinaron en el período preoperatorio con una radiografía de tórax en proyección posteroanterior y lateral, un hemograma completo, pruebas de bioquímica sérica, electrocardiograma, tomografía computarizada (TC) torácica y abdominal superior, ecografía abdominal y broncoscopia. Sólo se efectuaron una gammagrafía ósea y una TC de cráneo en pacientes con signos clínicos o de laboratorio positivos. Todo el material quirúrgico se evaluó histopatológicamente y se clasificó de acuerdo con el sistema de diagnóstico de extensión de la clasificación TNM de 199711. En todos los pacientes se efectuó una disección sistemática de ganglios linfáticos. La evaluación histopatológica postoperatoria siguió las pautas recomendadas por la OMS12.
Seguimiento de los pacientesUn mes después de ser dados de alta del hospital, los pacientes fueron seguidos cada 3 meses durante los 2 primeros años y, acto seguido, cada 6 meses durante 2 años y en los años siguientes, a intervalos anuales. En cada visita de seguimiento, se efectuaron un hemograma y una TC de tórax sistemáticos. Si fue necesario, se efectuaron análisis de sangre y exámenes radiológicos detallados. Todos los pacientes fueron seguidos hasta el término del estudio o su muerte. Por último, la información relacionada con los pacientes se actualizó valorando las historias clínicas y contactando por teléfono con ellos o su familia. La fecha en la que se detectó la primera metástasis se consideró la fecha de la metástasis. Las nuevas lesiones en el mismo hemitórax se consideraron recidivas locales, y otras lesiones se consideraron metástasis a distancia.
Protocolo de tinción de anticuerpos para inmunohistoquímicaLos materiales de resección se procesaron de acuerdo con los procedimientos descritos más adelante. Las muestras de biopsia se transfirieron a un porta revestido de polilisina y se incubaron toda la noche a 50-60°C. Los portas se trataron con xileno durante 2×15min y 2×20min, acto seguido con un 96% de etanol durante 6×1,5-2min y, más adelante, se lavaron 2 o 3 veces en agua destilada. Para la recuperación del antígeno, las secciones preparadas para VEGF, EGFR, y E-cadherina se incubaron con tripsina (Trypsin 4-Pack KIT; BioGenex, San Ramon, California, Estados Unidos) a 37°C durante 45min. Puesto que el tratamiento enzimático no era apropiado para p120, se calentó en un horno microondas con ácido etilendiaminotetraacético (EDTA) (pH=8) durante 20min. Acto seguido p120 se enfrió durante 15min y se lavó 2 o 3 veces en agua destilada. Cada porta se secó individualmente. Las secciones de tejido se marcaron con un círculo mediante rotulador hidrófobo (Super PAP PEN, Beckman Coulter, Marsella, Francia), e inmediatamente después del marcado se vertieron gotas de peróxido de hidrógeno. El porta se incubó durante 5min y se lavó en agua. Acto seguido, el porta se lavó en una solución neutralizadora de la peroxidasa (PBS) durante 5min. Después de aplicar la neutralización en el porta, se incubó durante 10min, se eliminó el exceso y se enjuagó, y el porta se introdujo en un frasco humidificado. VEGF (A20, sc-152, 1:100; Santa Cruz Biotechnology, Inc., Santa Cruz, California, Estados Unidos), EGFR (AR335-5R, 1:10; BioGenex), E-cadherina (1:10, clona 36; BioGenex) y catenina p120 (15D2, sc-23872, 1:50; Santa Cruz Biotechnology, Inc.) se dejaron a temperatura ambiente durante 1h y se utilizaron como anticuerpos primarios. El porta se introdujo en un líquido que contenía PBS sin derramarlo, y acto seguido se lavó, se eliminó el exceso y se enjuagó. El porta se dejó en PBS durante 10min. Se transfirió el anticuerpo secundario al porta y se dejó durante 15min. Se lavó con PBS y se dejó durante 5min. Se introdujo estreptavidina (Lab Vision, Fremont, California, Estados Unidos) en el porta y se dejó durante 15min. Se lavó con PBS, que se dejó durante 5min. Tras eliminar el exceso y enjuagarlo, se introdujo diaminobencidina (DAB, BioGenex) en el porta, se dejó durante 10min, y acto seguido el porta se transfirió a PBS. Después de un lavado en agua destilada, el porta se dejó en hematoxilina durante 1min, y acto seguido se lavó en agua. El porta se trató con un 96% de etanol durante 1min y acto seguido se secó. Tras dejarlo en xileno durante 5min, se cubrió con un cubreobjetos. P120 catenina sólo se estudió en 69 de 117 casos debido a causas técnicas surgidas en el servicio de anatomía patológica.
Examen inmunohistoquímicoUna tinción negativa se definió del modo siguiente: ausencia de tinción o tinción <10% para EGFR, tinción <25% para VEGF, tinción <50% para E-cadherina y p120 catenina. La tinción positiva se aceptó como un valor mayor que éstos.
Análisis estadísticoLas tasas de supervivencia en los diferentes grupos de pacientes se compararon de acuerdo con las características de tinción de EGFR, VEGF, p120 catenina y E-cadherina. Debido al reducido número de pacientes, las variables se agruparon del modo siguiente: los tipos histológicos como escamoso y no escamoso, estado de T como T1-2 y T3-4, estadio como estadio I (IA y IB), estadio II (IIA y IIB) y estadio III (III y más), estado de N como N0-1 (N0 y N1) y N2.
Los análisis estadísticos se efectuaron utilizando el programa SPSS (Versión 9.0; SPSS, Inc., Chicago, Illinois, Estados Unidos). Las comparaciones entre grupos se efectuaron utilizando la prueba de la t de Student para variables paramétricas y la prueba exacta de Fisher o la prueba de la χ2 de Pearson para variables no paramétricas. Para los análisis de supervivencia se usó el método de Kaplan-Meier. Las comparaciones entre las tasas de supervivencia se efectuaron mediante una prueba del log-rank utilizando las tablas de vida y el método de Kaplan-Meier. En los cálculos de la tasa de supervivencia se tuvo en cuenta la mortalidad relacionada con el cáncer de pulmón. Se efectuó un análisis multivariante utilizando el modelo condicional hacia delante de Cox. Se consideró estadísticamente significativo un valor de p≤0,05.
ResultadosLa edad media de los 117 pacientes incluidos en el estudio fue de 61,3 años (límites, 42-77 años). En la tabla 1 se presentan las características generales de los pacientes. Se administró tratamiento adyuvante a 33 pacientes; 5 recibieron quimioterapia; 18, radioterapia, y 10, quimiorradioterapia. Las indicaciones de los tratamientos adyuvantes fueron T3 entres pacientes, T4 en uno, N1 en seis y N2 en 23, mientras que cinco pacientes con enfermedad N2 no pudieron recibir un tratamiento adyuvante debido a la valoración desfavorable de su estado funcional. Los pacientes fueron seguidos durante un período medio de 27,5±20,0 meses (límites, 3-70 meses). La supervivencia mediana fue de 44,0 meses y la tasa de supervivencia a los 5 años fue del 46,2% al término del estudio. En 12 pacientes, el seguimiento fue de más de 60 meses, sobreviviendo 6 pacientes sin la enfermedad, 5 sobrevivían con recidivas y uno había fallecido de otra causa.
Características generales de los pacientes
| Característica | n (%) |
| Sexo | |
| Hombres | 111 (94,9) |
| Mujeres | 6 (5,1) |
| Edad (años) | |
| ≤60 | 53 (45,3) |
| >60 | 64 (54,7) |
| Intervención | |
| Lobectomía | 80 (68,4) |
| Neumonectomía | 37 (31,6) |
| Grado histológico | |
| Bien diferenciado | 29 (24,8) |
| Moderadamente diferenciado | 75 (64,1) |
| Mal diferenciado | 13 (11,1) |
| Tipo histológico | |
| Células escamosas | 62 (53,0) |
| Adenocarcinoma | 47 (40,2) |
| Células grandes | 7 (6,0) |
| Otro | 1 (0,9) |
| Estado de T | |
| 1 | 7 (6,0) |
| 2 | 84 (71,8) |
| 3 | 20 (17,1) |
| 4 | 6 (5,1) |
| Estado de N | |
| 0 | 69 (59,0) |
| 1 | 20 (17,1) |
| 2 | 6 (5,1) |
| Estadio anatomopatológico | |
| IA | 4 (3,4) |
| IB | 50 (42,7) |
| IIA | 3 (2,6) |
| IIB | 26 (22,2) |
| IIIA-IIIB | 34 (29,1) |
| EGFR | |
| Positiva | 49 (41,9) |
| Negativa | 68 (58,1) |
| VEGF | |
| Positiva | 82 (70,1) |
| Negativa | 35 (29,9) |
| E-cadherina | |
| Positiva | 29 (24,8) |
| Negativa | 88 (75,2) |
| p120 catenina | |
| Positiva | 43 (62,3) |
| Negativa | 26 (37,7) |
| Desenlace | |
| Supervivencia libre de enfermedad | 30 (25,6) |
| Supervivencia con enfermedad continuada | 27 (23,1) |
| Mortalidad relacionada con la enfermedad | 51 (43,6) |
| Mortalidad debida a otras causas | 9 (7,7) |
| Recidivas | |
| Presentes | 73 (62,4) |
| Ausentes | 44 (37,6) |
| Tipo de recidiva | |
| Local | 37 (50,7) |
| A distancia | 26 (35,6) |
| Local + a distancia | 10 (13,7) |
EGFR: receptor del factor de crecimiento epitelial; VEGF: factor de crecimiento endotelial vascular.
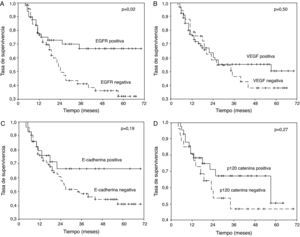
Los pacientes en los que se detectó tinción positiva de EGFR, VEGF, E-cadherina y P-120 catenina se caracterizaron por una mayor supervivencia a 5 años (fig. 1A-D). En el análisis univariante, la diferenciación, estado de N, estadio y tinción de EGFR fueron variables que afectaron significativamente a la supervivencia (p=0,001, 0,006, 0,03 y 0,02, respectivamente) (tabla 2).
A) Curva de supervivencia de los pacientes del estudio en función de los resultados de la tinción para el receptor del factor de crecimiento epitelial (EGFR). B) Curva de supervivencia de los pacientes del estudio en función de los resultados de la tinción para el factor de crecimiento endotelial vascular (VEGF). C) Curva de supervivencia de los pacientes del estudio en función de los resultados de la tinción para E-cadherina. D) Curva de supervivencia de los pacientes del estudio en función de los resultados de la tinción para p120 catenina.
Tasas de supervivencia generales
| Característica | Supervivencia a 5 años (%) | Valor de p |
| General | 46,2 | – |
| Sexo | ||
| Hombres | 43,8 | 0,22 |
| Mujeres | 83,3 | |
| Edad | ||
| ≤60 | 59,7 | 0,55 |
| >60 | 33,8 | |
| Intervención | ||
| Lobectomía | 48,1 | 0,55 |
| Neumonectomía | 42,1 | |
| Grado histológico | ||
| Bien diferenciado | 57,9 | 0,001 |
| Moderadamente diferenciado | 48,2 | |
| Mal diferenciado | 0,0 | |
| Tipo histológico | ||
| Células escamosas | 43,0 | 0,97 |
| Células no escamosas | 49,2 | |
| Estado de T | ||
| 1-2 | 48,9 | 0,74 |
| 3-4 | 34,3 | |
| Estado de N | ||
| 0-1 | 50,2 | 0,006 |
| 2 | 34,5 | |
| Estadio anatomopatológico | ||
| I | 55,9 | 0,03 |
| II | 41,1 | |
| III | 35,8 | |
| EGFR | ||
| Positiva | 66,6 | 0,02 |
| Negativa | 32,0 | |
| VEGF | ||
| Positiva | 50,7 | 0,50 |
| Negativa | 37,8 | |
| E-cadherina | ||
| Positiva | 66,0 | 0,19 |
| Negativa | 41,0 | |
| p120 catenina | ||
| Positiva | 50,0 | 0,27 |
| Negativa | 46,0 | |
EGFR: receptor del factor de crecimiento epitelial; VEGF: factor de crecimiento endotelial vascular.
Además de los valores de EGFR, VEGF, E-cadherina y p120 catenina, el análisis multivariante de Cox del estadio, tipo histológico, diferenciación y estado de T y N reveló que el nivel de tinción de EGFR y el estado de N fueron variables que afectaron significativamente a la supervivencia (p=0,021 y p=0,010) (tabla 3).
Análisis multivariante general de Cox
| Variable | Valor de p |
| EGFR (positivo/negativo) | 0,021 (OR=0,36) |
| Estado de N (N2/N0-1) | 0,010 (OR=3,04) |
| VEGF | 0,8684 |
| E-cadherina | 0,4840 |
| p120 de catenina | 0,1923 |
| Estadio | 0,5574 |
| Tipo histológico | 0,1808 |
| Estado de T | 0,5557 |
| Diferenciación | 0,6872 |
EGFR: receptor del factor de crecimiento epitelial; OR: odds ratio; VEGF: factor de crecimiento endotelial vascular.
Aunque se demostró que la tinción débil de EGFR guardó relación con una supervivencia menos prolongada, la tinción de VEGF, E-cadherina y p120 catenina no se relacionó con la supervivencia de pacientes en los que se obtuvieron muestras de la exéresis de un CPNM.
La sobreexpresión de EGFR se relacionó con la enfermedad en estadio avanzado, desarrollo de un fenotipo metastásico, disminución de la supervivencia y mal pronóstico3,13–15. Aunque en los estudios inmunohistoquímicos de los tejidos postoperatorios se ha descrito que EGFR es un factor pronóstico negativo en el CPNM16, en general se sugiere que, por sí mismo, este marcador no puede ser un factor pronóstico15,17,18. En el presente estudio, en pacientes con muestras EGFR negativas la tasa de supervivencia a 5 años fue del 32%, mientras que en el grupo EGFR positivo fue del 66,7% (p=0,02). Aunque se ha sugerido que la secreción excesiva o las características de tinción potente de EGFR dan lugar a una disminución de la supervivencia predecible18–20, también se han publicado estudios que han documentado que se relaciona con una supervivencia más prolongada, como se observó en el presente estudio21,22.
Rusch et al23 documentaron que la sobreexpresión de EGFR estuvo presente en el 70,8% de pacientes con CPNM, y en éstos se identificó una supervivencia a los 5 años más prolongada (p=0,023). En un estudio que incluyó una serie de 408 pacientes con resección tumoral completa, en los grupos EGFR positivo y EGFR negativo las tasas de supervivencia a 5 años fueron del 63 y del 61%, respectivamente13. En el presente estudio no se identificaron diferencias significativas por lo que respecta a las características de tinción de EGFR de acuerdo con el estadio determinado de la enfermedad. Así mismo, tampoco se detectó una diferencia significativa entre los grupos EGFR positivo y negativo por lo que respecta a la diferenciación o a las metástasis.
En algunos estudios se ha encontrado que la expresión elevada de VEGF y la frecuencia de metástasis a ganglios linfáticos guardan relación en los tejidos tumorales de pacientes con cáncer de pulmón sin metástasis a distancia, mientras que, en otros, no se ha descrito esta relación. En pacientes sin metástasis a ganglios linfáticos no se ha demostrado una relación entre el tamaño tumoral y los valores de VEGF6,7,24. Aunque previamente se ha sugerido que a medida que aumentan los valores de VEGF se produce un incremento de la afectación de ganglios linfáticos6, en el presente estudio no se detectó esta relación. Aunque en el grupo VEGF negativo la tasa de supervivencia a 5 años fue del 37,8%, en el grupo positivo fue del 50,7%. A pesar de los estudios que describen que la tinción VEGF positiva produce efectos negativos sobre la supervivencia8,25, también están disponibles estudios que sugieren que guarda relación con una mayor supervivencia26,27. Los resultados del presente estudio coinciden con este último grupo.
Sulzer et al28 describieron una correlación significativa entre la expresión de la E-cadherina y una mayor supervivencia. Hubo una correlación inversa significativa entre la expresión de E-cadherina y el estadio de los ganglios linfáticos, al igual que la diferenciación tumoral. La disminución de la expresión de E-cadherina se relacionó con la ausencia de diferenciación histológica tumoral, un aumento de las metástasis linfogénicas y una menor supervivencia. En el presente estudio no se detectó una diferencia significativa entre grupos E-cadherina positiva (24,1%) y negativa (23,9%) por lo que respecta a la frecuencia de N2. Aunque no fue estadísticamente significativo, en el grupo E-cadherina positiva se observó una tendencia hacia una mayor tasa de supervivencia comparado con los pacientes E-cadherina negativos en estadio III (50 y 30,2%, respectivamente; p=0,48).
Entre los 331 pacientes que se sometieron a resección, se demostró la expresión preservada de E-cadherina en 193 (58%) pacientes y una disminución de la expresión en 138 (42%) pacientes. Con respecto a la expresión de E-cadherina, las tasas de supervivencia a 5 años relacionada con el cáncer de pulmón fueron del 66,2% en el grupo con expresión preservada y del 56,3% en el de expresión reducida (p=0,065). Entre los casos con una expresión reducida tanto de E-cadherina como de β-catenina se demostró un pronóstico desfavorable significativo comparado con los casos de disminución de la expresión de E-cadherina o β-catenina y comparado con los casos de preservación de la expresión de ambas9.
En un estudio efectuado por Retera et al29 en pacientes con CPNM resecado, la disminución de la expresión de catenina se relacionó claramente con metástasis a ganglios linfáticos y un pronóstico desfavorable. La menor expresión de E-cadherina y β-catenina se relaciona con una menor supervivencia.
Una expresión deficiente de catenina se relaciona con un período libre de enfermedad y una supervivencia más breves en pacientes con adenocarcinoma y CPNM pT1-2 y pN030. Una tinción intensa de β-catenina se relaciona con una mayor supervivencia9. En el presente estudio, las tasas de supervivencia a 5 años fueron similares en los grupos positivos y negativos.
Las variaciones entre los resultados del estudio por lo que respecta a las tasas de supervivencia probablemente se deben a las variaciones en los criterios de valoración. Aunque la tinción de una célula se considera positiva para EGFR en algunos estudios, otros consideran positiva intensa una tinción >25% y negativa débil una tinción <25%. Esto da lugar a una diferencia sustancial de los resultados.
En el presente estudio, la presencia de negatividad de EGFR y enfermedad N2 se relacionó con un pronóstico desfavorable. Las variables que afectaron a la supervivencia fueron el grado de tinción de EGFR y el estado de N, mientras que la tinción de VEGF, E-cadherina y p120 catenina no produjo efectos sobre la supervivencia del cáncer de pulmón no microcítico resecado.
Conflicto de interesesNo se ha obtenido ninguna fuente de financiación ni ayuda en la redacción del manuscrito. No se ha declarado ningún conflicto de intereses.