El tratamiento clásico del derrame pleural maligno (DPM) es la administración de talco intrapleural desencadenando una reacción inflamatoria que fusiona las hojas pleurales evitando la producción de líquido pleural (LP). Decidimos administrar la quimioterapia intrapleural, como alternativa terapéutica, a través de un catéter tunelizado permanente (CTP) con objeto de poder repetir ese tratamiento en distintos ciclos.
Presentamos el primer caso de una mujer de 65 años diagnosticada de linfoma no Hodgkin difuso de célula grande B, estadio IVA, con infiltración pleural, DPM y una masa en pared torácica posterior derecha de 15×10×4cm que infiltra la 8.ª-10.ª costilla y pared torácica.
En los 2 primeros ciclos de inmuno-quimioterapia con DA-R-EPOCH se controla el DP con toracocentesis evacuadoras. Previo al tercer ciclo desarrolla nuevo DP masivo, por lo que se decide manejo con Pleurx®. Tras vaciamiento por Pleurx® decidimos administrar rituximab (100mg en 50ml de SSF cada 3 semanas) intrapleural el día +1 del ciclo a través de dicho tubo clampándose durante 2h.
La evolución del derrame fue excelente, persistiendo únicamente mínimo pinzamiento seno costo-frénico, sin necesidad de nuevos drenajes de LP en los 2 ciclos sucesivos.
Fallece un mes después del último ciclo intrapleural (3 meses después del diagnóstico) por una hemorragia intracraneal por infiltración neurológica del linfoma.
Presentamos otro caso de otra mujer de 65 años con antecedentes de mieloma múltiple (MM) IgA kappa desde hace 6 años. Presenta progresión a MM sintomático, iniciándose segunda línea con bortezomib-doxorubicina-dexametasona (PAD) obteniendo respuesta parcial. Presenta progresión del mieloma con plasmocitomas torácicos, iniciándose tercera línea con lenalidomida-dexametasona obteniendo respuesta completa después de 5 ciclos.
En el séptimo ciclo la paciente acude a urgencias con insuficiencia respiratoria y DP masivo izquierdo. El análisis del LP evidenció infiltración pleural por MM. Con el diagnóstico de progresión extramedular pleural se realiza toracentesis y evacuación de derrame por tubo torácico.
Se inicia esquema VRD (bortezomib, lenalidomida y dexametasona 2) decidiéndose administrar 2/3 de la dosis planeada de bortezomib a través del Pleurx®, cerrando 2h y apertura posterior. Con el primer ciclo presenta evidente mejoría clínica y descenso en la formación de líquido.
Después del segundo ciclo no se observan células plasmáticas en LP y al inicio del ciclo 3.° no se aprecia derrame en la radiografía ni en la TC por lo que se decide retirar el tubo. No ha vuelto a presentar DP tras 12 meses de seguimiento.
El CPT es un tubo fenestrado de silicona, tunelizado y asegurado al tejido celular subcutáneo gracias a una zona profibrótica. Dispone de una válvula unidireccional para drenar el LP evitando la entrada de aire o bacterias a la cavidad. Tiene su indicación principal en el pulmón atrapado; y de segunda elección a pacientes con DPM y una esperanza de vida inferior a 3 meses1.
Las complicaciones de la pleurodésis química son potencialmente graves: neumonía, arritmia, insuficiencia respiratoria y distrés respiratorio con una mortalidad que oscila entre el 6,1-8,4% según la técnica utilizada2.
Las principales ventajas de este tipo de catéteres frente a la pleurodésis tradicional son: mejora de la disnea, reducción en los días de ingreso y el abaratamiento de los costes. Es una alternativa válida y costo-efectiva para el tratamiento de este tipo de derrames frente a la pleurodésis3.
Las complicaciones son infección de la cavidad pleural, metástasis en trayecto del tubo, loculaciones asintomáticas, hipoproteinemia, rotura o la salida del tubo y dolor torácico.
De todas ellas la que más preocupa es la infección pleural. Se estima que la incidencia de esta complicación en individuos con DPM oscila entre el 4,8-7%4,5.
La válvula unidireccional se perfora con un sistema especialmente habilitado conectado a una botella de vacío o bien con una línea que se conecta a un sistema de aspiración. De la misma manera que se utiliza el tubo para el drenaje del líquido se puede utilizar para instilar fármacos. Dichos fármacos pueden ser tanto sustancias que favorezcan la pleurodésis como fármacos quimioterápicos para realizar un tratamiento local.
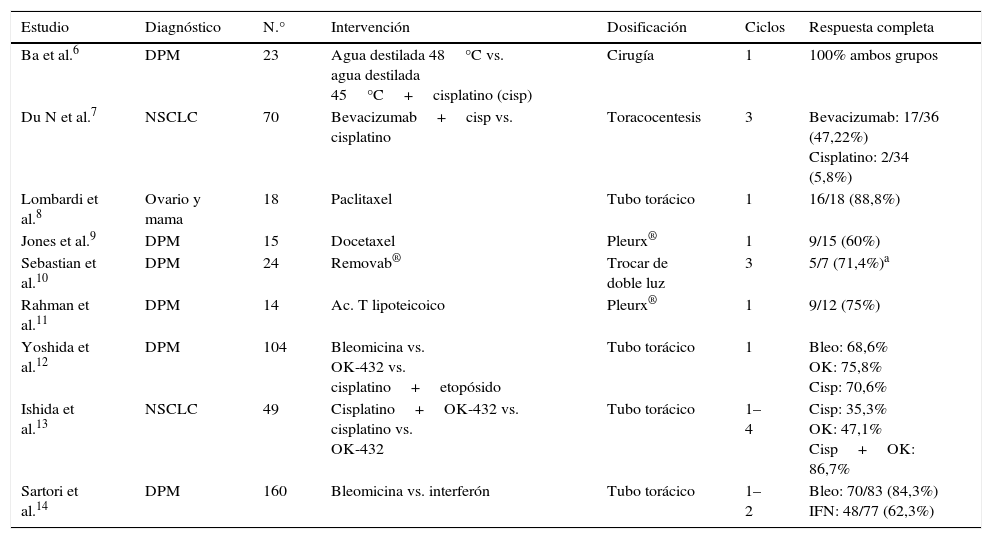
Hemos realizado una búsqueda bibliográfica de ensayos clínicos (EC) en los que se estudiase la instilación de quimioterapia intrapleural. Se han incluido los ensayos desde el año 2004 atendiendo a la técnica utilizada para su instilación, el número de ciclos y los resultados en forma de respuesta completa y la global al mes, 2 y 3 meses. Encontramos un total de 16 artículos de los cuales se excluyen 7, 4 de ellos porque se comparan con cirugía y los 3 restantes porque su variable principal es la supervivencia a corto plazo y no aporta información sobre la evolución del derrame pleural. Los resultados se muestran en la tabla 1.
Ensayos clínicos con administración de quimioterapia intrapleural, vía de administración y resultado
| Estudio | Diagnóstico | N.° | Intervención | Dosificación | Ciclos | Respuesta completa |
|---|---|---|---|---|---|---|
| Ba et al.6 | DPM | 23 | Agua destilada 48°C vs. agua destilada 45°C+cisplatino (cisp) | Cirugía | 1 | 100% ambos grupos |
| Du N et al.7 | NSCLC | 70 | Bevacizumab+cisp vs. cisplatino | Toracocentesis | 3 | Bevacizumab: 17/36 (47,22%) Cisplatino: 2/34 (5,8%) |
| Lombardi et al.8 | Ovario y mama | 18 | Paclitaxel | Tubo torácico | 1 | 16/18 (88,8%) |
| Jones et al.9 | DPM | 15 | Docetaxel | Pleurx® | 1 | 9/15 (60%) |
| Sebastian et al.10 | DPM | 24 | Removab® | Trocar de doble luz | 3 | 5/7 (71,4%)a |
| Rahman et al.11 | DPM | 14 | Ac. T lipoteicoico | Pleurx® | 1 | 9/12 (75%) |
| Yoshida et al.12 | DPM | 104 | Bleomicina vs. OK-432 vs. cisplatino+etopósido | Tubo torácico | 1 | Bleo: 68,6% OK: 75,8% Cisp: 70,6% |
| Ishida et al.13 | NSCLC | 49 | Cisplatino+OK-432 vs. cisplatino vs. OK-432 | Tubo torácico | 1–4 | Cisp: 35,3% OK: 47,1% Cisp+OK: 86,7% |
| Sartori et al.14 | DPM | 160 | Bleomicina vs. interferón | Tubo torácico | 1–2 | Bleo: 70/83 (84,3%) IFN: 48/77 (62,3%) |
DPM: derrame pleural maligno; NSCLC: carcinoma de pulmón de células no pequeñas.
De esta revisión concluimos que a mayor número de ciclos de quimioterapia intrapleural mayor posibilidad de éxito. Se consiguieron mayores tasas de éxito en los ensayos que utilizaron el Pleurx®. No hemos encontrado ningún EC que incluya datos relativos a neoplasias hematológicas. Si bien sí que existen casos publicados de neoplasias hematológicas con infiltración pleural tratados con instilación intrapleural de quimioterapia.
La administración concomitante de quimioterapia sistémica junto con local es una técnica que se ha utilizado en otros órganos como es el caso de los tumores vesicales con resultados satisfactorios. De esta forma se alcanza una concentración del fármaco muy superior a la realizada por vía sistémica y sin los efectos tóxicos del mismo. Sus limitaciones residen en la poca capacidad que posee de diseminarse por toda la pleura y la escasa penetrancia en tumores Bulky15.
En conclusión, la administración de quimioterapia intrapleural puede ser una alternativa eficaz para el tratamiento de las neoplasias intrapleurales. El CPT aporta una solución efectiva e integral al problema del DPM. Consigue un alivio rápido de los síntomas con una mejoría de la calidad de vida, permite el uso concomitante de quimioterapia sistémica, es costo-efectivo y sin un mayor riesgo de complicaciones. Y por otro lado nos abre una nueva diana terapéutica a la hora de tratar la infiltración neoplásica de la pleura.
A Paloma Clavería Marco por su inestimable colaboración.