Puntos clave:
- •
La base del tratamiento de la EPOC estable son los broncodilatadores de larga duración (BDLD).
- •
Los pacientes de bajo riesgo deben recibir tratamiento con BDLD exclusivamente.
- •
En pacientes de alto riesgo los fármacos que se deben añadir a BDLD dependerán del fenotipo del paciente.
- •
El tratamiento del fenotipo no agudizador se basa en el uso de los BDLD solos o en combinación.
- •
El tratamiento del ACO se basa en la utilización de BDLD combinados con corticosteroides inhalados (CI).
- •
El tratamiento del fenotipo agudizador con enfisema se basa en el empleo de BDLD a los que se puede añadir CI o teofilina.
- •
El tratamiento del fenotipo agudizador con bronquitis crónica se basa en el uso de BDLD; a los que se puede añadir CI, inhibidores de la fosfodiesterasa-4 o mucolíticos o, en casos especiales, macrólidos de forma preventiva.
Los objetivos generales del tratamiento de la EPOC se resumen en tres: a) reducir los síntomas crónicos de la enfermedad; b) disminuir la frecuencia y la gravedad de las agudizaciones, y c) mejorar el pronóstico. Se deben alcanzar tanto los beneficios a corto plazo (control de la enfermedad) como los objetivos a medio y largo plazo (reducción del riesgo)1–3.
Medidas generalesLas medidas generales que hay que tener en cuenta en todo paciente con EPOC comprenden el abandono del tabaco, la adecuada nutrición, la actividad física regular, la evaluación y tratamiento de las comorbilidades y la vacunación. La rehabilitación forma parte del tratamiento integral del paciente con EPOC.
VacunaciónLas vacunas son una estrategia para reducir el riesgo de exacerbaciones relacionadas con infecciones que pueden derivar en complicaciones y, por tanto, pretenden reducir la morbimortalidad y los costes sanitarios asociados a la EPOC.
La administración anual de la vacuna antigripal reduce el número de exacerbaciones durante los períodos epidémicos, pero los estudios disponibles son demasiado pequeños y de corta duración para determinar cualquier efecto sobre la mortalidad4. Una reciente revisión sistemática señala que la evidencia sobre el efecto de esta vacuna en los pacientes con EPOC en cuanto a la reducción de neumonías, hospitalizaciones y mortalidad es de baja calidad5. Sobre la base de estos estudios, se recomienda la vacunación anual contra la gripe en todos los pacientes con EPOC.
La actualización de la revisión sistemática Cochrane sobre la vacuna antineumocócica en los pacientes con EPOC incluye 7 estudios: los dos más antiguos realizados con la vacuna de 14 serotipos y los más recientes con la vacuna neumocócica polisacárida de 23 serotipos (PPV23)6. Los resultados indican que, si bien es posible que las vacunas antineumocócicas polivalentes inyectables proporcionen alguna protección contra la morbilidad en los pacientes con EPOC, no se observaron efectos significativos en ninguno de los resultados (riesgo de neumonía, riesgo de exacerbación, ingresos hospitalarios y mortalidad). Es cierto que para demostrar la eficacia clínica de una vacuna se precisan poblaciones muy amplías, que son difíciles de reclutar en el caso de la EPOC y los estudios antes mencionados carecían de una muestra suficiente de pacientes con EPOC para demostrar efectos. En un estudio específico en pacientes con EPOC, la vacuna antineumocócica de 23 serotipos fue efectiva en reducir el riesgo de neumonía en pacientes menores de 65 años y en los que presentaban EPOC grave7.
La nueva vacuna neumocócica conjugada de 13 serotipos aporta una mayor respuesta inmunológica, incluso en mayores de 70 años que han sido previamente vacunados con la vacuna neumocócica polisacárida8. Esto es especialmente relevante para la EPOC, ya que se asocia a un riesgo elevado de enfermedad neumocócica invasiva9 y la mayoría de pacientes son de edad avanzada, por lo que se debe recomendar la vacunación. En el mayor estudio realizado hasta la fecha en cerca de 85.000 adultos mayores de 65 años, la vacuna conjugada demostró una protección significativa frente a la neumonía bacteriémica y no bacteriémica causada por los serotipos incluidos en la vacuna10. En consecuencia, el grupo de trabajo de Tabaquismo de la SEPAR (Sociedad Española de Neumología y Cirugía Torácica) recomienda la vacunación antineumocócica utilizando una sola dosis de vacuna neumocócica conjugada de 13 serotipos (VNC-13) en todos los fumadores —independientemente de su edad e intensidad y/o carga de consumo— que padecen enfermedades respiratorias como la EPOC11.
En los pacientes con EPOC —por su eficacia, su escaso coste y su gran seguridad— se recomienda la vacunación antineumocócica sistemática, preferiblemente la vacuna conjugada de 13 serotipos. En el caso de administrar la vacuna polisacárida, será necesaria una revacunación a partir de los 8 años de la primera administración.
Tratamiento farmacológico de inicio en pacientes con EPOC en fase estableEl importante desarrollo farmacológico en el campo de la EPOC ha permitido disponer de diferentes opciones de tratamiento que han puesto de manifiesto que la respuesta clínica puede ser diferente según determinadas características de la enfermedad. De esta manera, en esta guía se propone un tratamiento personalizado, estratificado por nivel de riesgo y condicionado por el fenotipo clínico12–15.
Tratamiento del paciente con EPOC de bajo riesgoPuntos clave:
- •
El tratamiento del paciente de bajo riesgo consistirá en el uso de BDLD.
- •
Estos pacientes, al no sufrir agudizaciones de repetición, no precisan del uso de antiinflamatorios.
- •
Cuando, a pesar del tratamiento con un BDLD, el paciente sigue sintomático y/o con limitación importante al ejercicio, el segundo paso es la introducción de un segundo BDLD de un grupo farmacológico distinto.
- •
Si se administra un BDLD en monoterapia, se recomienda utilizar un agente antimuscarínico de acción prolongada (LAMA).
El paciente con EPOC de bajo riesgo es un paciente que presenta obstrucción leve o moderada al flujo aéreo, bajo grado de disnea (mMRC < 2 sin tratamiento) y fenotipo no agudizador. En este caso no está indicado ningún tipo de tratamiento antiinflamatorio y el tratamiento farmacológico se reduce a la prescripción de BDLD en monoterapia o en asociación.
En el caso poco frecuente de una obstrucción leve y sin síntomas aparentes, puede estar indicada la administración de broncodilatadores de corta duración (BDCD) a demanda, pero los pacientes más sintomáticos deben recibir BDLD de forma continuada.
Broncodilatadores de corta duraciónLos BDCD pueden ser de dos tipos: anticolinérgicos (SAMA, por su nombre en inglés short-acting muscarinic antagonist), como el bromuro de ipratropio, y beta-2 agonistas de acción corta (SABA, por su nombre en inglés short-acting beta-agonist), como salbutamol o terbutalina, y son eficaces en el control rápido de los síntomas. En pacientes con síntomas ocasionales, el tratamiento con BDCD reduce los síntomas y mejora la tolerancia al esfuerzo16. Estos fármacos, añadidos al tratamiento de base, son de elección para el tratamiento a demanda de los síntoma, sea cual sea el nivel de gravedad de la enfermedad.
Cuando el paciente tiene síntomas permanentes o sufre alguna limitación en sus actividades diarias por su problema respiratorio requerirá un tratamiento de base regular con un BDLD.
Broncodilatadores de larga duraciónLos BDLD pueden ser beta-2 adrenérgicos (salmeterol, formoterol, olodaterol, vilanterol e indacaterol [LABA, por su nombre en inglés long-acting beta-agonists] o anticolinérgicos (tiotropio, aclidinio, glicopirronio, umeclidinio [LAMA, por su nombre en inglés long-acting muscarinic antagonist]). Deben utilizarse como primer escalón en el tratamiento de todos los pacientes que presentan síntomas permanentes y precisan tratamiento de forma regular, porque permiten un mayor control de los síntomas que el conseguido con BDCD y mejoran tanto la calidad de vida como la función pulmonar17–22.
En ocasiones, los beneficios conseguidos a nivel clínico no se acompañan de una mejoría significativa del grado de obstrucción (cambios en el volumen espiratorio forzado en el primer segundo [FEV1]). No obstante, incluso en estos casos, su utilización está justificada por sus efectos al disminuir la hiperinsuflación dinámica y, por consiguiente, mejorar la capacidad inspiratoria, el grado de disnea y la tolerancia al ejercicio23,24. Además de su impacto directo sobre la capacidad de ejercicio, mejoran de forma indirecta la función cardíaca al disminuir la hiperinsuflación, y este hecho podría explicar en parte la tendencia a la reducción de la mortalidad observada en los grandes ensayos clínicos con BDLD en la EPOC25.
Además, los BDLD han demostrado reducir el número de exacerbaciones26; tanto los LABA19,27,28 como el bromuro de tiotropio26,29. Los resultados del ensayo clínico aleatorizado UPLIFT30 demostraron una reducción en el riesgo de exacerbaciones, hospitalizaciones e insuficiencia respiratoria con tiotropio frente al tratamiento habitual durante 4 años.
Hay diferencias entre los diversos BDLD; los hay con una duración de acción de 12 h (aclidinio, salmeterol y formoterol) y de 24 h (tiotropio, umeclidinio, glicopirronio, indacaterol, olodaterol y vilanterol). En relación con la prevención de agudizaciones, un ensayo clínico aleatorizado potenciado para agudizaciones demostró que tiotropio era más eficaz que salmeterol en la prevención de agudizaciones en pacientes con EPOC e historia de al menos una agudización durante el año previo31. También tiotropio ha demostrado ser superior a indacaterol en la prevención de agudizaciones32. Por este motivo, ante la elección de un BDLD en monoterapia, se recomienda un LAMA de primera elección sobre un LABA.
P11. En los pacientes con EPOC estable, ¿se recomienda la administración de un tratamiento broncodilatador de larga duración tipo LAMA frente a un broncodilatador de larga duración tipo LABA?
Recomendación débil a favor. En pacientes con EPOC que precisan un BDLD en monoterapia se recomienda el tratamiento con un LAMA.
Especificaciones. La evidencia analizada se basa en una mayor prevención de agudizaciones en estudios realizados con el LAMA tiotropio. En pacientes sin agudizaciones no hay diferencias en la eficacia clínica entre LAMA y LABA.
En general, los BDLD son bien tolerados y presentan escasos efectos adversos. No obstante se deben tener en cuenta los siguientes:
- •
LABA: temblor fino de las extremidades, calambres musculares, taquicardia, hipertensión arterial, vasodilatación periférica, cefalea, hiperglucemia, hipocalcemia, tos, broncoespasmo, irritación orofaríngea y dispepsia.
- •
El tratamiento con LAMA se puede asociar a sequedad de boca33. Otros efectos adversos observados son: retención urinaria, incremento de la presión ocular e irritación faríngea.
- •
Se debe tener en cuenta que los ensayos clínicos excluyen a pacientes con cardiopatía significativa, por lo que se debe estar alerta con el uso de los nuevos broncodilatadores en estos pacientes.
En pacientes sintomáticos o con una limitación al ejercicio evidente aun tras la monoterapia broncodilatadora se debe ensayar la doble terapia broncodilatadora. La asociación de LABA y LAMA ofrece un beneficio funcional añadido con reducción de la necesidad de medicación de rescate, mejoría de los síntomas y de la calidad de vida frente a la monoterapia34,35. Por este motivo, en un segundo escalón de tratamiento en los pacientes de bajo riesgo se puede asociar un BDLD de un tipo farmacológico distinto al que el paciente llevara en el primer nivel de gravedad. De esta manera se consigue optimizar el efecto broncodilatador.
Las combinaciones de BDLD deben utilizarse en los pacientes con EPOC que persisten sintomáticos a pesar de la monoterapia con un único BDLD. Las combinaciones existentes de BDLD (LABA/LAMA) se presentan en la tabla 1.
aracterísticas de los fármacos inhalados para el tratamiento de la EPOC
| Principio activo | Presentación | Dosis recomendada |
|---|---|---|
| Beta-2 adrenérgicos | ||
| Salbutamol | ICP: 100μg/inh | 200μg/4-6 h |
| Terbutalina | TH: 500μg/inh | 500μg/6 h |
| Salmeterol | ICP: 25μg/inh AH: 50μg/inh | 50μg/12 h |
| Formoterol | ICP: 12μg/inh TH: 9μg/inh AL: 12μg/inh | 12μg/12 h |
| Indacaterol | BH: 150μg/inh BH: 300μg/inh | 150μg/24 h |
| Olodaterol | RM: 2,5μg/inh | 5μg/24 h |
| Anticolinérgicos | ||
| Bromuro de ipratropio | ICP: 20μg/inh | 20-40μg/6-8 h |
| Bromuro de tiotropio | HA: 18μg/inh | 18μg/24 h |
| RM: 2,5μg/inh | 5μg/24 h | |
| Aclidinio | GE: 400μg/inh | 400μg/12 h |
| Glicopirronio | BH: 44μg/inh | 44μg/24 h |
| Umeclidinio | EL: 62,5μg/inh | 62,5μg/24 h |
| LABA/LAMA | ||
| Indacaterol/glicopirronio | BH: 110/50μg/inh | 110/50μg/24 h |
| Aclidinio/formoterol | GE: 340/12μg/inh | 340/12μg/12 h |
| Umeclidinio/vilanterol | EL: 62,5/25μg/inh | 62,5/25μg/24 h |
| Tiotropio/olodaterol | RM: 2,5/2,5μg/inh | 5/5μg/24 h |
| LABA/CI | ||
| Beclometasona/formoterol | NH: 100/6μg/inh ICP Modulite® 100/6μg/inh | 200/12μg/12 h |
| Formoterol/budesonida | TH: 4,5/160 y 9/320μg/inh SM: 4,5/160 y 9/320μg/inh EH: 4,5/160 y 9/320μg/inh | 9/320μg/12 h |
| Salmeterol/propionato de fluticasona | AH: 50/500μg/inh FP : 50/500μg/inh | 50/500μg/12 h |
| Furoato de fluticasona/vilanterol | EL: 100/25μg/inhalación | 100/25μg/24 h |
AH: Accuhaler®; AL: Aerolizer®; BH: Breezhaler®; Cl: cápsulas inhaladas; EH: Easyhaler®; EL: Ellipta®; FP: Forspiro®; GE: Genuair®; HA: Handihaler®; ICP: inhalador en cartucho presurizado; inh: inhalación; LABA/CI: beta-2 adrenérgico de larga duración/corticosteroide inhalado; LABA/LAMA: beta-2 adrenérgico de larga duración/antimuscarínico de larga duración; NH: Nexthaler®; RM: Respimat®; SM: Spiromax®; TH: Turbuhaler®.
Puntos clave:
- •
El tratamiento de este fenotipo consistirá en el uso de BDLD.
- •
Estos pacientes, al no sufrir agudizaciones de repetición, no precisan del uso de antinflamatorios.
- •
El tratamiento de primera elección es la doble broncodilatación (LAMA/LABA).
- •
En un nivel de gravedad superior se pueden añadir teofilinas.
El paciente con EPOC de alto riesgo es el que presenta una limitación al flujo aéreo grave o un elevado grado de disnea (mMRC > 2 sin tratamiento o entre 0 y 2 con tratamiento) o al menos dos agudizaciones ambulatorias o un ingreso el año previo, o cualquier combinación de estos factores. Se trata de un paciente que precisa una aproximación diagnóstica más detallada con el objetivo de identificar su fenotipo, que condicionará la opción terapéutica más adecuada36.
Doble terapia broncodilatadoraEl tratamiento inicial en un paciente no agudizador con EPOC de alto riesgo es la doble broncodilatación. Esta recomendación se basa en la demostración de una mayor eficacia broncodilatadora frente a la monoterapia, que se acompaña de una mejoría significativa de la disnea, de la calidad de vida y una reducción en la utilización de la medicación de rescate. Los resultados obtenidos en la comparación de la capacidad de ejercicio entre la doble broncodilatación y la monoterapia no son tan consistentes37,38.
No existen hasta la fecha comparaciones directas entre las diferentes combinaciones LABA/LAMA y los análisis comparativos indirectos realizados no permiten identificar claras diferencias entre ellas39,40.
P12. En los pacientes con EPOC estable, ¿se recomienda el uso del tratamiento con doble broncodilatación de larga duración frente a un tratamiento en monoterapia?
Recomendación débil a favor. La terapia con doble broncodilatación proporciona una mayor eficacia broncodilatadora y es de elección en pacientes sintomáticos a pesar de un tratamiento con un solo broncodilatador.
Especificaciones. En pacientes con afectación espirométrica grave o muy grave, la terapia con doble broncodilatación es recomendable de inicio sobre la monoterapia por su mayor efecto sobre la función pulmonar.
TeofilinasLas teofilinas son fármacos broncodilatadores débiles, pero que presentan efectos aditivos a los broncodilatadores habituales. Se ha descrito un efecto positivo de estos fármacos sobre la fuerza del diafragma, un aumento del rendimiento de los músculos respiratorios, una reducción del atrapamiento aéreo y una mejoría del aclaramiento mucociliar. También han demostrado tener efectos antiinflamatorios en la EPOC. La dosis habitual es de 200-300 mg/12 h por vía oral en comprimidos de liberación sostenida. En cualquier caso, su limitada eficacia clínica y su estrecho margen terapéutico las relega a ocupar un lugar de tercera línea, principalmente en pacientes de alto riesgo si persisten disneicos tras la doble terapia broncodilatadora41.
La toxicidad de la teofilina es dosis-dependiente. Su uso incrementa el riesgo de náuseas, diarrea, dolor de cabeza, irritabilidad y, a dosis elevadas (valores plasmáticos de 20 mg/ml), puede producir arritmias cardíacas, convulsiones, taquicardia e hipopotasemia41. Se han descrito también casos de dolor en epigastrio, hematemesis y hemorragia gastrointestinal y, en consecuencia, un número importante de personas abandona la medicación42. Cuando se administra de forma prolongada se deben verificar sus concentraciones plasmáticas y se debe tener en cuenta el riesgo de interacciones con otros fármacos como el alopurinol, ciprofloxacino, eritromicina, benzodiacepinas o cimetidina, entre otros. Estudios destinados a comprobar si pueden tener un efecto potenciador de la actividad antiinflamatoria de los CI han sido negativos, por lo que no se recomiendan en este contexto43.
Tratamiento del paciente con EPOC de alto riesgo y fenotipo mixto asma-EPOC o ACOPuntos clave:
- •
Los pacientes con ACO comparten características clínicas e inflamatorias con el asma, por lo que se caracterizan por una buena respuesta al tratamiento antiinflamatorio con CI.
- •
Se debe evitar el tratamiento con LABA en monoterapia y asociar siempre un CI.
- •
En el siguiente paso se puede establecer la terapia triple: tiotropio + CI + LABA en pacientes más graves o con agudizaciones a pesar de la asociación LABA/CI.
- •
Por último se puede ensayar añadir teofilina o roflumilast (si existe expectoración crónica y agudizaciones frecuentes) al régimen anterior.
Los pacientes con ACO se caracterizan por cumplir criterios diagnósticos de EPOC, pero presentar características compatibles también con asma bronquial. GesEPOC define el fenotipo mixto mediante unos criterios diagnósticos44.
Se ha asociado la presencia de ACO con un mayor grado de inflamación eosinofílica bronquial que sería la responsable de su mayor respuesta clínica y espirométrica a los CI45 y justifica el uso de los CI asociados a un BDLD como primera opción, con el objetivo de mejorar su función pulmonar, los síntomas respiratorios y reducir las agudizaciones si las hubiere14,46. En estos casos es necesario un seguimiento para evaluar la respuesta y, al igual que sucede con el asma, seleccionar la mínima dosis necesaria de CI para el tratamiento a largo plazo.
Los pacientes con ACO, definido en esta ocasión como pacientes con EPOC que tuvieron un diagnóstico de asma antes de los 40 años, demostraron tener una mayor frecuencia de agudizaciones que los pacientes sin diagnóstico previo de asma47. Sin embargo, se ha observado que estos pacientes tienen un mejor pronóstico a largo plazo, con una menor mortalidad que los pacientes con EPOC sin ACO48. Se ha descrito una asociación entre la inflamación eosinofílica en fase estable y durante las agudizaciones49 y los CI son especialmente eficaces en reducir la frecuencia de agudizaciones en pacientes con EPOC e inflamación bronquial eosinofílica50. Estas agudizaciones no suelen cursar con expectoración purulenta, sino con síntomas de rinitis, sibilantes y tos con expectoración blanquecina, y son las que se pueden beneficiar más del tratamiento preventivo con CI49. Por este motivo, los CI en asociación con un BDLD son un tratamiento eficaz en la prevención de agudizaciones en pacientes con ACO51.
En los casos de mayor gravedad puede ser necesario el tratamiento triple CI/LABA más LAMA. Esta triple combinación ha demostrado su eficacia en pacientes con EPOC que presentaban gran reversibilidad en la obstrucción al flujo aéreo52. Además, tiotropio ha demostrado eficacia en pacientes con asma grave53.
Asimismo, en los casos más graves se puede añadir al tratamiento la teofilina o, si hay agudizaciones frecuentes y tos con expectoración crónica, roflumilast. No hay estudios específicos de la eficacia y seguridad de estos fármacos en el ACO, pero se conoce la relativa eficacia de ambos fármacos en el asma.
Tratamiento del paciente con EPOC de alto riesgo y fenotipo agudizador con enfisemaPuntos clave:
- •
Los BDLD son el primer escalón terapéutico en pacientes con agudizaciones y fenotipo enfisema.
- •
Cuando los BDLD no son suficientes para el control de los síntomas o de las agudizaciones se puede añadir un CI y, en casos más graves, teofilina.
Un ensayo clínico aleatorizado (ECA) comparó indacaterol/glicopirronio frente a glicopirronio con un brazo abierto de tratamiento con tiotropio. La población de estudio fueron pacientes con FEV1 < 50% del teórico y que habían presentado al menos una agudización durante el año previo. El parámetro principal del estudio fue la incidencia de agudizaciones. Los resultados mostraron una reducción significativa de 12% en la tasa de agudizaciones moderadas o graves frente a glicopirronio (p=0,038) y un 15% de reducción en el total de agudizaciones (p=0,0012). Frente a tiotropio hubo una reducción numérica, pero no llegó a ser significativa. Este estudio demostró que la doble broncodilatación era superior al efecto de un LAMA en la prevención de agudizaciones en la EPOC.
Posteriormente, otro ECA comparó la misma combinación LABA/ LAMA, indacaterol/glicopirronio frente a salmeterol/fluticasona (LABA/CI) en la prevención de agudizaciones en pacientes con EPOC con FEV1 entre 25 y 60% y al menos una agudización durante el año previo. Los resultados mostraron una diferencia significativa a favor de indacaterol/glicopirronio en la reducción de agudizaciones de cualquier nivel de gravedad y en pacientes con cualquier grado de eosinofilia en sangre periférica. Además, los pacientes con indacaterol/ glicopirronio tuvieron una menor incidencia de neumonías54. Los resultados de ambos estudios justifican que la combinación LABA/ LAMA sea de primera elección en el tratamiento inicial de los pacientes con EPOC y fenotipo agudizador, excepto en pacientes con ACO. Cabe recordar que en este último ECA se excluyó a los pacientes con antecedentes de asma y a aquellos con eosinofilia sanguínea > 600 células por μl55.
Corticosteroides inhaladosLos CI están indicados en pacientes que presentan frecuentes agudizaciones pese a realizar un tratamiento broncodilatador óptimo, por cuanto su uso asociado a los BDLD produce una disminución significativa del número de agudizaciones y una mejoría en la calidad de vida, si bien no han mostrado un efecto beneficioso sobre la mortalidad56–60. Aunque la prevención de agudizaciones se ha evaluado en la mayoría de los estudios para los pacientes graves o muy graves (FEV1 < 50%) y con frecuentes agudizaciones, hay algunos estudios en pacientes con menor gravedad funcional (FEV1 < 60%), donde también los resultados avalan el uso de estos fármacos, por lo que parece que el principal determinante del beneficio es la presencia de agudizaciones repetidas, es decir, el fenotipo agudizador, y no el grado de obstrucción al flujo aéreo56. En la EPOC, los CI se deben utilizar siempre en asociación con un BDLD, generalmente un LABA. Las diversas asociaciones disponibles de LABA/CI se presentan en la tabla 1.
Subanálisis recientes de estudios clínicos de las combinaciones LABA/CI para la prevención de agudizaciones de la EPOC han mostrado que el mayor efecto preventivo del CI se obtiene en pacientes con concentraciones elevadas de eosinófilos en sangre61,62. Además, el riesgo de neumonía con el uso de CI en la EPOC parece mayor en pacientes con concentraciones bajas de eosinófilos63. Sin embargo, estos resultados todavía no se han demostrado en estudios prospectivos diseñados específicamente para este fin, y tampoco se ha establecido un punto de corte universalmente aceptado de eosinofilia sanguínea para recomendar o no el uso de CI en la EPOC. Por este motivo, y debido a que los estudios de registro de la combinación LABA/CI no diferenciaban entre pacientes con o sin eosinofilia, todavía no es posible dejar de recomendar el uso de los CI en pacientes agudizadores en general, si bien hay que esperar escasa eficacia en aquellos pacientes con bajas concentraciones de eosinófilos en sangre51.
Se debe buscar un equilibrio entre los efectos beneficiosos de los CI y sus posibles efectos adversos. En los grandes ensayos clínicos se ha observado que efectos secundarios tales como aftas orales, disfonía y hematomas eran más comunes en los pacientes tratados con CI64. También se ha apreciado una reducción en la densidad mineral ósea65; sin embargo, no se ha detectado un incremento significativo del riesgo de fracturas óseas en estudios de hasta 3 años de seguimiento. Los resultados del TORCH y otros estudios a largo plazo han demostrado un mayor riesgo de neumonía en los pacientes tratados con CI solos o en combinación con BDLD, pero sin aumento de la mortalidad66. Aunque el riesgo de neumonía es mayor en pacientes que toman fluticasona a dosis altas, también se ha observado un aumento del riesgo de neumonía, pero de menor magnitud, asociado al uso de budesonida67,68.
P13. En los pacientes con EPOC estable, ¿se recomienda el uso de un tratamiento combinado con un broncodilatador más un corticoide inhalado frente al tratamiento con doble broncodilatación?
Recomendación débil a favor. En pacientes sintomáticos —a pesar de un tratamiento con un broncodilatador de acción prolongada, y en especial si presentan agudizaciones— el tratamiento con doble broncodilatación (LABA/LAMA) es de elección frente al tratamiento con LABA/CI.
Especificaciones. La mayor eficacia de LABA/LAMA frente a LABA/CI en la prevención de agudizaciones se ha demostrado con indacaterol/ glicopirronio frente a salmeterol/fluticasona.
Triple terapia (LAMA/LABA/CI)En pacientes de alto riesgo y que no presentan un buen grado de control de los síntomas o de las agudizaciones con dos fármacos (sean dos BDLD o un BDLD más un CI) se puede utilizar la triple terapia LAMA/LABA/CI. Los escasos estudios existentes con triple terapia indican un mayor efecto sobre la función pulmonar52 y una disminución de las agudizaciones y las hospitalizaciones en pacientes graves52,69,70. Estos efectos son evidentes al añadir un LAMA a la combinación LABA/CI71–73, sin embargo no está claro el aumento en la eficacia al añadir un CI a la combinación LABA/LAMA69,70. El aspecto más importante relativo a la triple terapia es conocer su eficacia en comparación con la doble terapia broncodilatadora (LABA/LAMA).
MucolíticosEn tres revisiones sistemáticas se demostró una reducción de las exacerbaciones con el tratamiento mucolítico frente a placebo en el paciente con EPOC74–76. Estos resultados deben interpretarse con cautela, ya que los estudios incluidos tenían un escaso tamaño muestral y eran heterogéneos. Sin embargo, los mismos resultados se confirmaron en un ECA de mayor envergadura en el que el uso de carbocisteína a largo plazo, comparado con placebo, reducía el número de exacerbaciones, retrasaba el empeoramiento de los síntomas y mejoraba la calidad de vida de los pacientes con EPOC77. Los efectos de la N-acetilcisteína (NAC) a largo plazo en pacientes con EPOC se han evaluado en un ECA, en el que se demostró una disminución del número de exacerbaciones en pacientes no tratados con CI de forma concomitante78. Estudios más recientes con mucolíticos a dosis altas (NAC 600 mg/12 h) han demostrado una reducción significativa de las agudizaciones, especialmente en pacientes con alto riesgo de presentar estos episodios (pacientes con FEV, < 50% o con dos o más agudizaciones durante el año previo, o ambos)79,80.
El perfil de tolerancia y seguridad de ambos fármacos es excelente. La eficacia de los mucolíticos en general es superior en pacientes que por cualquier motivo no toman CI. Aunque por su supuesto mecanismo de acción parecería que el uso de mucolíticos debería quedar reservado a pacientes agudizadores con bronquitis crónica, los ensayos clínicos realizados no han seleccionado a los pacientes por la presencia de expectoración crónica, por lo que no se puede descartar un efecto en la prevención de agudizaciones derivado de su posible acción antioxidante también en pacientes con fenotipo agudizador con enfisema.
P14. En los pacientes con EPOC estable, ¿se deben usar los mucolíticos para prevenir las exacerbaciones?
Recomendación débil a favor de la intervención. En pacientes con EPOC y fenotipo agudizador a pesar de llevar un tratamiento adecuado se sugiere añadir un mucolítico a dosis altas.
Especificaciones. Se debe abordar con el paciente el tema de los costes asociados al tratamiento con agentes mucolíticos.
Tratamiento del paciente con EPOC de alto riesgo y fenotipo agudizador con bronquitis crónicaPuntos clave:
- •
La doble terapia broncodilatadora (LABA/LAMA) es eficaz en la reducción de agudizaciones, cuando no sea suficiente se debe plantear su uso combinado con un fármaco antiinflamatorio.
- •
Como antiinflamatorio se puede utilizar un CI, roflumilast o un macrólido. En casos especialmente graves se pueden asociar, aunque no hay estudios controlados acerca de la eficacia y seguridad de dichas asociaciones.
- •
También se puede administrar un mucolítico.
- •
En el paciente agudizador con bronquitis crónica se debe investigar la presencia de bronquiectasias y de infección bronquial crónica, que precisarán un tratamiento especializado.
La presencia de tos y expectoración crónica es un factor reconocido que predispone a las agudizaciones en la EPOC81. El primer escalón de tratamiento será la doble terapia broncodilatadora (LABA/LAMA), por su capacidad de reducir las agudizaciones. El siguiente paso será identificar la mejor opción para cada paciente según sus características82. Estas opciones incluyen fármacos ya descritos con anterioridad como los CI y los mucolíticos, además de los inhibidores de la fosfodiesterasa 4 y los antibióticos a largo plazo.
Inhibidores de la fosfodiesterasa-4Roflumilast es un fármaco antiinflamatorio oral que actúa mediante la inhibición selectiva de la fosfodiesterasa-4 (IPD4) y que ha demostrado prevenir las agudizaciones en pacientes con EPOC grave que presentan tos y expectoración crónica, y que además sufren agudizaciones frecuentes66,83, por lo que es un fármaco indicado para el fenotipo agudizador con bronquitis crónica. Este efecto se mantiene cuando se añade roflumilast al tratamiento de mantenimiento con un BDLD, sea LABA o LAMA. Además, consigue un incremento significativo del FEV, mínimo de 50 a 70 ml sobre el conseguido con salmeterol o tiotropio83,84. El efecto de roflumilast en la prevención de agudizaciones se ha observado incluso al añadirse a la terapia triple (LABA/ LAMA/CI)85. Un ECA reciente ha demostrado que esta medicación es más eficaz en la reducción de agudizaciones en pacientes más graves que requieren ingreso hospitalario86. La dosis habitual es de 500μg por vía oral 1 vez al día84,87.
Tanto el roflumilast como los CI son fármacos antiinflamatorios, aunque sus modos de acción son diferentes. De hecho, la inflamación neutrofílica típica de la EPOC es relativamente resistente a altas dosis de corticosteroides orales o inhalados. Por contra, en estudios in vitro e in vivo, roflumilast ha mostrado efectos sobre los neutrófilos y también sobre los macrófagos y los linfocitos CD8+. Todo ello indica que sus acciones son claramente distintas. Los resultados obtenidos en ensayos clínicos con la administración concomitante de CI y roflumilast indican que esta asociación es segura y que roflumilast mantiene su eficacia clínica87. Se debe evitar la utilización de roflumilast con teofilinas.
Los efectos adversos con roflumilast suelen aparecer al inicio del tratamiento, son rápidamente detectados por el paciente y suelen desaparecer en las cuatro primeras semanas, pero en ocasiones condicionan el abandono del fármaco. Los más frecuentes son pérdida de peso, efectos gastrointestinales, náuseas, dolor de cabeza y pérdida de apetito. Entre los efectos gastrointestinales, la diarrea es el más frecuente y aparece en el 8-9% de los pacientes incluidos en ensayos clínicos. Las náuseas se notificaron en el 3-5% de los pacientes. La pérdida de peso se produce entre un 6-12% de los casos. Esta pérdida de peso se aprecia en los primeros 6 meses de tratamiento, no progresa de forma significativa y en la mayoría de los pacientes se resuelve cuando se interrumpe el tratamiento. Por todo ello, y debido a que roflumilast es un tratamiento crónico, es recomendable controlar el peso, especialmente en los primeros meses de tratamiento. El perfil de seguridad de roflumilast no se modifica en función del tratamiento concomitante que el paciente pueda estar tomando para la EPOC.
P15. En los pacientes con EPOC, ¿se deben usar los inhibidores de la fosfodiesterasa 4 (roflumilast) para prevenir las exacerbaciones?
Recomendación débil a favor. Se sugiere el uso de roflumilast, como fármaco de segunda línea para prevenir exacerbaciones, en pacientes con fenotipo agudizador, bronquitis crónica y limitación grave al flujo aéreo.
Especificaciones. Su perfil de seguridad puede hacer que la tolerancia al fármaco sea escasa. Se debe prestar atención a la posible aparición de efectos adversos.
Utilización de antibióticos en la EPOC estableLa utilización de antibióticos en la EPOC estable se ha llevado a cabo empíricamente desde la década de 1960 en lo que se llamaba profilaxis antibiótica. Una revisión sistemática de los ensayos realizados hasta la década de 1980 concluyó que existía un efecto beneficioso significativo en la reducción de agudizaciones, aunque de escasa magnitud88. En estos estudios se incluían poblaciones mal definidas, con frecuencia pacientes con bronquitis crónica, sin confirmación diagnóstica de EPOC.
En la última década se han llevado a cabo ECA con un diseño más riguroso que pretenden conocer la eficacia de los antibióticos administrados en fase estable para la prevención de las agudizaciones. Se puede dividir estos estudios en dos grupos: a) los que utilizan macrólidos con intención de aprovechar también su acción antiinflamatoria, y b) los que utilizan quinolonas para lograr la prevención de agudizaciones a través de una máxima erradicación bacteriana.
Macrólidos en la EPOC en fase estableLos macrólidos, administrados de forma prolongada por su actividad antiinflamatoria e inmunomoduladora89, han demostrado, en pacientes estables con EPOC grave, reducir de forma significativa el número de agudizaciones. Las pautas utilizadas han sido: eritromicina (250 mg/12 h durante 1 año90); azitromicina (500 mg/día 3 días por semana durante 1 año91,92), y azitromicina (250 mg/día durante 1 año93). Los resultados de todos ellos han coincidido en demostrar una reducción significativa de las agudizaciones. Sin embargo, las poblaciones estudiadas fueron distintas y las pautas diferentes, por lo que es difícil hacer una recomendación. Cabe destacar que en el estudio de Albert et al93 se comprobó un aumento de las resistencias bacterianas a macrólidos y un aumento de problemas auditivos en los pacientes tratados con azitromicina. La indicación del tratamiento a largo plazo con macrólidos sería en pacientes de alto riesgo con al menos 3 agudizaciones durante el año previo a pesar de seguir un tratamiento inhalado adecuado92,94. Por analogía a las pautas utilizadas en pacientes con similares características y afectados de bronquiectasias, la dosis recomendada sería azitromicina 250 o 500 mg/día/3 días por semana durante 1 año, con repetición en sucesivos períodos invernales (de noviembre a mayo) en caso de respuesta (ausencia de agudizaciones). Este tratamiento debe reservarse a centros de referencia con seguimiento clínico, auditivo y de bioquímica hepática y microbiológico con identificación de microorganismos en esputo y estudio de sensibilidad a los antibióticos.
No hay evidencia de la eficacia de este tratamiento más allá del año de seguimiento, por lo que se recomienda evaluar el posible riesgo-beneficio de forma anual95.
Quinolonas en la EPOC en fase estableLa utilización de quinolonas durante los períodos de estabilidad (tratamiento de la infección bronquial crónica) ha demostrado erradicar las bacterias presentes en el esputo en la mayoría de pacientes con EPOC grave y agudizaciones frecuentes96. En el ensayo clínico PULSE97, se evaluó la eficacia de la administración cíclica de moxifloxacino (400 mg/día, 5 días cada 2 meses) durante un año en pacientes con EPOC estable. Los resultados demostraron que el tratamiento redujo de forma significativa un 45% las agudizaciones en los pacientes que presentaban esputo purulento o mucopurulento, es decir, aquellos con mayor probabilidad de presentar una infección bronquial bacteriana crónica. En este estudio no se observó un incremento significativo de las resistencias.
En este caso nos encontramos en un terreno experimental, sin indicación aprobada y con muchos interrogantes. No se conoce la duración óptima de esta terapia, el intervalo más adecuado, ni si sería más útil la rotación de antibióticos que mantener siempre una quinolona. Tampoco se puede asegurar que la falta de desarrollo de resistencias observada durante un año de tratamiento pulsátil se extienda con usos más prolongados. Se debe excluir de este tratamiento a los pacientes con colonización bronquial por Pseudomonas aeruginosa. Debido a que las quinolonas son el tratamiento de primera elección en el manejo de las agudizaciones de la EPOC en pacientes graves, es importante preservar esta clase de antibióticos, por lo que se desaconseja el uso de quinolonas a largo plazo con finalidad preventiva.
Los pacientes candidatos a tratamiento crónico o cíclico con antibióticos son pacientes con alta probabilidad de ser portadores de bronquiectasias. La presencia de bronquiectasias confirmada mediante tomografía computarizada de alta resolución (TACAR) debe investigarse en los pacientes con fenotipo agudizador, ya que pueden actuar como un factor favorecedor de la infección bronquial crónica y contribuir a mantener un círculo vicioso amplificando la inflamación subyacente e induciendo la presencia de agudizaciones frecuentes98. Así, las bronquiectasias se han vinculado a la existencia de agudizaciones repetidas y más graves99,100 y también a un peor pronóstico con una mayor mortalidad101. Los pacientes con EPOC, agudizadores frecuentes y con infección bronquial crónica se deben tratar con antibióticos, de acuerdo con las normativas de tratamiento de las bronquiectasias102.
Se debe tener mayor cautela al prescribir CI para la prevención de agudizaciones de tipo infeccioso, en pacientes con expectoración purulenta ya sea en fase estable o durante las agudizaciones, con bronquiectasias y/o con infección bronquial crónica. Estos pacientes pueden ser candidatos a recibir tratamiento con inhibidores de la PDE4 (si presentan tos y expectoración crónica), mucolíticos, antioxidantes76 y, en casos muy seleccionados, macrólidos de forma crónica o cíclica93,97,98.
P16. En los pacientes con EPOC estable, ¿se recomienda el uso de antibióticos orales para prevenir las exacerbaciones?
Recomendación débil a favor. En pacientes con EPOC con fenotipo agudizador, con al menos 3 agudizaciones durante el año previo a pesar del tratamiento adecuado, se sugiere el tratamiento con macrólidos a largo plazo.
Especificaciones. El grupo elaborador cree que se debe restringir esta indicación en pacientes con frecuentes agudizaciones y grado de obstrucción grave. Una vez seleccionados, se debe realizar un control estricto ante los posibles efectos adversos asociados al tratamiento (como la prolongación del intervalo QT, la pérdida de la capacidad auditiva o la generación de resistencias).
Recomendación fuerte en contra. En pacientes con EPOC en fase estable, no se recomienda administrar tratamiento crónico con fluoro-quinolonas con el propósito de prevenir exacerbaciones.
Especificaciones. Debido al riesgo de desarrollo de resistencias bacterianas, el grupo elaborador de la guía está de acuerdo en racionalizar el uso de estos agentes y no indicarlo como pauta preventiva de exacerbaciones.
Otros tratamientos farmacológicos específicosOxigenoterapia crónica domiciliariaLa oxigenoterapia crónica domiciliaria (OCD) es un tratamiento que consigue aumentar la supervivencia en pacientes con EPOC e insuficiencia respiratoria grave103–105. También ha demostrado reducir el número de exacerbaciones y hospitalizaciones y mejorar la capacidad de esfuerzo y la calidad de vida106.
Los beneficios conseguidos con la oxigenoterapia dependen de la duración de su administración. Se recomienda que la duración diaria de la OCD debe ser al menos de 16-18 h107,108, con el objetivo de mantener una presión arterial de oxígeno ≥ 60 mmHg o una saturación de oxígeno ≥ 90% en situación de reposo y a nivel del mar (evidencia moderada, recomendación fuerte a favor).
La indicación debe realizarse cuando la enfermedad está en fase estable, mediante la realización de una gasometría arterial (tabla 2). La gasometría arterial es el método de elección para establecer la indicación de la OCD109.
Indicaciones de la oxigenoterapia crónica domiciliaria111
| • Paciente con EPOC estable, en reposo y a nivel del mar, respirando aire ambiente |
| • Presión arterial de oxígeno entre 55-60 mmHg con repercusión por hipoxemia |
| • Presión arterial de oxígeno entre 55-60 mmHg con repercusión por hipoxemia |
| • Hipertensión arterial pulmonar/cor pulmonale |
| • Insuficiencia cardíaca congestiva/arritmias |
| • Hematocrito > 55% |
El seguimiento y la evaluación del cumplimiento del tratamiento es un objetivo clave110,111. Cuando se indica la OCD se debe comprobar que el paciente realiza un tratamiento adecuado para la EPOC, que no solo incluya el tratamiento farmacológico, sino el cese del tabaquismo y un correcto tratamiento de las comorbilidades, fundamentalmente cardiovasculares. También es importante recordar la necesidad de revaluarse y confirmar la indicación de oxigenoterapia domiciliaria si la indicación se efectuó en el contexto de una agudización.
La utilización de la OCD en pacientes con hipoxemia intermitente, como la que aparece durante el sueño o en los pacientes con hipoxemia leve a moderada en reposo o durante el ejercicio, no ha demostrado efectos sobre la supervivencia o el tiempo hasta el primer ingreso hospitalario u otros parámetros clínicos, por lo que no está recomendada103,112. En ausencia de criterios de OCD, la oxigenoterapia nocturna puede considerarse en pacientes con demostración de desaturación nocturna de oxihemoglobina (< 90% durante al menos un 30% del tiempo total de registro) y secuelas relacionadas con la hipoxia (poliglobulia o signos de insuficiencia cardíaca derecha). Se debe considerar la CPAP o la ventilación mecánica, que puede sustituir o complementar la oxigenoterapia113, pero se debe descartar un síndrome de apneas del sueño.
La oxigenoterapia durante la deambulación mejora la capacidad para realizar ejercicio en pacientes con EPOC grave. Se puede utilizar en casos de limitación por disnea y con desaturaciones inferiores al 88% en la prueba de la marcha113. La mejoría conseguida debe revaluarse en los primeros 2 meses, tanto en la disnea como en la distancia recorrida114. No obstante, son necesarios más estudios para definir los beneficios115.
Tratamiento sustitutivo con alfa-l-antitripsinaLas principales sociedades científicas (American Thoracic Society, European Respiratory Society y la Sociedad Española de Neumología y Cirugía Torácica)116–118 recomiendan el tratamiento sustitutivo con alfa-1-antitripsina purificada (AAT) en los pacientes con enfisema pulmonar con un déficit de AAT grave y con fenotipo homocigoto PiZZ o variantes raras deficitarias por su efecto en enlentecer la pérdida de densidad pulmonar medida por TACAR. El estudio RAPID119 es el mayor ensayo clínico realizado hasta la fecha para evaluar la eficacia del tratamiento sustitutivo en frenar la evolución del enfisema en pacientes con déficit grave de AAT. Los resultados demostraron que, tras 2 años de seguimiento, los pacientes en tratamiento presentaban una reducción significativa en la pérdida de densidad pulmonar medida por TACAR en comparación con los pacientes del grupo placebo. Además, el estudio tenía una fase de continuación abierta de 2 años más en la que los pacientes que habían estado en el grupo placebo recibieron tratamiento activo y se observó que enlentecían la progresión de la enfermedad de forma significativa con relación al período anterior de 2 años en el que estuvieron recibiendo el placebo. No obstante, el exceso de pérdida de tejido pulmonar que experimentaron durante los 2 años con placebo no se recuperó. Esto indica la importancia de identificar y tratar precozmente a los pacientes en riesgo de una evolución rápida de su enfermedad para prevenir el daño pulmonar120.
Sus criterios de inclusión y exclusión están bien definidos en las normativas específicas116–118.
Todo paciente con EPOC debe tener al menos una medición de sus concentraciones de alfa-1 antitripsina sérica para descartar que pueda presentar un déficit de esta enzima. Tras la identificación de un paciente con déficit de AAT se debe realizar un estudio familiar para detectar posibles casos no diagnosticados. Los casos detectados deben notificarse al Registro español de pacientes con déficit de alfa-1 antitripsina121 y se deben derivar a un centro de referencia para efectuar un diagnóstico completo y la evaluación del posible tratamiento sustitutivo y un estudio familiar.
Dispositivos de inhalaciónTras la elección del fármaco o fármacos necesarios para el tratamiento del paciente con EPOC, se debe comprobar que el dispositivo de inhalación se ajuste a las necesidades y las capacidades de cada paciente. Hay diversos tipos de dispositivos de inhalación, los más frecuentemente utilizados son los inhaladores de cartuchos presurizados o MDI (metered dose inhalers) y los inhaladores de polvo seco o DPI (dry powder inhalers), que a su vez pueden ser unidosis o multidosis. Recientemente se ha introducido el inhalador de vapor suave o SMI (soft mist inhaler) (tabla 3).
Dispositivos de inhalación utilizados en la enfermedad pulmonar obstructiva crónica
| Inhaladores de cartucho presurizado (MDI) | Convencionales | |
| Modulite® | ||
| Inhaladores de polvo seco (DPI) | Unidosis | Handihaler® |
| Breezhaler® | ||
| Multidosis | Accuhaler® | |
| Turbuhaler® | ||
| Genuair® | ||
| Nexthaler® | ||
| Spiromax® | ||
| Ellipta® | ||
| Easyhaler® | ||
| Forspiro® | ||
| Inhalador de vapor suave (SMI) | Respimat® | |
DPI: dry powder inhalers; MDI: metered dose inhalers; SMI: soft mist inhaler.
Los factores clave en la elección de un dispositivo de inhalación son la capacidad de coordinación del paciente y su capacidad de generar un adecuado flujo inspiratorio. Asimismo, es importante conocer las preferencias del paciente y sus conocimientos a la hora de elegir el dispositivo más adecuado122. No hay estudios que permitan comparar la eficacia de distintos dispositivos de inhalación. Los ensayos clínicos realizados con fármacos diversos utilizando dispositivos diferentes han aportado resultados similares, aunque en estos ensayos se trata de pacientes entrenados y monitorizados, además de haber sido seleccionados por ser capaces de utilizar el dispositivo correspondiente. En la vida real se ha observado que la técnica inhalatoria deficiente y el mayor número de errores en el uso del dispositivo de inhalación se asocian a un peor control de la enfermedad y a un mayor riesgo de agudizaciones123,124.
Asimismo, se debe tener en cuenta que el cambio de dispositivo de inhalación sin una adecuada explicación y adiestramiento constituye un factor de riesgo de mal control de la enfermedad y que el uso de diversos dispositivos en un mismo paciente también aumenta el riesgo de errores en la técnica de inhalación125.
Al iniciar un tratamiento inhalado se debe hacer una demostración con el paciente y verificar que es capaz de utilizar el dispositivo elegido. También es necesario que el paciente regrese con su dispositivo en la siguiente visita y demuestre la técnica inhalatoria para poder comprobar que se realiza con éxito.
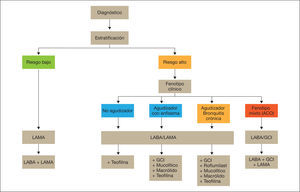
Esquema de tratamiento inicial de la EPOC estableEl esquema de tratamiento inicial de la EPOC estable se presenta en la figura 1. Tras la clasificación del nivel de riesgo, los pacientes con bajo riesgo recibirán inicialmente un LAMA. En caso de persistencia o empeoramiento de los síntomas o agudizaciones, se incrementará el tratamiento a la doble terapia broncodilatadora (LABA/LAMA).
Los pacientes de alto riesgo recibirán como primera elección una combinación de LABA/LAMA. En caso de persistencia o empeoramiento de los síntomas o agudizaciones, se determinará el fenotipo y se añadirán fármacos de acuerdo con el fenotipo del paciente.
Antes de llevar a cabo un aumento en la medicación, es importante investigar el cumplimiento adecuado; el uso de una técnica inhalatoria correcta, y también comprobar la presencia de comorbilidades que puedan ser la causa de la sintomatología.