En el año 2002 miembros de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), la Sociedad Española de Quimioterapia (SEQ), la Sociedad Española de Medicina de Urgencias y Emergencias (SEMES), la Sociedad Española de Medicina General (SEMG) y la Sociedad Española de Medicina Rural y Generalista (SEMERGEN) elaboraron el Segundo Documento de Consenso sobre el uso de antimicrobianos en la agudización de la enfermedad pulmonar obstructiva crónica (EPOC)1. Cinco años después, expertos de las mismas sociedades, conscientes de la amplia difusión e interés práctico que en su momento tuvo el citado documento, se han reunido de nuevo con objeto de actualizarlo a la luz de la bibliografía médica más relevante publicada durante este período. Este Documento de Consenso 2007 incorpora nuevos conocimientos sobre la valoración que ha de darse a la purulencia del esputo en la indicación del tratamiento antibiótico y la evolución de la tasa de resistencia de los principales patógenos frente a los antimicrobianos recomendados en su momento, y recoge la experiencia obtenida en el transcurso de estos años con el empleo de las fluoroquinolonas, la nueva formulación de amoxicilina-ácido clavulánico de liberación retardada, que posibilita la administración oral de dosis elevadas de amoxicilina, y las cefalosporinas orales de tercera generación como el cefditorén, que muestran una elevada actividad intrínseca frente a cepas de neumococo resistente a penicilina.
Magnitud del problemaLa agudización de la EPOC es una causa frecuente de consulta, tanto en atención primaria como en los servicios hospitalarios, y representa el 2% de las urgencias asistidas2, con amplias variaciones estacionales. La agudización de causa infecciosa constituye el 1,5% de las urgencias atendidas en el hospital y el 13,7% de las infecciones. Hasta el 40% de los pacientes atendidos por esta causa en urgencias precisan ingreso hospitalario3. Un 4% de la población general europea consulta a su médico al menos una vez al año por agudización respiratoria, y un 20% de estas consultas corresponde a pacientes con EPOC4. En España, en más del 90% de los casos de agudización respiratoria de la EPOC se prescribe un tratamiento antibiótico empírico5, aunque la microbiología del esputo se estudia sólo en el 5% de los pacientes6. Las penicilinas, las cefalosporinas y los macrólidos son los antibióticos más utilizados para el tratamiento de la agudización de la bronquitis crónica y de la EPOC en España, seguidos por las quinolonas5,7,8.
La infección es causa del 75% de las agudizaciones de la EPOC9. Las bacterias son responsables de la mitad de las agudizaciones de causa infecciosa, principalmente causadas por Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis y Chlamydia pneumoniae10. Sin embargo, en el paciente con EPOC grave con una agudización que requiere ventilación asistida, la infección puede estar causada por Pseudomonas aeruginosa11. El resto de las agudizaciones infecciosas están causadas por virus, en ocasiones asociados a bacterias, o excepcionalmente por otros microorganismos4,9,12,13. En las agudizaciones no infecciosas la causa suele estar mal definida, pero la exposición a contaminación atmosférica, polvo, vapores o humos, o el abandono de la medicación de base de la EPOC, muy probablemente se relacionen con algunas de estas agudizaciones14,15.
Gravedad y criterios de hospitalización en la agudización de la EPOCLa gravedad de la agudización de la EPOC viene dada por el grado de la alteración funcional del paciente en fase estable, por lo que las mediciones espirométricas constituyen la herramienta principal para su deter minación. El valor del volumen espiratorio forzado en el primer segundo (FEV1), expresado como porcentaje respecto al valor de referencia, es el mejor indicador de la gravedad del paciente. El FEV1 tiene las ventajas de que es fácil de determinar, posee una alta reproducibilidad y está bien correlacionado con el pronóstico de la enfermedad16. Se propone la siguiente clasificación de la gravedad de la enfermedad según el valor del FEV1, de acuerdo con las normativas Global Initiative for Chronic Obstructive Lung Disease (GOLD)16:
- –
EPOC leve: FEV1 superior al 80% del valor de referencia.
- –
EPOC moderada: FEV1 entre el 50 y el 80% del valor de referencia.
- –
EPOC grave: FEV1 entre el 30 y el 50% del valor de referencia.
- –
EPOC muy grave: FEV1 inferior al 30% del valor de referencia.
Estos valores corresponden a la medición del FEV1 tras la prueba broncodilatadora y siempre en presencia de obstrucción bronquial definida por un cociente FEV1/capacidad vital forzada inferior al 70%.
Tratamiento extrahospitalarioComo primera opción, el paciente con agudización de EPOC leve a moderada, e incluso en muchos casos de EPOC grave, será tratado ambulatoriamente. El tratamiento hospitalario será necesario en casos de dudas diagnósticas o cuando la evolución no sea favorable17. En todos los episodios de agudización deberá realizarse un seguimiento a las 48-72h de la primera consulta para modificar el tratamiento si la evolución no es adecuada (cambio en el tratamiento o remisión del paciente al hospital).
El tratamiento ambulatorio deberá optimizarse con el empleo de broncodilatadores de acción rápida a dosis elevadas. La utilización de corticoides orales para tratar la agudización de la EPOC leve a moderada no es siempre necesaria, aunque si el paciente recibía corticoides inhalados en su tratamiento de mantenimiento se mantendrán durante la agudización. Sin embargo, cuando en la visita de seguimiento no se haya detectado una evolución favorable, será aconsejable asociar glucocorticoides orales al tratamiento. Las pautas recomendadas son de 0,5mg/kg/día en dosis única matutina durante 7-10 días. Prolongar el tratamiento más de 14 días no mejora la evolución y se asocia a una mayor incidencia de efectos adversos18.
Tratamiento hospitalarioEs aconsejable que los episodios de agudización en los pacientes con EPOC muy grave sean evaluados en el hospital (tabla I). Si no se conoce cuál era la capacidad funcional respiratoria del paciente en fase estable, se utilizará el grado de disnea como aproximación a su gravedad. Si presentaba una disnea de grado 3 o superior (tabla II)19, debe considerarse inicialmente que se trata de una EPOC grave o muy grave.
Criterios de evaluación hospitalaria en la agudización de la EPOC
| EPOC muy grave |
| Cualquier grado de gravedad de la EPOC con: |
| Comorbilidad asociada grave |
| Taquipnea (> 30 respiraciones/min) |
| Uso de músculos accesorios |
| Cor pulmonale descompensado |
| Cianosis |
| Signos clínicos de encefalopatía hipercápnica |
| Imposibilidad de controlar la enfermedad en el domicilio |
| Necesidad de descartar otras enfermedades |
| Mala evolución en una visita de seguimiento de la agudización |
Escala de disnea19
| Grado | Definición |
| 0 | Ausencia de sensación disneica excepto al realizar ejercicio intenso |
| 1 | Disnea al andar deprisa o subir una cuesta poco pronunciada |
| 2 | Incapacidad de mantener el paso de otras personas de la misma edad, caminando en llano, debido a la dificultad respiratoria, o tener que parar a descansar al andar en llano al propio paso |
| 3 | Tener que parar a descansar al andar unos 100m o a los pocos minutos de andar en llano |
| 4 | La disnea impide al paciente salir de casa o aparece con actividades como vestirse |
En la agudización de la EPOC muy grave es preciso administrar dosis elevadas de broncodilatadores, por lo que puede ser necesario recurrir a soluciones adecuadas para su administración con un nebulizador. Será asimismo aconsejable administrar glucocorticoides sistémicos desde el inicio. Este tratamiento se mantendrá durante 3 o 4 días y se reducirá posteriormente de forma progresiva. En las agudizaciones que no respondan al tratamiento broncodilatador inicial puede ser de interés la administración adicional de aminofilina intravenosa, aunque su eficacia es controvertida20. Cuando haya insuficiencia respiratoria, se mantendrá una adecuada oxigenación tisular por medio de oxigenoterapia, utilizando la mínima fracción inspiratoria de oxígeno necesaria para conseguir un valor de presión arterial de oxígeno por encima de 60mmHg (o saturación de oxígeno > 90%) sin que se produzca una disminución importante (< 7,3) del valor del pH arterial.
Criterios de hospitalizaciónSe valorará en el hospital a los pacientes con agudización de la EPOC que no presenten mejoría en las primeras 12h, con persistencia del deterioro gasométrico y clínica de disnea intensa. La mortalidad durante un ingreso por agudización de EPOC en pacientes hipercápnicos es del 10%21, por lo que en esta situación deben utilizarse todas las opciones terapéuticas con que pueda conseguirse una mejoría clínica. Es fundamental dejar al paciente en observación en el servicio de urgencias para valorar la evolución en las primeras 24-48h antes de decidir el alta o el ingreso definitivo22.
El alta hospitalaria se considerará cuando se haya producido una mejoría clínica que permita alcanzar una situación próxima a la basal del paciente. Aunque esto no se consiga, puede plantearse el alta siempre que haya estabilidad clínica y gasométrica, y que el paciente sea capaz de controlar la enfermedad en el domicilio, incluso en caso de que persistan la hipoxemia o la hipercapnia.
El tratamiento con corticoides sistémicos se reducirá progresivamente hasta interrumpirlo tras el alta. Siempre será recomendable una visita médica a las 2 semanas del alta, ya que en este período una cuarta parte de los pacientes puede presentar un empeoramiento23. La presencia de hipercapnia en el momento del alta hospitalaria obliga a un seguimiento estricto del paciente, ya que ésta es una situación con elevado riesgo de mortalidad en los meses siguientes21,24.
Recomendaciones para el diagnóstico microbiológico de las agudizaciones de la EPOCLos microorganismos implicados en las agudizaciones de la EPOC varían en función de la gravedad de la obstrucción25,26 y del tratamiento antibiótico que el paciente haya recibido con anterioridad27. En la obstrucción de grado leve o moderado (FEV1 > 50%) predominan S. pneumoniae, H. influenzae y M. catarrhalis. En caso de obstrucción grave (FEV1 del 30-50%) o muy grave (FEV1 < 30%) suelen participar los mismos microorganismos, principalmente H. influenzae, junto con enterobacterias comunes (Escherichia coli, Klebsiella pneumoniae)25,26. Si el paciente ha recibido tratamiento antibiótico en los últimos 3 meses o en 4 o más ocasiones en el curso del último año, aumenta la probabilidad de que la flora del moco bronquial contenga, además, P. aeruginosa27 y ocasionalmente enterobacterias con factores de resistencia añadidos (producción de betalactamasas de espectro ampliado). Por lo general, los pacientes que presentan agudizaciones que requieren tratamiento antibiótico en 4 o más ocasiones en el período de un año suelen tener grados importantes de limitación del flujo aéreo (FEV1 < 50%).
Los estudios broncoscópicos confirman estos hallazgos y, en pacientes con agudización leve que no requieren ingreso hospitalario, han mostrado que cerca de la mitad de la población de pacientes con EPOC tiene bacterias en concentraciones elevadas y que H. influenzae (no tipificable y no capsulado), S. pneumoniae y M. catarrhalis son los microorganismos predominantes28. Sin embargo, en los pacientes que requieren ventilación artificial la frecuencia de estas bacterias es menor y otros microorganismos, como Haemophilus parainfluenzae y P. aeruginosa son los predominantes11,29.
A menudo los microorganismos que normalmente se identifican en las agudizaciones son resistentes a los antibióticos de uso habitual. Hasta el 40% de las cepas de H. influenzae y más del 90% de las de M. catarrhalis son productoras de betalactamasas, lo que implica que antibióticos como la ampicilina y la amoxicilina puedan resultar ineficaces30. También el neumococo es con frecuencia resistente a la penicilina y los macrólidos. En España concretamente las cifras de resistencia de S. pneumoniae a la penicilina se sitúan en torno al 40%, mientras que el porcentaje de resistencia a los macrólidos es cercano al 30%31. Recientemente se ha demostrado que, en pacientes con neumonía comunitaria, una concentración inhibitoria mínima (CIM) de penicilina para el neumococo igual o mayor de 4mg/l, o de 2 o superior de cefotaxima, puede tener implicaciones para el pronóstico de los pacientes32.
Finalmente, es necesario destacar que un porcentaje no desdeñable (del 10 al 20%) de pacientes con agudización moderada a grave no responde al tratamiento empírico inicial y requiere un cambio de antibiótico33,34. En estos casos la infección puede estar causada por Staphylococcus aureus, P. aeruginosa o algún microorganismo atípico no cubierto por la pauta inicial, por lo que una valoración microbiológica ayudaría al ajuste del tratamiento antibiótico de segunda opción. Dada la complejidad bacteriológica de las agudizaciones de cierto grupo de pacientes con EPOC, que pueden estar producidas por microorganismos de difícil tratamiento, así como la posibilidad de que los microorganismos causales sean resistentes a los antibióticos habituales, es aconsejable obtener un diagnóstico etiológico en ciertos grupos de pacientes que presentan una agudización de la EPOC.
Las recomendaciones establecidas son:
- 1.
Los pacientes que no requieren ingreso hospitalario no suelen tener los factores de riesgo antes mencionados y, por lo tanto, la recomendación será tratarlos de forma empírica, sin necesidad de establecer el diagnóstico microbiológico.
- 2.
En los pacientes que requieren hospitalización debe seleccionarse a aquellos que pueden tener riesgo de microorganismos poco habituales (P. aeruginosa) o resistentes a los antibióticos. Así pues, en los casos con tratamiento antibiótico en los 4 meses previos, tratamiento prolongado con corticoides, más de 4 agudizaciones el año anterior y/o obstrucción muy grave al flujo aéreo (FEV1 < 30%) es aconsejable obtener una muestra de secreciones respiratorias para su estudio microbiológico.
- 3.
En los casos de pacientes con EPOC que deben ser ingresados en una unidad de cuidados intensivos, ventilados mecánicamente o no, siempre es aconsejable intentar obtener un diagnóstico microbiológico. La razón es doble: por un lado, porque en estos pacientes suelen coincidir los factores de riesgo antes mencionados, y en segundo lugar, porque la gravedad de la agudización aconseja que el tratamiento antibiótico deba ser lo más ajustado posible en relación con la etiología microbiana.
- 4.
En aquellos otros pacientes que presenten una agudización con mala respuesta al tratamiento empírico, lo cual se evidencia por la persistencia de signos y síntomas capitales de la agudización a las 72h de iniciado el tratamiento, es aconsejable intentar efectuar un diagnóstico microbiológico.
Sangre. La mayoría de los pacientes con agudización de la EPOC no suelen tener bacteriemia, por lo que no es útil obtener muestras de sangre para cultivo. Debe reservarse para aquellos pacientes febriles o para los ingresados en una unidad de cuidados intensivos con una agudización grave.
Muestras de las vías respiratorias. Debe tenerse en cuenta que muchos de los pacientes con agudización de la EPOC han recibido alguna o varias dosis de tratamiento antibiótico antes de la obtención de las muestras, y ello puede afectar de forma significativa a la sensibilidad del método. Hecha esta premisa, las muestras de las vías respiratorias que pueden obtenerse serían las siguientes:
- –
Esputo. La obtención de una muestra de esputo para tinción de Gram y cultivo es la técnica más simple de las existentes. Se considerará válida la muestra que presente predominio de polimorfonucleares sobre células epiteliales escamosas, según la escala de Murray y Washington35. Con la muestra obtenida se procederá a efectuar una tinción de Gram y cultivo en medios habituales. Se recomienda considerar la obtención de una muestra de esputo únicamente en los pacientes hospitalizados con alguno de los factores de riesgo antes mencionados.
- –
Broncoaspiración. En pacientes intubados y ventilados mecánicamente, la aspiración simple a través del tubo orotraqueal es equivalente a la muestra de esputo en el paciente no ventilado. En este caso sí se han validado muestras en las que se han realizado cultivos cuantitativos con técnicas de referencia, como el catéter telescopado, con muy buena concordancia11. En principio, por su facilidad de obtención y buen rendimiento, estas muestras son de elección en el paciente con una vía aérea artificial.
- –
Muestras broncoscópicas. La técnica del catéter telescopado es la que mejor refleja, desde el punto de vista microbiológico, la presencia de infección bronquial, dado su carácter de exploración de tipo segmentario. En principio, como criterio orientativo, debe considerarse que un microorganismo es causante de la infección bronquial cuando el recuento de colonias sea igual o superior a 100 unidades formadoras de colonias/ml11,25, aunque algunos autores28 recomiendan utilizar un punto de corte igual o mayor de 1.000 unidades formadoras de colonias/ml. Esta técnica, en pacientes con agudización de la EPOC, debe reservarse para aquéllos con vía aérea artificial, aunque no hay ninguna evidencia de que proporcione mayor rentabilidad que la broncoaspiración, y puede estar indicada también en algunos pacientes que requieran hospitalización y no respondan al tratamiento inicial. El lavado broncoalveolar no es una técnica que deba aplicarse a los pacientes con agudización de EPOC.
El tratamiento antibiótico de un episodio de agudización de la EPOC tiene por objeto reducir la densidad de población bacteriana en la secreción bronquial36. Consecuentemente, ante cualquier agudización, definida por un empeoramiento de la clínica basal (tos, volumen de la expectoración o disnea), la indicación de tratamiento antibiótico está supeditada a la presencia de un esputo francamente purulento37,38 o a la aparición de cambios de sus características organolépticas (color, opacidad, viscosidad y/o adherencia) que tienden a estar asociadas a un aumento de la purulencia.
Actualmente disponemos de 4 familias de antibióticos cuyo espectro de actividad antimicrobiana incluye a los 2 principales microorganismos implicados en las agudizaciones de la EPOC: las penicilinas, las cefalosporinas, las fluoroquinolonas y los macrólidos/cetólidos.
Entre las penicilinas, la asociación de amoxicilina con ácido clavulánico, administrada por vía oral en dosis de 875/125mg/8h, y la formulación de liberación retardada de 2.000/125mg/12h generan una concentración sérica que permanece por encima del valor de la CIM frente al 90% de las cepas (CIM90) de S. pneumoniae y H. influenzae aisladas en los últimos años en España durante más del 50% del intervalo entre dosis39. Sin embargo, la concentración en la secreción bronquial puede ser insuficiente para una eficacia óptima frente a cepas con valores de CIM90 iguales o superiores a 2mg/l. Afortunadamente la prevalencia actual de estas cepas es baja y sólo limita el empleo de amoxicilina-ácido clavulánico por vía oral en las agudizaciones de la EPOC grave, en las que es necesario considerar, junto a otras opciones terapéuticas, el empleo de la vía parenteral.
Las cefalosporinas orales activas simultáneamente frente a S. pneumoniae y H. influenzae incluyen la cefuroxima, cefpodoxima y cefditorén. De ellas, el cefditorén es la más activa in vitro, con valores de CIM90 similares a los de las cefalosporinas parenterales de tercera generación como cefotaxima y ceftriaxona; de 2 a 4 veces menores que los de cefpodoxima, y de 8 a 16 veces inferiores a los de cefuroxima40,41. Si bien el cefditorén es varias veces más activo que la amoxicilina-ácido clavulánico, en la práctica los parámetros farmacocinéticos/farmacodinámicos de ambos antibióticos son superponibles si se comparan dosis de 400mg/12h de cefditorén con dosis de 2.000/125mg/12h de la formulación retardada de amoxicilina-ácido clavulánico42. La biodisponibilidad de la amoxicilina es lineal dentro de un amplio margen de dosis, lo que permite aumentar la cantidad administrada por toma y conseguir una concentración sérica superior a la de cefditorén, con la que se compensa su menor actividad intrínseca. Tanto la cefixima como el ceftibuteno deben excluirse de las posibles opciones de tratamiento de la infección respiratoria porque, si bien son muy activos frente a H. influenzae, apenas lo son frente a S. pneumoniae, incluso frente a las cepas sensibles a penicilina39,42.
Entre las fluoroquinolonas, tanto el levofloxacino como el moxifloxacino son activos frente a cerca del 100% de las cepas de S. pneumoniae y de H. influenzae, y alcanzan una concentración en la secreción bronquial que es varias veces superior al valor de la CIM para estos microorganismos43,44. Esta circunstancia, unida a su efecto bactericida rápido y dependiente de la concentración, los convierte en las opciones terapéuticas orales potencialmente más eficaces en el tratamiento de las agudizaciones de la EPOC grave o muy grave44,45. El moxifloxacino es de 4 a 8 veces más activo que el levofloxacino frente a S. pneumoniae. Si bien la concentración sérica de levofloxacino es superior a la de moxifloxacino, para obtener un valor del área bajo la curva similar al de moxifloxacino, el levofloxacino debe administrarse a dosis de 500mg/12h o 750mg/24h46. El moxifloxacino ha demostrado prolongar el período sin agudizaciones comparado con el tratamiento con antibióticos considerados de referencia (amoxicilina, cefuroxima o claritromicina). El estudio MOSAIC demostró que los pacientes tratados con moxifloxacino tenían un período libre de síntomas de 132 días, comparado con 118 días del grupo control (p = 0,03)47. Este efecto se atribuye a una mayor erradicación bacteriana, especialmente en comparación con los macrólidos47,48.
En último lugar, entre las posibles pautas terapéuticas utilizables por vía oral cabe considerar a los macrólidos (eritromicina, acitromicina y claritromicina). En España, en torno al 30% de las cepas de S. pneumoniae son resistentes a todos los macrólidos49, con valores de CIM muy superiores a la concentración que éstos alcanzan en suero y secreción bronquial. Por otro lado, la mayoría de las cepas de H. influenzae son resistentes a eritromicina y claritromicina. En cierta medida, es posible que el beneficio observado in vivo con el empleo de un macrólido en agudizaciones de la EPOC leve o moderada esté en relación con su potencial efecto antiinflamatorio. Los macrólidos deben contemplarse como un tratamiento alternativo válido para casos en que, por alergia o cualquier otro motivo, no pueda emplearse un betalactámico o una fluoroquinolona. La telitromicina es un cetólido que, a diferencia de los macrólidos, muestra actividad bactericida frente a cerca del 100% de cepas de S. pneumoniae. Por otro lado, de forma similar a la acitromicina, resulta activa frente a un porcentaje elevado de cepas de H. influenzae50. Sin embargo, las recientes descripciones de casos de hepatotoxicidad, ocasionalmente grave, han llevado a excluirla de las opciones de primera elección51.
Entre los antibióticos potencialmente útiles para el tratamiento de las agudizaciones de la EPOC, la elección del más apropiado debe basarse tanto en la valoración del patrón de sensibilidad de los microorganismos más probables como en la gravedad de cada caso. Así, el tratamiento antibiótico empírico inicial de un paciente con EPOC leve o moderada y sin comorbilidad, del que no se espera que presente más de 1-2 agudizaciones al año, puede hacerse con un margen razonable de seguridad empleando antibióticos cuya actividad abarque a la mayoría de los aislamientos de neumococo o Haemophilus actualmente prevalentes en la comunidad. En cambio, ante la agudización de una EPOC grave o muy grave o con factores de riesgo de fracaso, es aconsejable elegir antibióticos con la máxima actividad frente a los microorganismos causales y que a su vez desarrollen una acción rápidamente bactericida.
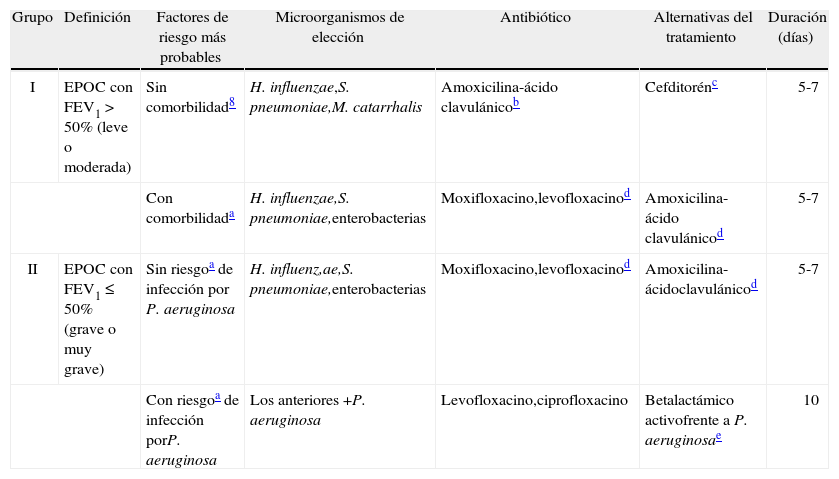
Estudios clínicos realizados con amoxicilina-ácido clavulánico (2.000/125mg)52, cefditorén53, levofloxacino54, moxifloxacino47,55 y telitromicina56 indican que estos antibióticos pueden emplearse en el tratamiento de las agudizaciones de la EPOC en regímenes de 5 días de duración. Los siguientes criterios: a) gravedad de la EPOC, determinada por el valor del FEV1; b) existencia o no de comorbilidad significativa (diabetes mellitus, cirrosis hepática, insuficiencia renal crónica o cardiopatía), y c) riesgo de participación de P. aeruginosa en la agudización (establecido por el antecedente de haber recibido tratamiento antibiótico en los últimos 3 meses o en más de 4 ocasiones durante el último año), permiten clasificar a los pacientes con agudización de la EPOC en 2 grupos (tabla III). En el grupo I se incluyen las agudizaciones en EPOC leve o moderada (FEVj > 50%), y en el grupo II en EPOC grave o muy grave (FEV1 ≤ 50%). A su vez, los pacientes del grupo I se subdividen de acuerdo con la existencia o no de factores de riesgo de fracaso, y los del grupo II según la existencia o no de riesgo de infección por P. aeruginosa. En el grupo I el tratamiento antibiótico, dirigido contra H. influenzae y S. pneumoniae, puede hacerse con amoxicilina-ácido clavulánico, administrada a dosis de 875/125mg/8h durante 7 días. La formulación de liberación retardada de 2.000/125mg administrada cada 12h durante 5 días se ha mostrado equivalente a la pauta de 875/125mg/8h administrada durante 7 días52. En los pacientes en que por alergia a la penicilina (no anafiláctica) o por cualquier otra causa no pueda emplearse amoxicilina, la alternativa es cefditorén administrado a dosis de 400mg/12h por vía oral durante 5 días y, en segundo lugar, un macrólido (acitromicina o claritromicina). En la mayoría de los estudios realizados con cefditorén en el tratamiento de las agudizaciones de la bronquitis crónica se han empleado dosis de 200mg/12h53. Sin embargo, la sensibilidad de las cepas de S. pneumoniae prevalentes actualmente en España hace aconsejable el empleo de dosis de 400mg/12h.
Clasificación de los pacientes con EPOC y pautas de tratamiento antibiótico empírico recomendadas en las exacerbaciones en función de los microorganismos más probables
| Grupo | Definición | Factores de riesgo más probables | Microorganismos de elección | Antibiótico | Alternativas del tratamiento | Duración (días) |
| I | EPOC con FEV1 > 50% (leve o moderada) | Sin comorbilidad8 | H. influenzae,S. pneumoniae,M. catarrhalis | Amoxicilina-ácido clavulánicob | Cefditorénc | 5-7 |
| Con comorbilidada | H. influenzae,S. pneumoniae,enterobacterias | Moxifloxacino,levofloxacinod | Amoxicilina-ácido clavulánicod | 5-7 | ||
| II | EPOC con FEV1 ≤ 50% (grave o muy grave) | Sin riesgoa de infección por P. aeruginosa | H. influenz,ae,S. pneumoniae,enterobacterias | Moxifloxacino,levofloxacinod | Amoxicilina-ácidoclavulánicod | 5-7 |
| Con riesgoa de infección porP. aeruginosa | Los anteriores +P. aeruginosa | Levofloxacino,ciprofloxacino | Betalactámico activofrente a P. aeruginosae | 10 | ||
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo.
Los pacientes del grupo I con factores de riesgo y los del grupo II sin criterios de infección por P. aeruginosa pueden tratarse con moxifloxacino (400mg/24h durante 5-7 días) o con levofloxacino (500mg/12-24h durante 7 días) administrados por vía oral. En este grupo de pacientes, la amoxicilina-ácido clavulánico administrada a dosis de 2.000/125mg/12h se considera una alternativa. Si es preciso el ingreso hospitalario, debe contemplarse la opción de tratamiento parenteral con levofloxacino (500mg/12h), amoxicilina-ácido clavulánico (1-2g/6-8h), cefotaxima (1-2g/8h) o ceftriaxona (1g/12-24h). El tratamiento parenteral con una cefalosporina puede seguirse de tratamiento oral con cefditorén. Finalmente, los pacientes incluidos en el grupo II que cumplen criterios de riesgo de infección por P. aeruginosa pueden recibir tratamiento por vía oral con dosis altas de ciprofloxacino o levofloxacino. Sin embargo, dado que la tasa actual de resistencia de P aeruginosa a ambas fluoroquinolonas es superior al 30%57, antes de iniciar el tratamiento es conveniente solicitar el cultivo de una muestra respiratoria. Los parámetros farmacodinámicos (valor del área bajo la curva de concentración/tiempo por encima de la CIM) del levofloxacino frente a P. aeruginosa son superponibles a los del ciprofloxacino empleando dosis máximas de ambos antibióticos58.
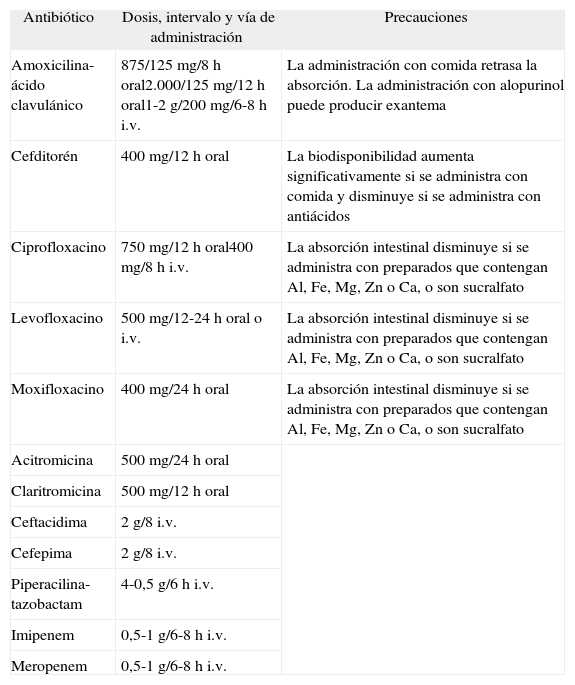
En casos graves es necesario iniciar el tratamiento por vía parenteral con un antibiótico betalactámico activo frente a P. aeruginosa (cefepima, ceftacidima, piperacilina-tazobactam, imipenem o meropenem), solo o preferiblemente asociado con un aminoglucósido (tobramicina o amikacina), durante los primeros 3 a 5 días. El levofloxacino o ciprofloxacino pueden sustituir al aminoglucósido en caso de que haya contraindicaciones para el empleo de aquéllos y la cepa sea sensible. En la tabla III se resumen las pautas de tratamiento empírico recomendadas para cada uno de los grupos de EPOC descritos. En la tabla IV se mencionan las dosis, intervalo y principales precauciones de administración de antibióticos para el tratamiento de la agudización de la EPOC.
Dosis, intervalo y precauciones de administración de los antibióticos empleados en el tratamiento de las exacerbaciones de la EPOC
| Antibiótico | Dosis, intervalo y vía de administración | Precauciones |
| Amoxicilina-ácido clavulánico | 875/125mg/8h oral2.000/125mg/12h oral1-2g/200mg/6-8h i.v. | La administración con comida retrasa la absorción. La administración con alopurinol puede producir exantema |
| Cefditorén | 400mg/12h oral | La biodisponibilidad aumenta significativamente si se administra con comida y disminuye si se administra con antiácidos |
| Ciprofloxacino | 750mg/12h oral400mg/8h i.v. | La absorción intestinal disminuye si se administra con preparados que contengan Al, Fe, Mg, Zn o Ca, o son sucralfato |
| Levofloxacino | 500mg/12-24h oral o i.v. | La absorción intestinal disminuye si se administra con preparados que contengan Al, Fe, Mg, Zn o Ca, o son sucralfato |
| Moxifloxacino | 400mg/24h oral | La absorción intestinal disminuye si se administra con preparados que contengan Al, Fe, Mg, Zn o Ca, o son sucralfato |
| Acitromicina | 500mg/24h oral | |
| Claritromicina | 500mg/12h oral | |
| Ceftacidima | 2g/8 i.v. | |
| Cefepima | 2g/8 i.v. | |
| Piperacilina-tazobactam | 4-0,5g/6h i.v. | |
| Imipenem | 0,5-1g/6-8h i.v. | |
| Meropenem | 0,5-1g/6-8h i.v. |
EPOC: enfermedad pulmonar obstructiva crónica; i.v.: intravenoso.
Uno de los objetivos principales del tratamiento de la EPOC es prevenir las agudizaciones. Los pacientes viven estos episodios con gran angustia y reclaman la posibilidad de evitarlos con un tratamiento farmacológico preventivo59. Hay diversas estrategias terapéuticas destinadas a la prevención de agudizaciones (tabla V)60. De acuerdo con los objetivos de esta guía, se repasarán las relacionadas con la prevención de las agudizaciones de etiología infecciosa.
Estrategias destinadas a reducir la frecuencia de agudizaciones
| De eficacia demostrada |
| Dejar de fumar |
| Optimizar el tratamiento de la EPOC en fase estable |
| Tratamiento con corticoides inhalados en pacientes con FEV1 < 50% |
| Administrar vacunaciones antigripal y antineumocócica |
| Tratamiento antibiótico erradicador en las agudizaciones |
| Tratamiento con corticoides orales en las agudizaciones |
| Rehabilitación respiratoria |
| Educación sanitaria, plan de autocuidados de la enfermedad |
| De eficacia cuestionada |
| Inmunomoduladores |
| Antioxidantes |
| Mucolíticos |
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo.
Tradicionalmente la vacunación ha constituido una opción útil para la prevención de ciertas enfermedades infecciosas. En el caso de la EPOC, las vacunas antineumocócica y antigripal tienen una potencial aplicación en la prevención de las agudizaciones.
La vacuna antineumocócica ha demostrado su eficacia para prevenir la neumonía neumocócica y la enfermedad invasiva por neumococo en adultos, incluidos los mayores de 65 años61. Por este motivo los Centers for Disease Control estadounidenses recomiendan la vacunación en mayores de 65 años y en individuos con un mayor riesgo de infección neumocócica, entre los que se encuentran los pacientes con enfermedades respiratorias crónicas62. En los mismos grupos de riesgo está indicada la revacunación transcurridos al menos 6-8 años de la vacunación inicial. Estudios realizados en España han demostrado que la vacuna antineumocócica es eficaz para prevenir la mortalidad por neumonía en mayores de 65 años63. En concreto, en pacientes con EPOC fue eficaz a la hora de reducir la incidencia de neumonía en los menores de 65 años y en pacientes con obstrucción grave al flujo aéreo64. Todos estos hallazgos justifican la vacunación antineumocócica sistemática de todos los pacientes con EPOC.
Por otro lado, diversos estudios han demostrado la importancia de las infecciones víricas en la EPOC9,12,65. Hay evidencias de que la vacuna antigripal inactivada, administrada por vía intramuscular, es eficaz para reducir la frecuencia de agudizaciones en pacientes con EPOC66, por lo que se recomienda su administración anual.
En el terreno de los inmunomoduladores, se comercializan desde hace años preparados de extractos liofilizados bacterianos para administración oral con el fin de mejorar los síntomas y prevenir las agudizaciones. En una revisión sistemática reciente se han analizado los resultados de 13 ensayos clínicos aleatorizados y controlados con placebo67. Los autores de la revisión reconocen que la mayoría de los ensayos son de baja calidad metodológica y no demuestran de forma concluyente un efecto en la prevención de agudizaciones. El único efecto significativo que se ha hallado es una reducción de la intensidad de los síntomas y una reducción media de la duración de las agudizaciones de 3 días, aunque la mala calidad de los estudios hace que estos resultados deban interpretarse con cautela.
Más interesante es la utilización de AM3 (Inmunoferón®), un inmunomodulador que es capaz de restablecer en parte la capacidad citotóxica de las células citolíticas e incrementar la capacidad fagocítica de los macrófagos y neutrófilos circulantes, capacidades que se encuentran afectadas en la EPOC. En un reciente ensayo clínico aleatorizado y doble ciego en pacientes con EPOC, entre los tratados con AM3 se observó una reducción leve, no significativa, del porcentaje de pacientes con agudizaciones a lo largo de 6 meses de seguimiento, acompañada de una mejoría significativa de la calidad de vida68. Serán necesarios estudios más amplios y prolongados para demostrar su eficacia en la prevención de agudizaciones en la EPOC.
La infección bronquial es uno de los procesos más importantes en la historia natural de la EPOC. El conocimiento de los mecanismos de interacción entre el huésped y los microorganismos debe ayudar a diseñar estrategias más eficaces para combatir la colonización y la infección en pacientes con EPOC y de esta forma mejorar el pronóstico de esta enfermedad tan frecuente.
Participantes en la elaboración del Documento de ConsensoCoordinador: José Ángel García-Rodríguez (SEQ).
Miembros del Comité Científico:
Por la SEQ: José Ángel García-Rodríguez (Departamento de Microbiología. Hospital Universitario de Salamanca), José Mensa (Servicio de Enfermedades Infecciosas. IDIBAPS. Hospital Clínic. Barcelona), Juan J. Picazo (Servicio de Microbiología. Hospital Clínico San Carlos. Madrid).
Por la SEPAR: Marc Miravitlles (Servicio de Neumología. Institut Clínic del Tórax. IDIBAPS. Hospital Clínic. Barcelona), Eduard Monsó (Servicio de Neumología. Hospital Germans Trias i Pujol. Badalona. Barcelona).
Por la SEMES: Manuel S. Moya Mir (Servicio de Medicina Interna. Hospital Puerta de Hierro. Madrid), Mikel Martínez Ortiz de Zárate (Servicio de Urgencias. Hospital de Basurto. Bilbao. Vizcaya).
Por la SEMG: Mario Bárcena Caamaño (Centro de Salud de Cariñena. Zaragoza), Jesús Aguarón Pérez (Centro de Salud Soria-Sur. Soria).
Por la SEMERGEN: José Luis Cañada Merino (Centro de Salud de Algorta. Getxo. Vizcaya), José Antonio Quintano Jiménez (Centro de Salud de Lucena. Córdoba).
Por la SEMI: José Barberán (Servicio de Medicina Interna. Hospital de la Defensa. Madrid).
AgradecimientosA GlaxoSmithKline por su apoyo para hacer realidad este documento.
Documento publicado simultáneamente en SEMERGEN. 2008;34(2):66-74.
Al final del artículo se indican los servicios de los participantes en la elaboración del Documento de Consenso.