El cáncer de pulmón (CP) es un grave problema sanitario debido a su elevada incidencia y mortalidad. La cirugía es la más eficaz de las estrategias terapéuticas en este tipo de tumor, pero en los últimos años se están investigando nuevos fármacos contra componentes diana específicos de las células tumorales, que mejoran la supervivencia en pacientes con enfermedad avanzada y recurrencias. Presentamos una revisión de los tratamientos individualizados en el CP, en particular las terapias inhibidoras del receptor de crecimiento epidérmico (EGFR), del factor de crecimiento endotelial vascular (VEGF) y de la cinasa del linfoma anaplásico (ALK).
Lung cancer (LC) is a serious health problem due to its high incidence and mortality. Surgery is the most effective therapeutic strategy in this type of tumor, but in recent years new drugs are being investigated that target specific components of the tumor cells, improving survival in patients with advanced disease and relapse. We present a review of individualized treatments in LC, particularly therapies that inhibit epidermal growth factor receptor (EGFR), vascular endothelial growth factor (VEGF) and anaplastic lymphoma kinase (ALK).
El cáncer de pulmón (CP) es la principal causa de muerte por cáncer en el mundo1,2, provocando 1,3 millones de muertes al año (el 29% de los fallecimientos por cáncer)3. Más del 80% de los CP son carcinomas no microcíticos (CPNM) y, dentro de estos, se diferencian varias estirpes histológicas, como el adenocarcinoma –el más frecuente de forma global, con el 38% de los casos–, el carcinoma escamoso o epidermoide y el carcinoma de célula grande, entre otros4. Su supervivencia a largo plazo es baja, y oscila entre el 7 y el 15% a los 5 años1,2. Esto se debe a que la mayoría de los pacientes se diagnostican en estadios avanzados, donde la opción del tratamiento quirúrgico –que es, hasta el momento, la más eficaz de las estrategias terapéuticas– ya no existe5–8.
En los últimos años se están investigando numerosas alteraciones moleculares (mutaciones, amplificaciones génicas), responsables de la supervivencia tumoral, y por tanto, con influencia en el pronóstico vital de los pacientes. Los tratamientos que actúan sobre estas alteraciones son las llamadas terapias dirigidas o individualizadas (target therapy), que se basan en el reconocimiento de alteraciones clínicas o moleculares comunes y que pueden suponer una esperanza para mejorar la supervivencia de los estadios no quirúrgicos.
Uno de los mediadores más estudiados, por sus implicaciones terapéuticas, es el receptor del factor de crecimiento epidérmico (EGFR), que desempeña un papel en el crecimiento, la proliferación y la motilidad celulares9. Se han desarrollado fármacos inhibidores del EGFR (anti-EGFR), tales como erlotinib y gefitinib, que han demostrado mejorar la supervivencia en pacientes con enfermedad avanzada y recurrencias.
Otra molécula en investigación es el factor de crecimiento endotelial vascular (VEGF), implicado en el proceso de angiogénesis tumoral. Altos niveles en el tumor o en el suero se han relacionado con estadios avanzados y peor supervivencia10. El bevacizumab es un anticuerpo monoclonal humanizado que actúa mediante la unión y la neutralización del VEGF11.
Recientemente se ha aprobado el uso de un nuevo fármaco en el CPNM, el crizotinib, un inhibidor de la cinasa del linfoma anaplásico (ALK), un oncogén que es positivo en alrededor del 5 al 13% de los pacientes con CPNM, y su inhibición tiene un impacto beneficioso en la supervivencia12.
En este artículo haremos una revisión de la evidencia científica actual sobre estos tratamientos.
Inhibidores del EGFREl EGFR es una glucoproteína transmembrana con actividad tirosina cinasa (TK) que está codificada por un gen localizado en el cromosoma 7p12. Es uno de los 4 miembros de la familia de receptores TK HER (human epidermal receptor)13. El EGFR juega un considerable papel en la carcinogénesis y su sobreexpresión ha sido relacionada con enfermedad avanzada y peor pronóstico14. Las mutaciones que afectan al dominio TK solo se han descrito en el CPNM, y las más frecuentes se encuentran en el exón 19 y en el exón 2115,16. Estas mutaciones se determinan en tejido tumoral introducido en parafina y están especialmente asociadas con el subtipo adenocarcinoma, sobre todo los bronquioloalveolares, y con las mujeres de origen oriental y no fumadoras17,18. Los pacientes con estas mutaciones tienen alta probabilidad de responder a las terapias anti-EGFR. Actualmente, los fármacos de este grupo con los que se tiene más experiencia son el erlotinib y el gefitinib; ambos inhiben de forma reversible la actividad catalítica del receptor, interrumpen la transducción de la señal de crecimiento y producen un efecto antitumoral. Son los que más estrechamente se han asociado con la respuesta parcial o mejoría clínica de los pacientes con mutaciones en el gen EGFR19.
Shepherd et al.20 demostraron que el erlotinib, como agente único, prolongaba la supervivencia en pacientes con CPNM después de quimioterapia (QT) de primera o segunda línea (p=0,001). La supervivencia al año mejoró del 21 al 31%, sobre todo en los pacientes que nunca habían fumado. Este es el primer estudio que confirmó que un anti-EGFR prolonga la supervivencia después de QT de primera o segunda línea, y su uso clínico fue aprobado en Estados Unidos en 2004. Sin embargo, en el estudio IRESSA Survival Evaluation in Lung Cancer (ISEL)21, el gefitinib en pacientes con CPNM avanzado no mejoró la supervivencia frente a placebo (p=0,08), aunque, en el grupo de tratamiento, esta fue significativamente más larga en los nunca fumadores y en la población asiática.
En un estudio prospectivo del Spanish Lung Cancer Group22, que incluyó 2.105 pacientes, la mutación EGFR estaba presente en el 16,6%, recibiendo 217 pacientes tratamiento con erlotinib, que en 113 de ellos fue la primera línea de tratamiento. En estos pacientes el tiempo medio de supervivencia fue de 14 meses y la mediana de supervivencia global, de 27 meses. Este estudio de cohortes demostró, que el cribado a gran escala de pacientes para mutaciones EGFR y el tratamiento con anti- EGFR era factible. Los resultados de estos trabajos también apoyan el concepto de que, en un subgrupo de pacientes particular, el tratamiento de primera línea con fármacos anti-EGFR puede ser la opción más efectiva.
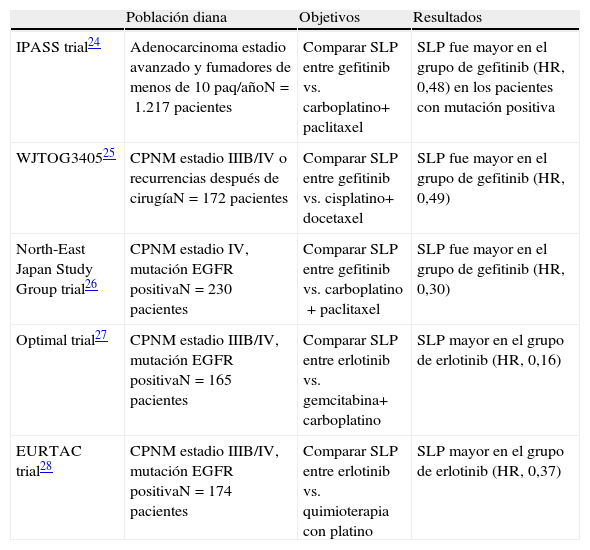
En otro estudio reciente, el Iressa Pan-Asia Study (IPASS)23, se comparó gefitinib en primera línea versus carboplatino/paclitaxel en 1.217 pacientes con CPNM avanzado, y los pacientes elegibles fueron no fumadores o ligeramente ex fumadores, con histología de adenocarcinoma. La frecuencia de mutaciones EGFR fue del 59,7%. El análisis demostró que los pacientes con mutaciones EGFR tenían un tiempo medio superior de supervivencia en la rama de gefitinib comparada con la rama de QT estándar (HR, 0,48; p<0,001). Esto argumenta a favor de que el test mutacional debe ser una práctica de obligada realización al diagnóstico del CPNM, al menos para los pacientes con adenocarcinoma, nunca fumadores o escasamente fumadores. Esos pacientes deberían ser tratados con fármacos anti-EGFR si sus tumores expresan la mutación, dado el beneficio demostrado. De todas formas, es importante observar que el estudio IPASS se realizó en Asia, y que las mutaciones EGFR se dan con menor frecuencia en poblaciones caucasianas (40 y 10%, respectivamente). En la tabla 1 se resumen los resultados de los principales estudios en fase III con erlotinib y gefitinib23–28.
Principales estudios en fase III con fármacos anti-EGFR
| Población diana | Objetivos | Resultados | |
| IPASS trial24 | Adenocarcinoma estadio avanzado y fumadores de menos de 10 paq/añoN=1.217 pacientes | Comparar SLP entre gefitinib vs. carboplatino+ paclitaxel | SLP fue mayor en el grupo de gefitinib (HR, 0,48) en los pacientes con mutación positiva |
| WJTOG340525 | CPNM estadio IIIB/IV o recurrencias después de cirugíaN=172 pacientes | Comparar SLP entre gefitinib vs. cisplatino+ docetaxel | SLP fue mayor en el grupo de gefitinib (HR, 0,49) |
| North-East Japan Study Group trial26 | CPNM estadio IV, mutación EGFR positivaN=230 pacientes | Comparar SLP entre gefitinib vs. carboplatino+paclitaxel | SLP fue mayor en el grupo de gefitinib (HR, 0,30) |
| Optimal trial27 | CPNM estadio IIIB/IV, mutación EGFR positivaN=165 pacientes | Comparar SLP entre erlotinib vs. gemcitabina+ carboplatino | SLP mayor en el grupo de erlotinib (HR, 0,16) |
| EURTAC trial28 | CPNM estadio IIIB/IV, mutación EGFR positivaN=174 pacientes | Comparar SLP entre erlotinib vs. quimioterapia con platino | SLP mayor en el grupo de erlotinib (HR, 0,37) |
CPNM: cáncer de pulmón no microcítico; SLP: supervivencia libre de progresión; HR: hazard ratio.
Por otra parte, un metaanálisis de 4 estudios en fase III que comparan gefitinib con QT estándar concluye que no hay diferencias en la supervivencia media entre los 2 grupos, pero en el grupo de pacientes tratados con gefitinib se observan menos efectos secundarios y una mejor calidad de vida que en los que reciben QT estándar29.
En nuestro medio, la mutación del gen del EGFR se observa en aproximadamente el 15% de los CPNM30,31. Alrededor del 75% de los casos con esta mutación responden al tratamiento con erlotinib/gefitinib, mientras que entre los no mutados solo responde el 10%32. Sin embargo, casi todos los pacientes inicialmente respondedores acaban desarrollando progresión de la enfermedad. Las causas de esta resistencia adquirida a los fármacos anti-EGFR no son del todo conocidas, pero parecen implicados diferentes mecanismos, como mutaciones secundarias del EGFR o amplificación del oncogén MET33,34.
Inhibidores del VEGFEl gen VEGF está localizado en el cromosoma 6p21.3 y es un mediador clave en la angiogénesis10, ya que es el más potente factor angiogénico conocido11. Un aumento de la expresión VEGF en el tumor o en el suero se ha asociado con tumores en estadio avanzado, y sus niveles son significativamente más altos en el adenocarcinoma que en el carcinoma escamoso35. La familia VEGF está formada por distintas proteínas, llamadas VEGF-A, VEGF-B, VEGF-C, VEGF-D y PIGF (placental growth factor)36.
Entre los efectos de los VEGF se incluyen: aumento de la mitosis de las células endoteliales, control de la permeabilidad vascular y aumento de la supervivencia del endotelio vascular, entre otros37. Los VEGF realizan estas funciones mediante la unión a sus receptores (VEGFR), que se encuentran en las células endoteliales. Hay 3 tipos de receptores: VEGFR-1, VEGFR-2 y VEGFR-3, todos ellos con actividad TK38.
Carrillo et al.39 investigaron los VEGF y sus receptores en pacientes con CPNM y su correlación con el pronóstico. Los pacientes con moderada/alta expresión VEGF-C, VEGFR-1 y VEGFR-2 tenían peor supervivencia, mientras que en los pacientes con moderada/alta expresión de VEGF-D y VEGFR-3 la supervivencia era mejor. En el análisis multivariado, el estadio y la expresión VEGF-D y VEGFR-1 fueron factores significativos de pronóstico independientes. Por otra parte, un metaanálisis de 20 estudios, llevado a cabo por Delmotte et al.35, puso de manifiesto que la expresión VEGF-A era un factor de pronóstico desfavorable en pacientes con CPNM. Los resultados de estos estudios sugieren que los perfiles de expresión de los VEGF y de los VEGFR pueden tener valor pronóstico en el CPNM y pueden ayudar a identificar pacientes que, potencialmente, puedan ser buenos respondedores a las terapias antiangiogénicas.
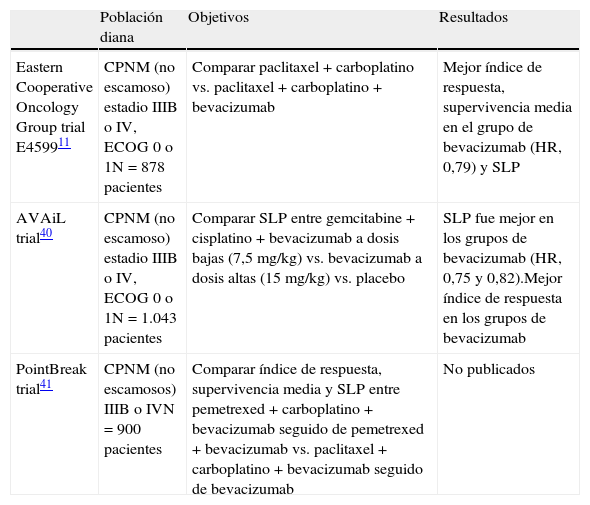
La importancia del VEGF hace que sea una diana atractiva para el desarrollo de nuevas terapias dirigidas. El bevacizumab es un anticuerpo monoclonal humanizado que actúa mediante la unión y neutralización de todas las isoformas VEGF-A. La eficacia y la seguridad del bevacizumab han sido evaluadas en 3 estudios en fase III11,40,41, cuyas características generales pueden consultarse en la tabla 2. En resumen, se comprobó que el tratamiento con bevacizumab aportaba un mayor tiempo medio de supervivencia y una tendencia al incremento de la misma. Sin embargo, se observó un aumento del riesgo de sangrado, sobre todo en tumores localizados centralmente, próximos a grandes vasos y con histología de carcinoma escamoso.
Estudios en fase III con bevacizumab
| Población diana | Objetivos | Resultados | |
| Eastern Cooperative Oncology Group trial E459911 | CPNM (no escamoso) estadio IIIB o IV, ECOG 0 o 1N=878 pacientes | Comparar paclitaxel+carboplatino vs. paclitaxel+carboplatino+bevacizumab | Mejor índice de respuesta, supervivencia media en el grupo de bevacizumab (HR, 0,79) y SLP |
| AVAiL trial40 | CPNM (no escamoso) estadio IIIB o IV, ECOG 0 o 1N=1.043 pacientes | Comparar SLP entre gemcitabine+cisplatino+bevacizumab a dosis bajas (7,5mg/kg) vs. bevacizumab a dosis altas (15mg/kg) vs. placebo | SLP fue mejor en los grupos de bevacizumab (HR, 0,75 y 0,82).Mejor índice de respuesta en los grupos de bevacizumab |
| PointBreak trial41 | CPNM (no escamosos) IIIB o IVN=900 pacientes | Comparar índice de respuesta, supervivencia media y SLP entre pemetrexed+carboplatino+bevacizumab seguido de pemetrexed+bevacizumab vs. paclitaxel+carboplatino+bevacizumab seguido de bevacizumab | No publicados |
CPNM: cáncer de pulmón no microcítico; SLP: supervivencia libre de progression; HR: hazard ratio.
La inhibición dual de EGFR y VEGF está en investigación en la actualidad. Existen 2 estrategias: la primera es combinar 2 agentes con vías específicas anti-diana como erlotinib y bevacizumab42, y la otra es el uso de un agente con actividad dual como vandetanib, una pequeña molécula con actividad contra VEGFR-2, -3, y anti-EGFR43. Recientemente se han publicado los resultados de un ensayo clínico que incluyó 1.240 pacientes con CPNM en estadios IIIB y IV que ya habían recibido al menos una primera línea de QT; los pacientes fueron aleatorizados en 2 grupos de tratamiento: uno recibió vandetanib y el otro erlotinib, y no se observaron diferencias de supervivencia entre los dos grupos (p=0,83)44.
Inhibidores del ALKEn un subgrupo de pacientes con CPNM, sus tumores presentan una mutación genética que consiste en la ruptura en los genes EML4 (echinoderm microtubule-associated proteine-like4) y ALK (anaplasic lympoma kinasa), y posteriormente la fusión de los dos genes en dirección opuesta45. El resultado final es el oncogén EML4-ALK, el cual inhibe la apoptosis y favorece la proliferación tumoral45. Este oncogén está presente en un porcentaje relativamente bajo de pacientes con CPNM (alrededor del 5%)46–48. Se ha comprobado que es más frecuente en pacientes jóvenes, no fumadores, o fumadores con un consumo acumulado de tabaco bajo, y de la estirpe adenocarcinoma46. En este tipo de población, la frecuencia del EML4-ALK puede llegar hasta el 13%48.
En agosto de 2011 se aprobó la comercialización de un nuevo fármaco para el tratamiento del CPNM en estadio avanzado, el crizotinib, que inhibe el EML4-ALK49. Su eficacia se demostró en 2 estudios multicéntricos con la dosis de 250mg, 2 veces al día por vía oral50. En total, en esos 2 estudios se incluyeron 255 pacientes cuyos tumores contenían el oncogén EML4-ALK, el 95% de ellos con enfermedad metastásica. Se comprobó que el tratamiento con crizotinib producía una respuesta completa o parcial en el 55% de los pacientes, y la mediana de duración de la respuesta estuvo entre 42 y 48 semanas50,51. El tratamiento con este fármaco fue bien tolerado, y los efectos adversos más frecuentes fueron alteraciones visuales, molestias gastrointestinales y alteraciones en el perfil hepático50.
Actualmente están en marcha 2 estudios en fase III sobre el papel del crizotinib en el tratamiento del CPNM52. Sus características pueden observarse en la tabla 3. Se ha descrito resistencia al tratamiento con crizotinib después de una buena respuesta inicial, lo cual se ha relacionado con mutaciones dentro del dominio TK del ALK53.
Estudios en fase III en marcha con crizotinib
| Población diana | Objetivos | |
| NCT0093289352 | Oncogén EML4-ALK positivo, CPNM estadio IV que hayan recibido un esquema de quimioterapia previo con platinoN=318 pacientes | Comparar crizotinib con pemetrexed o docetaxel |
| NCT0115414052 | Oncogén EML4-ALK positivo, CPNM enfermedad avanzada o metastásicaN=334 pacientes | Comparar crizotinib con pemetrexed+platino |
En la actualidad se encuentran en investigación otras moléculas para el tratamiento del CP avanzado o recurrente. Un ejemplo es la amrubicina, un fármaco que ejerce su efecto antitumoral mediante la inhibición de la topoisomerasa II54. Recientemente se ha publicado un estudio en fase I54 en el que se administró este fármaco a pacientes con CPNM y microcítico, observándose un índice de respuesta del 15,4%. Así que, en los próximos años, seguiremos asistiendo al avance en el tratamiento médico del CP en estadios no quirúrgicos.
ConclusionesLos fármacos anti-EGFR, los inhibidores del VEGF y del EML4-ALK mejoran la supervivencia libre de enfermedad en ciertos grupos de pacientes con CPNM avanzado o recurrente, con mejor tolerancia y calidad de vida, y menos efectos secundarios que la QT convencional. Por tanto, el estudio molecular del tejido tumoral es necesario para optimizar el manejo del CP y conseguir futuras mejoras de su pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.