Los grandes avances de la genómica y la proteómica han propiciado la creación de colecciones de muestras biológicas y de biobancos destinados a la investigación biomédica. Estas colecciones, y sus múltiples datos asociados, permitirán realizar estudios longitudinales, obtener subproductos como ADN o ARN e incluso prever estudios futuros.
Para mantener la integridad de las muestras se deberán diseñar desde el principio los procedimientos de obtención, transporte, subproductos que se obtendrán, condiciones de conservación, destino final y bioseguridad, así como disponer de una supervisión adecuada de los equipos. El control de todas estas condiciones proporcionará valor añadido a las muestras, ya que permitirá asegurar su calidad y trazabilidad.
Nos proponemos ofrecer una visión general de las recomendaciones relativas a la seguridad biológica, transporte y conservación de muestras biológicas destinadas a la investigación biomédica en el ámbito de las enfermedades respiratorias, de acuerdo con la legislación vigente.
Major advances in genomics and proteomics have prompted the creation of biological specimen collections and biobanks for use in biomedical research. These specimen collections and the wealth of data they generate will allow longitudinal studies to be conducted and subproducts such as DNA or RNA to be obtained. They may even be used in future studies.
To ensure specimen integrity, from the outset it is necessary to define procedures for sampling, transport and storage, the subproducts to be obtained, and the end purpose, as well as to address biosafety issues and arrange for suitable equipment monitoring. Strict control of these conditions will confer added value on the specimens, as quality and traceability would be assured.
This article aims to provide a general overview of the recommendations concerning biological safety, transport, and storage of biological specimens for biomedical research into respiratory diseases in accordance with current legislation.
Las muestras biológicas, a menudo con múltiples datos asociados, constituyen actualmente un material imprescindible y preciado de estudio, además de una herramienta fundamental en el ámbito de la investigación biomédica.
Durante años los excedentes de las muestras biológicas obtenidas en el ámbito del diagnóstico se archivaban con vistas a una posible comprobación diagnóstica o la hipotética realización de algún proyecto de investigación futuro. En la actualidad, en el propio diseño de los proyectos de investigación ya consta la posibilidad de aprovechar dichas muestras para finalidades científicas. Por lo tanto, es aconsejable que, en el momento de obtener muestras biológicas para diagnóstico o para determinados estudios, se prevea la posibilidad de su conservación en unas condiciones tales que permitan proyectos de investigación futuros.
Desde el punto de vista ético, cualquier estudio o proyecto de investigación que incluya la obtención de muestras biológicas deberá contar obligatoriamente con el consentimiento informado del donante y con la correspondiente aprobación del comité ético de investigación clínica. Este comité velará para que prevalezca siempre el interés del paciente y para que no se interfiera en su diagnóstico y/o manejo clínico (tratamiento, seguimiento, evolución). Desde el punto de vista de la bioseguridad, deberá cumplir con la legislación vigente referida a la obtención, transporte y uso de muestras biológicas humanas.
Por otra parte, la complejidad que entrañan tanto la obtención de las muestras y de sus datos asociados como su conservación a largo plazo obliga a optimizar todos los procesos. Para ello será necesario obtener, con el menor coste posible, la cantidad suficiente de cada una de las muestras (sangre total, esputo, biopsia, etc.) para permitir la posterior obtención de submuestras (ADN, ARN, proteínas, células, etc.) en las mejores condiciones de extracción posibles. También será fundamental disponer de unas instalaciones que permitan su procesamiento y almacenamiento en condiciones óptimas de seguridad y temperatura, así como contar con unas buenas bases de datos para procesar toda la información asociada.
Estas colecciones ordenadas y controladas permitirán obtener la trazabilidad de las muestras y representarán una garantía en cuanto a la reproducibilidad de los resultados. También facilitarán la posibilidad de participar en redes o proyectos multicéntricos y compartir o ceder muestras entre diversos proyectos de investigación. Disponer de unos protocolos estandarizados de trabajo que incluyan procedimientos para un correcto transporte y almacenamiento de las muestras, aunque costoso desde el punto de vista logístico, se ha convertido en un factor decisivo sobre todo en estudios a largo plazo y en estudios longitudinales, en los que es fundamental mantener la integridad de las muestras almacenadas.
Todos estos factores son los que, a su vez, hacen que sea cada vez más frecuente la creación de biobancos, colecciones de muestras que se han recogido siguiendo unas normas de trabajo, que se han transportado y almacenado según las recomendaciones actuales, que disponen de datos asociados a las muestras y que cumplen con los requisitos éticos y legales1.
La presente revisión se centra en los procesos y las recomendaciones que afectan a la seguridad biológica, el transporte y el almacenamiento de las muestras biológicas obtenidas específicamente en el ámbito de las enfermedades respiratorias y destinadas a la investigación biomédica, incluidas aquellas que, por su carácter genérico, son útiles para cualquier enfermedad. No obstante, la mayoría de las recomendaciones dependerán de los productos a obtener o de los análisis posteriores a los que se someterán dichas muestras. Por lo tanto, muchas de ellas también serán comunes a otros procesos patológicos de distinto origen.
Origen y obtención de las muestras biológicasEn la ley española de investigación biomédica2 se define como muestra biológica “cualquier material biológico de origen humano susceptible de conservación y que pueda albergar información sobre la dotación genética característica de una persona”.
A continuación se describen las muestras —y los productos que se pueden obtener— más utilizadas en el ámbito de las enfermedades respiratorias. Figuran tanto las más genéricas, comunes a diversas enfermedades (biopsias de tejido, orina o sangre periférica), como las más específicas, de procedencia respiratoria. Cabe decir que no todas las muestras aquí definidas se usan de forma sistemática en investigación biomédica, aunque todas ellas tienen un gran valor diagnóstico.
- •
Esputo: permite análisis microbiológicos, de factores solubles y citológicos.
- •
Condensado de aire exhalado: permite el análisis de moléculas localizadas en el parénquima pulmonar y la vía aérea.
- •
Broncoaspirado: muestra de secreciones bronquiales, que permite el estudio citológico y microbiológico.
- •
Lavado broncoalveolar: procedimiento diagnóstico realizado durante la fibroscopia mediante fibra óptica para obtener material procedente del intersticio alveolar (células, microorganismos y sustancias solubles).
- •
Catéter protegido o catéter microbiológico: procedimiento diagnóstico para el estudio de la infección bacteriana.
- •
Cepillado bronquial citológico: técnica endoscópica para obtener células procedentes de la vía aérea inferior o de lesiones del parénquima pulmonar.
- •
Punción aspirativa transbronquial: procedimiento diagnóstico para la obtención de células de diferentes localizaciones, tales como mediastino, lesiones pulmonares, lesiones endobronquiales, lesiones en el hilio y mediastino peribronquial y peritraqueal.
- •
Biopsia bronquial y biopsia pulmonar transbronquial: son técnicas broncoscópicas que permiten obtener tejido bronquial y pulmonar, respectivamente.
- •
Punción aspirativa con aguja fina transtorácica y biopsia aspirativa transtorácica: técnica que permite la obtención de muestras de células (habitualmente para el diagnóstico de neoplasia pulmonar periférica) y de gérmenes (para el diagnóstico de neumonía).
- •
Biopsia pulmonar quirúrgica: para la obtención de tejido.
- •
Punción aspirativa con ultrasonografía endoscópica digestiva: permite obtener muestras citológicas de lesiones y ganglios del mediastino inferior y ventana aortopulmonar.
- •
Líquido pleural (toracocentesis): análisis microbiológico y citológico.
- •
Biopsia pleural: obtención de tejido.
- •
Músculo esquelético: la obtención de biopsias musculares, especialmente de los músculos de las extremidades inferiores (cuádriceps), permite realizar estudios en pacientes con enfermedades respiratorias crónicas que presentan alteraciones de tipo metabólico y limitación al esfuerzo.
- •
Muestras de otros territorios: también es útil obtener muestras de otros territorios, como biopsias cutáneas y de la mucosa nasal, siempre que haya una relación entre dichos órganos y la correspondiente afectación pulmonar.
Todas las muestras mencionadas deben considerarse siempre potencialmente patógenas y, por lo tanto, deben seguirse en todo momento las medidas de prevención de riesgos relacionados con la exposición a agentes biológicos3, así como las recomendaciones de bioseguridad en el laboratorio de la Organización Mundial de la Salud4.
Preservación de las muestras biológicasLa obtención de muestras para la investigación biomédica nunca deberá interferir en el diagnóstico o el manejo clínico estandarizado del paciente, y muy especialmente en aquellos casos en que se obtienen mediante técnicas invasivas. Las muestras con potencial finalidad diagnóstica deberán ser analizadas en primer lugar por un anatomopatólogo, quien decidirá la parte y/o el tamaño del material que se podrá utilizar para la investigación5.
Para que estas muestras tengan valor diagnóstico y a la vez puedan utilizarse en la investigación habrá que cumplir una serie de protocolos. Algunos de ellos serán muy generales, mientras que otros serán más específicos del tipo de muestra o del ámbito de estudio. La calidad de las muestras vendrá dada tanto por su rápida obtención como por un correcto procesamiento y transporte hasta el laboratorio. Todo ello es tan importante como su conservación a largo plazo.
A continuación se detallan algunas recomendaciones básicas, comunes a varias sociedades, como la Sociedad Internacional de Repositorios Biológicos y Ambientales (ISBER)5, la Organización de Cooperación y Desarrollo Económico (OECD)6, y la Agencia Internacional para la Investigación sobre Cáncer (IARC)7:
- 1.
Protocolos estandarizados de trabajo. Es importante disponer de ellos en lo referente a temperaturas de obtención, transporte y almacenamiento. También es imprescindible contar con registros y anotar las incidencias y variaciones respecto a esas normas (p. ej., un tiempo de transporte excesivo, una extracción más larga o a una temperatura no recomendada).
- 2.
Fraccionamiento y alicuotado. Es aconsejable realizarlo en el momento de la obtención. De esta manera se evitarán cambios de temperatura y manipulaciones posteriores que afectarán a la calidad de las muestras o a la expresión de algunos marcadores8.
- 3.
Elección de los contenedores idóneos para las muestras. Es un punto importante. Los contenedores deben elegirse de antemano teniendo en cuenta el tiempo que se van a mantener las muestras, la temperatura a la que se van a almacenar y el procesamiento o análisis a que serán sometidas. Otro punto que cabe destacar es la importancia de definir un identificador único de la muestra que resista perfectamente las condiciones de almacenamiento y/o procesamiento, y que debe seguir siendo legible al finalizar éstos. La codificación no debe permitir que se identifique a la persona de la que proviene la muestra. Todas las muestras dispondrán de un consentimiento informado y estarán anonimizadas o codificadas, o bien serán totalmente anónimas, tal como prevé la Ley de Investigación Biomédica2.
- 4.
Supervisión de los equipos de almacenamiento. Asimismo hay que disponer de equipos de emergencia o sistemas alternativos por si se produjeran fallos en los sistemas de almacenamiento.
- 5.
Intervalos de temperatura óptima. Existen intervalos de temperatura que se consideran estándares para unos determinados tipos de muestra o para unos determinados procesos. En la tabla 1 se muestran las normas básicas de criopreservación. Estas temperaturas son recomendaciones generales, que deberán revisarse en función del uso final de las muestras o del tiempo de almacenamiento.
Tabla 1.Estándares básicos de criopreservación
Temperatura (°C) Importancia biológica 0 a +4 Temperatura a la que se deben realizar las manipulaciones del material fresco −20 Límite de movilidad proteica, estabilidad de ADN −80 Estabilidad de ARN, almacenamiento de tejidos −150 a −196 Almacenamiento recomendado de células
Para este tipo de tejido hay unas recomendaciones elaboradas por los miembros del Banco Europeo de tejido tumoral congelado (TuBaFrost) y ampliamente aceptadas9. En el momento de la obtención el tejido debe recogerse en un recipiente cerrado y mantenerse en frío, sin añadir ningún medio líquido. Debería disponerse de un registro del lapso de tiempo que transcurre entre la escisión u obtención de la muestra y la congelación, ya que, como se verá más adelante, el tiempo transcurrido puede hacer que disminuya la calidad de las muestras.
Por lo que respecta al tipo de congelación, puede realizarse sumergiendo las muestras en nitrógeno líquido (N2L) o bien mediante congelación en isopentano previamente enfriado. La congelación por inmersión en N2L, aunque rápida y fácil, no es la mejor opción, ya que provoca la aparición de crioartefactos que pueden afectar algunas técnicas citológicas. El procedimiento recomendado tanto por la IARC como por el TuBaFrost es la congelación en isopentano7,9. Este procedimiento puede resultar complejo, pues no es sencillo disponer del equipo necesario en el lugar donde van a obtenerse las biopsias y/o muestras. En el caso de que las muestras vayan a utilizarse en histología debe evitarse la congelación lenta del tejido en congelador de −80°C, ya que dificulta mucho la obtención de cortes de criostato de buena calidad debido a la formación de cristales de hielo. El almacenamiento definitivo dependerá de la futura utilización de este tejido.
Un tiempo de isquemia prolongado puede provocar degradación en algunas de las submuestras que se pueden obtener (p. ej., en el ARN)10. Un estudio de Spruessel et al11 demuestra cómo el tiempo de isquemia afecta a los patrones de expresión génica y proteica. Este estudio analizó los cambios que se producen a partir de los 5min de isquemia y hasta los 30min. En este último punto la expresión génica y proteica variaba un 20% respecto a la basal. Por otra parte, el trabajo de Huang et al12, realizado con muestras de cáncer de colon, demuestra que los tiempos de isquemia inferiores a 20min mantienen de forma bastante estable los patrones de expresión génica, mientras que éstos se ven afectados de forma importante a partir de los 40min. Basándose en estos y otros estudios, TuBaFrost recomienda que el tiempo transcurrido entre la escisión y la congelación no supere los 30min. En cualquier caso, siempre que el tiempo sea inferior a las 2h, la muestra se congelará, pero se indicará el tiempo transcurrido entre la escisión y la congelación. Teniendo en cuenta estos resultados y recomendaciones, sería conveniente fijar un tiempo máximo en función del uso final del tejido. Si el tiempo que transcurre es superior al que se estableció en el protocolo, se decidirá si se acepta el tejido, anotando el tiempo transcurrido, o bien si se descarta la muestra.
Si el tejido se va a utilizar para la extracción de ADN, algunos estudios muestran que la estabilidad a −80°C se mantiene a lo largo del tiempo, mientras que la integridad del ARN disminuye a partir de los 5 años de almacenamiento13. Otros autores han descrito que la estabilidad del ADN y del ARN se mantiene durante una década si el tejido ha estado almacenado en vapores de N2L14.
Sangre periféricaEs una de las muestras habituales en las colecciones porque a partir de ella se pueden obtener varias fracciones y realizar estudios de un amplio espectro de moléculas. Puede cubrir estudios de genómica, proteómica, metabolómica y parámetros hematológicos. Es sencilla y barata de obtener. Los factores que pueden afectar la estabilidad de las muestras son principalmente los anticoagulantes, los estabilizantes, la temperatura, el tiempo entre la extracción y el procesamiento, la esterilidad y los factores endógenos de degradación como el contenido de enzimas15. Es de gran importancia seleccionar los anticoagulantes con los que se va a recoger la sangre, ya que esto condicionará los estudios futuros; por ejemplo, el uso de cualquier anticoagulante induce la producción de citocinas in vitro16. De las muestras de sangre recogidas con citrato de dextrosa se obtienen un ADN y un ARN de buena calidad, y se recupera un número de linfocitos superior para cultivo celular. El uso de ácido etilendiaminotetraacético (EDTA) proporciona buenos resultados en la extracción de ADN, pero da problemas para estudios citogenéticos. Para producir líneas celulares inmortalizadas es necesario recoger la sangre con citrato de dextrosa. Por el contrario, la heparina tiene un efecto adverso sobre la proliferación de linfocitos T y afecta además a la extracción de ADN y a las técnicas de amplificación por reacción en cadena de la polimerasa (PCR). Para estudios de metabolómica el mejor anticoagulante es la heparina de litio.
En algunos estudios epidemiológicos se recoge sangre total únicamente en ácido etilendiaminotetraacético17,18, mientras que en otros se obtienen muestras en diversos anticoagulantes para así disponer de un amplio abanico de posibilidades futuras19.
Otro factor que debe tenerse en cuenta es el tiempo entre la obtención y el procesamiento. El tiempo que transcurre es más o menos crítico en función de los componentes por los que se tenga interés y de su estabilidad. Algunos estudios han analizado la importancia de la etapa preanalítica en los resultados finales20. Para determinados parámetros un período de como mínimo 24h antes del procesamiento y análisis puede dar lugar a variaciones significativas en un 25% de las muestras analizadas21. La viabilidad celular disminuye de forma apreciable a partir de las 48h, aunque algunos estudios, como el de Bull et al22, en que se comparan 2 tiempos de procesamiento distinto (a las 8 y 24h de obtener la muestra), describen una disminución de la viabilidad y una menor secreción de citocinas en las muestras procesadas a partir de las 24h.
Fracciones de la sangreSi se quieren obtener células para la extracción de ADN o ARN, será suficiente con realizar un gradiente de centrifugación, a partir del cual se podrá separar el plasma, la fracción leucoplaquetaria y la fracción de eritrocitos. Se prepararán alícuotas de cada una de las fracciones obtenidas y se almacenarán a −80°C.
Si además se requieren células para una posterior inmortalización, hay varios métodos descritos en la bibliografía. Los linfocitos transformados con el virus de Epstein-Barr son una fuente inagotable de ADN. Hay varias posibilidades: por un lado, la extracción y transformación inmediata, y por otro, la extracción, separación celular y criopreservación para una transformación futura. Existe bibliografía que confirma que la criopreservación a largo plazo no afecta de forma significativa a la viabilidad de las células B y tampoco a los índices de transformación23–25.
Las células criopreservadas se almacenarán siempre a −150°C en vapores de N2L26. El transporte de estas muestras se realizará en un contenedor seco de nitrógeno, para evitar que disminuya la viabilidad celular27.
Otra de las fracciones que se pueden obtener a partir de la sangre total es el suero. Es la fracción recomendada para obtener resultados en bioquímica clínica y en estudios metabólicos. Es igualmente importante conservar parte de esta muestra para estudios futuros. En grandes estudios epidemiológicos en los que se analizará un gran número de parámetros en suero se recomienda recoger las muestras de sangre en tubos de plástico siliconados18.
OrinaEs otra de las muestras habituales en las colecciones13,15,18, ya que es una muestra sencilla y barata de obtener, que permite realizar estudios de un amplio espectro de moléculas: ADN, proteómica, metabolómica. Es habitual el almacenamiento durante largos períodos de tiempo a −80°C5,18.
EsputoA partir de las muestras de esputo, y siguiendo los protocolos de procesamiento de Djukanović et al28, es posible obtener tanto el sobrenadante (que se utilizará para la determinación de factores solubles y de marcadores de inflamación29) como células30. Ambos tipos de productos se almacenarán a −80°C. A partir de los botones celulares congelados del esputo es posible obtener ADN y/o ARN27.
Condensado de aire exhaladoEste tipo de muestra permite determinar de forma no invasiva la inflamación pulmonar31,32. Contiene un amplio número de mediadores, como adenosina, amonio, peróxido de hidrógeno, isoprostanos, leucotrienos, óxido de nitrógeno, péptidos y citocinas. Las sociedades norteamericana y europea de neumología han emitido recomendaciones metodológicas específicas que incluyen la temperatura de almacenamiento33. En algunos estudios, como el de Lehtonen et al34, las muestras se han almacenado a −70°C hasta su utilización futura.
Lavado broncoalveolarEs el sistema habitual para obtener muestras procedentes del intersticio alveolar (células, microorganismos y sustancias solubles)35. Los primeros 10ml se procesan de forma separada para obtener el lavado bronquial. El resto se deposita en tubos siliconizados y se transporta en hielo al laboratorio, donde se centrifuga a 400g durante 5min y se recuperan las células. Los sobrenadantes se alicuotan y se almacenan a −80°C36. Los botones celulares se congelarán inmediatamente y se almacenarán a −80 o −196°C, según los análisis o estudios que vayan a realizarse en el futuro.
BroncoaspiradoDe los broncoaspirados se podrán realizar cultivos microbiológicos diagnósticos y también obtener células para posteriores estudios moleculares. En este último caso las células se almacenaran a −80°C o en N2L en función de los estudios que se vayan a realizar con posterioridad.
Otras técnicas para la obtención de muestrasPor lo que respecta a las muestras obtenidas mediante punción aspirativa transbronquial, punción aspirativa con aguja fina transtorácica y biopsia aspirativa transtorácica, en todos los casos la muestra que se obtendrá es equivalente a una biopsia de tejido37,38 y, por lo tanto, se seguirán las recomendaciones descritas en el apartado “Biopsias de tejidos sólidos”.
En el caso de los cultivos celulares, las muestras se criopreservarán y almacenarán en N2L. En el caso de los bloques y de las células en botones celulares, se congelarán rápidamente y se almacenarán a −80°C o en N2L en función de su utilización futura.
En la tabla 2 se han resumido las recomendaciones de diferentes organismos internacionales sobre las temperaturas de conservación a largo plazo.
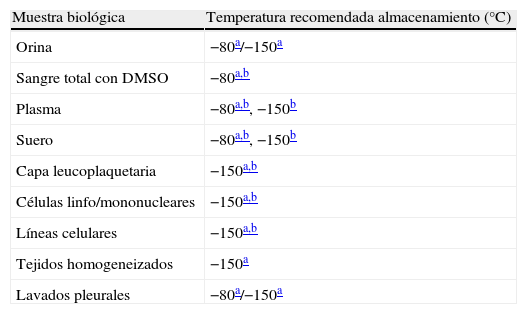
Temperaturas recomendadas según el tipo de muestra para almacenamiento a largo plazo
| Muestra biológica | Temperatura recomendada almacenamiento (°C) |
| Orina | −80a/−150a |
| Sangre total con DMSO | −80a,b |
| Plasma | −80a,b, −150b |
| Suero | −80a,b, −150b |
| Capa leucoplaquetaria | −150a,b |
| Células linfo/mononucleares | −150a,b |
| Líneas celulares | −150a,b |
| Tejidos homogeneizados | −150a |
| Lavados pleurales | −80a/−150a |
DMSO: dimetil sulfóxido.
La temperatura de los vapores de nitrógeno (−150°C) es suficiente para el almacenamiento de cualquier muestra y es innecesario el almacenamiento en nitrógeno líquido (−196°C). Recomendación de la Australasian Biospecimen Network (ABN).
La obtención de diversos productos a partir de las muestras iniciales (células, tejidos, sangre u orina) será el objetivo final de muchos de los estudios de proteómica y genómica. En la bibliografía científica y entre los grupos de trabajo de organismos internacionales no hay unas recomendaciones comunes para el almacenamiento del ADN, ARN y proteínas. En la bibliografía científica sí se describe mayoritariamente el almacenamiento del ARN a −70°C39 o −80°C40.
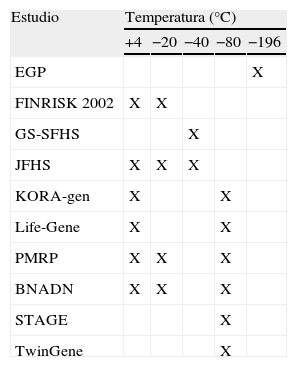
En el caso del ADN la variabilidad es mayor y las recomendaciones de temperatura están en función del período previsto de almacenamiento. En la tabla 3 se detallan algunas de las recomendaciones de diversos estudios respecto al almacenamiento del ADN, que varía entre +4°C y −80°C. En la tabla se recogen las temperaturas de almacenamiento que los principales proyectos sobre genómica de poblaciones están utilizando en la actualidad. Algunos de estos proyectos almacenan diferentes alícuotas de ADN a diferentes temperaturas. Un ejemplo de esto sería el Banco Nacional de ADN de Salamanca, que para un almacenamiento inferior a 2 meses recomienda +4°C; para un almacenamiento a corto plazo (hasta un año), −20°C, y para períodos superiores al año, −80°C.
Recomendaciones para el almacenamiento de ADN
| Estudio | Temperatura (°C) | ||||
| +4 | −20 | −40 | −80 | −196 | |
| EGP | X | ||||
| FINRISK 2002 | X | X | |||
| GS-SFHS | X | ||||
| JFHS | X | X | X | ||
| KORA-gen | X | X | |||
| Life-Gene | X | X | |||
| PMRP | X | X | X | ||
| BNADN | X | X | X | ||
| STAGE | X | ||||
| TwinGene | X | ||||
BNADN: Banco Nacional de ADN; EGP: Proyecto Genoma de Estonia; FINRISK 2002: estudio poblacional finlandés de factores de riesgo en enfermedades de declaración no obligatoria; GS-SFHS: Generación Escocia-Estudio de Salud en Familias Escocesas; JFHS: Estudio de Salud en Familias de Joondalup; KORA-gen: estudio de hábitos de vida y salud en la región de Augsburg; Life-Gene: estudio prospectivo de cohorte en salud y estilos de vida que se lleva a cabo en Suecia; PMRP: Proyecto de Investigación en Medicina Personalizada de la Cínica Marshfield; STAGE: estudio sueco de gemelos adultos: genes y ambiente; TwinGene: estudio sueco basado en parejas de gemelos para determinar factores ambientales y genéticos en las enfermedades cardiovasculares.
También existe la posibilidad de almacenar gotas de sangre o de otros fluidos sobre papel FTA (papel de filtro tratado) a temperatura ambiente para la posterior extracción de ADN. El estudio de Burger et al41 demuestra que es posible obtener ADN de muestras de saliva almacenada en papel FTA mantenido a temperatura ambiente durante 2 años, aunque en otro estudio similar Sigurdson et al42 no consiguen obtener ADN de calidad con el mismo tipo de muestras almacenadas durante 7 años a temperatura ambiente. Rajendram et al43, que realizaron un estudio con suspensiones bacterianas, concluyen que es posible obtener ADN de buena calidad de estas muestras después de 3 años de almacenamiento a temperatura ambiente. Por último, Galaal et al44, que almacenaron a temperatura ambiente células tumorales de ovario sobre papel FTA, obtuvieron ADN de buena calidad al cabo de 5 años y ARN después de 6 meses de almacenamiento.
Son varios los estudios que han analizado la estabilidad de diversas proteínas y metabolitos después de largos períodos de almacenamiento. Algunos concluyen que no hay variaciones en las concentraciones de diversas proteínas séricas cuando han estado almacenadas a −70°C45,46. En cambio otros, como el de Basit et al47, concluyen que un almacenamiento a −70°C durante más de 2 años sí puede afectar a las concentraciones séricas de determinadas proteínas. Shih et al48 describen asimismo un efecto sobre los valores de lípidos y lipoproteínas en suero como consecuencia del tiempo de almacenamiento a −70°C.
Transporte de muestras biológicas: definiciones y clasificaciónEn primer lugar se definen los términos más empleados en las recomendaciones internacionales y en la legislación.
Se define como sustancia infecciosa aquella que se sabe o se cree fundadamente que contiene agentes patógenos (microorganismos o priones) que pueden causar enfermedades en humanos o animales. Esta definición se aplicará a todas las muestras excepto las excluidas explícitamente. Las sustancias infecciosas se dividen en 2 categorías:
- •
Sustancia infecciosa de categoría A: la exposición a este tipo de sustancia puede causar una incapacidad permanente, poner en peligro la vida o provocar una enfermedad mortal para seres humanos o animales previamente sanos. Algunos ejemplos serían cultivos de Mycobacterium tuberculosis, virus de la gripe aviar hiperpatógena, Chlamydia psittaci (cepas aviares) y Bacillus anthracis, entre muchos otros. A las sustancias de este grupo se les asignará el número UN 2814, que es una identificación de mercancía peligrosa. La designación oficial de transporte de UN 2814 es: “sustancia infecciosa que afecta a humanos”.
- •
Sustancia infecciosa de categoría B: toda sustancia infecciosa que no cumple criterios para entrar en la categoría A. A las sustancias de la categoría B se les asignará el número UN 3373, y la designación oficial para el transporte será: “sustancia biológica de categoría B”.
Existen excepciones, conocidas como muestras exentas. Son muestras que presentan un riesgo mínimo de contener agentes patógenos. Deben transportarse en un embalaje igual que las muestras UN 3373 (embalaje de 3 elementos, que se describe más adelante) e identificarse como “muestra humana exenta”. Ahora bien, para que una muestra pueda considerarse exenta, se requerirá una opinión profesional basada en el historial médico conocido, síntomas y condiciones locales endémicas. Algunos ejemplos de muestras que pueden considerarse exentas son: derivados de análisis de sangre o de orina utilizados para determinar concentraciones de colesterol o de hormonas, glucemia y muestras para análisis de farmacovigilancia terapéutica, entre otras.
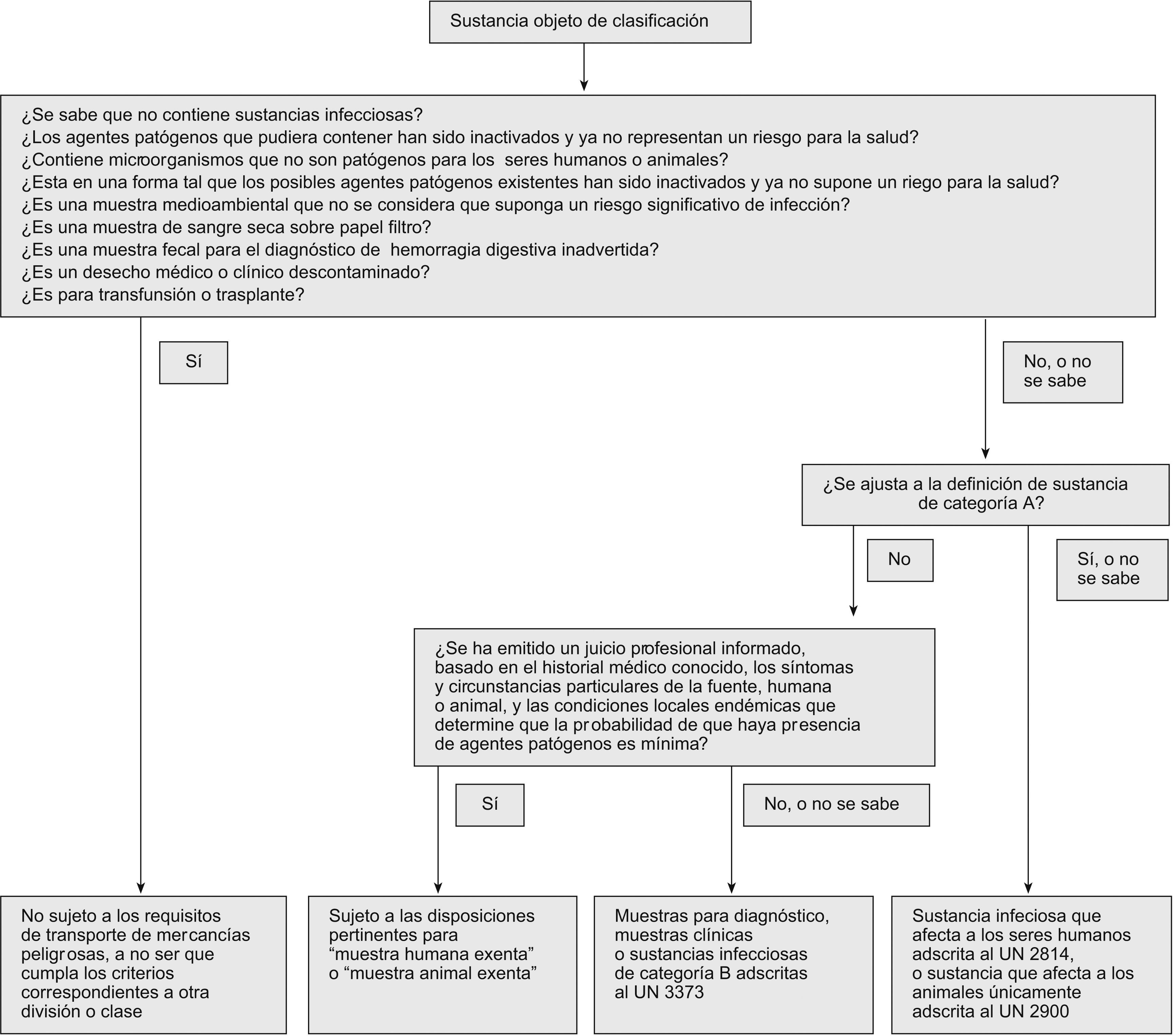
Con objeto de clasificar de forma simple las sustancias infecciosas para su transporte, la Organización Mundial de la Salud, en su Guía sobre la reglamentación relativa al transporte de sustancias infecciosas, 2007–200849, ofrece un árbol de decisiones que puede ser muy útil para asignar las muestras biológicas a un determinado código de mercancía peligrosa (fig. 1).
Árbol de decisiones para la clasificación de las muestras biológicas según códigos UN. (Diagrama obtenido de la Guía sobre la reglamentación relativa al transporte de sustancias infecciosas, 2007–200849, de la Organización Mundial de la Salud.)
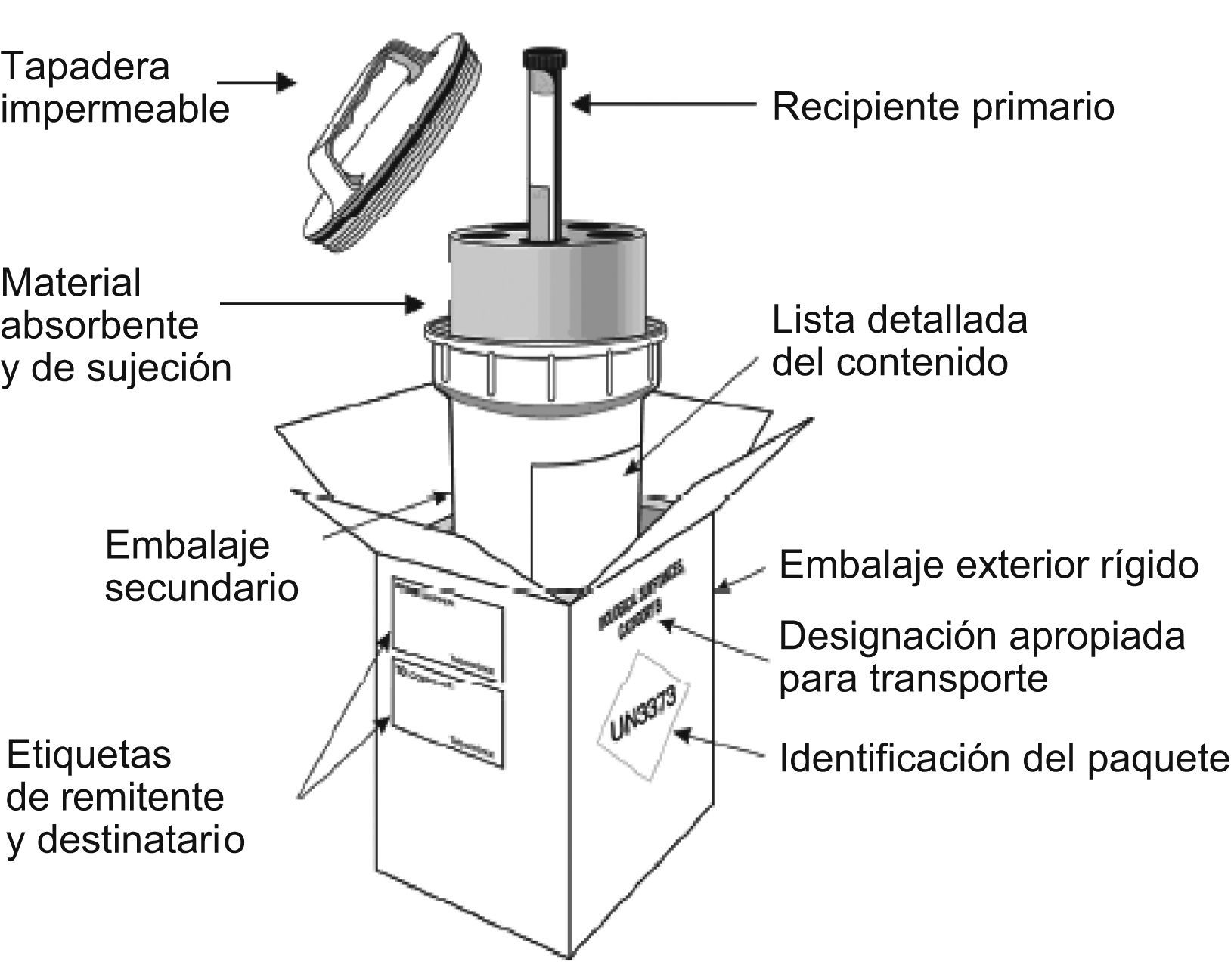
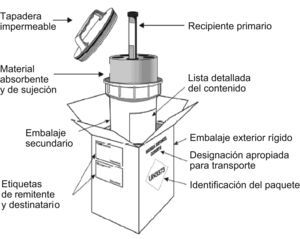
Se utilizará el sistema triple de embalaje, incluso para el transporte local por carretera, y se seguirán las instrucciones de embalaje 650 (PI650) de la Organización de las Naciones Unidas, que se resumen a continuación. En general, para este grupo, los embalajes deben ser de buena calidad a fin de evitar posibles incidentes, y constarán de un sistema triple (un recipiente primario, un embalaje/envase secundario y un embalaje/envase exterior). Además, el envase primario se envolverá con un material absorbente por si hubiera un derrame accidental. El embalaje exterior se identificará con el símbolo correspondiente y con la designación oficial de transporte: «Sustancia biológica de categoría B». (Hay algunas especificaciones exclusivas para el transporte aéreo50 que no se detallan aquí.) En la figura 2 se muestra el embalaje correspondiente al UN 3373.
Esquema de embalajes UN 3373. (Esquema obtenido de la Guía sobre la reglamentación relativa al transporte de sustancias infecciosas, 2007–200849, de la Organización Mundial de la Salud.)
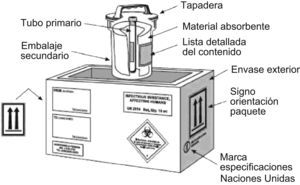
Se utilizará el sistema triple de embalaje, incluso para el transporte local por carretera. Las sustancias infecciosas de la categoría A sólo pueden transportarse en embalajes/envases que cumplan las especificaciones correspondientes a la clase 6.2 de Naciones Unidas y la instrucción de embalaje 602 (PI602), que son las mismas que las definidas para el grupo UN 3373. Además, estas muestras cumplirán el siguiente requisito: los embalajes/envases interiores que contengan sustancias infecciosas no se agruparán con embalajes/envases interiores que contengan mercancías que no sean afines.
Por otra parte, las sustancias infecciosas incluidas en el número UN 2814 se embalarán/envasarán con arreglo a las siguientes disposiciones:
- 1.
Sustancias expedidas a temperatura ambiente o superior: los recipientes primarios serán de vidrio, de metal o de plástico. Para asegurar la estanqueidad se utilizarán termosoldaduras, tapones de faldón o cápsulas metálicas encastadas. Si se emplean tapones roscados, se reforzarán con bandas, cinta adhesiva o cierres de fijación fabricados para tal fin.
- 2.
Sustancias expedidas refrigeradas o congeladas: el hielo, el hielo seco u otro producto refrigerante se colocará alrededor del envase secundario o bien en el interior de un sobreembalaje que contenga uno o varios bultos completos marcados según lo prescrito. Se colocarán calzos interiores para que el embalaje secundario se mantenga en su posición inicial cuando el hielo o el hielo seco se hayan fundido o evaporado. Si el refrigerante es hielo, el embalaje exterior o el sobreembalaje habrán de ser estancos. Si el refrigerante es hielo seco, el embalaje exterior o el sobreembalaje habrán de permitir la salida del gas carbónico. El recipiente primario y el embalaje/envase secundario conservarán su integridad a la temperatura del refrigerante utilizado.
- 3.
Sustancias expedidas en N2L: se utilizarán recipientes primarios de plástico capaces de soportar temperaturas muy bajas. El embalaje/envase secundario también habrá de poder soportar temperaturas muy bajas y, en la mayoría de los casos, tendrá que ajustarse sobre el recipiente primario individualmente. Se aplicarán asimismo las disposiciones relativas al transporte de N2L. El recipiente primario y el embalaje/envase secundario conservarán su integridad a la temperatura del N2L.
- 4.
Las sustancias liofilizadas también podrán transportarse en recipientes primarios consistentes en ampollas de vidrio termoselladas o frascos de vidrio con tapón de caucho y precinto metálico.
Sea cual fuere la temperatura prevista para la sustancia durante el transporte, el recipiente primario o el embalaje/envase secundario habrán de poder resistir, sin que se produzcan fugas, una presión interna que produzca una diferencia de presión de no menos de 95 kPa y temperaturas de −40 a +55°C.
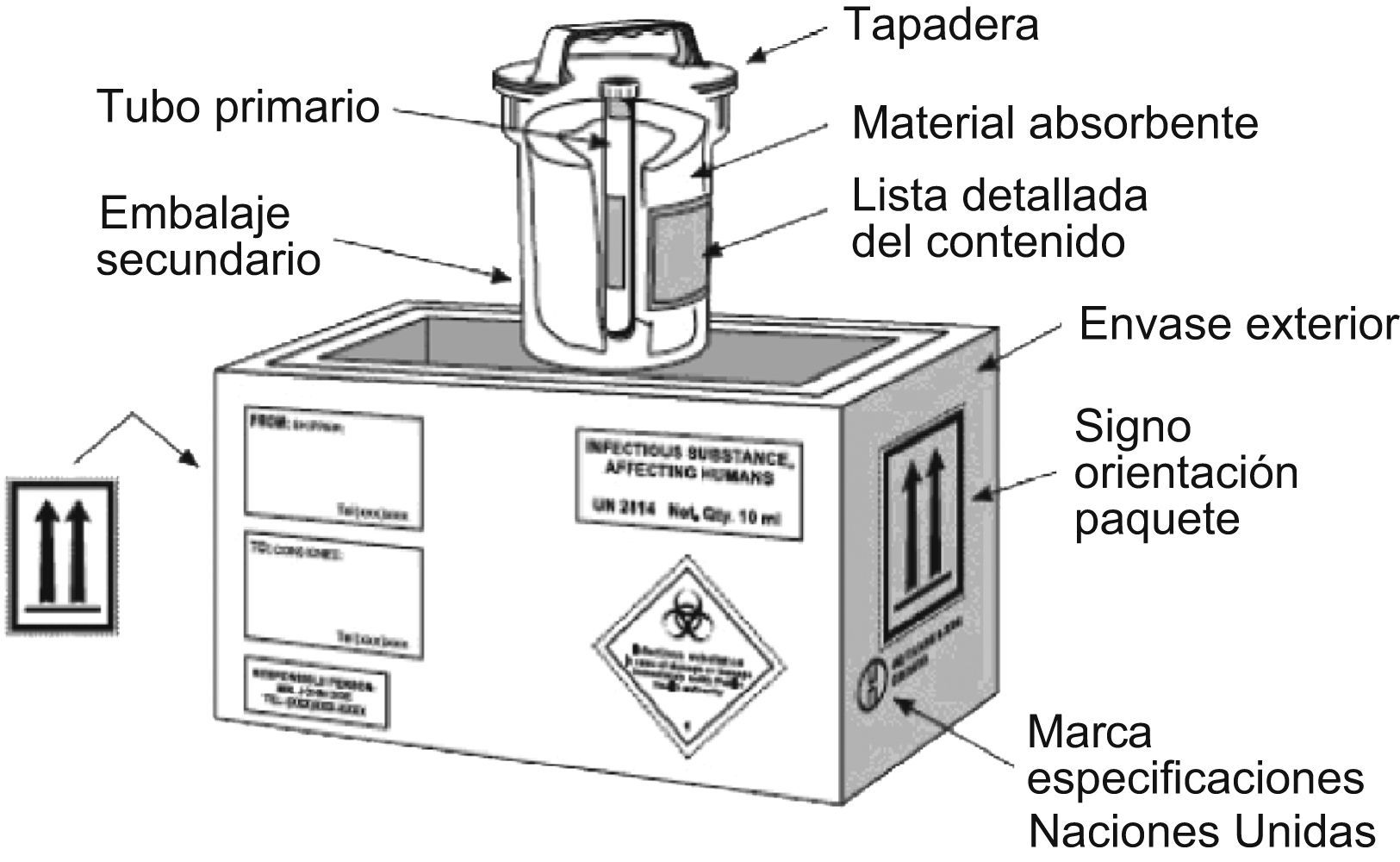
En la figura 3 se detalla el embalaje correspondiente al UN 2814.
Esquema de embalaje UN 2814. (Esquema obtenido de la Guía sobre la reglamentación relativa al transporte de sustancias infecciosas, 2007–200849, de la Organización Mundial de la Salud.)
La entrada en vigor de la ley española de investigación biomédica ha supuesto algunos cambios por lo que respecta a la importación y exportación de muestras biológicas. Para cualquier muestra que sea cedida a terceros o que provenga de centros extranjeros se deberá cumplir el real decreto sobre importación y exportación de muestras biológicas51. Este real decreto especifica las condiciones para la importación y exportación de muestras biológicas y establece un registro voluntario que permite la importación y exportación continuas, independientemente de la finalidad (diagnóstica, analítica o de investigación). Se considera muestra biológica cualquier material humano o de otra procedencia, así como cualquier sustancia, patógena o no, que se destine al diagnóstico o investigación en seres humanos, incluidas las sustancias infecciosas. La inscripción en dicho registro exime de la obligación de presentar ciertos certificados en importaciones o exportaciones. Los importadores y exportadores inscritos deberán renovar la documentación cada 5 años o actualizarla cuando haya una modificación en el tipo de muestra destinada a la importación o exportación. La falta de renovación o cualquier variación en el tipo de muestras dará lugar a la baja en el registro de importadores y exportadores.
ConclusionesLas recomendaciones más relevantes para la recogida, el procesamiento, transporte y almacenamiento de muestras biológicas indican que cualquier biobanco debería contar desde el inicio con unos protocolos de obtención, manipulación y almacenamiento que permitan una adecuada utilización futura de las muestras biológicas. En el momento de la obtención es fundamental la correcta identificación de la muestra, así como un tiempo de extracción, transporte y procesamiento lo más corto posible con el fin de garantizar la estabilidad de las moléculas objeto de estudio. Es igualmente importante disponer de un buen equipamiento con sistemas de seguridad suficientes para unos correctos almacenamiento y supervisión de los equipos. En el diseño inicial es importante tener en cuenta todos los factores que pueden influir en la estabilidad de las muestras52. Las temperaturas a las que se almacenarán éstas pueden comprometer los posibles estudios futuros, y puede ser recomendable reservar algunas alícuotas en N2L para análisis futuros de moléculas desconocidas en la actualidad19. Por último, cabe recordar que es igualmente imprescindible conocer bien las normas éticas y legales tanto en lo relativo a la obtención y manipulación como al uso y/o cesión de las muestras.
Los grandes avances en el campo de la genómica pueden ser ampliamente aprovechados si las colecciones de muestras cumplen con todos estos requisitos.
Los autores dan las gracias al Dr. V. Curull por su asesoramiento clínico en los métodos de obtención de las muestras más utilizados en el ámbito de las enfermedades respiratorias; a la Dra. E. Barreiro por la revisión del artículo, y a J. Manaut por su colaboración en la elaboración del manuscrito.