En 2008, Abrams et al. publicaron que, habida cuenta de las anteriores relaciones encontradas entre la hipoxemia (hipoxia tisular) y el cáncer, el síndrome de apneas e hipopneas del sueño (SAHS) y su principal consecuencia, la hipoxia intermitente, podrían relacionarse con una mayor propensión a padecer cáncer o a un peor pronóstico de un tumor preexistente. Con esta base fisiopatológica y tras algunos estudios en animales que confirmaron esta asociación, 2 grupos independientes de investigación observaron en sendos estudios clínicos amplios de cohortes históricas que el grado de hipoxia nocturna aparecida en pacientes con SAHS se asociaba a una mayor incidencia y mortalidad por cáncer. Este dato ha sido confirmado por casi todos los estudios posteriores, si bien el carácter retrospectivo de todos ellos obliga a considerarlos tan solo como trabajos generadores de hipótesis. Un estudio puesto en marcha actualmente sobre un amplio grupo de pacientes con melanoma posiblemente arroje más luz en un futuro cercano sobre la existencia o no de esta relación y de los mecanismos fisiopatológicos que la gobiernan.
In the light of relationships reported between hypoxemia (tissue hypoxia) and cancer, Abrams et al. concluded in 2008 that sleep apnea-hypopnea syndrome (SAHS) and its main consequence, intermittent hypoxia, could be related with increased susceptibility to cancer or poorer prognosis of a pre-existing tumor. This pathophysiological association was confirmed in animal studies. Two large independent historical cohort studies subsequently found that the degree of nocturnal hypoxia in patients with SAHS was associated with higher cancer incidence and mortality. This finding has been confirmed in almost all subsequent studies, although the retrospective nature of some requires that they be considered as hypothesis-generating only. The relationship between sleep apnea and cancer, and the pathophysiological mechanisms governing it, could be clarified in the near future in a currently on-going study in a large group of melanoma patients.
La relación entre la apnea obstructiva del sueño (SAHS) y el cáncer abre un apasionante panorama de investigación para los próximos años, aunque de momento se sustenta clínicamente sobre arenas movedizas. Sin embargo, tanto los estudios fisiopatológicos como los estudios en animales realizados hasta la fecha parecen coincidir en otorgar credibilidad a esta relación. Desde un punto de vista clínico, varios estudios han observado que existe una asociación entre el SAHS (especialmente valorado por la hipoxemia que produce) y la incidencia y mortalidad por cáncer, si bien su metodología retrospectiva obliga a profundizar más en el tema antes de emitir un juicio más contundente. Todo parece indicar que, de existir esta relación, sería una de las más importantes descubiertas en lo que llevamos de siglo, dado que tanto el SAHS como el cáncer comparten ciertas características comunes desde un punto de vista epidemiológico, como son su elevada prevalencia, su gran impacto sociosanitario y su potencial tratamiento. La siguiente revisión trata de ofrecer al lector los hallazgos encontrados hasta la fecha sobre la relación entre el SAHS y el cáncer, así como los mecanismos en los que se sustenta la hipótesis fisiopatológica que harían plausible dicha relación.
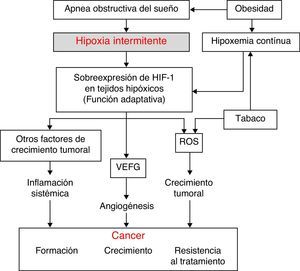
Aspectos fisiopatológicosSe han descubierto diversos mecanismos fisiopatológicos que podrían dar plausibilidad biológica a una posible relación entre el SAHS y la transformación de células sanas en malignas o la diseminación y el crecimiento tumoral. Entre los mecanismos implicados destacan: el estrés oxidativo1,2, la existencia de un mayor grado de inflamación sistémica3,4 (ambas amplificadas por la habitual coexistencia de obesidad en estos pacientes) y, por último y posiblemente más importante, la presencia de hipoxemia intermitente (HI)5 (y en definitiva de hipoxia tisular intermitente secundaria a la primera), que posiblemente esté presente en la génesis de todas las vías anteriormente mencionadas (fig. 1).
El patrón de desaturación-reoxigenación que define a la hipoxemia intermitente es característico del SAHS y constituye un estímulo importante para la activación del sistema de estrés oxidativo con la producción de especies reactivas de oxígeno (ROS)1,2. Ello supone un desequilibrio entre la producción y la degradación de ciertos productos oxidantes/antioxidantes. Esta circunstancia se ha visto relacionada con un incremento de la mutagénesis tanto de forma aguda como crónica, con diversas alteraciones de la función y la estructura de las células, daño del ADN, inestabilidad del genoma que puede derivar en una mayor proliferación celular y transformación neoplásica. Por último, el estrés oxidativo se ha relacionado con algunos factores de transcripción tales como la proteína activadora1 (AP-1) y el factor nuclearkB (NF-kB) involucrados en una mayor propensión a desarrollar cáncer6.
Factor inducido por la hipoxiaTodas las células del organismo presentan diferentes mecanismos compensadores ante situaciones de hipoxia tanto continua como intermitente (propia del SAHS). Uno de los mecanismos más potentes es el incremento en la producción de una molécula clave llamada factor inducido por la hipoxia (HIF-1). El HIF-1 orquesta la regulación de algunos genes que codifican mediadores que hacen a las células capaces de adaptarse a situaciones de hipoxia tisular. El HIF-1 está compuesto por 2 subunidades: HIF-1α y la HIF-1β, siendo la primera molécula la más importante en la regulación de la hipoxia tisular7. La compensación hipóxica se consigue gracias a que HIF-1α pone a su vez en marcha una serie de mecanismos que activan la producción de moléculas angiogénicas, entre las que destaca el factor de crecimiento endotelial vascular (VEFG) que regula la formación de nuevos vasos sanguíneos colaterales que nutren de más oxígeno a la zona hipóxica o que evitan zonas de obstrucción vascular8–14. Si bien en enfermedades cardiovasculares relacionadas con zonas hipóxicas este es un mecanismo compensador importante, en el escenario de un paciente con cáncer esta situación parece tener, sin embargo, un efecto deletéreo. Así, en el interior de los tumores existen grandes zonas de hipoxia (con pO2 por debajo de 10mmHg) que son potentes activadores de los sistemas de compensación mediados por HIF-1. La génesis de una neovascularización tumoral como consecuencia proporciona a las células tumorales un mecanismo excelente de propagación y por lo tanto de generación de metástasis a distancia. Por otro lado, esta neovascularización se produce a expensas de vasos anómalos y frágiles, y por lo tanto la reoxigenación no se produce en estado óptimo.
Inflamación sistémicaEn el SAHS existe tanto un aumento de la inflamación local como sistémica15,16. El SAHS como generador de inflamación sistémica juega un papel aún más importante para explicar la posible asociación entre SAHS y cáncer. Como ya ha sido comentado, el desequilibrio oxidante/antioxidante y el incremento de las ROS se han relacionado con un incremento sistémico en la concentración de sustancias proinflamatorias, incluidas el factor de necrosis tumoral (TNF-α), la interleucina (IL)-6 y la IL-8 mediante la ya mencionada activación de los factores de transcripción NF-kB y AP-1. Se considera que el factor NF-kB es clave en la transcripción de múltiples genes relacionados con la inflamación, arterioesclerosis y cáncer. La HI parece el elemento más importante para la activación de este elemento inflamatorio en pacientes con SAHS15,16.
Por otro lado, la presencia de obesidad en pacientes con SAHS es muy elevada17, y ha sido relacionada per se con algunos tipos de tumores18-21. Ello hace que sea una importante variable de confusión a la hora de analizar la relación existente entre SAHS y cáncer. La inflamación asociada a la obesidad, que podría describirse como una inflamación crónica de bajo grado generada por los propios adipocitos en respuesta a un exceso calórico y de nutrientes, parece ser el elemento de mayor importancia en esta relación y podría ser independiente de la existencia de SAHS.
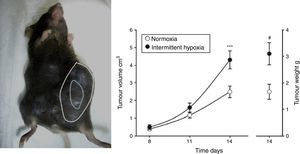
Evidencias en modelos animales de SAHSEfectos de la hipoxia intermitente en cáncerEn un primer estudio22 se observó que la HI que simula a la acontecida en el SAHS era capaz de duplicar la tasa de crecimiento del tumor en un modelo de melanoma (fig. 2). Estos resultados se confirmaron en un segundo trabajo23, donde se cuestionó si la obesidad en el SAHS podría enmascarar en cierta medida los efectos de la HI en la evolución del tumor. En ausencia de HI, los autores observaron un mayor crecimiento tumoral en los animales obesos respecto a los controles, tal y como se ha descrito previamente18,24,25. Sin embargo, la aplicación de HI a ratones obesos no ocasionó un mayor crecimiento tumoral al ya inducido por la propia obesidad. Los niveles plasmáticos de VEGF aumentaron en todos los animales obesos, independientemente de la aplicación de HI, y solo en los delgados sometidos a HI. De hecho, el VEGF circulante presentó una importante correlación con el tamaño de tumor. Esta proteína señalizadora, propuesta por diferentes estudios oncológicos como posible marcador para el pronóstico del cáncer26-28, podría tener relevancia en el SAHS, considerando que los pacientes con esta enfermedad experimentan niveles más elevados en la circulación29-31.
Modelo animal basado en la inyección subcutánea de 106 células de melanoma en ratón (izquierda). Crecimiento y peso tumorales medidos a los 14días significativamente mayores en el grupo de ratones sometidos a hipoxemia intermitente (simulando un SAHS) con respecto al grupo control sometido a normoxia (derecha).
Reproducido de Almendros et al.22.
En un estudio posterior se valoró la capacidad metastásica de melanoma en respuesta a la HI a partir de 2 modelos experimentales de metástasis: inducida y espontánea32. A partir de ambos modelos se encontró un incremento tanto en el número como en el área metastásica de melanoma en respuesta a HI. Siguiendo la misma línea, Eubank et al.18, utilizando un modelo similar de HI, observaron una mayor presencia de células de melanoma en sangre (intravasación) y en muestras de pulmón en los animales sometidos a HI. Los autores sugirieron que la capacidad metastásica observada en HI depende de un incremento en la actividad del HIF-1α (que regula las metaloproteinasas de la matriz extracelular [MMP]-7) y una disminución de HIF-2α (MMP-9 y 12). Además, la pre-exposición de células tumorales a hipoxia cíclica similar a la acontecida en el SAHS parece ser suficiente para incrementar su capacidad metastásica in vivo12,13.
En un trabajo muy reciente se ha estudiado si los cambios en la malignidad asociados a la HI estaban modulados en parte por el sistema inmune33. Actualmente, la información disponible sobre el papel mediado por los macrófagos en el tumor es muy extensa. Por ejemplo, una mayor presencia de los macrófagos asociados al tumor (TAM) se ha relacionado con un peor pronóstico en la evolución del cáncer34. De hecho, se ha demostrado que los TAM pueden modular el crecimiento y las propiedades invasivas del tumor regulando una serie de factores de crecimiento, citoquinas y proteasas35. Para ello, los TAM son capaces de ser «reeducados» desde un estado anti-tumoral (activación clásica) a un estado pro-tumoral (activación alternativa) en el que se promueve la síntesis de moléculas que favorecen el crecimiento del tumor y la angiogénesis. Para demostrar el posible papel de los macrófagos en el crecimiento tumoral observado en los modelos animales, se cultivaron células de melanoma, aisladas o en cocultivo con macrófagos, en condiciones de HI in vitro33. En ambos casos se sometieron a HI o a normoxia, y a las 48h se cuantificaron ambas poblaciones para evaluar la proliferación de los melanocitos. Los resultados obtenidos mostraron que los melanocitos no proliferaban más rápido en condiciones de HI cuando estaban aislados, sino que necesitaban la presencia de los macrófagos (incremento del 30%). De hecho, la HI promovió un cambio de fenotipo de los macrófagos hacia un estado más pro-tumoral o activación alterna. Los resultados de este último trabajo sugieren que los efectos de la HI observados en los tumores in vivo podrían estar regulados más por la respuesta inmunológica del huésped que por cambios producidos directamente en las células del tumor.
Efectos de la fragmentación del sueño sobre el cáncerLa alteración del sueño es muy prevalente y está potencialmente relacionada con el crecimiento del cáncer. De hecho, esta relación se ha estudiado durante la última década y se ha establecido una asociación entre la malignidad de diferentes tipos de cáncer con el insomnio o falta de sueño36-38.
El estudio de los efectos del sueño sobre el cáncer es escaso hasta la fecha debido a la dificultad del desarrollo de modelos experimentales que simulen las condiciones fisiopatológicas de la enfermedad. De hecho, los primeros estudios se basaron en los efectos de la privación del sueño tanto en ratones como en ratas39,40. Estos trabajos encontraron evidencias de los efectos negativos de la falta de sueño en la tumorogénesis, crecimiento tumoral y mortalidad; sin embargo, no reproducían la fragmentación del sueño característica de la OSA y, por consiguiente, son limitados a la hora de interpretar los resultados.
En un estudio reciente, Hakim et al.41 realizaron un estudio mediante un nuevo modelo en ratón que lograba simular la fragmentación del sueño en OSA. En dicho trabajo se observó que el tamaño del tumor se duplicaba, y presentaba una mayor capacidad invasiva hacia los tejidos adyacentes, como consecuencia de la fragmentación del sueño. Este estudio sugiere el papel activo de las TAM en la mayor malignidad observada en respuesta a la fragmentación del sueño.
Los posibles mecanismos implicados aún no han sido descritos en detalle. No obstante, hay evidencias de que la fragmentación del sueño es capaz de movilizar macrófagos a la pared de la aorta42 y producir cambios metabólicos43,44 que podrían servir de base en los mecanismos que podrían participar en la mayor malignidad observada en los tumores.
Apnea del sueño y cáncer. Evidencia actual en humanosDatos indirectosDesafortunadamente, a día de hoy existen muy pocos estudios que hayan analizado la posible asociación entre el SAHS y cáncer en humanos (tabla 1), pero se dispone de algunos datos indirectos. En estudios de mortalidad en pacientes con SAHS, el cáncer suele ser la segunda causa de muerte, después de las enfermedades cardiovasculares45-47. Incluso, en alguno de estos estudios, se ha encontrado una asociación entre la presencia de un SAHS y mortalidad por cáncer48. Sin embargo, un reciente estudio que utilizó la presencia de síntomas como marcadores de SAHS no encontró que la presencia de ronquidos, pausas observadas o excesiva somnolencia diurna se asociaran a una mayor incidencia de cáncer49.
Estudios que han analizado la asociación de SAHS y cáncer en humanos
| Autor (año) | Diseño | Sujetos (n) | Seguimiento | Outcomes | Principales hallazgos |
|---|---|---|---|---|---|
| Nieto et al. (2012) | Cohorte poblacional. Estudio prospectivo. Diagnóstico por PSG | 1.522 | 22 años | Mortalidad por cualquier tipo de cáncer | • Asociación dosis-respuesta entre la gravedad de SAHS medida por IAH y CT90 y la mortalidad por cáncer• La asociación entre SAHS y la mortalidad por cáncer fue más intensa cuando la gravedad de SAHS se midió por CT90 que cuando se midió por IAH (CT90>11,2%; HR ajustada 8,6; IC95% 2,6-28,7) |
| Marshall (2014) | Cohorte poblacional. Estudio prospectivo. Diagnóstico por PR | 397 | 20 años | Incidencia y mortalidad por cualquier tipo de cáncer | • SAHS moderado-grave (IAH≥15) se asoció de forma independiente tanto a una mayor mortalidad por cáncer (HR 3,4; IC95% 1,1-10,2) como a una mayor incidencia de cáncer (HR 2,5; IC95% 1,2-5,0) |
| Chang (2014) | Estudio de cohortes poblacional. Base de datos del Instituto Nacional de Salud de Taiwán | 846 mujeres con códigos de SAHS y 4.230 controles pareados por edad | 5 años | Incidencia de cáncer de mama | • El riesgo de desarrollar un cáncer de mama fue superior en el grupo SAHS respecto al grupo control (HR ajustada 2,09; IC95% 1,06-4,12) |
| Chen (2014) | Estudio de cohortes poblacional. Base de datos del Instituto Nacional de Salud de Taiwán | 23.055 SAHS y 69.165 controles pareados por edad y género | 10 años | Incidencia de cánceres primitivos del sistema nervioso central | • La incidencia de cánceres primitivos del SNC fue superior en el grupo con diagnóstico SAHS respecto al grupo control (HR ajustada 1,54; IC95% 1,01-2,37)• Los pacientes SAHS presentaron un mayor riesgo de desarrollar un cáncer cerebral, pero no de médula espinal |
| Campos-Rodriguez (2013) | Estudio retrospectivo, multicéntrico de cohortes clínica. Diagnóstico por PSG y PR | 4.910 sujetos estudiados por sospecha de SAHS | 4,5 años | Incidencia de cualquier tipo de cáncer | • La gravedad de SAHS medida por CT90 fue un predictor independiente de incidencia de cáncer (CT90>12% vs CT90<1,2%; HR ajustada 2,33; IC95% 1,57-3,46)• La asociación más potente se detectó en pacientes <65años, donde la incidencia de cáncer se relacionó tanto con el IAH como con el CT90 como marcadores de gravedad de SAHS |
| Martínez-García (2014) | Estudio retrospectivo, multicéntrico de cohortes clínica. Diagnóstico por PSG y PR | 5.427 sujetos estudiados por sospecha de SAHS | 4,5 años | Mortalidad por cualquier tipo de cáncer | • Se encontró una asociación significativa entre la mortalidad por cáncer y el CT90 como marcador de gravedad de SAHS (CT90>13% vs CT90<1,2%; HR ajustada 2,06; IC95% 1,72-4,58)• La asociación más estrecha se encontró en pacientes <65años, donde tanto el CT90 como el IAH fueron predictores independientes de mortalidad |
| Martínez-García (2014) | Estudio piloto, prospectivo, multicéntrico transversal. Diagnóstico por PR | 56 sujetos con diagnóstico de melanoma cutáneo | Asociación entre SAHS y marcadores de gravedad de melanoma | • La prevalencia de SAHS. moderado o grave (IAH≥15) en pacientes con melanoma fue del 30,3%• Tanto el IAH como el ID fueron predictores independientes de una mayor velocidad de crecimiento del melanoma (OR ajustada 1,08; IC95% 1,02-1,14; OR ajustada 1,08; IC95% 1,02-1,11, respectivamente) | |
| Kendzerska (2014) | Estudio retrospectivo, de cohortes clínica. Diagnóstico por PSG | 10.149 sujetos estudiados por sospecha de SAHS | 7,8 años | Prevalencia e incidencia de cualquier tipo de cáncer | • No se encontró relación entre IAH y mayor prevalencia de cáncer• No se encontró una mayor incidencia de cáncer en pacientes con SAHS grave medido por IAH o CT90, respecto a pacientes sin SAHS |
CT90: tiempo nocturno con saturación arterial de oxígeno por debajo del 90%; IAH: índice de apneas-hipopneas; PR: poligrafía respiratoria; PSG: polisomnografía convencional; SAHS: apnea obstructiva del sueño; SNC: sistema nervioso central.
El primer estudio poblacional que analizó la asociación entre SAHS y cáncer fue la cohorte de Wisconsin, compuesta por 1.522 sujetos y con un seguimiento de 22años50. En este estudio se encontró una asociación dosis-respuesta entre la gravedad del SAHS medida por el índice de apneas-hipopneas (IAH) y la mortalidad por cualquier tipo de cáncer. Esta asociación se mantuvo tras ajustar por diversas variables de confusión, e incluso se observó que el SAHS grave (IAH≥30) era un predictor independiente de mortalidad por cáncer. Dicha asociación fue incluso más intensa cuando, en lugar del IAH, se utilizó como marcador de gravedad de SAHS un índice oximétrico, el porcentaje de tiempo nocturno con saturación de oxígeno <90% (CT90). En este estudio no se observó que la relación se influyese por el sexo o la edad, si bien resultó más intensa en pacientes no obesos.
Por otro lado, la cohorte de Busselton, compuesta por 400 sujetos seguidos durante 20años, también encontró una asociación entre SAHS moderado-grave (IAH≥15) y una mayor mortalidad (HR 3,4; IC95% 1,1-10,2) e incidencia de cáncer (HR 2,5; IC95% 1,2-5,0)51.
Finalmente, 2 grandes series taiwanesas49,50 que utilizaron datos procedentes del Instituto Nacional de Salud observaron que los pacientes con SAHS tenían un riesgo superior de desarrollar un cáncer de mama (HR 2,09; IC95% 1,06-4,12)36 y un cáncer primitivo del sistema nervioso central (HR 1,54; IC95% 1,01 a 2,37)52 respecto a los grupos control sin SAHS. Ambos estudios, sin embargo, presentaron importantes limitaciones, como la falta de datos sobre la gravedad de SAHS o el ajuste por diversas variables de confusión fundamentales.
Estudios clínicosEl Grupo Español de Sueño (GES) publicó en 2013 el primer estudio clínico que analizaba la asociación entre SAHS y cáncer. Se trató de un estudio retrospectivo y multicéntrico con un seguimiento medio de 4,5años. En un primer análisis se estudió la asociación entre la gravedad del SAHS y la incidencia de cualquier tipo de cáncer en 4.910 pacientes sin antecedentes de cáncer previo53. Tras ajustar por diversas variables fundamentales se encontró una asociación significativa entre la incidencia de cáncer y la gravedad de SAHS medida por el CT90, pero no por el IAH. La asociación más potente se encontró en el grupo de pacientes <65años, donde la incidencia de cáncer se relacionó tanto con el IAH como con el CT90. Cuando se analizó la mortalidad en esta serie, los resultados fueron muy similares a los obtenidos para incidencia, encontrándose una asociación significativa entre la mortalidad por cáncer y el CT90 como marcador de gravedad de SAHS especialmente en hombres y menores de 65años54. En un subanálisis que incluyó solo a aquellos pacientes con cáncer (n=527) se observó que CT90 fue una variable independiente predictora de mortalidad.
Estos resultados, sin embargo, no han sido reproducidos en otro estudio muy reciente que analizó 10.149 pacientes estudiados por sospecha de SAHS entre 1994 y 2010 en Toronto, con un seguimiento de 7,8años55. Tras ajustar por diversas variables, los autores no encontraron una mayor incidencia de cáncer en pacientes con SAHS grave medido por IAH o CT90, respecto a pacientes sin SAHS (IAH>30 vs.<5; HR ajustada 1,02; IC95% 0,80-1,31; CT90: HR ajustada 1,00; IC95% 0,99-1,02). Estos resultados no variaron cuando los autores utilizaron los mismos puntos de corte para IAH y CT90 que en el estudio del GES. En un estudio de subgrupos estos mismos autores observaron que en aquellos tumores relacionados con el tabaco sí existió asociación con algunos parámetros de gravedad del SAHS.
Si bien de los 6 estudios existentes hasta la fecha, en 5 de ellos se ha encontrado una asociación entre la gravedad del SAHS, sobre todo medida por marcadores oximétricos, y la incidencia y mortalidad por cáncer36,50-54; todos estos estudios presentan una serie de limitaciones que obligan a aceptar con cautela sus conclusiones y continuar investigando en esta asociación. Así, ninguna de las series analizadas había sido diseñada originalmente para investigar la asociación entre SAHS y cáncer, no se ha estudiado en la mayoría de estudios un tipo determinado de tumor, histología o localización (diferentes células pueden ser más o menos sensibles a la acción de la hipoxia), no se ha utilizado un marcador válido de hipoxemia intermitente50,51,53-55 y finalmente, debido al escaso número de eventos, algunas asociaciones en subgrupos concretos, como los no obesos, <65años o género masculino presentan escasa potencia estadística.
Estudios en cursoActualmente solo se ha publicado un estudio prospectivo que ha pretendido analizar la asociación entre SAHS y un tipo concreto de tumor, el melanoma cutáneo, y que es liderado por el GES. El objetivo de este estudio es comprobar si la gravedad de SAHS medida por diferentes marcadores se asocia a un comportamiento más agresivo de este tumor. Inicialmente, se realizó un estudio piloto incluyendo 56 pacientes diagnosticados de melanoma a los que se efectuó una poligrafía respiratoria56. La prevalencia de SAHS en esta serie fue elevada; el 60,7% de los pacientes presentaban un IAH≥5 y el 14.3% tenían un IAH≥30. Además, se encontró que la gravedad de SAHS medida tanto por el IAH como por el índice de desaturación (ID) se correlacionaba con una mayor profundidad cutánea del tumor, así como con una tasa más elevada de crecimiento tumoral. Tras ajustar por variables de confusión, tanto el IAH como el ID fueron predictores independientes de una mayor velocidad de crecimiento del melanoma. Estos hallazgos han estimulado la puesta en marcha de un estudio multicéntrico de mayores dimensiones que intentará confirmar estos resultados preliminares en los próximos meses.
ConclusionesA pesar del creciente interés en la posible asociación entre SAHS y cáncer, los escasos datos disponibles hasta la fecha, unidos a las limitaciones que presentan los estudios, inherentes a su diseño, los erigen más bien en estudios generadores de hipótesis que suscitan más preguntas de las que responden, y que animan a la realización de nuevos estudios, mejor diseñados, que aclaren esta posible relación (tabla 2)57-59.
Retos futuros en la investigación de la asociación entre SAHS y cáncer
| • Identificar qué tipos de cáncer y qué estirpes histológicas se asocian a SAHS |
| • Analizar qué papel juegan las diversas variables de confusión |
| • Identificar qué grupos de población en función de género, edad, la presencia de excesiva somnolencia diurna, obesidad, etc., son más susceptibles |
| • Identificar los mecanismos fisiopatológicos implicados |
| • Establecer qué marcadores polisomnográficos son los mejores predictores de cáncer en pacientes con SAHS |
| • Posible papel de la CPAP u otros tratamientos del SAHS |
Fondo de Investigación Sanitaria (FIS) PI12/01363, Beca SEPAR 058/2011 y Programa Beatriu de Pinós de la Generalitat de Catalunya (2010 BP_00238).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.