Un buen control de la tuberculosis (TB) requiere disponer de personal multidisciplinario bien coordinado. El objetivo fue evaluar el impacto de la acreditación de unidades de TB (UTB) fomentada por la Sociedad Española de Neumología (SEPAR) y ver las diferencias entre los centros que se acreditaron y los que no.
Material y métodos. DiseñoEstudio observacional descriptivo basado en una encuesta autoadministrada entre octubre de 2014 y febrero de 2018 a 139 responsables de neumología registrados por SEPAR, antes y después de la acreditación.
Variablesdemográficas, epidemiológicas y sobre estudio de contactos, entre otras. Análisis: descriptiva básica, cálculo de medianas para variables continuas y proporciones para categóricas. Se compararon las variables mediante el test chi-cuadrado y regresión logística.
ResultadosLa tasa de respuesta fue del 54,7 y del 43,2% en el período pre- y postacreditación de UTB, respectivamente. No se observaron cambios en los diferentes ámbitos de atención y coordinación entre la encuesta pre- y postacreditación, ni tampoco en la organización, al analizar los centros acreditados. Al comparar los centros que se acreditaron con los que no, se detectaron diferencias significativas con relación a recogida de conclusión final, manejo de resistencias, coordinación con otros servicios, estudios de contactos o tratamiento directamente observado.
ConclusionesSe ha objetivado cómo abordan la TB diferentes profesionales, se han detectado aspectos positivos y otros mejorables, y se han observando indicadores de mejor funcionamiento en los centros que se acreditaron frente a los que no lo hicieron. Se precisa una supervisión cercana de las UTB para mejorar su efectividad.
Well-coordinated multidisciplinary teams are essential for better tuberculosis (TB) control. Our objective was to evaluate the impact of Spanish Society of Pneumology (SEPAR) accreditation of TB Units (TBU) and to determine differences between the accredited and non-accredited centers.
Material and methods. DesignObservational descriptive study based on a self-administered survey from October 2014 to February 2018 completed by 139 heads of respiratory medicine departments collected by SEPAR, before and after TBU accreditation.
Variablesdemographic, epidemiological and contact tracing (CT) variables, among others. Analysis: basic descriptive analysis, and calculation of medians for continuous variables and proportions for categorical variables. The variables were compared using the Chi-squared test and logistic regression.
ResultsThe response rate was 54.7% and 43.2% in the pre- and post-TBU accreditation period, respectively. No differences were observed in the care and coordination variables between the pre- and post-accreditation survey, nor in the organization when only accredited centers were analyzed. When we compared the accredited and non-accredited centers, significant differences were detected in the collection of the final conclusion, management of resistance, coordination with other departments, contact tracing, and directly observed treatment.
ConclusionsThe approach of different professionals with regard to TB has been addressed. Positive aspects and areas for improvement have been detected, and better results were observed in the accredited versus non-accredited centers. A closer supervision of TBUs is necessary to improve their effectiveness.
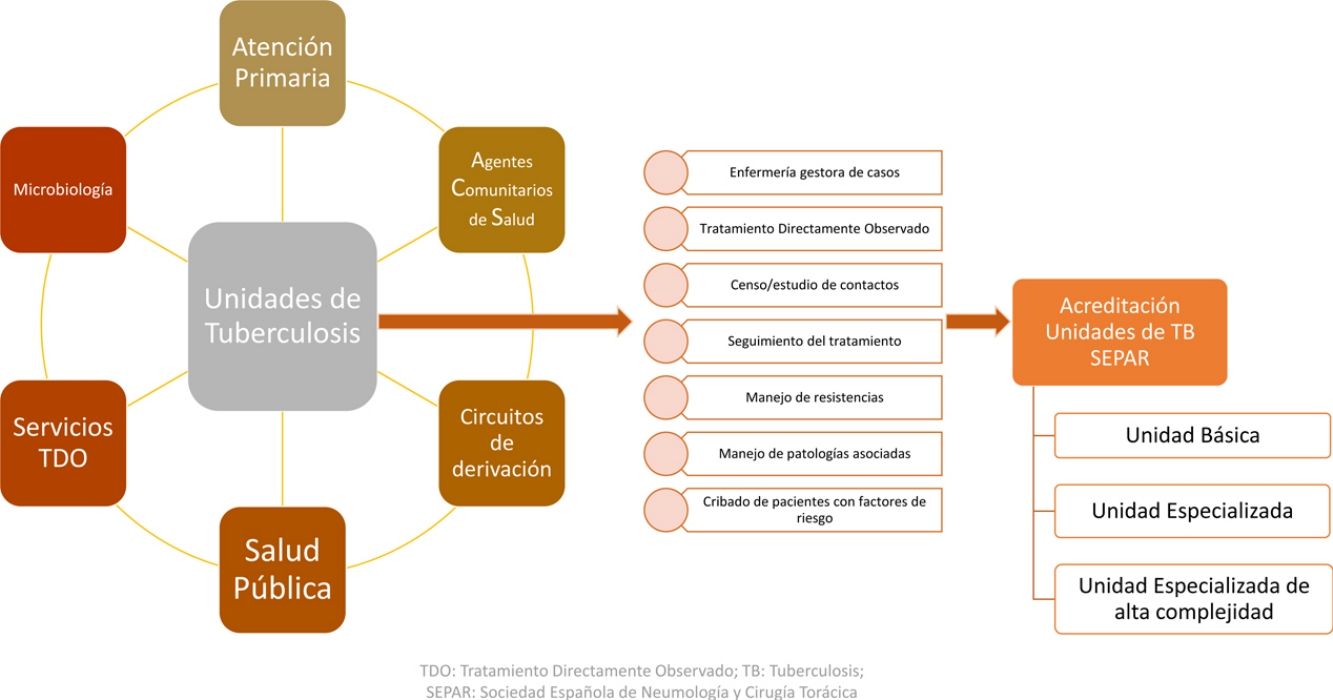
Para un buen control de la tuberculosis (TB), incluyendo la detección precoz y el manejo adecuado de los casos, una de las claves es disponer de personal especializado y una buena coordinación entre diferentes estamentos. Su buen control requiere, además, disponer no solo de médicos expertos sino de un número adecuado de personal de enfermería especializado, así como de una buena estructura y organización de los servicios y responsables que la llevan a cabo1-4. En países con baja incidencia de TB como España, donde ya hay muchos más médicos de Atención Primaria (AP) que casos de TB, es recomendable que se centralicen las actividades referentes a la TB y al estudio de contactos (EECC) en unidades especializadas5. El documento marco para la eliminación de la TB en países de baja incidencia destaca la importancia de contar con un equipo de coordinación central, unidades especializadas para el diagnóstico y tratamiento de la TB y el nivel apropiado de centralización5.
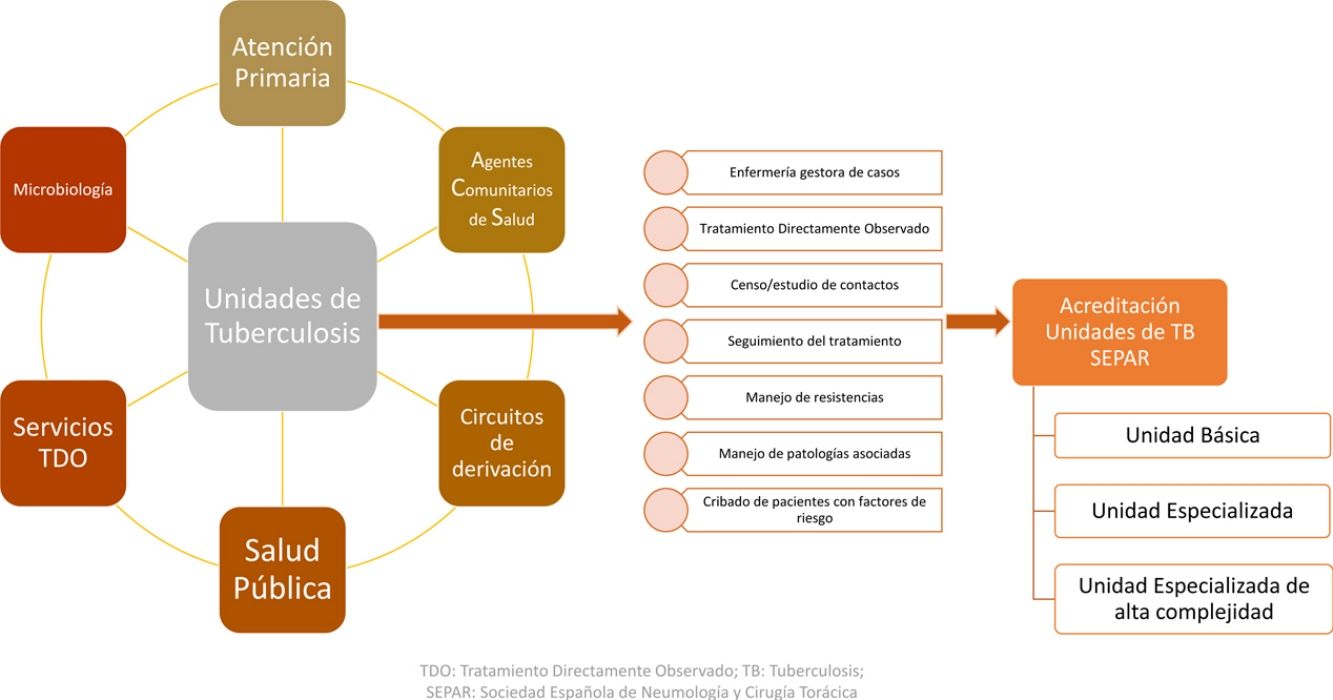
Con el objetivo de mejorar el control de la TB, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) impulsó la acreditación de unidades de tuberculosis (UTB) dedicadas al tratamiento, seguimiento y prevención de la enfermedad. Si bien el número de casos ha descendido notablemente, la TB sigue teniendo importancia clínica. Su manejo muchas veces no es fácil y se ha complicado con la presencia de formas resistentes a los medicamentos más eficaces. Por ello, es necesario contar con unidades básicas, pero también con expertos y unidades especializadas que pueden aconsejar y dirigir tratamientos complejos, estudiar los contactos de los casos y coordinarse con otras especialidades o niveles asistenciales. Desde la SEPAR se busca la creación y posterior acreditación de UTB funcionales y multidisciplinarias, en el sentido de agrupar especialidades, profesionales y entidades que están implicadas en el manejo de esta enfermedad6,7.
Conocer quiénes son los especialistas encargados del diagnóstico, tratamiento y del EECC de los pacientes con TB pulmonar y extrapulmonar y cómo se coordinan diferentes estamentos podría ayudar a proponer estrategias para mejorar la organización de las UTB. Con ello se daría un paso importante para el control de la TB en España.
Por ello, el objetivo del estudio fue conocer cómo se organizan los servicios de neumología y los profesionales dedicados a la TB en España para controlar la enfermedad, antes y después de la acreditación de UTB por parte de SEPAR, a fin de analizar la efectividad de esta iniciativa.
Material y métodosDiseño y períodoEstudio observacional descriptivo transversal de base poblacional pre- y postacreditación en la atención especializada en España del 1 de octubre de 2014 al 31 de diciembre de 2016 y del 1 de enero de 2017 al 28 de febrero de 2018.
ÁmbitoServicios de neumología de los hospitales de España a través de una encuesta online autoadministrada dirigida a los jefes de servicio o sección de neumología registrados por SEPAR (N=139). La encuesta se administró antes y después del inicio de la acreditación de UTB. Se enviaron 3 correos electrónicos desde la SEPAR para la encuesta pre- y 3 más para la post- en los que se invitaba a responderlas y se llamó por teléfono a los que no se pudo contactar mediante el correo electrónico. En algunos casos los jefes de servicio o sección de neumología derivaron la encuesta a otros servicios dedicados a la TB.
La iniciativa consistió en la acreditación como unidad asistencial de TB por parte de la SEPAR a todas las unidades que lo solicitaban y que reunían una serie de criterios preestablecidos6. Se acreditaron un total de 26 UTB desde el año 2015, que fueron clasificadas en función de la complejidad en unidades básicas, especializadas o especializadas de alta complejidad. Los criterios y requisitos de acreditación en cada una de estas categorías se clasificaron siguiendo las siguientes líneas y objetivos estratégicos: actividad asistencial, recursos técnicos y humanos, disponibilidad de laboratorio de micobacterias, capacidad de realizar EECC, formación y actividad investigadora6.
Variables y fuentes de informaciónLa información se obtuvo de una encuesta diseñada específicamente para ello (Apéndice A), la cual se elaboró teniendo en cuenta los criterios de acreditación de UTB de la SEPAR. Se recogieron variables demográficas de los encuestados (especialidad, centro de trabajo, tipo de centro, ciudad, provincia, área de influencia y comunidad autónoma), epidemiológicas (número total de TB atendidos al año, de casos multirresistentes y monorresistentes y conclusión final del tratamiento), especialista responsable del tratamiento de la TB pulmonar, TB extrapulmonar y pediátrica (neumólogo, internista, infectólogo, pediatra, otros), existencia de un referente de TB, coordinación con AP y otros circuitos de derivación, existencia de unidad específica de TB, presencia de gestora de casos y de residentes, notificación a Salud Pública (SP), posibilidad de suministrar tratamiento directamente observado (TDO), realización de censo y EECC y especialista responsable del mismo (AP, neumología, medicina interna, infecciosas, medicina preventiva), cribado de infección tuberculosa latente en pacientes con factores de riesgo, participación con el Programa Integrado de Investigación en Tuberculosis (PII-TB) y acreditación como UTB por la SEPAR.
Definiciones:
- -
Referente de TB: persona responsable y de referencia de la unidad con capacidad de coordinación y colaboración con otros médicos neumólogos y de otras especialidades, así como con el personal de enfermería6.
- -
Gestor de casos: personal de enfermería referente de TB que favorece la organización, coordinación y comunicación dentro de la UTB y fuera de esta. Es el nexo entre los distintos actores implicados en el diagnóstico, tratamiento y seguimiento tanto de la enfermedad como de la infección tuberculosa latente y puede, así, centralizar toda la información referente a los casos y a los contactos de TB.
- -
Paciente con factores de riesgo: incluye a aquellas personas que han tenido contacto reciente con enfermos con TB y a las personas con afecciones o comportamientos que debilitan el sistema inmunitario8.
Se realizó un análisis descriptivo de las variables antes y después de la acreditación. Se compararon las encuestas entre centros acreditados y no acreditados, utilizando la más reciente en el caso de que el centro hubiese cumplimentado ambas. Se calcularon medianas y rangos intercuartílicos (RI) para las variables continuas y proporciones para las categóricas. Se compararon las variables categóricas a nivel univariado mediante el test de chi-cuadrado o la prueba exacta de Fisher si no se cumplían los criterios del chi-cuadrado, considerando un valor p<0,05 como estadísticamente significativo. Se calcularon los factores asociados a acreditarse por la SEPAR mediante un análisis de regresión logística comparando los centros que se acreditaron con los que no lo hicieron. Como medida de asociación se utilizó la odds ratio (OR), con un intervalo de confianza del 95% (IC) y un valor de significación estadística p<0,05. Para determinar el ajuste del modelo se utilizó el test de Hosmer y Lemeshow.
Consideraciones éticasTodos los datos se trataron de forma estrictamente confidencial siguiendo en todo momento los principios éticos de la Declaración de Helsinki9, la Ley española de Protección de Datos 15/199910 y el Reglamento de la Unión Europea n.° 2016/679 General de Protección de Datos11. El proyecto se presentó y aprobó por el Comité de Ética e Investigación Clínica del Institut Municipal d’Assistència Sanitària, número 2013/5389/I.
ResultadosDe los 139 servicios o secciones de neumología de España contactados, 76 (54,7%) respondieron la encuesta preacreditación realizada entre 2014 y 2016 y 60 (43,2%) la encuesta postacreditación contestada entre los años 2017 y 2018. Un total de 93 centros contestaron al menos una encuesta, 43 de los cuales respondieron ambas encuestas.
Las 76 encuestas preacreditación procedían de 16/17 (94,1%) comunidades autónomas y 33/50 (66%) provincias de España. El 90,8% (69/76) pertenecían a servicios o secciones de neumología y 7/76 (9,2%) a medicina interna o infecciosas. El 42,1% (32) y 52,6% (40) formaban parte de hospitales con más de 500 y de 100-500 camas, respectivamente. La mediana global de casos de TB en los años 2014, 2015 o 2016 fue de 28 (RI 10,5-52,5) por centro encuestado y el 84,2% (64) de ellos recogían el resultado final del tratamiento. En un mayor porcentaje de los centros la TB pulmonar era atendida por neumólogos (59,2%), mientras que la extrapulmonar era tratada por medicina interna en un 57,9% de ellos. En el 72,4% de los centros (55) se realizó censo de los contactos y en el 60,5% el EECC. En el 64,5% (49) existía un referente de TB, el 63,2% (48) se coordinaban con AP y el 61,8% (47) con niveles asistenciales superiores. El 34,2% (26) ya estaban organizados como UTB, el 42,1% (32) disponían de gestora de casos y el 94,7% (72) notificaban más del 75% de los casos a SP.
Según procedencia geográfica, las 60 encuestas postacreditación procedían de 15/17 (88,2%) comunidades autónomas y 26/50 (52%) provincias. El 86,7% (52/60) pertenecían a servicios o secciones de neumología y 8/60 (13,3%) a medicina interna o infecciosas. El 45,0% (27) y 50,0% (30) formaban parte de hospitales con más de 500 y de 100-500 camas, respectivamente. La mediana de casos de TB en los años 2017 o 2018 fue de 20 (RI 14,5-45,5) por centro y hasta el 86,7% (52) recogían el resultado final del tratamiento. Se hizo el censo de los contactos en el 68,3% de los centros (41) y se realizó el EECC en el 61,7% de ellos. En el 68,3% (41) existía un referente de TB, el 73,3% (44) se coordinaban con AP y el 63,3% (38) con niveles asistenciales superiores. El 36,7% (22) ya estaban organizados como UTB, el 46,7% (28) disponían de gestora de casos y el 91,7% (55) notificaban más del 75% de los casos a SP. De los 40 centros no acreditados, 21 (52,5%) manifestaban que les gustaría acreditarse como UTB.
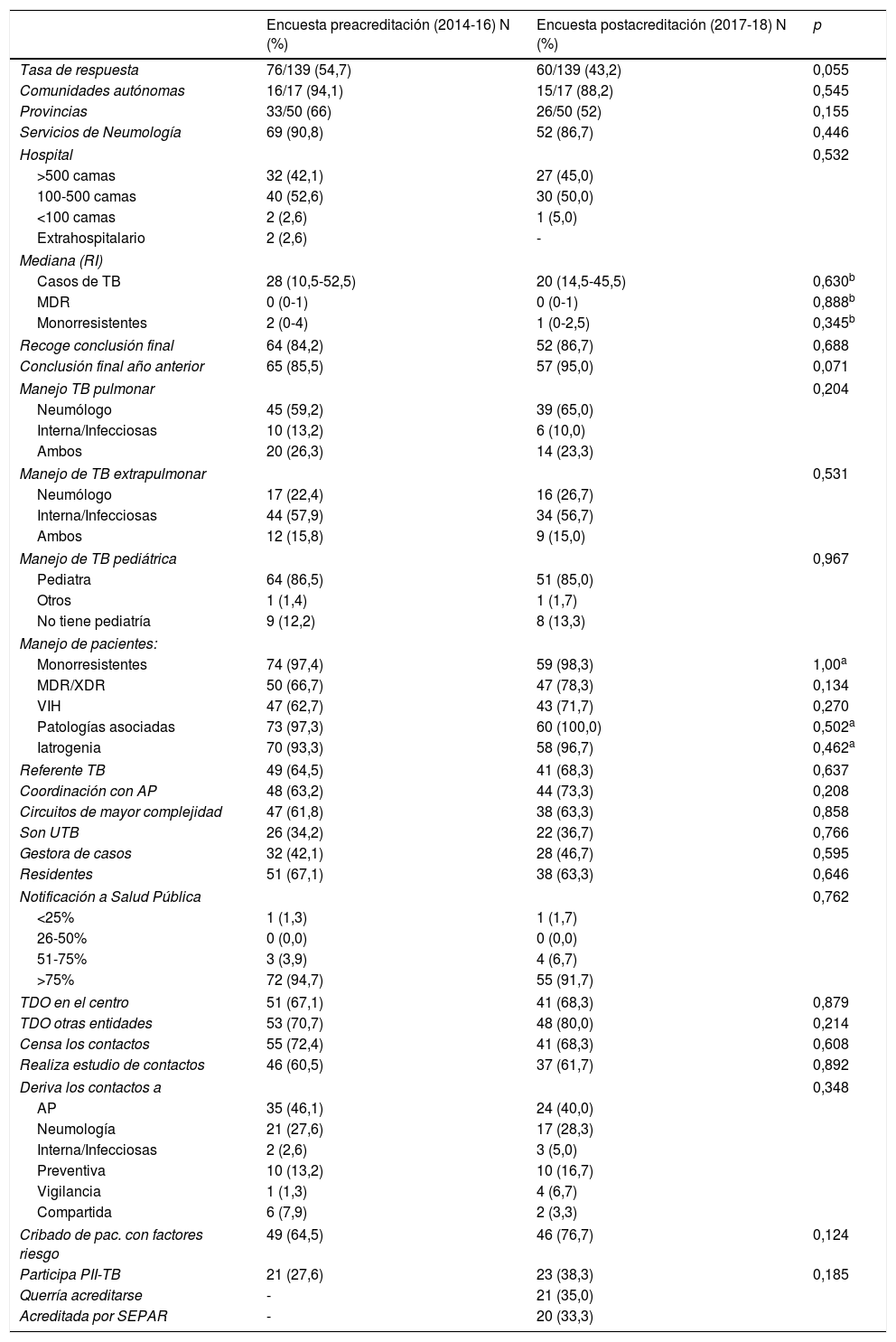
La tabla 1 compara las principales variables recogidas en la encuesta antes y después de la acreditación. No se observaron cambios significativos en los diferentes ámbitos de atención y coordinación entre la encuesta pre- y postacreditación, aunque sí se mejoraba la recogida de conclusiones finales.
Comparación entre diferentes variables asistenciales y de coordinación recogidas de la encuesta antes y después de la acreditación de unidades de tuberculosis por SEPAR en España (2014-2018)
| Encuesta preacreditación (2014-16) N (%) | Encuesta postacreditación (2017-18) N (%) | p | |
|---|---|---|---|
| Tasa de respuesta | 76/139 (54,7) | 60/139 (43,2) | 0,055 |
| Comunidades autónomas | 16/17 (94,1) | 15/17 (88,2) | 0,545 |
| Provincias | 33/50 (66) | 26/50 (52) | 0,155 |
| Servicios de Neumología | 69 (90,8) | 52 (86,7) | 0,446 |
| Hospital | 0,532 | ||
| >500 camas | 32 (42,1) | 27 (45,0) | |
| 100-500 camas | 40 (52,6) | 30 (50,0) | |
| <100 camas | 2 (2,6) | 1 (5,0) | |
| Extrahospitalario | 2 (2,6) | - | |
| Mediana (RI) | |||
| Casos de TB | 28 (10,5-52,5) | 20 (14,5-45,5) | 0,630b |
| MDR | 0 (0-1) | 0 (0-1) | 0,888b |
| Monorresistentes | 2 (0-4) | 1 (0-2,5) | 0,345b |
| Recoge conclusión final | 64 (84,2) | 52 (86,7) | 0,688 |
| Conclusión final año anterior | 65 (85,5) | 57 (95,0) | 0,071 |
| Manejo TB pulmonar | 0,204 | ||
| Neumólogo | 45 (59,2) | 39 (65,0) | |
| Interna/Infecciosas | 10 (13,2) | 6 (10,0) | |
| Ambos | 20 (26,3) | 14 (23,3) | |
| Manejo de TB extrapulmonar | 0,531 | ||
| Neumólogo | 17 (22,4) | 16 (26,7) | |
| Interna/Infecciosas | 44 (57,9) | 34 (56,7) | |
| Ambos | 12 (15,8) | 9 (15,0) | |
| Manejo de TB pediátrica | 0,967 | ||
| Pediatra | 64 (86,5) | 51 (85,0) | |
| Otros | 1 (1,4) | 1 (1,7) | |
| No tiene pediatría | 9 (12,2) | 8 (13,3) | |
| Manejo de pacientes: | |||
| Monorresistentes | 74 (97,4) | 59 (98,3) | 1,00a |
| MDR/XDR | 50 (66,7) | 47 (78,3) | 0,134 |
| VIH | 47 (62,7) | 43 (71,7) | 0,270 |
| Patologías asociadas | 73 (97,3) | 60 (100,0) | 0,502a |
| Iatrogenia | 70 (93,3) | 58 (96,7) | 0,462a |
| Referente TB | 49 (64,5) | 41 (68,3) | 0,637 |
| Coordinación con AP | 48 (63,2) | 44 (73,3) | 0,208 |
| Circuitos de mayor complejidad | 47 (61,8) | 38 (63,3) | 0,858 |
| Son UTB | 26 (34,2) | 22 (36,7) | 0,766 |
| Gestora de casos | 32 (42,1) | 28 (46,7) | 0,595 |
| Residentes | 51 (67,1) | 38 (63,3) | 0,646 |
| Notificación a Salud Pública | 0,762 | ||
| <25% | 1 (1,3) | 1 (1,7) | |
| 26-50% | 0 (0,0) | 0 (0,0) | |
| 51-75% | 3 (3,9) | 4 (6,7) | |
| >75% | 72 (94,7) | 55 (91,7) | |
| TDO en el centro | 51 (67,1) | 41 (68,3) | 0,879 |
| TDO otras entidades | 53 (70,7) | 48 (80,0) | 0,214 |
| Censa los contactos | 55 (72,4) | 41 (68,3) | 0,608 |
| Realiza estudio de contactos | 46 (60,5) | 37 (61,7) | 0,892 |
| Deriva los contactos a | 0,348 | ||
| AP | 35 (46,1) | 24 (40,0) | |
| Neumología | 21 (27,6) | 17 (28,3) | |
| Interna/Infecciosas | 2 (2,6) | 3 (5,0) | |
| Preventiva | 10 (13,2) | 10 (16,7) | |
| Vigilancia | 1 (1,3) | 4 (6,7) | |
| Compartida | 6 (7,9) | 2 (3,3) | |
| Cribado de pac. con factores riesgo | 49 (64,5) | 46 (76,7) | 0,124 |
| Participa PII-TB | 21 (27,6) | 23 (38,3) | 0,185 |
| Querría acreditarse | - | 21 (35,0) | |
| Acreditada por SEPAR | - | 20 (33,3) | |
AP: Atención Primaria; MDR: multirresistente; pac.: pacientes; PII-TB: Programa Integrado de Investigación en Tuberculosis; RI: rango intercuartílico; SEPAR: Sociedad Española de Neumología y Cirugía Torácica; TB: tuberculosis; TDO: tratamiento directamente observado; UTB: unidad de tuberculosis; VIH: virus de la inmunodeficiencia humana; XDR: extremadamente resistente.
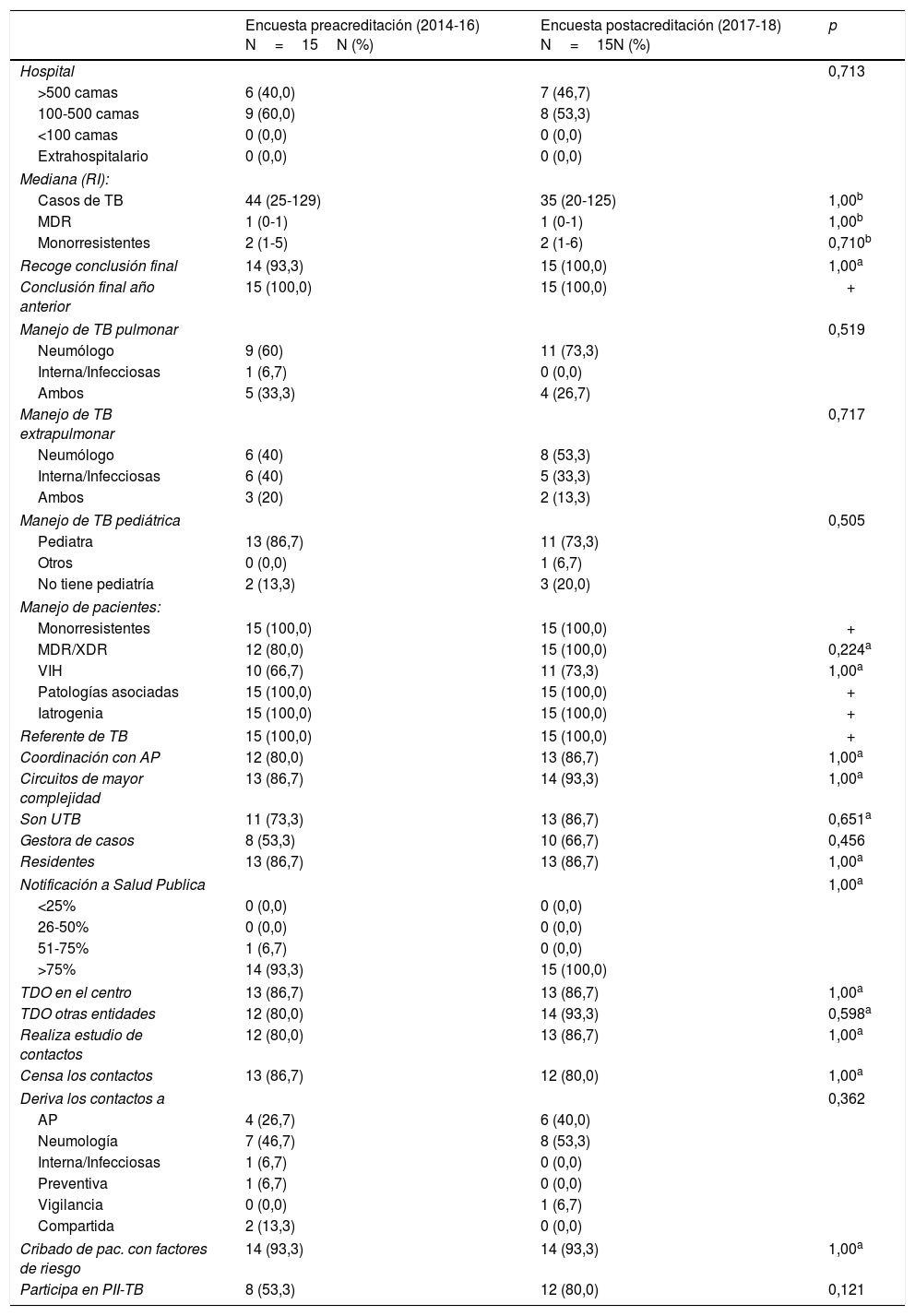
De todos los centros que respondieron la encuesta, se acreditaron como UTB 20 centros y 15 de estos respondieron ambas encuestas. Al comparar los resultados de la encuesta antes y después de la acreditación de UTB en estos 15 centros, no se observaron diferencias en la organización antes y después de haberse acreditado (tabla 2).
Comparación de variables asistenciales y de coordinación recogidas en la encuesta antes y después de la acreditación entre las unidades de tuberculosis acreditadas por SEPAR (2014-2018)
| Encuesta preacreditación (2014-16) N=15N (%) | Encuesta postacreditación (2017-18) N=15N (%) | p | |
|---|---|---|---|
| Hospital | 0,713 | ||
| >500 camas | 6 (40,0) | 7 (46,7) | |
| 100-500 camas | 9 (60,0) | 8 (53,3) | |
| <100 camas | 0 (0,0) | 0 (0,0) | |
| Extrahospitalario | 0 (0,0) | 0 (0,0) | |
| Mediana (RI): | |||
| Casos de TB | 44 (25-129) | 35 (20-125) | 1,00b |
| MDR | 1 (0-1) | 1 (0-1) | 1,00b |
| Monorresistentes | 2 (1-5) | 2 (1-6) | 0,710b |
| Recoge conclusión final | 14 (93,3) | 15 (100,0) | 1,00a |
| Conclusión final año anterior | 15 (100,0) | 15 (100,0) | + |
| Manejo de TB pulmonar | 0,519 | ||
| Neumólogo | 9 (60) | 11 (73,3) | |
| Interna/Infecciosas | 1 (6,7) | 0 (0,0) | |
| Ambos | 5 (33,3) | 4 (26,7) | |
| Manejo de TB extrapulmonar | 0,717 | ||
| Neumólogo | 6 (40) | 8 (53,3) | |
| Interna/Infecciosas | 6 (40) | 5 (33,3) | |
| Ambos | 3 (20) | 2 (13,3) | |
| Manejo de TB pediátrica | 0,505 | ||
| Pediatra | 13 (86,7) | 11 (73,3) | |
| Otros | 0 (0,0) | 1 (6,7) | |
| No tiene pediatría | 2 (13,3) | 3 (20,0) | |
| Manejo de pacientes: | |||
| Monorresistentes | 15 (100,0) | 15 (100,0) | + |
| MDR/XDR | 12 (80,0) | 15 (100,0) | 0,224a |
| VIH | 10 (66,7) | 11 (73,3) | 1,00a |
| Patologías asociadas | 15 (100,0) | 15 (100,0) | + |
| Iatrogenia | 15 (100,0) | 15 (100,0) | + |
| Referente de TB | 15 (100,0) | 15 (100,0) | + |
| Coordinación con AP | 12 (80,0) | 13 (86,7) | 1,00a |
| Circuitos de mayor complejidad | 13 (86,7) | 14 (93,3) | 1,00a |
| Son UTB | 11 (73,3) | 13 (86,7) | 0,651a |
| Gestora de casos | 8 (53,3) | 10 (66,7) | 0,456 |
| Residentes | 13 (86,7) | 13 (86,7) | 1,00a |
| Notificación a Salud Publica | 1,00a | ||
| <25% | 0 (0,0) | 0 (0,0) | |
| 26-50% | 0 (0,0) | 0 (0,0) | |
| 51-75% | 1 (6,7) | 0 (0,0) | |
| >75% | 14 (93,3) | 15 (100,0) | |
| TDO en el centro | 13 (86,7) | 13 (86,7) | 1,00a |
| TDO otras entidades | 12 (80,0) | 14 (93,3) | 0,598a |
| Realiza estudio de contactos | 12 (80,0) | 13 (86,7) | 1,00a |
| Censa los contactos | 13 (86,7) | 12 (80,0) | 1,00a |
| Deriva los contactos a | 0,362 | ||
| AP | 4 (26,7) | 6 (40,0) | |
| Neumología | 7 (46,7) | 8 (53,3) | |
| Interna/Infecciosas | 1 (6,7) | 0 (0,0) | |
| Preventiva | 1 (6,7) | 0 (0,0) | |
| Vigilancia | 0 (0,0) | 1 (6,7) | |
| Compartida | 2 (13,3) | 0 (0,0) | |
| Cribado de pac. con factores de riesgo | 14 (93,3) | 14 (93,3) | 1,00a |
| Participa en PII-TB | 8 (53,3) | 12 (80,0) | 0,121 |
+: constante;
AP: Atención Primaria; MDR; multirresistente; pac.: pacientes; PII-TB: Programa Integrado de Investigación en Tuberculosis; RI: rango intercuartílico; SEPAR: Sociedad Española de Neumología y Cirugía Torácica; TB: tuberculosis; TDO: tratamiento directamente observado; UTB: unidad de tuberculosis; VIH: virus de la inmunodeficiencia humana; XDR: extremadamente resistente.
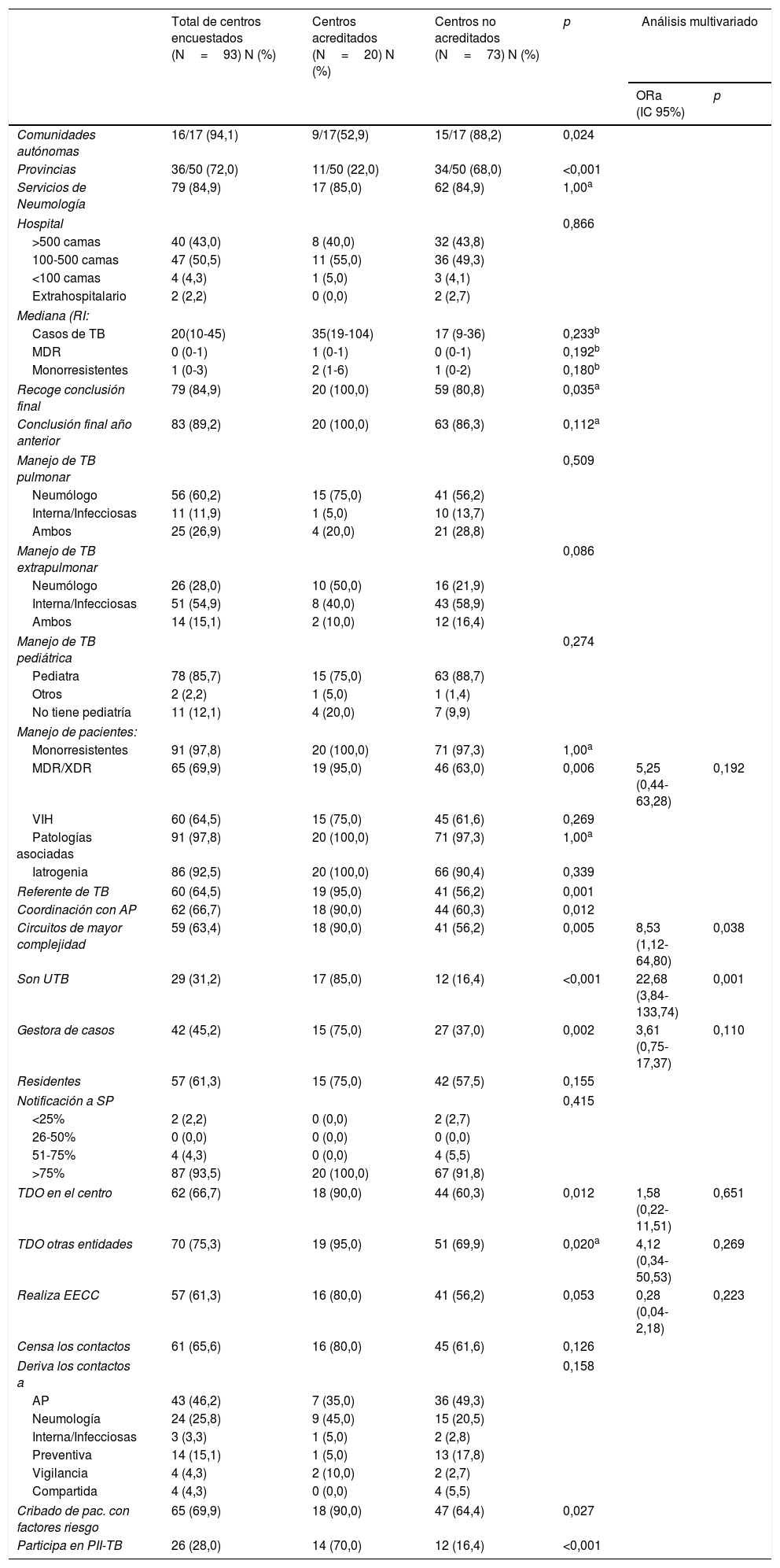
En la comparación entre los 20 centros acreditados y los 73 no acreditados, observamos que existen diferencias estadísticamente significativas entre ellos. Entre los acreditados hubo un porcentaje mayor de centros que recogen la conclusión final de los casos, que se coordinan con la AP, que cuentan con un referente de TB y con circuitos de derivación a otros servicios de mayor complejidad. También se observa una mayor proporción de centros que manejan pacientes con TB multirresistente/extremadamente resistente, que tienen capacidad para facilitar TDO en el centro o en otras entidades, que realizan el EECC y que cuentan con la figura de la gestora de casos. Los centros acreditados están ubicados en solamente 9 comunidades autónomas y la mayoría de estos centros ya constituían una UTB y participaban aportando casos al PII-TB (tabla 3).
Comparación de diferentes variables asistenciales y de coordinación recogidas en la encuesta antes y después de la acreditación entre las unidades de tuberculosis acreditadas por SEPAR y las no acreditadas (2014-2018)
| Total de centros encuestados (N=93) N (%) | Centros acreditados (N=20) N (%) | Centros no acreditados (N=73) N (%) | p | Análisis multivariado | ||
|---|---|---|---|---|---|---|
| ORa (IC 95%) | p | |||||
| Comunidades autónomas | 16/17 (94,1) | 9/17(52,9) | 15/17 (88,2) | 0,024 | ||
| Provincias | 36/50 (72,0) | 11/50 (22,0) | 34/50 (68,0) | <0,001 | ||
| Servicios de Neumología | 79 (84,9) | 17 (85,0) | 62 (84,9) | 1,00a | ||
| Hospital | 0,866 | |||||
| >500 camas | 40 (43,0) | 8 (40,0) | 32 (43,8) | |||
| 100-500 camas | 47 (50,5) | 11 (55,0) | 36 (49,3) | |||
| <100 camas | 4 (4,3) | 1 (5,0) | 3 (4,1) | |||
| Extrahospitalario | 2 (2,2) | 0 (0,0) | 2 (2,7) | |||
| Mediana (RI: | ||||||
| Casos de TB | 20(10-45) | 35(19-104) | 17 (9-36) | 0,233b | ||
| MDR | 0 (0-1) | 1 (0-1) | 0 (0-1) | 0,192b | ||
| Monorresistentes | 1 (0-3) | 2 (1-6) | 1 (0-2) | 0,180b | ||
| Recoge conclusión final | 79 (84,9) | 20 (100,0) | 59 (80,8) | 0,035a | ||
| Conclusión final año anterior | 83 (89,2) | 20 (100,0) | 63 (86,3) | 0,112a | ||
| Manejo de TB pulmonar | 0,509 | |||||
| Neumólogo | 56 (60,2) | 15 (75,0) | 41 (56,2) | |||
| Interna/Infecciosas | 11 (11,9) | 1 (5,0) | 10 (13,7) | |||
| Ambos | 25 (26,9) | 4 (20,0) | 21 (28,8) | |||
| Manejo de TB extrapulmonar | 0,086 | |||||
| Neumólogo | 26 (28,0) | 10 (50,0) | 16 (21,9) | |||
| Interna/Infecciosas | 51 (54,9) | 8 (40,0) | 43 (58,9) | |||
| Ambos | 14 (15,1) | 2 (10,0) | 12 (16,4) | |||
| Manejo de TB pediátrica | 0,274 | |||||
| Pediatra | 78 (85,7) | 15 (75,0) | 63 (88,7) | |||
| Otros | 2 (2,2) | 1 (5,0) | 1 (1,4) | |||
| No tiene pediatría | 11 (12,1) | 4 (20,0) | 7 (9,9) | |||
| Manejo de pacientes: | ||||||
| Monorresistentes | 91 (97,8) | 20 (100,0) | 71 (97,3) | 1,00a | ||
| MDR/XDR | 65 (69,9) | 19 (95,0) | 46 (63,0) | 0,006 | 5,25 (0,44-63,28) | 0,192 |
| VIH | 60 (64,5) | 15 (75,0) | 45 (61,6) | 0,269 | ||
| Patologías asociadas | 91 (97,8) | 20 (100,0) | 71 (97,3) | 1,00a | ||
| Iatrogenia | 86 (92,5) | 20 (100,0) | 66 (90,4) | 0,339 | ||
| Referente de TB | 60 (64,5) | 19 (95,0) | 41 (56,2) | 0,001 | ||
| Coordinación con AP | 62 (66,7) | 18 (90,0) | 44 (60,3) | 0,012 | ||
| Circuitos de mayor complejidad | 59 (63,4) | 18 (90,0) | 41 (56,2) | 0,005 | 8,53 (1,12-64,80) | 0,038 |
| Son UTB | 29 (31,2) | 17 (85,0) | 12 (16,4) | <0,001 | 22,68 (3,84-133,74) | 0,001 |
| Gestora de casos | 42 (45,2) | 15 (75,0) | 27 (37,0) | 0,002 | 3,61 (0,75-17,37) | 0,110 |
| Residentes | 57 (61,3) | 15 (75,0) | 42 (57,5) | 0,155 | ||
| Notificación a SP | 0,415 | |||||
| <25% | 2 (2,2) | 0 (0,0) | 2 (2,7) | |||
| 26-50% | 0 (0,0) | 0 (0,0) | 0 (0,0) | |||
| 51-75% | 4 (4,3) | 0 (0,0) | 4 (5,5) | |||
| >75% | 87 (93,5) | 20 (100,0) | 67 (91,8) | |||
| TDO en el centro | 62 (66,7) | 18 (90,0) | 44 (60,3) | 0,012 | 1,58 (0,22-11,51) | 0,651 |
| TDO otras entidades | 70 (75,3) | 19 (95,0) | 51 (69,9) | 0,020a | 4,12 (0,34-50,53) | 0,269 |
| Realiza EECC | 57 (61,3) | 16 (80,0) | 41 (56,2) | 0,053 | 0,28 (0,04-2,18) | 0,223 |
| Censa los contactos | 61 (65,6) | 16 (80,0) | 45 (61,6) | 0,126 | ||
| Deriva los contactos a | 0,158 | |||||
| AP | 43 (46,2) | 7 (35,0) | 36 (49,3) | |||
| Neumología | 24 (25,8) | 9 (45,0) | 15 (20,5) | |||
| Interna/Infecciosas | 3 (3,3) | 1 (5,0) | 2 (2,8) | |||
| Preventiva | 14 (15,1) | 1 (5,0) | 13 (17,8) | |||
| Vigilancia | 4 (4,3) | 2 (10,0) | 2 (2,7) | |||
| Compartida | 4 (4,3) | 0 (0,0) | 4 (5,5) | |||
| Cribado de pac. con factores riesgo | 65 (69,9) | 18 (90,0) | 47 (64,4) | 0,027 | ||
| Participa en PII-TB | 26 (28,0) | 14 (70,0) | 12 (16,4) | <0,001 | ||
AP: Atención Primaria; EECC: Estudio de contactos; MDR: multirresistente; ORa: odds ratio ajustado; pac.: pacientes; PII-TB: Programa Integrado de Investigación en Tuberculosis; RI: rango intercuartílico; SEPAR: Sociedad Española de Neumología y Cirugía Torácica; SP: Salud Pública; TB: tuberculosis; TBEP: tuberculosis extrapulmonar; TDO: tratamiento directamente observado; UTB: unidad de tuberculosis; VIH: virus de la inmunodeficiencia humana; XDR: extremadamente resistente.
Al comparar los 20 centros que se acreditaron con los 73 que no lo hicieron, el modelo de regresión logística indica que las variables asociadas a acreditarse como UTB fueron constituir una UTB (ORa=22,68; IC95%: 3,84-133,74; p=0,001) y disponer de circuitos de derivación a otros servicios de mayor complejidad (ORa=8,53; IC95%: 1,12-64,80; p=0,038) (tabla 3).
DiscusiónEste estudio ha permitido conocer mejor cómo se aborda la TB en España por parte de los servicios y secciones de neumología y otros profesionales dedicados a esta enfermedad y también ha permitido observar qué diferencias hay entre los centros que se acreditaron y los que no. Según las respuestas de las encuestas, el manejo de la TB pulmonar es llevado a cabo, sobre todo, por neumólogos y la extrapulmonar, por internistas. En una alta proporción, se realiza seguimiento de los casos hasta finalizar el tratamiento, se manejan resistencias y enfermedades asociadas y se facilita TDO a los pacientes. No obstante, debe mejorarse el censo y el EECC por parte de los servicios de neumología o de medicina preventiva y, aunque el porcentaje de casos notificados a SP es elevado, se han identificado centros donde la notificación es menor del 75%, a pesar de ser una enfermedad de declaración obligatoria.
Los resultados obtenidos mediante las encuestas autoadministradas muestran que no se observaron diferencias importantes en las distintas variables de atención y coordinación entre los centros que respondieron la encuesta pre- y aquellos que respondieron la encuesta postacreditación. Por otro lado, aquellos centros que se acreditaron y contestaron ambas encuestas (N=15) tampoco presentaron diferencias en la organización antes y después de la acreditación. Por último, al comparar los centros que se acreditaron con los que no lo hicieron, se observaron diferencias estadísticamente significativas en variables organizativas y de atención de los pacientes. El análisis multivariado indica que constituir una UTB y disponer de circuitos de derivación a otros servicios de mayor complejidad está asociado con el hecho de acreditarse como UTB.
La falta de mejoras significativas entre los centros acreditados por la SEPAR cuando se comparan sus características antes y después de la acreditación podría atribuirse a que dichos centros ya abordaban la TB de forma efectiva y correcta antes de solicitar la acreditación. Además, se trata de un tamaño muestral pequeño con bajo poder estadístico. Sí que se encuentran diferencias entre los centros según estuvieran acreditados o no, y esto podría deberse a que se acreditan mayoritariamente aquellos centros que ya cuentan con una mayor organización y mejores indicadores. La acreditación implica revisar y desempeñar acciones para mejorar el manejo y control de la enfermedad, así como evaluar y reorganizar el personal y las actividades realizadas en el centro.
Como limitación del estudio, se debe citar la imposibilidad de verificar las respuestas y que las encuestas postacreditación se realizaron solo 2 años más tarde del inicio de las acreditaciones y puede que se precise más tiempo para que aumente el número de UTB acreditadas y se pueda evaluar su evolución. De todos modos, las UTB acreditadas podrían servir de estímulo para la acreditación de otras unidades. En cuanto al contenido de la encuesta, podría evaluarse en mayor profundidad el manejo y abordaje de los pacientes inmunodeprimidos (tratamientos biológicos, ancianos…) por parte de las UTB, ya que se trata de un colectivo especialmente vulnerable.
Se ha visto que en las grandes ciudades de países de baja incidencia de TB se puede aumentar la eficiencia de los programas de control mejorando su organización1,4. En relación con los resultados obtenidos, otros autores también han relacionado el control de la TB con una mejora organizativa basada en la creación de UTB. Más concretamente, un estudio en Barcelona evaluó el impacto de la creación de UTB en la ciudad y pudo concluir que la intervención mejoraba el EECC3; lo mismo que se observa en este estudio comparando los centros que se acreditaron con los que no lo hicieron. Resultados similares se observaron en el Programa TB de Galicia, organizado en torno a 7 UTB12. Todos estos estudios destacaban como puntos clave para la organización del manejo de la enfermedad la centralización de la atención de la TB, el papel de la enfermería gestora de casos y la coordinación y comunicación entre los diferentes ámbitos y profesionales implicados1,3. En todos estos aspectos presentaron mejores indicadores aquellas unidades que se acreditaron.
La Comunidad Autónoma de Madrid llevó a cabo una evaluación del control de la TB y encontró elevados porcentajes de pérdida de seguimiento de los casos y un número bajo de EECC realizados. Los autores destacaron la necesidad de centralizar el seguimiento de los enfermos y los EECC en UTB para mejorar los resultados obtenidos13. Otras publicaciones recomiendan que, debido a que la baja incidencia no permite acumular experiencia entre los profesionales de la AP, se centralice la atención a la TB y se cuente con grupos de profesionales especializados en constante comunicación y coordinados entre ellos5,14-16.
Igualmente, un estudio realizado en el Reino Unido concluyó que un buen control de la enfermedad depende de que exista un número adecuado de especialistas dedicados a la TB. Se identificó como una estrategia de control de la enfermedad contar con una enfermera dedicada a la TB por cada 40 pacientes2. Este estudio no permite establecer comparaciones adecuadas, pero el porcentaje de centros con enfermeras gestoras de casos y referentes de TB fue mucho mayor en aquellas unidades que se acreditaron.
En la misma línea, el consenso sobre el control de la TB en las grandes ciudades elaborado por un grupo de trabajo que representa a varias grandes ciudades de la Unión Europea destaca la importancia de organizarse para garantizar el acceso de los pacientes e incluir suficiente personal y experiencia, así como promover una fuerte colaboración y coordinación entre sectores4.
Por otra parte, una revisión sistemática sobre intervenciones que mejoran la adherencia y los resultados del tratamiento de la TB concluyó que la administración de TDO, juntamente con la educación del paciente, aumenta la adherencia y las tasas de éxito del tratamiento17.
Es relevante destacar que, aunque la TB es una enfermedad de declaración obligatoria, en algunos centros de España existe subnotificación de casos a SP, lo que supone una complicación para el control de la enfermedad. Un estudio de Giménez-Duran et al. demostró la existencia de subnotificación en las Islas Baleares a partir de las prescripciones de fármacos antituberculosos18 y otro de Morales-García et al. observó en 16 centros españoles una importante subnotificación y destacó que los centros que contaban con enfermera gestora de casos tuvieron tasas de notificación del 100%19, lo que refuerza la importancia de esta figura en las UTB.
Según un estudio desarrollado en California, implementar una evaluación sistemática anual y un proceso de mejora mediante el uso de indicadores en los programas de control de la TB mejoraba los resultados20. Ello respaldaría el que las unidades acreditadas implementasen indicadores a modo de herramientas para la mejora de los resultados en los centros acreditados. Una encuesta administrada a 31 países de la UE y del Espacio Económico Europeo para conocer sus estrategias de control de la TB detectó que las acciones prioritarias eran: llegar a grupos de población vulnerable, detección de TB activa en grupos de alto riesgo, implementación de registros electrónicos, EECC, control de la TB multirresistente y centralización de la atención21.
Todos los estudios mencionados respaldan el uso de los indicadores relacionados con la organización como la figura de la enfermería gestora de casos, la realización de EECC, el tratamiento correcto, la administración de TDO o la coordinación con otros servicios y profesionales22,23. La acreditación de unidades monográficas es una iniciativa de la SEPAR mediante la cual otorga un sello de garantía en términos de calidad a partir de una serie de criterios objetivos que coinciden con los indicadores utilizados en los estudios anteriores6. Además, la creación de las UTB puede contribuir a la estrategia End TB de la Organización Mundial de la Salud24.
Aunque se han detectado varios aspectos positivos como la recogida de conclusión final, notificación a SP, manejo de resistencias y control de enfermedades asociadas o iatrogenia, también se han detectado aspectos mejorables. Entre estos últimos deben citarse que haya un referente en TB, que se organice el censo y la realización de EECC, que se disponga de circuitos de derivación y coordinación y que haya enfermería gestora de casos. Esta última recomendación, primordial para la gestión de la TB, destaca entre los puntos de mejora en las UTB acreditadas. Las diferencias significativas en los resultados y funcionamiento entre las unidades acreditadas y las que no lo están debería servir de estímulo a estas últimas para mejorar su funcionamiento e intentar alcanzar los criterios exigidos para la acreditación.
ConclusionesEste estudio permite conocer cómo se organiza actualmente el manejo y control de la TB en España y cuál ha sido el impacto de la acreditación de UTB por parte de la SEPAR.
Se precisa una supervisión cercana de las UTB a partir de indicadores anuales simples que faciliten, incluso, la autoevaluación. La mejora progresiva de la efectividad de las UTB, junto con un aumento también progresivo de las acreditaciones, tanto de nuevas solicitudes como de ascenso del nivel de complejidad y de reacreditaciones, contribuiría a la mejora de la organización del control de la TB en España.
FinanciaciónEste trabajo ha sido financiado mediante la beca de la Sociedad Española de Neumología y Cirugía Torácica SEPAR 114/2013 (IP: Joan Pau Millet), España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los clínicos que participaron en el estudio respondiendo las encuestas.
| Campos encuesta |
|---|
| Fecha de cumplimentación |
| Cumplimentado por: Nombre y apellidos |
| Especialidad |
| Servicio |
| Nombre del Centro de Trabajo |
| Tipo de centro (Hospitalario < 100 camas / Hospitalario 100-500 camas / Hospitalario > 500 camas / Extrahospitalario) |
| Ciudad del Centro de Trabajo |
| Provincia del Centro de Trabajo |
| Área de influencia |
| Población total |
| Número de casos de Tuberculosis atendidos: |
| ¿Quién realiza el tratamiento de la tuberculosis pulmonar y pleural en su centro? |
| Número de casos de MDR-TB: |
| Número de casos de Monorresistentes: |
| ¿Se recogen las conclusiones finales de los enfermos? |
| ¿Podrían saber lo que pasó con los pacientes del 2016? |
| ¿Quién realiza el tratamiento de la tuberculosis extrapulmonar (excluida la pleural) en su centro? |
| ¿Quién realiza el tratamiento de la tuberculosis pediátrica en su centro? |
| ¿Existen circuitos claros de coordinación con Atención Primaria? |
| ¿Existe una figura de referente en Tuberculosis en su centro? |
| ¿Tiene capacidad de manejo de pacientes monorresistentes? |
| ¿Existen circuitos claros de derivación a otros servicios asistenciales de mayor complejidad? |
| ¿Ya constituyen Unidad específica de tuberculosis? |
| ¿Posibilidad de facilitar medicación y dar TDO en el centro? |
| Estudio de contactos: Se hace un censo de los contactos |
| Estudio de contactos: ¿Se estudian directamente? |
| Estudio de contactos: en caso de remitirse, ¿a dónde se remiten? |
| Cuál es el porcentaje de casos con al menos un contacto estudiado? |
| ¿Realizan cribado y seguimiento de pacientes con factores de riesgo (indigentes, ADVP, VIH, tratamientos biológicos, etc.)? |
| ¿Disponen de enfermera gestora de casos? |
| ¿Disponen de residentes en formación? |
| ¿Porcentaje estimado de casos notificados a Salud Pública? |
| ¿Ha participado aportando casos en la base de datos del PII-TB de SEPAR en 2014? |
| ¿Se ha acreditado como Unidad de Tuberculosis por la SEPAR? |
| Comentarios que quieran hacerse acerca de los datos expuestos: |
| ¿Tiene capacidad de manejo de pacientes MDR/XDR? |
| ¿Tiene capacidad de manejo de pacientes VIH? |
| ¿Tiene capacidad de manejo de pacientes con patologías asociadas? |
| ¿Tiene capacidad de manejo de pacientes con Iatrogenia? |
| ¿Posibilidad de facilitar medicación y dar TDO en otras entidades? |
| ¿Disponen de enfermera gestora de casos y de contactos? |
| ¿Disponen de enfermera gestora de contactos? |
| Si aún no se ha acreditado ¿Querría acreditarse como Unidad de Tuberculosis por la SEPAR? |