La vacunación es la medida más efectiva para la prevención de la enfermedad neumocócica invasiva (ENI). Los pacientes con enfermedades predisponentes se podrían beneficiar de esta vacuna si se recomienda durante las visitas médicas.
ObjetivosDescribir los casos de ENI. Valorar los serotipos más frecuentes y evaluar oportunidades perdidas de vacunación.
MétodosEstudio descriptivo retrospectivo de la incidencia de ENI en Elche durante 5 años. Se ha revisado el estado vacunal y las visitas a atención especializada previas a la enfermedad. También se ha calculado la efectividad vacunal con vacuna antineumocócica 23 valente en nuestra población.
ResultadosDesde 2007 a 2011 se han notificado 181 casos de ENI. Las formas clínica más frecuentes son neumonía y sepsis, con una tasa de mortalidad del 12%. El 80% de los serotipos causales son serotipos vacunales. Más de la mitad tenían alguno de los factores de riesgo que indican vacunación. Este porcentaje disminuye hasta el 6,2% en los menores de 65 años con algún factor de riesgo.
ConclusionesTras 10 años de introducción de la vacuna en el calendario vacunal del adulto sigue siendo baja la cobertura vacunal de pacientes con factores de riesgo. En nuestro estudio, el 75% de los casos no están vacunados. Teniendo en cuenta la efectividad de la vacuna para la prevención de ENI, entre los pacientes que han sido atendidos en el hospital por el especialista previo a su ENI, se podrían haber prevenido en el mejor de los supuestos (85% de efectividad vacunal) 60 casos de ENI.
Vaccination is the most effective measure in the prevention of invasive pneumococcal disease (IPD). High-risk patients immunized during medical visits would benefit from the vaccine.
ObjectivesTo describe the IPD cases. To assess the most prevalent causative serotypes and to evaluate the missed opportunities for vaccination.
MethodsThis is a descriptive retrospective study of the incidence of IPD cases in Elche during 5 years. It was reviewed the vaccination status and the visits to specialized care prior to disease. It was also calculated the vaccine effectiveness with the 23-valent pneumococcal vaccine in our population.
ResultsBetween 2007 and 2011 were notified 181 of IPD, the most frequent medical conditions were pneumonia and sepsis, with a mortality rate of 12%. 80% of the causative serotypes are included in the vaccine. More than the half of the cases had at least one of the risk factor for indicating the vaccination. This percentage decreases by 6.2% in cases below 65 years of age with any risk factor.
ConclusionsAfter 10 years of introducing the vaccine into the adult immunization schedule the coverage it is still low among the patients with risk factors. In our study, 75% of the cases were not vaccinated. Taking in count the vaccine effectiveness for preventing IPD, among the patients attended at the hospital by the specialist prior their IPD, it could have been prevented in the best assumption (85% vaccine effectiveness) 60 IPD cases.
La enfermedad neumocócica invasiva (ENI) es una de las causas de mortalidad frecuentes en los adultos mayores y contribuye significativamente al exceso de morbilidad y hospitalización en el resto de la población, por lo que se considera un problema importante de salud pública en España1,2.
La ENI es menos frecuente que la neumonía neumocócica no invasiva, pero la presencia del Streptococcus pneumoniae (neumococo) en líquidos estériles está asociada a una mayor tasa de letalidad. Aunque se han identificado más de 90 serotipos diferentes de este microorganismo a escala mundial, solo 20 serotipos son responsables de más del 70% de las neumonías invasivas en todos los grupos de edad3.
Ya que estos serotipos están incluidos en las vacunas antineumocócicas, la recomendación de vacunación contra el neumococo por parte de los profesionales sanitarios a los pacientes en grupos de riesgo es una medida de prevención de la que estos pacientes se podrían beneficiar mediante el consejo sanitario durante la consulta médica4,5.
En la Comunidad Valenciana, se indicó la vacunación con vacuna antineumocócica polisacarídica 23 valente (VP23) en grupos de riesgo en el año 20006, e incluía a mayores de 65 años, pacientes con asplenia (orgánica o funcional) y enfermos de sida. Posteriormente se han ido incorporando las indicaciones para otros grupos de riesgo: cardiópatas, enfermedades respiratorias crónicas, diabetes mellitus, y otras inmunodeficiencias.
Al mismo tiempo, para conocer mejor la incidencia de esta enfermedad, en 2003 el Ministerio de Sanidad y Consumo dictó una orden por la cual la ENI pasó a ser una enfermedad de declaración obligatoria (EDO), incorporándose así en el sistema de vigilancia epidemiológico. A partir del año 2007 esta notificación se realiza en la Comunidad Valenciana de forma electrónica (sistema AVE).
En nuestra región, la tasa de ENI se ha mantenido estable, con una tasa media en los últimos 5 años de 17,8 casos por 105 habitantes, por lo que el número de casos sigue siendo elevado, a pesar de la introducción de la vacunación en grupos de riesgo y de la recomendación de vacunación en población infantil con vacunas conjugadas7 (aún no está incluida en el calendario de vacunación infantil).
Aunque científicamente está demostrado el valor de la vacunación como medida de prevención de la enfermedad, entre los profesionales sanitarios hay controversia en muchos foros sobre la efectividad de esta vacuna8–10, y sobre su efectividad a largo plazo, y existen dudas razonables sobre el cumplimiento de la indicación de vacunación por parte de estos profesionales11,12.
Actualmente existen 2 tipos de vacunas antineumocócicas: la VP23, que protege frente a 23 serotipos y está indicada en el calendario vacunal del adulto y en población de riesgo a partir de los 2 años; y las más modernas vacunas conjugadas (10 y 13 serotipos) indicadas para la población infantil y aprobado recientemente su uso en adultos mayores de 50 años. Las vacunas conjugadas no están incluidas en el calendario infantil, pero sí se recomienda su uso por parte de los pediatras de atención primaria.
Con este trabajo nos proponemos evaluar los casos de ENI declarados a través del sistema AVE de la Comunidad Valenciana en el Departamento de Salud de Elche, conocer los serotipos patógenos más frecuentes en nuestro medio, describir el estado de vacunación en los casos y comprobar la efectividad de la vacunación con VP23. También queremos valorar las oportunidades perdidas de vacunación en los casos de ENI.
MetodologíaSe trata de un estudio descriptivo retrospectivo de la incidencia de ENI en el Departamento de Salud de Elche, que atiende a una población de cerca de 260.000 habitantes.
En la Comunidad Valenciana se ha creado un registro electrónico de todas las EDO llamado Sistema de Análisis de Vigilancia Epidemiológica (AVE), en el que se introduce cada EDO de forma informatizada, y para los Departamentos de Salud es muy fácil obtener la información registrada en este sistema. Así, se han seleccionado todos los casos de ENI declarados en el sistema AVE, durante el periodo comprendido entre enero de 2007, fecha en la que se inició la declaración de forma electrónica, y diciembre de 2011, ambos incluidos.
Según este protocolo de declaración, se define como caso confirmado de ENI aquel paciente con clínica de infección y con un cultivo de una muestra biológica estéril (sangre, líquido pleural o líquido cefalorraquídeo) con crecimiento de neumococo.
En todos los casos declarados se ha seleccionado datos sobre edad, sexo, tipo de enfermedad neumocócica, enfermedades previas y otros factores de riesgo para conocer la necesidad de vacunación previa en los casos. Para determinar estos factores se ha seleccionado la clasificación de condiciones médicas que indican la vacunación del Advisory Committee on Immunization Practices13,14. Se ha utilizado el programa informático Excel 2003, para realizar la base de datos y el análisis estadístico de los datos.
Además, en todos los casos, se ha revisado el estado vacunal a través de encuesta personal, cartilla vacunal y registro nominal de vacunas que es la base de datos oficial en la que cualquier acto de vacunación queda registrado de forma electrónica. Esta base de datos está asociada al número de tarjeta de salud identificativo de cada persona y a su historia clínica electrónica, y queda registrado el acto vacunal con información sobre el tipo de vacuna administrada, la fecha de administración y la dosis de vacunación correspondiente.
Para el cálculo de las tasas por población se han utilizado los datos del último padrón de población realizado por el Instituto Nacional de Estadística15.
Para calcular la efectividad de la vacuna (EV) se han tenido en cuenta solamente los casos mayores de 2 años, en los que por ficha técnica y protocolo de vacunación se puede administrar la VP23. La EV se ha calculado por el método de control con la formula de Farrington: EV=(PPV-PCV)/PPV(1-PCV)16,17; donde PCV es la proporción de vacunados en los casos y PPV es la proporción de vacunados en la población.
Al no tener estadísticas oficiales sobre cobertura vacunal según grupos de riesgo en la población, para estimar el PPV se ha realizado un muestreo consecutivo de todos los pacientes ingresados en el hospital durante los 6 primeros meses del año 2010 que tuvieran como diagnóstico principal o secundario en el informe de alta las condiciones médicas que son indicación para vacunación del Advisory Committee on Immunization Practices (p. ej., EPOC, diabetes mellitus, insuficiencia cardiaca crónica). Posteriormente se han agrupado en las mismas categorías de riesgo de la encuesta epidemiológica (enfermedades cardiacas crónicas, pulmonares crónicas, cirrosis, otitis crónicas, implante coclear, diabetes mellitus, asplenia e inmunodeficiencias). Se ha utilizado el programa estadístico EPIDAT 3.1 para el cálculo de la EV y sus intervalos de confianza al 95%.
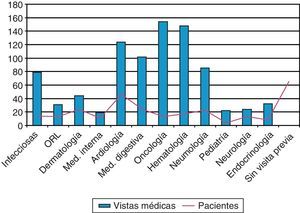
Por otro lado, se ha estudiado a través de la base de datos del registro de actividad hospitalaria y especializada (HIGUIA) todas las visitas a atención especializada que, desde el año 2000 en adelante, habían realizado los casos mayores de 2 años previas a su ENI, seleccionando y contabilizando cualquier asistencia a alguna consulta externa de las especialidades médicas de Digestivo, Neumología, Medicina Interna, Enfermedades Infecciosas, Hematología, Oncología, Nefrología, Endocrinología, Cardiología, Pediatría y Otorrinolaringología. A su vez, se ha definido como oportunidad perdida de vacunación aquel caso de ENI que cumple las siguientes condiciones: 1) no estar vacunado con VP23 y 2) haber tenido al menos una visita previa a su ENI al médico especialista hospitalario de las especialidades médicas seleccionadas.
ResultadosDurante el tiempo entre el 1 enero de 2007 y el 31 de diciembre de 2011 se han declarado a través del sistema AVE 181 casos de ENI en el Departamento de Salud de Elche. La tasa media de los 5 años es de 17,8 casos de ENI al año por cada 105 habitantes. Hubo un pico máximo en el año 2010, de 28,3 casos por 105 que coincidió con la epidemia de gripe A (H1N1)n.
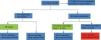
En el grupo de estudio no hay diferencias significativas por sexo, y en cuanto a la edad, el 62% son menores de 65 años (113 pacientes) (fig. 1).
El 100% de los casos estudiados han precisado ingreso hospitalario. De ellos, el 92,1% de los casos tenía síntomas sugestivos de enfermedad neumocócica, siendo la forma clínica más frecuente la neumonía (66%).
En cuanto a la existencia de factores de riesgo predisponentes para ENI, el resultado es el siguiente: el 27% enfermedad pulmonar crónica, el 25% de los pacientes tenía una enfermedad cardiovascular crónica diagnosticada, el 16% diabetes mellitus, el 4% otitis crónicas, el 3% tuvieron un traumatismo craneoencefálico previo, el 5% eran VIH positivos y el 20% con otra inmunodeficiencia. En la tercera parte de los casos no se encontró ningún factor de riesgo (33%), incluyendo edad mayor de 65 años como factor de riesgo (tabla 1). Hubo 33 casos que tenían más de una condición de riesgo.
La tasa de letalidad observada fue del 12%, siendo más de la mitad de los fallecimientos en mayores de 65 años. En este grupo la tasa de mortalidad es del 22%.
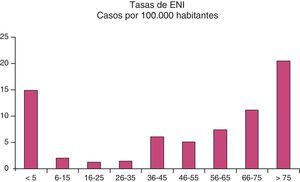
En cuanto al estudio microbiológico de las cepas obtenidas en líquidos estériles, en el 85% de las muestras se aisló el neumococo, y de estas, en 119 se consiguió realizar la serotipificación. En el 79% de las muestras serotipificadas se encontró un serotipo incluido en la vacuna del adulto (VP23) (fig. 2).
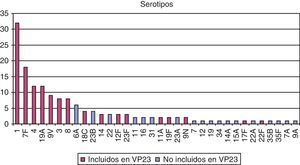
Ordenando los casos según su estado de vacunación previo a tener el episodio de ENI, vemos que el 75% de los mismos no estaban vacunados (fig. 3). De ellos, casi el 60% tiene factor de riesgo que indica vacunación por lo que se consideran casos prevenibles. Y 6 casos vacunados hace menos de 5 años han tenido una ENI con serotipo incluido en la vacuna VP23, por lo que se consideran fallo en la vacunación.
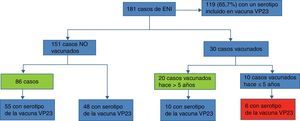
Por último, para evaluar si existió indicación previa de vacunación en los casos no vacunados se ha realizado la revisión de los contactos previos de los pacientes mayores de 2 años pertenecientes a alguno de los grupos de riesgo de vacunación, que han sido atendidos en consulta de asistencia especializada desde que se publicó el protocolo de vacunación contra neumococo en el año 2000. Se han contabilizado un total de 864 contactos, siendo la media 11 visitas previas por paciente. En 65 casos (36%) no se había realizado ninguna atención en los servicios seleccionados (fig. 4).
En cuanto a la EV en nuestra población, según la fórmula de Farrington, hemos calculado la efectividad de la VP23 teniendo en cuenta solamente para los serotipos incluidos en la vacuna y los casos vacunados hace menos de 5 años. Se muestran los resultados en la tabla 2.
Efectividad de la vacuna por grupos de riesgo
| Grupo de riesgo | Población | Casos | Efectividad vacunal | |||||||
| n | PPV | IC 95% | n | PCV | IC 95% | Serotipos VP23 | IC 95% | <5 años | IC 95% | |
| Cardiopatías crónicas | 1.245 | 46,7 | 44-49 | 27 | 22,2 | 9-42 | 67 | 20: 87 | 57 | −5: 83 |
| Enfermedades pulmonares crónicas | 669 | 43,4 | 40-47 | 33 | 18,2 | 7-35 | 71 | 31: 88 | 83 | 44: 95 |
| Implante coclear | 55 | 18,2 | 7-29 | 0 | 0 | - | -a | -a | ||
| Otitis crónica | 23 | 26,1 | 10-48 | 4 | 0 | 0-60 | -a | -a | ||
| Diabetes mellitus | 1.690 | 39,8 | 37-42 | 19 | 21,1 | 6-46 | 58 | −20: 87 | 68 | −8: 91 |
| Immunodeficiencias | 753 | 45,3 | 42-49 | 25 | 28,0 | 12-49 | 52 | −13: 80 | 78 | 27: 93 |
| Total | 4.435 | 42,9 | 41-44 | 119 | 13,4 | 8-21 | 79 | 65: 88 | 85 | 71: 92 |
Tras 10 años de introducción de la vacuna antineumocócica en el calendario vacunal del adulto, la cobertura vacunal en nuestro medio sigue siendo pobre. En la muestra de población recogida para hacer el cálculo de la efectividad de la vacuna ya se ve que en ninguno de los grupos de riesgo se supera el 50% de cobertura vacunal. Otros trabajos como el de Pebody et al. en Inglaterra y Gales encuentran coberturas poblacionales en grupos de riesgo similares (69% [implante coclear], 53,4% [disfunción esplénica], 36,5% [enfermedad cardiovascular crónica], 34,7% [diabetes], 22,9% [inmunosupresión], 28,7% [enfermedad renal crónica], 15,9% [anemia falciforme] to 12,6% [enfermedad pulmonar crónica])18. Lu y Nuorti, en un trabajo del CDC han encontrado una cobertura vacunal para todos los grupos de riesgo en personas trabajadoras de 18 a 64 años del 26,1%19.
En nuestro estudio, el 81,7% de los casos de ENI con indicación de vacunación previa por pertenecer a los grupos de riesgo reconocidos como susceptibles de padecer una forma invasiva de neumococia no estaba vacunado. Esto indica 2 cosas; por un lado, pone de manifiesto la carencia de la indicación de la vacunación en patologías ya reconocidas como factor de riesgo, y por otro, confirma la mayor incidencia de patología neumocócica en estos grupos de riesgo.
En cuanto a la infección neumocócica invasiva en personas sin factor de riesgo, en nuestra población, 59 personas menores de 65 años han padecido una ENI y no había evidencia en la historia clínica de las mismas de padecer ninguna enfermedad.
Respecto a la indicación vacunal más aceptada, mayores de 65 años, vemos que en los casos con enfermedad invasiva y una edad superior a 65 años el 65% no estaba vacunado. En el año 2001 se hizo una vacunación conjunta durante la campaña de vacunación de gripe, pues desde la Dirección General de Salud Pública se hizo una campaña informativa destinada a los centros de salud para promover la vacunación en este colectivo. Pero en años posteriores, por la dificultad de conocer si se había vacunado previamente o no, no se insistió en esta indicación. Por poner un ejemplo, durante el año 2011 se vacunó por este motivo a 55 personas, cuando la población que cumplía 65 años durante 2011 era de casi 1.500 personas. En EE. UU. se ha encontrado una cobertura vacunal en este grupo de población del 60%20, lejos de su objetivo de salud de conseguir el 90% de cobertura vacunal en los ancianos.
En lo que respecta a la efectividad de la vacunación con 23 valente en nuestra población observamos que en conjunto se obtiene una efectividad vacunal del 85% para los serotipos incluidos en la vacuna y vacunados hace menos de 5 años, resultado superior a lo publicado en otros artículos: el 55% de EV en la Revisión Cochrane de 20084, entre el 56 y el 92% en ensayos clínicos controlados, entre el 48 y el 81% en estudios experimentales no aleatorizados21. Es posible que la exhaustiva selección de los casos (diagnóstico microbiológico en muestra estéril) pueda aumentar la EV, porque se excluyen formas menos graves de la enfermedad a los que no se realizan técnicas específicas de diagnóstico.
También es posible que la selección de la muestra para el cálculo de cobertura vacunal en grupos de riesgo aumente la EV, pues el porcentaje de vacunación en la población está seleccionado a partir de los pacientes con patologías de riesgo que ingresan en el hospital y que por lo tanto su patología de base es más grave, por lo que su probabilidad de estar vacunado puede ser mayor.
En cuanto a la menor efectividad de la vacuna en el grupo de riesgo de inmunodeprimidos, nuestros datos coinciden con los obtenidos en otros estudios7,22.
Es destacable el dato de que, teniendo en cuenta que el 80% de los aislamientos se han producido por un serotipo vacunal, se aprecia la carencia de la posible prevención de esta enfermedad. En este sentido, uno de los objetivos principales de nuestro estudio era revisar las posibles oportunidades perdidas de vacunación antineumocócica en los pacientes con ENI. Así, hemos comprobado que de los casos no vacunados y con factor de riesgo, 71 de ellos tuvieron al menos una ocasión en la que se podía haber indicado la vacunación, lo que supone que, con una efectividad vacunal del 85%, se podrían haber evitado 60 casos de ENI. En lo que respecta a los casos con enfermedades respiratorias crónicas (49 pacientes), 8 de ellos tuvieron consulta previa con el neumólogo, lo que supone que con una EV específica para este grupo del 83% se podrían haber evitado 6 casos de ENI.
En nuestra comunidad, la vacunación con VP23 según calendario vacunal (mayores de 65 años) se realiza en atención primaria. En el hospital, es el servicio de Medicina Preventiva el encargado de realizar la vacunación en los pacientes de riesgo que deben ser remitidos desde las especialidades que tratan a estos pacientes. En un trabajo realizado en un hospital de Madrid21 encuentran que hay diferencias significativas en los conocimientos de los profesionales de atención primaria y atención especializada a favor de los primeros. Un dato importante de este estudio es que menos de la tercera parte de los profesionales hospitalarios afirmaron recomendar de forma expresa la vacunación a sus pacientes. En nuestro hospital no hemos podido evaluar este dato, pero tenemos la impresión de que muchos pacientes se quedan fuera de la recomendación de vacunación y los datos que presentamos con este trabajo lo confirman. Eso nos anima a trabajar en concienciar, informar, recomendar y fomentar la vacunación entre los profesionales sanitarios que trabajan en el hospital. A partir de mediados de 2011, se han iniciado una serie de charlas informativas a servicios específicos encaminadas a reforzar la información sobre la vacunación que precisan los especialistas que atienden a los pacientes de los grupos de riesgo. Aún no hemos evaluado cuánto de efectiva ha sido esta medida, pero esperamos que se traduzca en un descenso en la tasa de ENI en adultos de nuestra población.
Y en cuanto a los fallos vacunales observados, 3 de ellos se produjeron en casos con inmunodeficiencias graves, lo que refuerza la pobre capacidad de respuesta inmunológica a la vacuna en esta población, aunque la muestra es escasa y no podemos sacar datos concluyentes.
ConclusionesCreemos que en nuestro medio se debe utilizar una estrategia de información al médico especialista, recordando las indicaciones de vacunación en pacientes con factores de riesgo predisponentes. Esto podría mejorar la actual cobertura vacunal en población adulta, y es posible que así se produjera un descenso en las formas invasivas de enfermedad neumocócica, así como con la introducción en la práctica clínica de las nuevas indicaciones de vacunación antineumocócica con la vacuna conjugada 13 valente en el adulto, sobre todo en aquellos casos con inmunidad reducida para la respuesta a la vacuna polisacarídica23–25.
FinanciaciónNo hemos recibido financiación para la realización de este trabajo.
Contribución de los autoresMercedes Arencibia Jiménez, Especialista en Medicina Preventiva, investigadora principal. Ha realizado la búsqueda bibliográfica, el análisis estadístico de los datos y elaborado el documento.
Juan Francisco Navarro Gracia, Jefe de Servicio de Medicina Preventiva. Ha supervisado el trabajo y aportado su conocimiento.
Jose Antonio Delgado de los Reyes y Gerardo Pérez Torregrosa, MIR de Medicina Preventiva, han realizado las encuestas epidemiológicas a los casos de ENI y han revisado el estado de vacunación, de los casos y de la población.
David López Parra y Pilar López García, MIR y especialista en Microbiología respectivamente, del servicio de Microbiología, han realizado el aislamiento y serotipificado de las cepas de neumococo.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses en la elaboración de este trabajo.
Agradecemos al servicio de Vigilancia Epidemiológica del Departamento de Salud de Elche la autorización para utilizar la información generada a través de las encuestas de enfermedades de declaración obligatoria.