En 2008 la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) publicó las primeras normativas del mundo sobre el diagnóstico y tratamiento de las bronquiectasias. Tras casi una década muchos han sido los avances científicos en esta enfermedad, no solo en sus aspectos terapéuticos, sino también en su valoración y diagnóstico. Por ello, estas nuevas normativas sobre la valoración y diagnóstico de las bronquiectasias tratan de ofrecer al lector una actualización del conocimiento científico sobre las bronquiectasias basándose en un estricto procedimiento metodológico que asegura la calidad del contenido de las mismas, y en una amplia cantidad de información online que incluye abundante bibliografía. Estas normativas recogen desde una definición consensuada de bronquiectasias hasta la valoración de la historia natural y del pronóstico de la enfermedad. Se tratan los temas de mayor interés y algunos novedosos, como epidemiología y costes económicos de las bronquiectasias, aspectos fisiopatológicos, etiología (haciendo especial énfasis en la relación con otras enfermedades de la vía aérea como la enfermedad pulmonar obstructiva crónica y el asma), aspectos clínico-funcionales, medición de la calidad de vida, diagnóstico y valoración radiológica, algoritmo diagnóstico, aspectos microbiológicos (incluyendo la definición consensuada de conceptos clave como el de erradicación bacteriana o infección bronquial crónica), así como la valoración de la gravedad y el pronóstico de la enfermedad mediante el uso de las nuevas herramientas multidimensionales publicadas.
In 2008, the Spanish Society of Pulmonology (SEPAR) published the first guidelines in the world on the diagnosis and treatment of bronchiectasis. Almost 10 years later, considerable scientific advances have been made in both the treatment and the evaluation and diagnosis of this disease, and the original guidelines have been updated to include the latest scientific knowledge on bronchiectasis. These new recommendations have been drafted following a strict methodological process designed to ensure the quality of content, and are linked to a large amount of online information that includes a wealth of references. These guidelines cover aspects ranging from a consensual definition of bronchiectasis to an evaluation of the natural course and prognosis of the disease. The topics of greatest interest and some new areas are addressed, including epidemiology and economic costs of bronchiectasis, pathophysiological aspects, the causes (placing particular emphasis on the relationship with other airway diseases such as chronic obstructive pulmonary disease and asthma), clinical and functional aspects, measurement of quality of life, radiological diagnosis and assessment, diagnostic algorithms, microbiological aspects (including the definition of key concepts, such as bacterial eradication or chronic bronchial infection), and the evaluation of severity and disease prognosis using recently published multidimensional tools.
Las bronquiectasias (BQ) no debidas a fibrosis quística (FQ) son, en frecuencia, la tercera enfermedad inflamatoria crónica de la vía aérea, después del asma y de la enfermedad pulmonar obstructiva crónica (EPOC), y están en estrecha relación con ambas. En 2008 la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) fue la primera sociedad científica en establecer unas normativas sobre el diagnóstico y tratamiento de esta enfermedad, incluyendo en aquella ocasión también a la FQ1. Trascurridos más de 8 años, la evidencia científica sobre las BQ ha avanzado en algunos puntos importantes, de forma que la aportación de los nuevos estudios ha permitido que se considerara esta nueva normativa que, para ofrecer al lector una información más específica, tan solo se dedicará a las BQ del adulto. Esta primera entrega se dedicará a la valoración y diagnóstico de las BQ. Para su confección se ha contado con el consejo de un experto en metodología. Por un lado, se ha utilizado un sistema Delphi para construir el temario priorizando las preguntas clínicas (anexo 1, Metodología). Para la elaboración de las preguntas clínicas clave se utilizó la estructura pacientes incluidos-intervención a valorar-comparación a realizar-variable final (outcome) a analizar (PICO) y que aparece como anexo al final del manuscrito (anexo 3).
Finalmente, la calidad de la evidencia y la fuerza de las recomendaciones se han establecido siguiendo las directrices de la propuesta GRADE (anexo 4 on line. En este anexo 4 se ha añadido un amplio conjunto de referencias bibiliográficas por cada uno de los puntos en los que está dividida la presente normativa).
DefiniciónSe definen las BQ como una enfermedad bronquial inflamatoria crónica con dilatación irreversible de la luz bronquial que puede producirse por diferentes causas. Clínicamente suelen presentarse con tos y expectoración crónica, así como con agudizaciones recurrentes de perfil infeccioso. Pueden cursar con infección bronquial crónica y un declive progresivo de la función pulmonar, todo lo cual puede derivar en un deterioro de la calidad de vida y un incremento en la morbimortalidad. Las BQ por tracción, secundarias a otra enfermedad pulmonar (intersticial o enfisematosa) no se consideran en la presente normativa.
Epidemiología y costesA pesar de que la prevalencia real de las BQ es desconocida, se estima que se sitúa entre 42-566 casos por cada 100.000 habitantes, siendo mayor en mujeres y en ancianos, si bien se admite un importante infradiagnóstico. Estos datos confirman que no se trata de una enfermedad rara, al superar los 5 casos/10.000 habitantes establecido en la definición de enfermedad huérfana en Europa. Actualmente, asistimos a un aumento importante en el número de casos diagnosticados de BQ, posiblemente debido a la creciente longevidad de la población, a la cronicidad de las enfermedades generadoras, a su recientemente estudiada asociación con otras entidades muy prevalentes (como el asma o la EPOC) y, sobre todo, al uso generalizado de las técnicas de imagen que confirman su diagnóstico (tomografía computarizada de alta resolución de tórax [TCAR]). El coste de las BQ es elevado (se estima que en España el coste medio del tratamiento anual está cercano a los 4.700€). El coste es mayor a mayor gravedad de la enfermedad (unos 10.000€ anuales en los casos graves), si coexiste una EPOC, a mayor número de agudizaciones, y ante la presencia de una infección bronquial crónica por Pseudomonas aeruginosa. La mayor parte de dicho coste es debido a las agudizaciones y al tratamiento antibiótico inhalado en las BQ graves. Se precisa de estudios de coste-efectividad de los tratamientos disponibles actualmente para las BQ2,3.
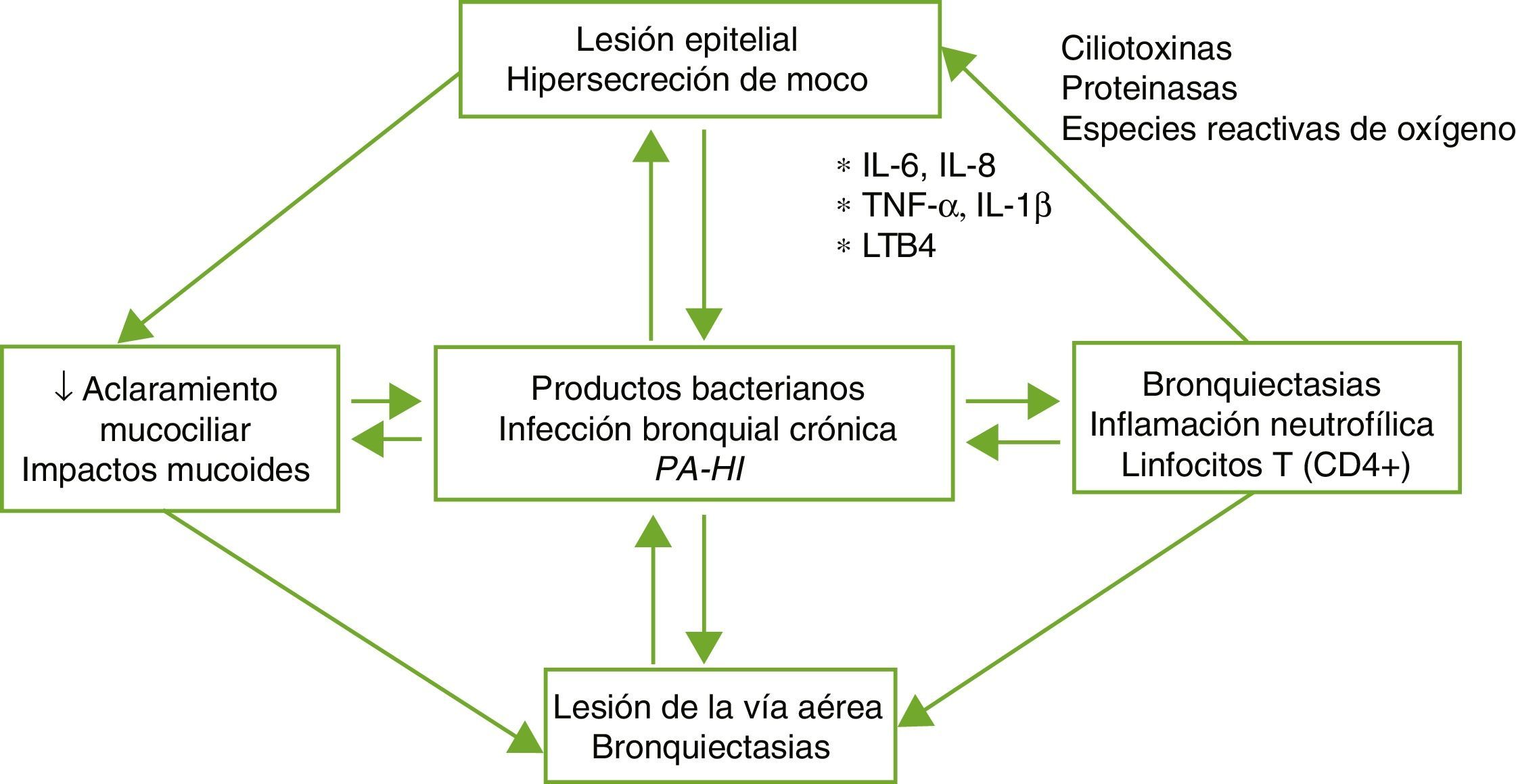
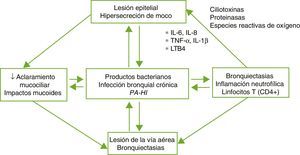
FisiopatologíaLas BQ son consecuencia de un círculo vicioso complejo compuesto por la lesión del sistema mucociliar, la inflamación, la infección y la reparación de la vía aérea, con diferencias según la etiología específica que desencadena la alteración inicial. El daño del sistema mucociliar dificulta la eliminación de las secreciones y facilita el crecimiento bacteriano y la inflamación bronquial, siendo estos 2 últimos los responsables del daño estructural bronquial y de la perpetuación del círculo vicioso patogénico (fig. 1). Un disbalance entre los productos proinflamatorios y antiinflamatorios, y la falta de resolución completa de la infección e inflamación a pesar de la respuesta inmune y del tratamiento, podrían desempeñar un papel importante en la progresión de la enfermedad. La inflamación de la vía aérea presenta un perfil neutrofílico. Un porcentaje elevado de pacientes con BQ presenta también inflamación sistémica en fase estable de la enfermedad que se ha relacionado con formas más graves de la misma4,5.
Patogenia de las bronquiectasias.
HI: Haemophilus influenzae; IL: interleuquina; LTB4: leucotrieno B4; PA: Pseudomonas aeruginosa; TNF: factor de necrosis tumoral.
Tomada de: Fuschillo et al.4.
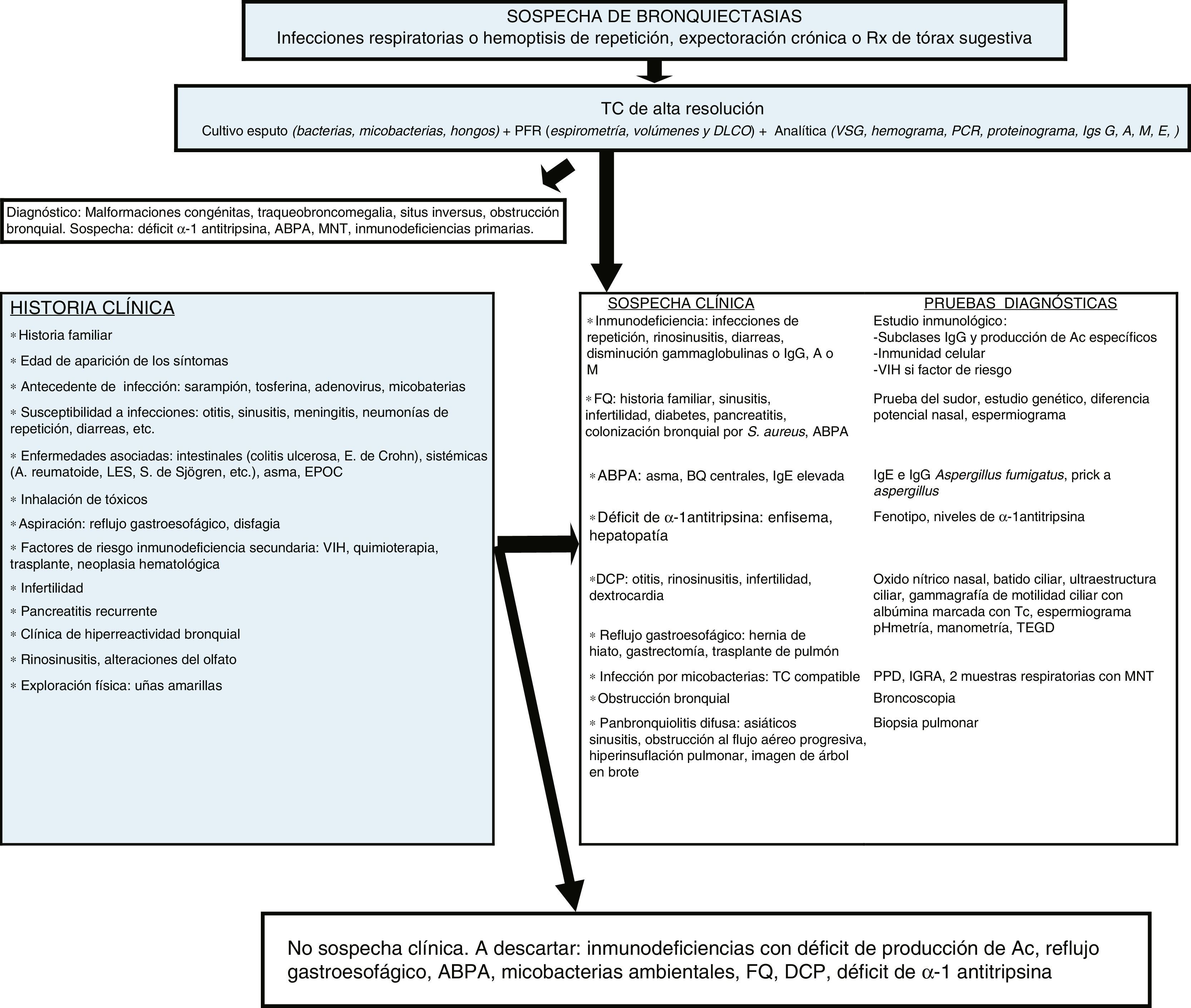
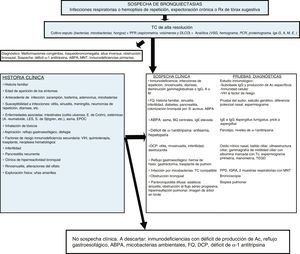
Las BQ pueden estar producidas por un gran número de causas diferentes, tanto pulmonares como sistémicas. La frecuencia relativa de estas etiologías depende de la zona geográfica en la que se estudie, de las características propias del paciente y del lugar de control (consultas generales o específicas). En la mayoría de las series las formas postinfecciosas son las más frecuentes (tabla 1). Se consideran BQ de origen desconocido (o idiopáticas) a aquellas en las que no se conoce su causa a pesar de un exhaustivo estudio etiológico (fig. 2, algoritmo diagnóstico). Pueden representar entre el 25-45% de los casos según las series6–8. Se considera que un porcentaje importante de estas BQ podría ser debido a déficits inmunológicos selectivos, reflujo gastroesofágico, infecciones no referidas por el paciente u otras enfermedades de la vía aérea como la EPOC o el asma.
Etiología y enfermedades asociadas a las bronquiectasias
| Postinfecciosas (30%) | Bacterias, tuberculosis, MNT, virus y hongos |
| Asociadas a enfermedad respiratoria crónica (6,3-13,7%) | EPOC (3,9-7,8%), asma bronquial (1,4-5,4%), déficit de α-1 antitripsina |
| Inmunodeficiencias (5-9,4%) | Primarias: déficits cuantitativos o cualitativos humorales, celulares o combinados. Secundarias: neoplasias, VIH, otros virus, tratamiento biológicos e inmunosupresores |
| Asociadas a enfermedades sistémicas (1,4-3,8%) | Artritis reumatoide, lupus, síndrome de Sjögren, síndrome de Marfan, policondritis recidivante, espondilitis anquilopoyética, sarcoidosis, enfermedad inflamatoria intestinal |
| Hipersensibilidad (0,9-2,6%) | Aspergilosis broncopulmonar alérgica |
| Discinesias ciliares (2,5-2,9%) | Discinesia ciliar primaria, síndrome de Young |
| Causas locales (obstructivas) (<1%) | Intrínsecas (tumores, cuerpos extraños, estenosis). Extrínsecas (tumores, adenopatías) |
| Postrasplantes (<1%) | Bronquiolitis obliterante o enfermedad injerto contra huésped |
| Neumonitis postinflamatoria (<1%) | Aspiración, reflujo gastroesofágico, radioterapia, inhalación de gases tóxicos o drogas |
| Otras (<1%) | Síndrome de las uñas amarillas, panbronquiolitis difusa, síndrome de Swyer-James, defectos congénitos del árbol traqueobronquial, endometriosis, amiloidosis |
| Etiología desconocida (24,2-44,8%) |
Algoritmo diagnóstico.
ABPA: aspergilosis broncopulmunar alérgica; Ac: Anticuerpos; BQ: bronquiectasias; DCP: discinesia ciliar primaria; DLCO: difusión pulmonar de monóxido de carbono; E: enfermedad; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio máximo en el primer segundo; FQ: fibrosis quística; ID: inmunodeficiencias; IGRA: interferon gamma release assay; Igs: inmunoglobulinas; LES: lupus eritematoso sistémico; PCR: proteína C reactiva; MNT: micobacterias no tuberculosas; PFR: pruebas funcionales respiratorias; PPD: prueba cutánea de derivado proteico purificado S: Staphylococcus; S: síndrome; Tc: Tecnecio; TC: tomografía computarizada; TEGD: tránsito esofagogastroduodenal; VIH: virus de la inmunodeficiencia humana; VSG: velocidad de sedimentación globular.
Entre un 30 y un 50% de los pacientes con EPOC grave presenta BQ y su prevalencia aumenta con la gravedad de la EPOC, mientras que un 5-10% de los pacientes con BQ asocia una EPOC6–8. Los pacientes con EPOC y BQ conforman un grupo o fenotipo clínico con características propias (mayor producción y purulencia del esputo, mayor disnea y un mayor número de agudizaciones), peor pronóstico y posibles implicaciones terapéuticas. Se aconseja la realización de una TCAR para descartar la presencia de BQ en aquellos pacientes con EPOC moderada o grave con múltiples agudizaciones, y/o aislamiento repetido de microorganismos potencialmente patógenos (MPP) en muestras respiratorias (o único de Pseudomonas aeruginosa) en fase de estabilidad clínica. Si bien no se ha estudiado una relación de causalidad entre ambas entidades, existe plausibilidad biológica para que así sea9,10.
Relación de las bronquiectasias con el asmaLa prevalencia de BQ en el asma grave o no controlada es del 20-30%. Se desconoce el impacto que la presencia de BQ pueda tener en el asma, si bien suelen aparecer en el asma grave, no controlada o neutrofílica11. De la misma forma, se desconoce el mecanismo fisiopatológico de las mismas y si existe una relación de causalidad. En pacientes con BQ centrales que se presentan con síntomas sugestivos de asma debe descartarse la aspergilosis broncopulmonar alérgica (ABPA).
DiagnósticoAspectos clínicosFormas de presentaciónLos pacientes con BQ suelen presentarse clínicamente con tos crónica (41-100%), expectoración crónica (46-76%) o intermitente (20-38%), así como con infecciones respiratorias de repetición, pudiendo permanecer asintomáticos entre estos episodios. Otros síntomas de presentación frecuentes son la disnea, la hemoptisis de intensidad variable, el dolor torácico intermitente y el cansancio. Las acropaquias son infrecuentes y pueden aparecer en fases avanzadas. La sinusitis es frecuente, en especial, en la discinesia ciliar primaria y en las inmunodeficiencias primarias.
AnamnesisDebe incluir los síntomas más frecuentes de las BQ mencionados en el apartado anterior, así como datos dirigidos a identificar una causa específica (fig. 2, algoritmo diagnóstico). Es útil cuantificar el volumen diario (de forma semicuantitativa, marcado por el paciente en un recipiente graduado) y la coloración del esputo (escala de Murray, fig. 3)12.
Tabla para valorar la coloración del esputo de menor a mayor purulencia
M: mucoso; MP: mucopurulento; P: purulento.
Fuente: Murray et al.12.
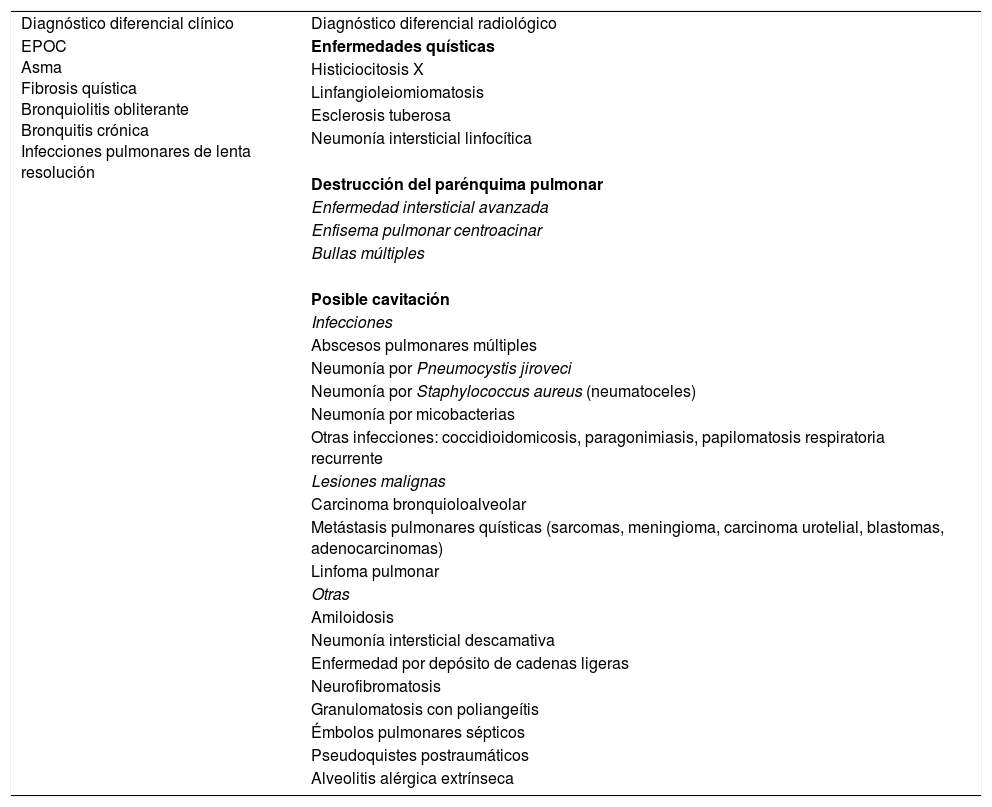
El diagnóstico diferencial se plantea con otras enfermedades respiratorias crónicas con síntomas similares, o con enfermedades pulmonares quísticas difusas o que puedan cursar radiológicamente con cavitación (tabla 2).
Enfermedades respiratorias que plantean diagnóstico diferencial clínico o radiológico con las bronquiectasias
| Diagnóstico diferencial clínico | Diagnóstico diferencial radiológico |
| EPOC Asma Fibrosis quística Bronquiolitis obliterante Bronquitis crónica Infecciones pulmonares de lenta resolución | Enfermedades quísticas |
| Histiciocitosis X | |
| Linfangioleiomiomatosis | |
| Esclerosis tuberosa | |
| Neumonía intersticial linfocítica | |
| Destrucción del parénquima pulmonar | |
| Enfermedad intersticial avanzada | |
| Enfisema pulmonar centroacinar | |
| Bullas múltiples | |
| Posible cavitación | |
| Infecciones | |
| Abscesos pulmonares múltiples | |
| Neumonía por Pneumocystis jiroveci | |
| Neumonía por Staphylococcus aureus (neumatoceles) | |
| Neumonía por micobacterias | |
| Otras infecciones: coccidioidomicosis, paragonimiasis, papilomatosis respiratoria recurrente | |
| Lesiones malignas | |
| Carcinoma bronquioloalveolar | |
| Metástasis pulmonares quísticas (sarcomas, meningioma, carcinoma urotelial, blastomas, adenocarcinomas) | |
| Linfoma pulmonar | |
| Otras | |
| Amiloidosis | |
| Neumonía intersticial descamativa | |
| Enfermedad por depósito de cadenas ligeras | |
| Neurofibromatosis | |
| Granulomatosis con poliangeítis | |
| Émbolos pulmonares sépticos | |
| Pseudoquistes postraumáticos | |
| Alveolitis alérgica extrínseca |
La alteración funcional más frecuente en las BQ es una obstrucción crónica al flujo aéreo no reversible (con capacidad vital forzada normal o ligeramente reducida) más acusada en pacientes fumadores o con EPOC. Pueden aparecer patrones mixtos en las formas postuberculosas, fibróticas o destructivas, aunque un patrón restrictivo puro es infrecuente. Puede observarse un ligero descenso de la capacidad de difusión pulmonar del monóxido de carbono. Se ha observado hiperreactividad bronquial (HRB) en el 30-69% de los casos.
Calidad de vidaLos pacientes con BQ presentan peores índices de calidad de vida que la población general. Este deterioro se ha relacionado en mayor medida con la edad, la infección bronquial crónica por P. aeruginosa, el grado de disnea, el número de agudizaciones, una peor función pulmonar, la presencia de HRB, un mayor daño estructural, broncorrea crónica, la presencia de insuficiencia respiratoria y síntomas de depresión y ansiedad. Los únicos cuestionarios diseñados de forma específica para su uso en BQ es el Quality of Life-Bronchiectasis13 y el recientemente publicado Bronchiectasis Health Questionnaire. Otros cuestionarios validados son: St. George's Respiratory Questionnaire14 y el Leicester Cough Questionnaire15, este último para la valoración específica del impacto de la tos. Para valorar anualmente la percepción de gravedad del paciente resulta útil utilizar el cuestionario de calidad de vida Quality of Life-Bronchiectasis (http://www.psy.miami.edu/qol_b/qol_measures01.phtml).
Aspectos analíticosAlgunos marcadores inflamatorios sistémicos, como el número de neutrófilos periféricos, la concentración de la proteína C reactiva y la velocidad de sedimentación globular se asocian con una pérdida acelerada de la función pulmonar y una mayor extensión radiológica, siendo la determinación de la concentración de proteína C reactiva la que ha demostrado una mayor utilidad.
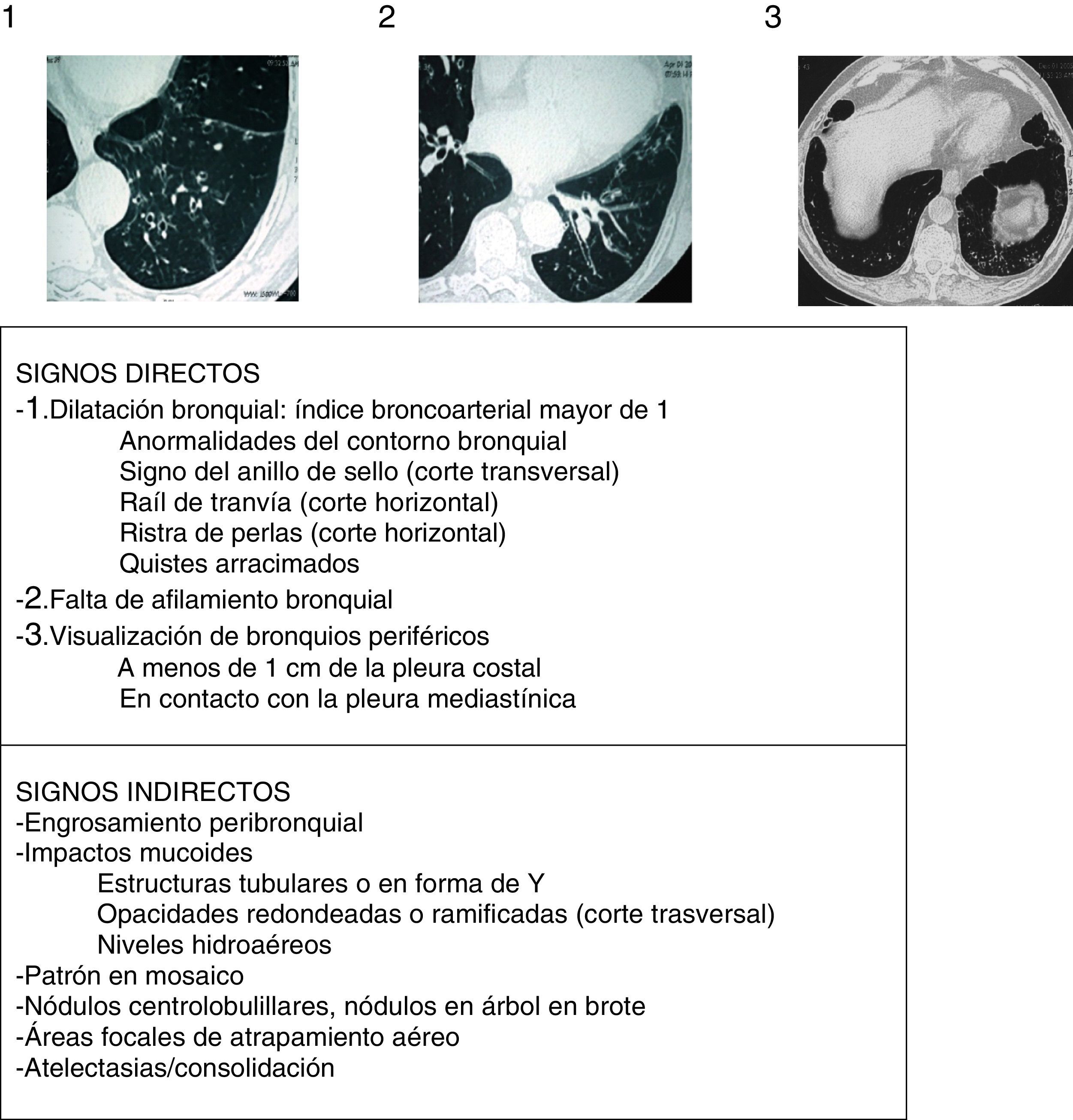
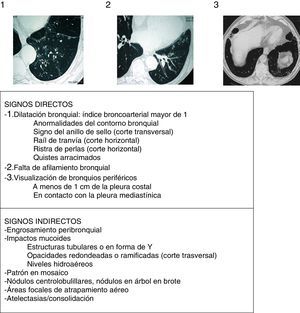
Aspectos radiológicosLa radiografía de tórax muestra una escasa sensibilidad y especificidad para el diagnóstico de BQ. Debe realizarse ante la sospecha de complicaciones (como neumonías, neumotórax o atelectasias). Actualmente la TCAR es la técnica de elección tanto para el diagnóstico como para valorar la morfología, extensión y progresión de la enfermedad (recomendación fuerte, calidad de la evidencia elevada). Por otro lado, también ayuda a la toma de decisiones terapéuticas y al diagnóstico de hallazgos coexistentes. Se utilizan comúnmente los protocolos de adquisición de baja radiación (<1mSv), volumétricos, sin contraste y con un algoritmo de reconstrucción de alta resolución con espesores de 1-1,25mm cada 10mm en inspiración máxima. Las imágenes en espiración pueden ayudar a valorar la presencia de atrapamiento aéreo, de broncomalacia y de alteraciones en la pequeña vía aérea. Para el diagnóstico radiológico de BQ se aconseja seguir los criterios descritos por Naidich et al. (fig. 4)16 utilizando como signo fundamental la demostración de una dilatación bronquial tomando como referencia el diámetro de la arteria bronquial adyacente, si bien hasta un 20% de individuos ancianos sanos pueden presentar este criterio radiológico. La TCAR puede evidenciar la etiología en algunos casos (fig. 2). Las BQ difusas sugieren un problema sistémico subyacente, las debidas a tuberculosis predominan en campos superiores y las secundarias a ABPA suelen ser centrales. La presencia de múltiples nódulos pequeños asociados, de predominio en la língula y en el lóbulo medio, sugieren infección por micobacterias no tuberculosas (MNT).
Signos radiológicos de bronquiectasias (imágenes encima de la tabla de los 3 criterios principales o signos directos de Naidich et al.)
Fuente: Webb et al.16.
En todos los pacientes, independientemente de si existe una sospecha clínica de la causa que genera las BQ, debería realizarse inicialmente una historia clínica detallada, estudio microbiológico incluyendo bacterias, micobacterias y hongos, y una analítica que incluya proteinograma y niveles de inmunoglobulinas (Ig) IgG, IgA, IgM e IgE. El resultado de estas pruebas permite sospechar la mayoría de causas e indicar, de manera racional, las pruebas diagnósticas necesarias para confirmarlas. En el caso de no llegar a un diagnóstico etiológico, siempre deben descartarse las causas que tienen un tratamiento o manejo específico. El déficit de subclases de IgG debe confirmarse con un estudio de producción de anticuerpos que solo puede obviarse en casos de niveles muy bajos de IgG217. El estudio de enfermedades autoinmunes y la infección por el virus de la inmunodeficiencia humana solo debe de realizarse en caso de sospecha clínica, porque raramente las BQ son la primera manifestación. Solo debería de atribuirse a una causa postinfecciosa aquellas BQ que iniciaron una clínica compatible tras un episodio de infección respiratoria aguda o neumonía siempre que se hayan excluido previamente otras causas. El diagnóstico de inmunodeficiencias con déficit de producción de anticuerpos, la FQ y la discinesia ciliar primaria deben confirmarse en centros especializados.
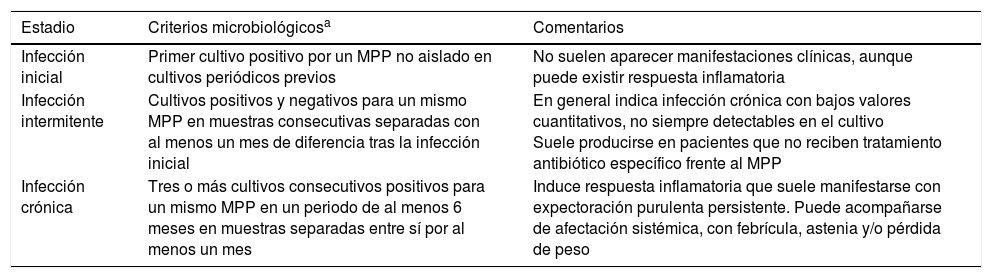
Aspectos microbiológicosColonización e infección en bronquiectasiasEs preferible utilizar el término «colonización patogénica» que suele expresarse como «infección bronquial» y no como «colonización bronquial». Responde a un modelo de «patogénesis pasiva» provocado por el crecimiento de los microorganismos en la superficie de la mucosa respiratoria sin invadir los tejidos adyacentes y que determina un efecto inflamatorio local. Se distinguen distintos estadios en la infección en las BQ, que tienen trascendencia en el manejo clínico y el tratamiento antimicrobiano (tabla 3).
Estadios de la infección bronquial (colonización patogénica) en las bronquiectasias
| Estadio | Criterios microbiológicosa | Comentarios |
|---|---|---|
| Infección inicial | Primer cultivo positivo por un MPP no aislado en cultivos periódicos previos | No suelen aparecer manifestaciones clínicas, aunque puede existir respuesta inflamatoria |
| Infección intermitente | Cultivos positivos y negativos para un mismo MPP en muestras consecutivas separadas con al menos un mes de diferencia tras la infección inicial | En general indica infección crónica con bajos valores cuantitativos, no siempre detectables en el cultivo Suele producirse en pacientes que no reciben tratamiento antibiótico específico frente al MPP |
| Infección crónica | Tres o más cultivos consecutivos positivos para un mismo MPP en un periodo de al menos 6 meses en muestras separadas entre sí por al menos un mes | Induce respuesta inflamatoria que suele manifestarse con expectoración purulenta persistente. Puede acompañarse de afectación sistémica, con febrícula, astenia y/o pérdida de peso |
MPP: microorganismos potencialmente patógenos.
Se considera erradicación para un determinado MPP a la ausencia de cultivos positivos del microorganismo en al menos 3 esputos separados entre ellos como mínimo un mes y durante un periodo de 6 meses. El recuento de colonias en el cultivo no es práctica habitual, pero puede orientar en la valoración de la eficacia del tratamiento18.
Microorganismos potencialmente patógenos y microbiomaLa infección bronquial en las BQ se produce habitualmente por los denominados MPP entre los que se incluye Haemophilus influenzae no tipable, P. aeruginosa, Streptococcus pneumoniae, Moraxella catharralis y Staphylococcus aureus, este último más frecuente en FQ, siendo de todos ellos P. aeruginosa el que ha demostrado asociarse a un peor pronóstico. Debido a la mejora de los métodos microbiológicos, últimamente ha aumentado el aislamiento de enterobacterias, bacilos Gram-negativos no fermentadores como Achromobacter (Alcaligenes) xylosoxidans y Stenotrophomonas maltophilia, Nocardia spp., hongos (esencialmente Candida albicans y Aspergillus fumigatus, aunque también Scedosporium apiospermum) y MNT, alguno de los cuales puede tener consecuencias clínicas y pronósticas negativas para el paciente (Mycobacterium abscessus). Por el momento, existen pocos datos de la infección por S. aureus resistente a la meticilina en las BQ, aunque su incidencia podría estar aumentando.
Los cultivos de rutina para la detección de MPP, micobacterias y hongos (levaduriformes y filamentosos) se realizan habitualmente en los pacientes estables, y siempre que se produzca una exacerbación antes de la toma de antibióticos si es posible. Además, el cultivo de las MNT se debe realizar en los pacientes con lesiones fibronodulares en los controles radiológicos que no respondan al tratamiento habitual y en los que se objetive un deterioro clínico del paciente, así como en aquellos pacientes que vayan a iniciar un tratamiento con macrólidos.
El microbioma asociado a las BQ aún está poco estudiado. Por el momento, no existe suficiente evidencia científica que sustente realizar de rutina estudios del microbioma respiratorio ni la búsqueda de anaerobios19.
Diagnóstico microbiológico de la infección bronquialLa valoración microscópica del esputo debe excluir contaminaciones del tracto respiratorio superior, por lo que deben observarse >25 leucocitos y <10 células epiteliales. Desde su recogida, el trasporte y procesamiento de las muestras debe ser inferior a 6h. Si no es posible se debe evitar mantenerlas más de 24h a temperatura ambiente, siendo preferible su almacenamiento a 4°C que a –20°C. Para periodos más largos, el mantenimiento debe ser a –80°C. En el cultivo se prefiere la inclusión de medios generales y selectivos diferenciales para incrementar su rentabilidad. Los recuentos bacterianos de rutina son controvertidos por el tiempo necesario para su realización y la potencial utilidad de los datos obtenidos. No obstante, deberían ser utilizados en la evaluación de nuevos tratamientos, incluyendo las asociaciones de antimicrobianos, y para valorar la erradicación de los MPP. En los cultivos pueden aparecer morfotipos diferentes de un mismo microorganismo. Para detectarlos se debe realizar antibiograma de cada uno de ellos.
Los resultados del antibiograma son referencia en el tratamiento antimicrobiano; sin embargo, no siempre existe una buena correlación entre la sensibilidad in vitro convencional y la respuesta in vivo, en especial con los microorganismos que crecen en biopelículas, o durante la toma de antibióticos inhalados con los que se alcanzan concentraciones muy elevadas en la mucosa bronquial y, por lo tanto, debe de ser la respuesta clínica la que guíe la decisión terapéutica1.
Las MNT requieren cultivos con medios especiales y una petición expresa al microbiólogo. Una tinción ácido-alcohol resistente (Ziehl-Neelsen o, preferentemente, fluorescente con auramina) puede ser útil. En los casos en los que se obtenga una tinción positiva se debe realizar una técnica molecular para su confirmación e identificación y antibiograma. En el caso de sospecha de infección por Nocardia spp. debería comentarse al microbiólogo para facilitar su identificación. Por último, la determinación de anticuerpos antipseudomonas no aporta ventajas sobre los cultivos bacterianos.
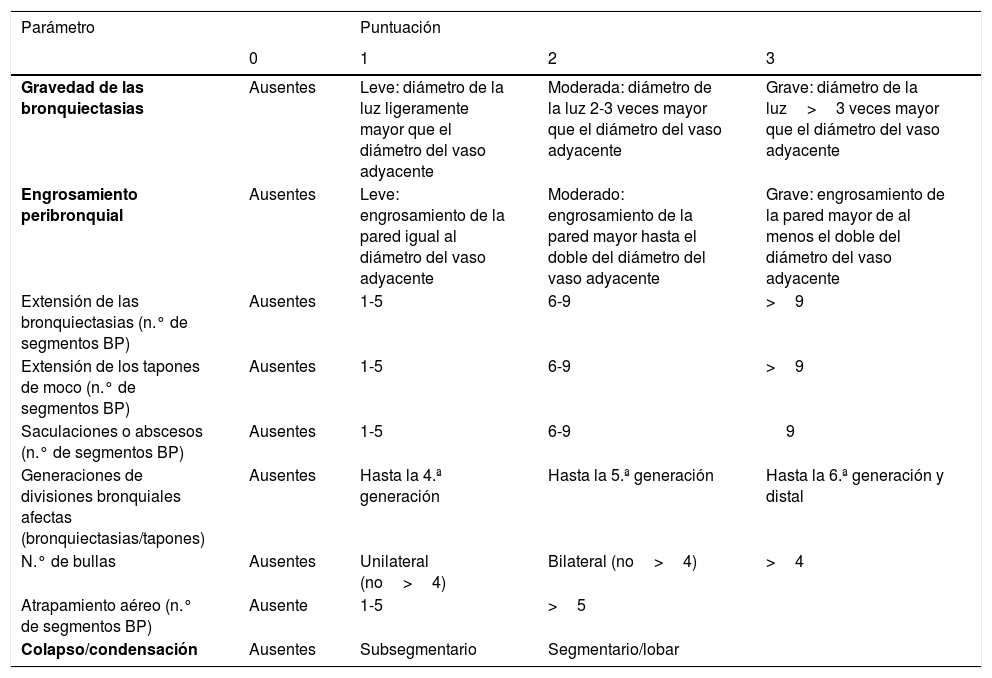
Gravedad y factores pronósticoPuntuaciones radiológicasDe los múltiples sistemas de puntuación radiológica existentes se recomienda por su sencillez la utilización de la puntuación de Reiff modificada20. Esta puntuación se basa en el cociente: diámetro de la luz bronquial/diámetro del vaso adyacente (0 puntos≤1; 1 punto=1-2; 2 puntos=2-3; 3 puntos≥3) en cada uno de los 6 lóbulos pulmonares. En el caso de necesitar una información radiológica más extensa o detallada se recomienda el sistema de puntuación modificada de Bhalla21 (tabla 4). La correlación entre ambas puntuaciones es muy elevada.
Sistema de puntuación Bhalla modificada
| Parámetro | Puntuación | |||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 | |
| Gravedad de las bronquiectasias | Ausentes | Leve: diámetro de la luz ligeramente mayor que el diámetro del vaso adyacente | Moderada: diámetro de la luz 2-3 veces mayor que el diámetro del vaso adyacente | Grave: diámetro de la luz>3 veces mayor que el diámetro del vaso adyacente |
| Engrosamiento peribronquial | Ausentes | Leve: engrosamiento de la pared igual al diámetro del vaso adyacente | Moderado: engrosamiento de la pared mayor hasta el doble del diámetro del vaso adyacente | Grave: engrosamiento de la pared mayor de al menos el doble del diámetro del vaso adyacente |
| Extensión de las bronquiectasias (n.° de segmentos BP) | Ausentes | 1-5 | 6-9 | >9 |
| Extensión de los tapones de moco (n.° de segmentos BP) | Ausentes | 1-5 | 6-9 | >9 |
| Saculaciones o abscesos (n.° de segmentos BP) | Ausentes | 1-5 | 6-9 | 9 |
| Generaciones de divisiones bronquiales afectas (bronquiectasias/tapones) | Ausentes | Hasta la 4.ª generación | Hasta la 5.ª generación | Hasta la 6.ª generación y distal |
| N.° de bullas | Ausentes | Unilateral (no>4) | Bilateral (no>4) | >4 |
| Atrapamiento aéreo (n.° de segmentos BP) | Ausente | 1-5 | >5 | |
| Colapso/condensación | Ausentes | Subsegmentario | Segmentario/lobar |
Los 3 parámetros seleccionados para la escala simplificada se marcan en negrita.
En el sistema de puntuacion Bhalla original el atrapamiento aéreo se sustituye por la presencia de enfisema, pero con la misma puntuación.
BP: bronquiales pulmonares.
Tomada y modificada de: Bhalla et al.21.
Para valorar el pronóstico y gravedad inicial de las BQ existen 2 puntuaciones multidimensionales, el FACED22 y el Bronchiectasis Severity Index (BSI)23, así como una modificación de la primera (E-FACED)24 que incluye además el número y gravedad de las agudizaciones en el año previo. Para el manejo clínico y valoración inicial del paciente se recomienda por su sencillez la utilización del E-FACED (tabla 5). Se deben recoger las variables lo más próximo posible del momento del diagnóstico. Tanto FACED como E-FACED han demostrado una buena capacidad pronóstica de mortalidad. E-FACED además presenta una buena capacidad pronóstica del número y gravedad de las agudizaciones. Se aconseja que E-FACED sea obtenido anualmente para valorar la progresión clínica de la enfermedad (recomendación fuerte, calidad de la evidencia moderada). Si bien el BSI (www.bronchiectasisseverity.com/) presenta una mayor complejidad, ha demostrado también una buena capacidad pronóstica de calidad de vida y declive de la función pulmonar.
Sistema de puntuación de la escala multidimensional E-FACED
| Variable | Valores | Puntuación |
|---|---|---|
| Exacerbaciones con ingreso hospitalario (año previo) | No Al menos 1 | 0 2 |
| FEV1 (% predicho) | Al menos el 50% Menos del 50% | 0 2 |
| Edad (Age) | Menos de 70 años Al menos 70 años | 0 2 |
| Infección (Colonización) bronquial crónica por P. aeruginosa | No Sí | 0 1 |
| Extensión radiológica (n.° de lóbulos)a | 1-2 lóbulos Más de 2 lóbulos | 0 1 |
| Disnea (escala MRC modificada) | 0-II III-IV | 0 1 |
FEV1: volumen espiratorio máximo en el primer segundo; MRC: Medical Research Council.
Rango total de creciente gravedad: 0-9 puntos (E-FACED).
Clasificación de gravedad E-FACED:
0-3 puntos: bronquiectasias leves
4-6 puntos: bronquiectasias moderadas
7-9 puntos: bronquiectasias graves
Lóbulo medio y língula considerados como lóbulos independientes.
Tomado de: Martínez-García et al.24.
Las BQ son una enfermedad irreversible, crónica y de progresión variable. Con la evolución de la enfermedad suele aparecer un mayor número de agudizaciones e ingresos hospitalarios, obstrucción progresiva al flujo aéreo, infección bronquial crónica por P. aeruginosa y otros MPP multirresistentes, clínica progresiva de disnea, insuficiencia respiratoria, cor pulmonale y muerte (sobre todo por agudizaciones respiratorias). La presencia de inflamación sistémica, infección bronquial crónica por P. aeruginosa y las agudizaciones graves se han asociado a una progresión más rápida de las BQ25.
Conflicto de interesesMiguel Ángel Martínez ha participado en reuniones de formación patrocinadas por Gilead, Novartis, Glaxo, Praxis, Teva y Zambon. Asimismo ha sido investigador principal de proyectos financiados por Praxis y Zambón y participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer y Grifols.
Luis Máiz ha participado en reuniones de formación patrocinadas por Gilead, Novartis, Zambón y Praxis.
Casilda Olveira ha participado en actividades de formación o comités de expertos patrocinadas por Gilead, Praxis, Novartis, Teva y Zambon.
Rosa Maria Girón Moreno ha participado en reuniones de formación patrocinadas por Gilead, Teva y Zambon.
Marina Blanco Aparicio ha participado en reuniones de formación patrocinadas por Zambón, Praxis Pharmaceuthical y ha sido investigador principal de ensayo clínico sobre antibioterapia inhalada patrocinado por Bayer.
David de la Rosa ha participado en reuniones de formación patrocinadas por Praxis, Zambon y Teva.
Rafael Cantón ha participado en reuniones de formación patrocinadas por Gilead, MSD, Novartis y Zambon. Asimismo ha sido investigador principal de proyectos financiados por AZ y MSD y participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer.
Montserrat Vendrell ha participado en reuniones de formación patrocinadas por Praxis, Zambon, Novartis y Chiesi. Ha sido investigador principal de proyectos financiados por Praxis, Zambon y Chiesi. Ha participado en reuniones de Grifols y Raptor pharmaceuticals.
Eva Polverino ha sido investigadora principal de ensayos clínicos promovidos por BAYER, GRIFOLS, INSMED, CHIESI; ha participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer e Insmed”; ha participado en reuniones de formación patrocinadas por Zambon.
Javier de Gracia participado en reuniones de formación patrocinadas por Gilead, Novartis y Zambon. Asimismo ha sido investigador principal de proyectos financiados Bayer y Gilead
Concepción Prados ha participado en reuniones organizadas por Gilead, Praxis, Zambón, Teva y Vertex.
David Rigau. Centro Cochrane Iberoamericano. Barcelona, España. Correo electrónico: DRigau@santpau.cat
Gabriel Olveira. Endocrinology and Nutrition Service, Nutrition Unit, Regional University Málaga Hospital, CIBERDEM, CIBER of Diabetes and Associated Metabolic Diseases (Instituto de Salud Carlos III). Madrid, España. Correo electrónico: gabrielm.olveira.sspa@juntadeandalucia.es
M.a Isabel Marco Galve. Servicio de Radiología. Hospital de Alta Resolución de Benalmádena (E.P. Hospital Costa del Sol). Málaga, España. Correo electrónico: isabelmarcogalve@yahoo.es
Marta López Martín. Servicio de Rehabilitación y Medicina Física. Hospital Universitario de la Princesa. Madrid, España. Correo electrónico: marta.lopez.martin@salud.madrid.org
Jordi Vilaró Casamitjana. Facultad de Ciencias de la Salud Blanquerna, Grupo de Investigación en Salud, Actividad Física y Deporte, Universidad Ramon Llull. Barcelona, España. Correo electrónico: Jordi.gestos@gmail.com