La enfermedad pulmonar intersticial (EPI) es una complicación frecuente en la esclerosis sistémica (ES) progresiva, presente en el 25-90% de los pacientes.
ObjetivoEvaluar si los niveles séricos de propéptido aminoterminal de procolágeno tiposi y iii (PINP y PIIINP) se correlacionan con la gravedad de la EPI en mujeres mexicanas con ES.
MétodosEn 33 pacientes con ES se evaluaron las características de la enfermedad, anticuerpos antitopoisomerasa (topoi), pruebas de función pulmonar y tomografía computarizada de alta resolución (TCAR). Diecinueve pacientes tenían ES+EPI y 14 no presentaban afectación pulmonar (ES sin EPI). Se compararon con 45 controles sanos. Se evaluaron PINP y PIIINP en los 3 grupos.
ResultadosEl grupo ES tuvo mayores niveles de PINP y PIIINP que el control (p=0,001 y p<0,001, respectivamente). Las pacientes ES+EPI habían presentado la enfermedad más años que las ES sin EPI (p=0,005), tenían mayor puntuación en el índice modificado de Rodnan (p<0,001), puntuación alta en el índice de evaluación de discapacidad (p<0,001), mayores niveles de antitopoisomerasa i (p<0,001), PINP (49,28±28,63 vs. 32,12±18,58μg/l, p=0,05), y PIIINP (4,33±1,03 vs. 2,67±1,26μg/l, p<0,001). La gravedad de la EPI en TACAR se correlacionó con los niveles de PINP (r=0,388, p=0,03) y PIIINP (p=0,594, p<0,001). En el análisis ajustado, la gravedad de la EPI se asoció con la duración de la enfermedad (p=0,037) y con los niveles de PIIINP (p=0,038) y de antitopoisomerasai (p=0,045).
ConclusionesEl PINP y el PIIINP son marcadores útiles para la ES+EPI grave. Esto apoya su uso clínico para el seguimiento de esta complicación.
Interstitial lung disease (ILD) is a frequent complication in progressive systemic sclerosis (SSc), being present in 25% to 90% of cases.
ObjectivesTo evaluate whether serum levels of procollagen typei and iii aminoterminal propeptide (PINP and PIIINP) correlate with severity and patterns of ILD in Mexican women with SSc.
MethodsThirty three SSc patients were assessed for disease characteristics and anti-topoisomerase antibodies (topoi), and also underwent pulmonary function tests and high-resolution computed tomography (HRCT). Nineteen patients had ILD+SSc, and 14 had no lung involvement (no ILD-SSc); data were compared with those from 45 healthy controls. PINP and PIIINP were assessed in all 3 groups.
ResultsPatients with SSc had higher PINP and PIIINP vs controls (P=.001, P<.001, respectively). Compared to no ILD-SSc patients, those with ILD+SSc had longer disease duration in years (P=.005), higher modified Rodnan skin score (P<.001), higher Health Assessment Questionnaire-Disability-Index scores (P<.001), higher topoi U/mL (P<.001), PINP (49.28±28.63 vs. 32.12±18.58μg/L, P=.05), and PIIINP (4.33±1.03 vs. 2.67±1.26μg/L, P<.001) levels. ILD severity based on total HRCT correlated with PINP (r=.388, P=.03) and PIIINP (P=.594, P<.001). On adjusted analysis, ILD severity was associated with disease duration (P=.037), PIIINP (P=.038), and topoi (P=.045).
ConclusionsPINP and PIIINP are useful markers for severe ILD+SSc, suggesting they could play a role in the follow-up of this complication in SSc.
La esclerosis sistémica (ES) progresiva se caracteriza por una acumulación excesiva de colágeno en diversos tejidos, como la piel, los tejidos subcutáneos, los pulmones y otros órganos internos1. La enfermedad pulmonar intersticial (EPI) es una complicación frecuente de la ES, presente entre el 25 y el 90% de los casos, dependiendo del método utilizado para el diagnóstico2. A lo largo de la evolución de la EPI aparecen anomalías en los procesos de remodelación de la matriz extracelular similares a las observadas en la fibrosis pulmonar idiopática, con proliferación de fibroblastos, depósitos de colágeno excesivo y, en las primeras etapas, abundante presencia de miofibroblastos3. Se ha demostrado en estudios in vitro que estos miofibroblastos aumentan la síntesis de colágeno de tipoi4.
La fibrosis pulmonar es una de las causas de mortalidad más frecuentes en la ES. Nagy y Czirják5, en un estudio prospectivo de cohortes, hallaron que el aumento de los niveles de PIIINP estaba asociado a un pronóstico desfavorable de la ES, y la afectación de los pulmones se asociaba a un mal pronóstico en el análisis de Kaplan-Meier. El aumento de la síntesis de colágeno está vinculado a niveles altos de propéptidos aminoterminales del procolágeno de tipoiii (PIIINP) y de tipoi (PINP), que se liberan en sangre en la ES asociada a EPI. De estos biomarcadores, el PIIINP ha sido el más investigado6-8.
Los hallazgos sobre los niveles de PINP en ES son contradictorios, y algunos autores no encuentran diferencias y sí valores normales9,10. Una revisión sistemática concluyó que la evidencia actual es insuficiente para apoyar el uso de marcadores séricos asociados al recambio de colágeno para evaluar la actividad de la enfermedad o la gravedad de la ES y se indicó la necesidad de realizar evaluaciones estandarizadas en los estudios futuros11. Por otra parte, la utilidad de estos posibles marcadores se debe medir en manifestaciones concretas de la ES. Actualmente no se sabe si los niveles séricos de los propéptidos de procolágeno tiposi y iii se correlacionan con la gravedad de la ES asociada a EPI. Por lo tanto, el objetivo del presente estudio fue evaluar si los niveles de propéptidos de procolágeno de tiposi y iii en suero se correlacionaban con las características clínicas, los patrones de afectación basados en tomografía computarizada de alta resolución (TCAR) y con alteraciones en las pruebas de función pulmonar.
Material y métodosPacientes y diseño del estudioEste estudio transversal incluyó el cribado de mujeres consecutivas con ES que acudieron a una clínica ambulatoria de reumatología de un centro de atención secundaria en Guadalajara, México. Para ser elegibles, las pacientes debían tener al menos 18años y cumplir con los criterios para ES de 1980 del American College of Rheumatology12. Se excluyeron las pacientes con esclerodermia localizada, síndrome de superposición, embarazadas, y aquellas con antecedentes hepáticos o cardiacos, con infección respiratoria activa o asma. Las pacientes con ES se clasificaron posteriormente en 2 subgrupos (véase más adelante): las pacientes con resultados de TACAR pulmonar normales se incluyeron en el grupo sin afectación pulmonar intersticial (grupo ES sin EPI, n=14), y el grupo de pacientes con ES que presentaron hallazgos concluyentes de EPI en la TCAR fueron el grupo ES+EPI (n=19).
Para el grupo control se incluyeron mujeres donantes de sangre de la misma edad que no tuvieran infecciones o antecedentes o indicadores de enfermedad reumática sistémica u otros trastornos autoinmunes. Todos los criterios de exclusión descritos para las pacientes con ES se aplicaron también en la selección de controles. Este grupo estaba constituido por 45 mujeres.
Valoración clínica de la esclerosis sistémicaCada paciente respondió un cuestionario estructurado para evaluar las variables demográficas y clínicas relacionadas con la enfermedad reumática, incluyendo la duración de la enfermedad, el tiempo con control reumatológico, las comorbilidades y el historial de medicamentos. Un reumatólogo realizó la evaluación clínica y se clasificaron los subtipos de ES según las definiciones de LeRoy et al.13, que incluyen el engrosamiento de la piel según el índice de Rodnan modificado (mRSS)14, la medición de la apertura bucal, la distancia dedo-palma, una escala visual analógica (EVA) para evaluar la gravedad de la enfermedad según la percepción de la paciente y el funcionamiento según el Cuestionario de Evaluación de la Salud-Índice de Discapacidad (Health Assessment Questionnaire-Disability Index HAQ-DI), validado para la ES15.
Evaluación de la calidad de vida de las pacientes con esclerosis sistémicaPara evaluar el impacto de la EPI sobre el sistema cardiopulmonar se utilizaron 3 índices. El primero fue una versión en español del Saint George Respiratory Questionnaire (SGRQ), un índice específico de calidad de vida relacionada con la salud (CVRS) para pacientes con enfermedades pulmonares crónicas. Este cuestionario de 50 ítems evalúa 3 dominios relacionados con la CVRS: síntomas, actividad e impacto de la enfermedad, los cuales se resumen en una medida global16. El segundo índice fue la prueba de marcha de 6min (PM6M), que se utiliza para evaluar la función cardiopulmonar según las guías de la American Thoracic Society17. El tercer instrumento fue la escala de Borg modificada para evaluar disnea y fatiga (guías ATS)18.
Cribado con pruebas de función respiratoriaLa espirometría se realizó con un espirómetro portátil SpiroPro (SensorMedics versión 2.0) en los 3 grupos (controles, ES+EPI y ES sin EPI) de acuerdo con las recomendaciones publicadas en 2005 por la American Thoracic Society y la European Respiratory Society18. Los parámetros evaluados fueron el volumen espiratorio forzado en 1segundo (FEV1), la capacidad vital forzada (FVC) y la razón FEV1/FVC, en 3 medidas tomadas durante la misma evaluación con patrón ventilatorio restrictivo. Los valores obtenidos se expresaron como porcentajes del valor esperado por comparación con sujetos del mismo sexo, edad, peso y estatura. El patrón restrictivo se definió, de acuerdo con los resultados de las pruebas de función respiratoria, cuando FVC<80% y FEV1/FVC>80%18.
Se excluyeron las pacientes con síndrome de superposición, las embarazadas, aquellas con infecciones activas, insuficiencia cardiaca de gradosiii o iv, enfermedad pulmonar obstructiva crónica, asma o tuberculosis pulmonar.
Tomografía computarizada de alta resoluciónSe realizó TACAR a todas las pacientes en un solo tomógrafo (equipo de cuarta generación SOMATOM Ar.T. Siemens®). Los cortes fueron de 1-2mm (intervalos de 10mm) con la paciente en decúbito prono. Se reconstruyeron las imágenes con un algoritmo de alta resolución, filtro óseo y ventana pulmonar estándar (WL-700, WW1.000-1.500 HU). Los criterios utilizados para clasificar EPI, determinados prospectivamente, se establecieron por consenso entre 2 neumólogos (JP, MM), 2 reumatólogos (LGL, JIGN) y un radiólogo (JFN). El diagnóstico definitivo de EPI asociada a ES (ES+EPI) estaba condicionado a la presencia en la TACAR de opacidades reticulares definidas periféricas y bilaterales, con o sin patrón subpleural en panal (honeycombing) o datos de actividad de densidades en vidrio deslustrado. Como ya se ha indicado, las pacientes con ES se diferenciaban en 2 grupos según los resultados de la TACAR: grupo 1, ES+EPI, y grupo 2, ES sin EPI.
Siguiendo el estudio de Kazerooni et al.19, se utilizó un formulario estandarizado para tabular la presencia o ausencia de 2 características: a)opacidad en vidrio deslustrado (operativamente equivalente a puntuación alveolar), definida como un área más atenuada, y b)patrón en panal (operativamente equivalente a puntuación intersticial), definido como espacios aéreos quísticos subpleurales agrupados con paredes definidas de 3 a 25mm de diámetro. En una escala de 0-5 se puntuó de la siguiente manera en los 3 lóbulos de ambos pulmones: en el caso de la escala alveolar, 0 se asignó a ausencia de afectación alveolar; 1, vidrio deslustrado afectando <5% del lóbulo; 2, afectación >25%; 3, afectación del 25 al 45%; 4, afectación del 50 al 75%; 5, afectación >75% del lóbulo. En la escala intersticial, 0 fue ausencia de fibrosis; 1, engrosamiento septal sin patrón en panal; 2, patrón en panal en >25% del lóbulo; 3, afectación del 25 al 49%; 4, afectación del 50 al 75%; 5, afectación >75% del lóbulo. La suma para cada patrón se calculó a partir de la puntuación de las secciones evaluadas. Operativamente, la puntuación total de la TACAR se calculó sumando las puntuaciones alveolar e intersticial y dividiendo por 2.
Evaluación de la presión arterial pulmonar por ecocardiografíaUn cardiólogo ecocardiografista con experiencia, ciego a las características clínicas y analíticas de las pacientes, realizó ecocardiografía de todas las participantes con un equipo Philips 7500 usando un transductor de 2,5MHz. La regurgitación tricuspídea se estudió mediante Doppler en color y el chorro de regurgitación se registró con Doppler de onda continua. La velocidad máxima de regurgitación observada sirvió para calcular el gradiente de presión transvalvular con la ecuación de Bernoulli modificada (4V2). Para estimar la presión de la aurícula derecha se utilizó el diámetro máximo de la vena cava inferior, siguiendo los parámetros descritos por Denton et al.20. Finalmente, la presión arterial pulmonar sistólica (PAPS) correspondió a la suma del gradiente de presión a través de la válvula tricúspide + la presión de la aurícula derecha.
Marcadores séricosSe extrajeron muestras de sangre venosa en el momento de la evaluación clínica. El suero se recogió en un tubo frío (4°C) tras centrifugación de sangre total a 2.000rpm durante 15min a 4°C. Se almacenaron alícuotas de suero a −20°C durante un máximo de 6meses, que se utilizaron para la determinación de PINP y PIIINP por radioinmunoanálisis con la técnica de Risteli en kits comerciales21,22. Se determinaron en los controles los niveles de PINP y PIIINP, expresados en μg/dl. El personal encargado de estas pruebas fue ciego a los datos clínicos del paciente.
Análisis estadísticoLas variables cuantitativas se expresan como media y desviación estándar y las variables cualitativas, como frecuencias y porcentajes. Se utilizó la prueba t de Student para comparar las variables cuantitativas entre las pacientes con ES+EPI y ES sin EPI. Para comparar las variables cualitativas entre estos grupos se utilizó la prueba de Chi-cuadrado (o la prueba exacta de Fisher, si era necesario). Se analizaron correlaciones mediante la prueba de Pearson (r) entre las puntuaciones alveolares, intersticiales, y puntuaciones totales en la TACAR y las características clínicas, la CVRS, los índices cardiopulmonares y los niveles de PINP y PIIINP. Se realizó análisis de regresión multivariante para identificar los factores asociados con la puntuación EPI en TACAR, y las variables incluidas en este análisis se seleccionaron según dos criterios: a) por significación estadística en el análisis univariado, y b) las variables que se consideraron factor de confusión. Tras probar varios modelos, en el modelo final se incluyeron las siguientes variables: edad, duración de la enfermedad, niveles PINP y de PIIINP y título de anticuerpos antitopoisomerasa. También se realizó un análisis de regresión logística utilizando como variable dependiente la presencia de EPI con ES, incluyendo como covariables el sexo, la edad, la duración de la enfermedad y los niveles PINP y de PIIINP. La significación se fijó en 0,05. Todos los análisis se realizaron con SPSS versión 8.0.
ÉticaEl estudio fue aprobado por la Junta de Revisión Institucional del hospital del Instituto Mexicano del Seguro Social (IMSS) (número de autorización IMSS R-2005-1303-93). Todas las participantes otorgaron su consentimiento informado por escrito.
ResultadosLas pacientes con ES (n=33) y el grupo de controles sanas (n=45) no presentaron diferencias en cuanto a la edad (52,55±11,48 frente a 49,47±7,25, respectivamente, p=0,15), la frecuencia de exposición a disolventes (15,2% frente a 8,9%, respectivamente, p=0,48), la exposición a humo (45,5% frente a 26,7%, respectivamente, p=0,98), antecedentes de tabaquismo (24,4% frente a 15,6%, respectivamente, p=0,39), consumo de alcohol (3,0% frente a 2,2%, respectivamente, p=1,00) o el uso de anticonceptivos (39,4% frente a 44,4%, respectivamente, p=0,13). Se observaron diferencias en todos los parámetros evaluados en las pruebas de función pulmonar (%FVC, FEV1, FEV1/FVC) entre las pacientes y las mujeres control (p<0,001). La media en la PM6M fue significativamente menor en el grupo con ES en comparación con el control (372,87±112,14 frente a 563,84±131,34, respectivamente, p<0,001). Los niveles séricos de PINP fueron significativamente mayores en el grupo ES en comparación con el control (PINP, 42,0 frente a 26,58, respectivamente, p=0,001). Del mismo modo, los niveles del PIIINP estaban significativamente aumentados en el grupo ES en comparación con el control (3,67 frente a 2,32, respectivamente, p<0,001).
Cuatro controles eran fumadoras activas (8,9%). Las pacientes con ES informaron de síntomas pulmonares con la siguiente frecuencia: tos (n=15, 45,5%), flema (n=10, 30,3%), sibilancias (n=3, 9,1%), crepitaciones bilaterales en inspiración y espiración (n=23, 69,7%) y disnea (n=15, 45,5%). Además, 22 (66,7%) pacientes con ES mostraron patrón restrictivo en las pruebas de función pulmonar (PFP). La escala modificada de Borg antes de la PM6M mostró empeoramiento significativo del grupo con ES en comparación con el control (1,17 frente a 0, respectivamente, p<0,001). Se observó una diferencia similar en los valores de la escala de Borg tras la PM6M entre el grupo ES y el control (2,62 frente a 0, respectivamente, p<0,001). Las puntuaciones en el SGRQ también fueron significativamente mayores en las pacientes con ES en comparación con las controles en cada dominio, lo que indicaba mayor disminución en la calidad de vida en relación a los síntomas (15,42 frente a 0, respectivamente, p<0,001), la actividad (17,67 vs 0, respectivamente, p<0,001), y el impacto (10,39 frente a 0, respectivamente, p<0,001).
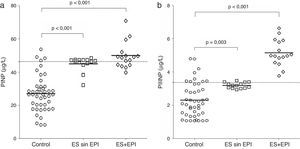
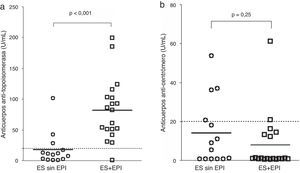
Niveles de marcadores séricosLa figura 1 muestra una comparación entre los niveles de PINP y PIIINP en controles, los de las pacientes ES sin EPI y los del grupo ES+EPI. Los grupos ES sin EPI y ES+EPI presentaron niveles de PINP más altos (con U de Mann-Whitney) que el grupo control (figura 1a, con p<0,001 en ambas comparaciones). También se encontraron niveles de PIIINP más altos en las pacientes ES sin EPI (p=0,003) y ES+EPI (p<0,001) en comparación con las control (figura 1b). En un subanálisis no mostrado en esta figura, se compararon las medias de PINP y el PIIINP entre los 3 grupos de estudio: las pacientes con ES+EPI tenían niveles significativamente más altos de PINP que las control (49,28±28,63 frente a 26,58±11,12, respectivamente, p<0,001), aunque no hubo diferencias en los niveles séricos de PINP entre el grupo ES sin EPI y el grupo control (32,12±18,59 frente a 26,58±11,12 respectivamente, p=0,061). Asimismo, las pacientes con ES+EPI tenían niveles significativamente más altos de PIIINP que las control (4,33±1,03 frente a 2,32±1,04, respectivamente, p<0,001) y no había diferencia en los niveles séricos de PIIINP entre el grupo ES sin EPI y el grupo control (2,67±1,26 vs 2,32±1,04, respectivamente, p=0,058). La figura 2 muestra la comparación de los niveles de anticuerpos antitopoisomerasai y anticentrómero entre pacientes ES sin EPI y pacientes ES+EPI. Las pacientes ES+EPI presentaron niveles de anticuerpos antitopoisomerasai significativamente mayores que las ES sin EPI (p<0,001; fig. 2a), pero no se observaron diferencias en los títulos de anticuerpos anticentrómero entre los grupos ES+EPI y ES sin EPI (p=0,25; fig. 2b).
Comparación de los niveles de PINP y PIIINP entre grupos. a)Comparación entre los niveles séricos del propéptido de procolágeno tipoi en controles sanos, en pacientes con esclerosis sistémica sin enfermedad pulmonar intersticial (ES sin EPI) y en pacientes con esclerosis sistémica y enfermedad pulmonar intersticial (ES+EPI). b)Comparación entre los niveles séricos de propéptido de procolágeno tipoiii en controles, ES sin EPI y ES+EPI. Los valores de p se calcularon con la prueba de U de Mann-Whitney.
En a)se muestra la comparación entre los títulos de anticuerpos antitopoisomerasai entre el grupo de esclerosis sistémica sin enfermedad pulmonar intersticial (ES sin EPI) y el de esclerosis sistémica con enfermedad pulmonar intersticial (ES+EPI). En b)se muestra la comparación entre los títulos de anticuerpos anticentrómero en ES sin EPI frente a ES+EPI. Los valores de p se calcularon con la prueba de U de Mann-Whitney.
Se realizó una comparación de las diferencias en las medianas de los niveles PINP y PIIINP entre ES sin EPI y ES+EPI, si bien los datos no se muestran en las tablas (prueba de U de Mann-Whitney). Se observaron diferencias significativas en los niveles de PINP en ambos grupos de pacientes ES con respecto al grupo control (p<0,001 para ambos grupos), y este fue también el caso de PIIINP (p=0,003 y p<0,001 en ES sin EPI). El título de anticuerpos antitopoisomerasai fue significativamente más alto en pacientes ES+EPI que en el grupo ES sin EPI (p<0,001), pero no se observaron diferencias entre ES+EPI y ES sin EPI en el caso de los anticuerpos anticentrómero (p=0,25).
Comparación entre los 2 grupos con ES: ES+EPI frente a ES sin EPIEn la tabla 1 se comparan los grupos ES+EPI y ES sin EPI según la TACAR respecto a sus características clínicas, puntuaciones de los índices cardiopulmonares, resultados de FVC, niveles séricos de propéptidos y frecuencia de resultados positivos de anticuerpos antinucleares, antitopoisomerasai y anticuerpos anticentrómero. Las pacientes ES+EPI habían padecido la enfermedad durante más tiempo (p=0,005), presentaban con más frecuencia ES difusa (p=0,03) y tenían puntuaciones más altas en el mRSS (p<0,001) en el HAQ-DI (p<0,001). Como se preveía, la FVC era significativamente menor en las pacientes con ES+EPI comparado con las que no tenían EPI (p<0,001).
Comparación de características seleccionadas entre los pacientes con esclerosis sistémica progresiva (ES) con enfermedad pulmonar intersticial asociada (ES+EPI) frente a pacientes con ES sin EPI (ES sin EPI)
| ES sin EPI (n=14) | ES+EPI (n=19) | p | |
|---|---|---|---|
| Características clínicas | |||
| Edad, años | 46,64 ± 8,39 | 56,89 ± 11,69 | 0,06 |
| Exposición a disolventes, n (%) | 2 (14,3) | 3 (15,8) | 1,00 |
| Exposición a humo, n (%) | 7 (50,0) | 8 (42,1) | 0,73 |
| Síntomas pulmonares | |||
| Crepitaciones bilaterales en inspiración y espiración, n (%) | 6 (42,9) | 17 (89,5) | 0,007 |
| Disnea, n (%) | 1 (7,1) | 14 (73,7) | < 0,001 |
| Características de la ES | |||
| Duración de la enfermedad, años | 6,50 ± 4,20 | 11,21 ± 4,66 | 0,005 |
| Subtipo de ES | |||
| Limitada, n (%) | 6 (42,9) | 1 (5,3) | 0,03 |
| Difusa, n (%) | 8 (57,1) | 18 (94,7) | |
| Índice modificado de Rodnan (unidades) | 11,29 ± 2,52 | 22,68 ± 9,57 | < 0,001 |
| Índice HAQ-DI (unidades) | 0,41 ± 0,23 | 1,43 ± 0,49 | < 0,001 |
| Presión arterial pulmonar sistólica, mmHg | 34,29 ± 3,95 | 43,53 ± 3,58 | < 0,001 |
| Hipertensión pulmonar (≥40 mmHg), n (%) | 1 (7,1) | 15 (93,8) | < 0,001 |
| Función pulmonar | |||
| FVC (% de lo esperado) | 78,14 ± 7,73 | 65,68 ± 6,91 | < 0,001 |
| Patrón restrictivo, n (%) | 4 (28,6) | 18 (94,7) | < 0,001 |
| Índices cardiopulmonares | |||
| PM6M, metros | 431,1 ± 97,9 | 324,9 ± 101,9 | 0,006 |
| Escala de Borg modificada EVA antes de PM6M | 0,54 ± 1,01 | 1,64 ± 1,56 | 0,02 |
| Escala de Borg modificada EVA después de PM6M | 0,99 ± 1,51 | 3,96 ± 2,79 | 0,001 |
| Disnea después de PM6M, n (%) | 3 (21,4) | 9 (52,9) | 0,14 |
| SGRQ, % | |||
| Síntomas | 6,79 ± 10,10 | 21,79 ± 15,59 | 0,002 |
| Actividad | 8,43 ± 11,88 | 24,47 ± 14,21 | 0,001 |
| Impacto | 4,07 ± 6,88 | 15,05 ± 9,71 | 0,001 |
| Total | 8,71 ± 11,06 | 25,32 ± 15,17 | 0,001 |
| Marcadores de metabolismo de colágeno | |||
| PINP (μg/l) | 32,12 ± 18,58 | 49,28 ± 28,63 | 0,05 |
| PIIINP (μg/l) | 2,67 ± 1,26 | 4,33 ± 1,03 | < 0,001 |
| Perfil de autoanticuerpos | |||
| Anticuerpos antinucleares, n (%) | 12 (85,7) | 18 (94,7) | 0,56 |
| Anticuerpos antitopoisomerasa, n (%) | 3 (21,4) | 18 (94,7) | < 0,001 |
| Anticuerpos anticentrómero, n (%) | 4 (28,6) | 2 (10,5) | 0,36 |
| Tratamiento | |||
| D-penicilamina, n (%) | 9 (64,3) | 14 (73,7) | 0,71 |
| Azatioprina, n (%) | 6 (42,9) | 11 (57,9) | 0,49 |
| Colchicina, n (%) | 6 (42,9) | 7 (36,8) | 1,00 |
| Cloroquina, n (%) | 3 (21,4) | 4 (21,1) | 1,00 |
| Uso de corticosteroides, n (%) | 6 (42,9) | 14 (73,7) | 0,15 |
EVA, escala visual analógica; FVC, capacidad vital forzada; HAQ-DI, Cuestionario de Evaluación de la Salud-Índice de Discapacidad; PIIINP, propéptido aminoterminal de procolágenoiii. PINP, propéptido aminoterminal de procolágenoi; PM6M, prueba de marcha de 6min; SGRQ, Saint George Respiratory Questionnaire.
Las variables cualitativas expresan en frecuencia (%); las variables cuantitativas se expresan como media ± desviación estándar. Las proporciones se compararon con la prueba de Chi-cuadrado o la prueba exacta de Fisher. Las medias se compararon con la prueba de t de Student no pareada.
La tabla 2 muestra la correlación en 33 pacientes con ES entre las puntuaciones de gravedad de la EPI en TACAR y una serie de características seleccionadas. La puntuación total de TACAR se correlacionó con la edad (p=0,03), la duración de la enfermedad (p<0,001), la puntuación en el mRSS (p<0,001), la distancia dedo-palma (p=0,04), la apertura bucal (correlación negativa, p=0,02), la puntuación HAQ-DI (p<0,001), todos los dominios del SGRQ (p<0,001), la PM6M (correlación negativa, p=0,01), el resultado de la escala de Borg modificada antes de la PM6M (p=0,03), el resultado de la escala de Borg modificada después de la PM6M (p=0,001), los niveles de PINP (p=0,03) y de PIIINP (p<0,001). La PAPS se correlacionó significativamente con los niveles de PINP (r=0,422, p=0,014) y con los niveles de PIIINP (r=0,476, p=0,005). Estos datos no se muestran en la tabla.
Correlación entre las puntuaciones de gravedad de la enfermedad pulmonar intersticial en tomografía computarizada de alta resolución (TACAR) y las características seleccionadas de las mujeres con esclerosis sistémica progresiva (ES)
| Puntuación alveolar | Puntuación intersticial | Puntuación total en TACAR | ||||
|---|---|---|---|---|---|---|
| r | p | r | p | R | P | |
| Edad, años | 0,341 | 0,05 | 0,362 | 0,04 | 0,373 | 0,03 |
| Duración de la enfermedad, años | 0,582 | < 0,001 | 0,653 | < 0,001 | 0,665 | < 0,001 |
| Características de la ES | ||||||
| Índice de Rodnan modificado (unidades) | 0,866 | < 0,001 | 0,850 | < 0,001 | 0,922 | < 0,001 |
| Distancia dedo-palma (cm) | 0,236 | 0,19 | 0,460 | 0,007 | 0,368 | 0,04 |
| Apertura bucal (cm) | −0,283 | 0,110 | -0,502 | 0,003 | −0,410 | 0,02 |
| Puntuación HAQ-DI (unidades) | 0,665 | < 0,001 | 0,723 | < 0,001 | 0,743 | < 0,001 |
| Función pulmonar | ||||||
| FVC (% de lo esperado) | −0,858 | < 0,001 | −0,851 | < 0,001 | −0,914 | < 0,001 |
| Calidad de vida relacionada con la salud | ||||||
| SGRQ, Síntomas | 0,749 | < 0,001 | 0,830 | < 0,001 | 0,840 | < 0,001 |
| SGRQ, Actividad | 0,617 | < 0,001 | 0,752 | < 0,001 | 0,723 | < 0,001 |
| SGRQ, Impacto | 0,663 | < 0,001 | 0,773 | < 0,001 | 0,764 | < 0,001 |
| SGRQ, Total | 0,611 | < 0,001 | 0,775 | < 0,001 | 0,713 | < 0,001 |
| Índices cardiopulmonares | ||||||
| Escala de Borg modificada EVA antes de PM6M | 0,383 | 0,03 | 0,302 | 0,09 | 0,372 | 0,03 |
| PM6M, metros | −0,469 | 0,008 | −0,376 | 0,04 | −0,453 | 0,01 |
| Escala de Borg modificada EVA después de PM6M | 0,556 | 0,001 | 0,519 | 0,003 | 0,572 | 0,001 |
| Marcadores de colágeno | ||||||
| PINP (μg/dl) | 0,200 | 0,26 | 0,550 | 0,001 | 0,388 | 0,03 |
| PIIINP (μg/dl) | 0,521 | 0,002 | 0,582 | < 0,001 | 0,594 | < 0,001 |
EVA, escala visual analógica; FVC, capacidad vital forzada; HAQ-DI, Cuestionario de Evaluación de la Salud-Índice de Discapacidad; PIIINP, propéptido aminoterminal de procolágeno iii;PINP, propéptido aminoterminal de procolágenoi; PM6M, prueba de marcha de 6min; SGRQ, Saint George Respiratory Questionnaire.
En la tabla 3 se muestran los resultados del análisis de regresión lineal multivariado con las variables asociadas a las puntuaciones alveolar, intersticial y total en las TACAR de 33 pacientes con ES. Tras ajustar por edad y duración de la enfermedad, las variables asociadas con presentar una mayor puntuación alveolar fueron el PINP (p=0,029), el PIIINP (p=0,050) y los anticuerpos antitopoisomerasa (p=0,023). No se identificaron asociaciones significativas para la puntuación intersticial. La puntuación total de TACAR se asoció a la duración de la enfermedad (p=0,037), los niveles de PIIINP (p=0,038), y los títulos de anticuerpo antitopoisomerasa (p=0,045). Se realizó un análisis de regresión logística para evaluar si los niveles de PINP y PIIINP estaban asociados con ES+EPI. Tras ajustar por edad y duración de la enfermedad, los niveles de PIIINP se mantuvieron significativamente asociados (OR=9,74, IC95%: 1,20 a 78,78, p=0,03), mientras que los niveles de PINP ya no resultaron significativos en este modelo (datos no mostrados en la tabla).
Factores determinantes de enfermedad pulmonar intersticial (EPI) en el análisis de regresión múltiple
| Variable | Coeficiente β | R2 parcial | p |
|---|---|---|---|
| Puntuación alveolar | |||
| Edad, años | 0,090 | 0,116 | 0,538 |
| Duración de la enfermedad, años | 0,752 | 0,340 | 0,074 |
| PINP (μg/dl) | −0,143 | 0,347 | 0,029 |
| PIIINP (μg/dl) | 1,983 | 0,487 | 0,050 |
| Anticuerpos anti-topoisomerasa (U/ml) | 0,085 | 0,578 | 0,023 |
| Puntuación intersticial | |||
| Edad, años | 0,057 | 0,131 | 0,675 |
| Duración de la enfermedad, años | 0,689 | 0,430 | 0,076 |
| PINP (μg/dl) | 0,054 | 0,505 | 0,350 |
| PIIINP (μg/dl) | 1,976 | 0,599 | 0,060 |
| Anticuerpos anti-topoisomerasa (U/ml) | 0,034 | 0,615 | 0,298 |
| Puntuación total en TACAR | |||
| Edad, años | 0,067 | 0,139 | 0,587 |
| Duración de la enfermedad, años | 0,748 | 0,445 | 0,037 |
| PINP (μg/dl) | −0,053 | 0,452 | 0,321 |
| PIIINP (μg/dl) | 2,000 | 0,531 | 0,038 |
| A Anticuerpos antitopoisomerasa (U/ml) | 0,062 | 0,647 | 0,045 |
PINP: propéptido aminoterminal de procolágenoi; PIIINP, propéptido aminoterminal de procolágenoiii; TACAR: tomografía computarizada de alta resolución.
Análisis de regresión múltiple de la gravedad de la enfermedad pulmonar intersticial según marcadores de TACAR con las características clínicas y propéptidos aminoterminales de procolágeno en mujeres con esclerosis sistémica progresiva. Los valores beta son coeficientes no estandarizados. R2 es la varianza total explicada en el modelo.
En el presente estudio, las pacientes con EPI asociada a ES tenían mayores concentraciones de PINP y PIIINP en comparación con aquellas con ES sin afectación pulmonar. El aumento del PIIINP se correlacionó con la gravedad y la extensión del daño alveolar, del intersticial y de la puntuación total en la TACAR, mientras que los niveles de PINP se correlacionaron solo con afectación intersticial y la puntuación total de gravedad en la TACAR.
Los niveles de propéptido aminoterminal de los tiposi y iii reflejan la formación de colágeno y, por lo tanto, son un marcador útil de fibrogénesis en múltiples órganos. El proceso fibrótico que tiene lugar en la piel y otros órganos en la ES aumenta la producción de colágeno de tipoi, lo que supone altos niveles de PINP en sangre. Aquí observamos que los niveles séricos de PINP fueron significativamente más altos en comparación con los de las controles, pero algunos autores no han encontrado este aumento10. Por otra parte, el colágeno de tipoiii se encuentra en gran cantidad en la arquitectura del pulmón en condiciones normales, y los niveles de PIIINP reflejan la producción de colágenoiii en el pulmón y otros órganos. En el caso de enfermedades pulmonares se puede observar aumento de PIIINP cuando hay daño alveolar e intersticial, y se asocia a la producción activa de colágeno tipoiii. Por lo tanto, el aumento de la concentración sérica de PIIINP puede reflejar una excesiva formación de colágenoiii, y estos altos niveles han sido previamente descritos en la ES9. El aumento de PIIINP se ha asociado además con un pronóstico desfavorable en pacientes con ES5.
Hasta la fecha, y comparado con el PIIINP, la utilidad de los niveles séricos de PINP para valorar la afectación orgánica en la ES ha sido menos investigada. Diot et al.23 describieron que niveles altos de PIIINP se asociaban a una afectación pulmonar en la ES, pero no hallaron correlación con su gravedad. Scheja et al.9 mostraron que los niveles más altos del PIIINP en la ES se correlacionaban con una disminución en la capacidad de difusión del monóxido de carbono, pero estos autores tampoco realizaron estudios radiológicos de EPI.
El aumento de los niveles séricos de PIIINP se ha relacionado con el desarrollo de alveolitis, que llevaría a fibrosis pulmonar. Lammi et al.24 hallaron aumento del PIIINP en lavado broncoalveolar de 18 pacientes con alveolitis fibrosante de etiología variada, principalmente idiopática. Esto apoya la posibilidad de que el PIIINP se pueda utilizar como marcador de EPI activa. Lee et al.25 observaron que los pacientes con ES y FVC<80% tenían niveles más altos de PIIINP, lo que sugiere que este biomarcador serviría para identificar pacientes con patrón espirométrico restrictivo.
Hasta donde sabemos, ningún estudio ha investigado la correlación entre la gravedad de la EPI, según una evaluación mediante TACAR en pacientes con ES, y los niveles séricos de PINP o PIIINP. Tampoco conocemos ningún estudio de análisis multivariado que explore la asociación de estos propéptidos con la gravedad y los patrones de EPI. Hemos observado que mayor gravedad de la EPI según TACAR se correlaciona con niveles más altos de PIIINP, y que estos niveles se asocian con mayor afectación intersticial y alveolar. Estos datos apoyan el papel del PIIINP no solo en la detección de la ES+EPI, sino también como biomarcador para determinar mayor gravedad de la afectación pulmonar. El papel de PINP como biomarcador en la ES no está tan claro todavía. Hunzelmann et al.10 evaluaron los niveles séricos de PINP en pacientes con ES y no hallaron ninguna correlación entre la puntuación dermatológica y los niveles de este biomarcador. Sin embargo, nosotros hemos observado que los pacientes con ES tenían niveles de PINP significativamente más altos en comparación con los controles sanos y, por otro lado, Scheja et al.9 observaron correlación entre los niveles de PINP y la capacidad vital en espirometría.
La hipertensión pulmonar (HTP) es una complicación importante de la ES. Se puede realizar ecocardiografía para detectar HTP, y la PAPS se puede estimar frecuentemente mediante ecocardiografía Doppler. En este estudio se observó que la PAPS se correlacionaba significativamente con los niveles de PINP (r=0,422, p=0,014) y los de PIIINP (r=0,476, p=0,005). Denton et al.20 observaron que había correlación entre la ecocardiografía Doppler y el cateterismo cardiaco derecho.
Una limitación de nuestro estudio es que, aunque observamos que los pacientes con EPI grave tenían niveles más altos de PIIINP, no hemos podido determinar si estos pacientes tienen un mayor riesgo de pronóstico desfavorable. Por ejemplo, Nagy y Czirják5 hallaron que los pacientes con valores de PIIINP más altos tenían mayor riesgo de pronóstico desfavorable. Otra limitación es que no se incluyeron hombres con ES. El motivo es que tenemos muy pocos casos de pacientes masculinos en consulta con esta enfermedad y constituyen una muestra insuficiente para análisis estadístico. Esta limitación reduce la generalización de nuestros resultados exclusivamente a mujeres con ES, y estudios posteriores deberían confirmar nuestros hallazgos en una muestra que incluyera a ambos sexos. Una limitación más es que no hay asociación estadística entre PINP o PIIINP con patrón reticular en el análisis de regresión lineal. Esto puede explicarse parcialmente por la limitada precisión de nuestra puntuación TACAR para identificar algunos casos no graves de EPI (falsos negativos) que se habrían clasificado erróneamente. Estos problemas deben ser tenidos en cuenta en futuros estudios usando una combinación de métodos diagnósticos que permitan detectar la afectación intersticial, y así aumentar la sensibilidad del diagnóstico de EPI. Otra limitación de este estudio es que estos propéptidos no pueden ser considerados biomarcadores altamente específicos de la EPI; otras características y comorbilidades se asocian a un aumento de los niveles séricos de estos propéptidos y deben ser tenidas en cuenta. Entre las enfermedades asociadas a niveles más altos de PINP están la osteoporosis26,27, el lupus eritematoso sistémico28, las metástasis óseas secundarias a cáncer de mama29 y la insuficiencia renal crónica30. Por su parte, tanto el PINP como el PIIINP aparecen aumentados en la insuficiencia respiratoria aguda31. Para minimizar los posibles factores de confusión, se excluyeron las pacientes con síndrome de superposición, esclerodermia localizada y antecedentes cardiacos o hepáticos, en las que pueden aumentar los niveles de estos propéptidos. Sin embargo, no se realizó una evaluación estructurada de osteoporosis en las pacientes midiendo la densidad ósea, por lo que esta debe ser considerada otra limitación de nuestro estudio, especialmente en el caso de los niveles de PINP. Por otro lado, ninguna de nuestras pacientes tenía niveles séricos de creatinina >1,5mg/dl, por lo que esta variable no parece influir en el aumento de PINP y de PIIINP en suero observado en la ES+EPI. Aunque en nuestro estudio la insuficiencia renal crónica no era un factor de confusión, la utilidad de los niveles de PINP o PIIINP como marcadores de ES+EPI puede disminuir en pacientes con deterioro significativo de la función renal. Por último, la metodología utilizada para explorar la función pulmonar en nuestro estudio no permitió evaluar con firmeza la correlación entre los parámetros de función pulmonar y los niveles de PINP o PIIINP en suero. Por otro lado, este estudio cuenta como fortaleza que la metodología utilizada para evaluar la afectación pulmonar en la ES se basó en una definición validada de los hallazgos de EPI en TACAR y un índice de gravedad de la afectación validado. La principal aportación de este estudio es que la presencia de EPI en la ES no solo se asocia con los niveles séricos de propéptido sino que, además, estos niveles aumentan según se incrementa la gravedad de la afectación pulmonar en la puntuación de la TACAR. Otra fortaleza de este estudio es que se realizó análisis multivariante ajustado por factores de confusión y se observó que los niveles de PIIINP se mantenían como factor asociado a la gravedad de la EPI. Aunque nuestro estudio no fue diseñado para evaluar el papel de las concentraciones de PINP o PIIINP para establecer el pronóstico de estas pacientes, los resultados observados en algunas pacientes en las que aumentaban estos biomarcadores, incluso si no había EPI como complicación, indican la necesidad de realizar estudios longitudinales para determinar si existen diferencias clínicamente relevantes en la evolución según los niveles de propéptidos.
En resumen, aportamos evidencia de que el PINP y el PIIINP son marcadores de la gravedad de la EPI en la ES y se correlacionan con los cambios observados en la TACAR de estas pacientes. El PIIINP se asocia además a la afectación intersticial y alveolar en la EPI, lo que apoya que este marcador tenga utilidad para evaluar la gravedad de la enfermedad. Es necesario realizar más estudios en cohortes bien controladas para investigar más a fondo este hallazgo.
FinanciaciónEste proyecto ha sido cofinanciado por 2 becas de investigación: Instituto Mexicano del Seguro Social IMSS FOFOI-2005/1/I/065 y los fondos mixtos del Consejo Nacional de Ciencia y Tecnología (CONACYT), Gobierno del Estado de Michoacán, MICH-2003 C01-12442.
Contribuciones de los autoresConcepto y diseño: Laura Gonzalez-Lopez, Araceli Garcia-Gonzalez, Alberto D. Rocha-Muñoz, Jorge I. Gámez-Nava.
Análisis e interpretación de los datos: Laura Gonzalez-Lopez, Alberto D. Rocha-Muñoz, Arnulfo H. Nava-Zavala, Jorge I. Gámez-Nava, Eva M Olivas-Flores.
Redacción del artículo: Jorge I. Gamez-Nava, Alberto D. Rocha-Muñoz, Eva M Olivas-Flores, Laura Gonzalez-Lopez, Mayra Mejía, Soraya A Zavaleta-Muñiz, Mónica Vázquez-del Mercado, Ernesto G. Cardona-Muñoz, Benjamín Trujillo-Hernández.
Revisión crítica del artículo sobre contenido intelectual de importancia: Araceli Garcia-Gonzalez, Arnulfo H. Nava-Zavala, Alberto I. Villa-Manzano, Soraya A. Zavaleta-Múñiz, Mónica Vázquez-del Mercado, Ernesto G. Cardona-Muñoz, Benjamín Trujillo-Hernández, Mario Salazar-Paramo, Ana Peguero.
Suministro de materiales o pacientes de estudio: Laura González-López, Juan Flores-Navarro, Alberto I. Villa-Manzano, Pablo Juárez-Contreras.
Apoyo administrativo, técnico o logístico: Mario Salazar-Paramo, Ana Peguero, Juan Flores-Navarro, Pablo Juárez-Contreras, Mayra Mejía.
Aprobación final del artículo: Laura González-López, Alberto D. Rocha-Muñoz, Eva M. Olivas-Flores, Araceli García-Gonzalez, Ana Peguero, Juan Flores-Navarro, Alberto I. Villa-Manzano, Soraya A. Zavaleta-Muñiz, Mario Salazar-Paramo, Mayra Mejía, Pablo Juárez-Contreras, Mónica Vázquez-del Mercado, Ernesto G. Cardona-Muñoz, Benjamín Trujillo-Hernández, Arnulfo Nava, Jorge I. Gámez-Nava.
Conflicto de interesesTodos los autores declaran que no existe ningún conflicto de intereses con respecto a la publicación de este artículo.