En los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), la neumonía es una afección frecuente, generalmente causada por gérmenes habituales. Describimos a continuación el caso clínico de un paciente que presentó neumonía por Dialister pneumosintes. Según la revisión realizada en PubMed desde el año 1960 hasta la actualidad, no se ha aislado este germen como causante de neumonía en pacientes sin factores de riesgo.
En el momento de acudir a consultas el paciente tenía 74 años y entre sus antecedentes personales destacaba que era exfumador y exbebedor, y que presentaba EPOC, sin tratamiento habitual. Se hallaba en seguimiento en las consultas de neumología por presentar infecciones de repetición desde hacía 5 años. Durante dicho período se habían observado infiltrados seudonodulares, que cambiaban de localización, en las tomografías computarizadas (TAC) de tórax de seguimiento. También se le había realizado una fibrobroncoscopia que no mostró malignidad ni bacterias causantes de estos infiltrados. Se habían determinado marcadores tumorales, que descartaban malignidad. Cuando llevaba 3 años sin presentar ninguna reagudización de la EPOC se le dio el alta desde consultas.
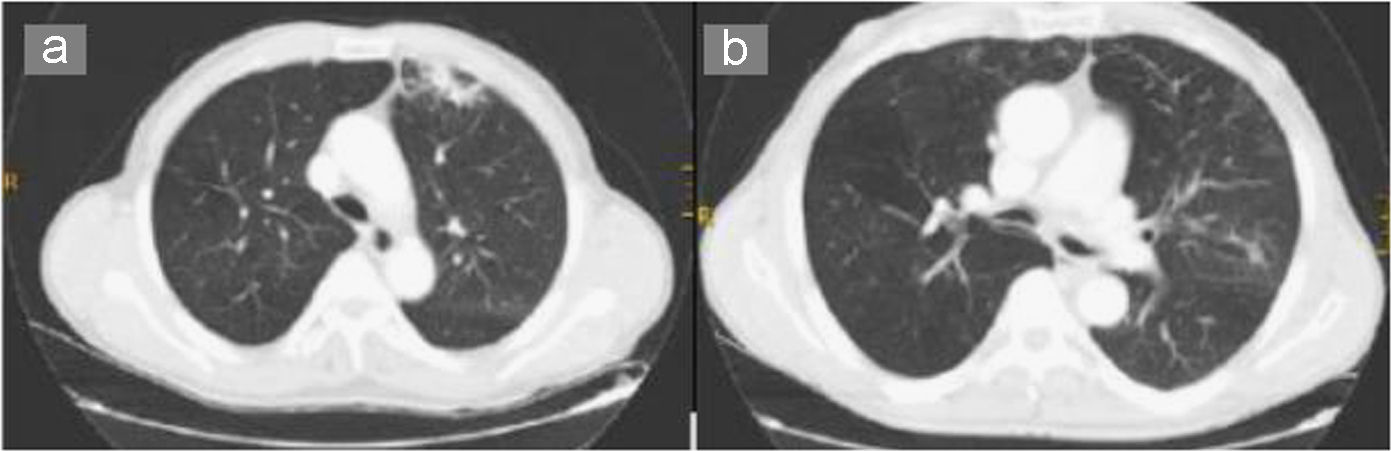
Al año el paciente fue remitido de nuevo por empeoramiento de la disnea hasta ser de reposo, acompañada de expectoración hemoptoica en 5 ocasiones durante el mes previo al ingreso y fiebre de 38°C. Las pruebas complementarias realizadas durante este ingreso fueron una analítica general, donde destacaban la cifra de leucocitos (15.600/dl), velocidad de sedimentación globular de 24mm/h, proteína C reactiva de 3,8mg/dl y presión arterial de oxígeno de 52,6mmHg. Se realizó una radiografía de tórax que mostró una condensación en el lóbulo inferior derecho. Los valores de la espirometría fueron los siguientes: volumen espiratorio forzado en el primer segundo del 32% y capacidad vital forzada del 45%. Se completó el estudio con una TAC torácica donde destacaban imágenes seudonodulares en el segmento anterior del lóbulo superior izquierdo y campo pulmonar medio derecho, así como agrupamiento de estructuras broncovasculares con atelectasias laminares y múltiples tractos fibrosos en ambas bases pulmonares (fig. 1a).
Tras estos hallazgos se decidió completar el estudio con una broncoscopia. En esta ocasión en las pruebas de microbiología se detectó un bacilo gramnegativo y difteromorfo, anaerobio en cultivo puro (pendiente de identificar). Tras el hallazgo se reexploró al paciente y se observó que la boca presentaba un aspecto séptico. Este hallazgo nos hizo replantear el tratamiento antibiótico, pues en los ingresos previos había consistido en lefloxacino, que se decidió sustituir por amoxicilina-ácido clavulánico. El paciente presentó una evolución satisfactoria con el cambio de antibiótico, por lo que se le dio el alta hospitalaria.
En consultas se recibió la identificación del germen como D. pneumosintes, por lo que se decidió prescribir amoxicilina-ácido clavulánico en ciclos de 10 días de tratamiento al inicio del mes, además de recomendar tratamiento a cargo de odontología. Tras 4 meses de seguimiento desaparecieron las lesiones en la TAC (fig. 1b). El paciente no ha presentado nuevos episodios.
D. pneumosintes es una bacteria pequeña gramnegativa, anaerobia estricta, no fermentadora, perteneciente a la flora habitual de la boca. Fue descrita por Olisky y Gates por primera vez como Bacterium pneumosintes tras su aislamiento en el exudado nasofaríngeo durante la epidemia de gripe de 1918–1921. Después de su clasificación filogenética, se ha reclasificó como D. pneumosintes. Es un microorganismo perteneciente a la flora habitual de la boca (sobre todo en la zona peridontal), la nasofaringe, el intestino y la vagina1.
Esta bacteria no crece en los medios de cultivos clásicos, por lo que precisa para su diagnóstico técnicas de amplificación genética, en concreto, una secuencia de nucleótidos ARN 16S2. Es de reseñar que en nuestro estudio se sospechó su presencia al crecer una colonia en un medio anaerobio estricto y, al no poder identificarla, se emplearon técnicas de ampliación genética, con lo que se consiguió el diagnóstico. Las infecciones típicas de esta bacteria son periodontitis, gingivitis y abscesos alveolodentales, generalmente en asociación con otras bacterias saprofitas3,4. Tras estas infecciones se describen casos aislados asociados a otras bacterias en infecciones respiratorias de pacientes con ventilación mecánica ingresados en unidades de cuidados intensivos5. Se han comunicado 2 casos de abscesos cerebrales en pacientes con infecciones óticas y nasales6. También se han descrito casos de infecciones vaginales e infecciones del líquido amniótico en mujeres con rotura temprana de la placenta7.
Respecto al tratamiento, han demostrado ser resistentes a macrólidos y fluoroquinolonas, presentan una resistencia intermedia al metronidazol, la rifampicina y la pristamicina, y son sensibles a betalactámicos, ya que no producen betalactamasas8.