En la mayoría de los ámbitos de la neumología se sigue utilizando un principio osleriano (basado en los síntomas y signos) en los que la enfermedad es el centro de toda actividad, pero este paradigma está cambiando. Actualmente, gracias al reconocimiento de la heterogeneidad y complejidad de las enfermedades pulmonares, la tendencia es a realizar una medicina más personalizada, de precisión, o centrada en el paciente. En la presente revisión se intentará establecer la situación actual sobre el conocimiento de las bronquiectasias, o mejor, del síndrome bronquiectásico, como una enfermedad multidimensional, sistémica, heterogénea y compleja, los pasos que ya se han dado en este sentido, y sobre todo, en los muchos que quedan por dar. Asimismo, se propondrán algunas herramientas que podrían facilitar la traslación de estos conceptos a la práctica clínica, y con ellos seguir avanzando hacia una imagen más holística de esta enfermedad.
Most areas of respiratory medicine continue to use an Oslerian approach, based on signs and symptoms, in which the disease is the center of all activity. However, this paradigm is changing. Now that lung diseases have been recognized as heterogeneous and complex, we are moving towards more personalized, precise, patient-oriented medicine. The aim of this review was to define the current state of the knowledge on bronchiectasis, or, more accurately, the bronchiectasis syndrome, as a multidimensional, systemic, heterogeneous, complex disease. We explore the advances that have already been made, and above all the many steps that are still to be taken. We also propose some tools which might facilitate the application of these concepts in clinical practice, and help us continue our journey towards a more holistic view of this disease.
Aún hoy en día, gran parte de la actividad asistencial en el diagnóstico y tratamiento de las enfermedades se basa en la antigua teoría osleriana centrada en los síntomas y signos de la enfermedad (síndrome), y en un número reducido de pruebas complementarias y pautas terapéuticas1. Sin embargo, los avances producidos en el conocimiento de las bases moleculares y las vías fisiopatológicas no dejan lugar a dudas de que las enfermedades son entidades muy complejas y que nuestra forma actual de enfocar su diagnóstico y tratamiento es enormemente reduccionista. Por otro lado, estas enfermedades no afectan al individuo de una forma única, sino que pueden aparecer de muy diversas formas dependiendo de las circunstancias particulares de cada sujeto, tanto propias como de su entorno, de todo lo cual la interacción entre la genética y el medio ambiente son los responsables últimos2. Además, pueden presentar cierto grado de asociación con otras enfermedades que aparecen en el mismo individuo, y cambiar con el tiempo de forma espontánea, o bien como consecuencia del tratamiento administrado. El control de todas estas características, aún no conseguido, será lo que probablemente más nos acerque a una verdadera medicina de precisión3 que trata, en última instancia, de personalizar el tratamiento dependiendo de las características de cada individuo.
Las enfermedades de las vías aéreas, y en particular las bronquiectasias, no son una excepción a esta regla2. En la presente revisión se tratará de abordar el conocimiento actual tanto de la complejidad como de la heterogeneidad de las bronquiectasias como paso previo hacia el desarrollo de herramientas que allanen el camino que lleve a una futura medicina de precisión en esta enfermedad.
Las bronquiectasias son una enfermedad heterogéneaLas bronquiectasias son una enfermedad heterogénea en muchos sentidos, entendiendo heterogeneidad como el hecho de que no todas las variables que definen la enfermedad aparecen en todos los individuos en un mismo momento2,4. Un aspecto clave para entender la heterogeneidad de las bronquiectasias parte de su propio origen, dado que lo que hoy se entiende por bronquiectasias no es sino el estadio final de la afectación pulmonar de más de un centenar de enfermedades, tanto locales como sistémicas5,6. Además, cada paciente puede presentarse con diferentes características clínicas, pronósticas, radiológicas e incluso de respuesta terapéutica, lo que hace que realmente cuando se habla del término «bronquiectasias» se esté hablando de un grupo amplio de enfermedades que se engloban bajo un misma terminología.
¿Cómo se intenta manejar la heterogeneidad en bronquiectasias?Concepto actual de bronquiectasiasUn primer elemento a tener en cuenta es que las bronquiectasias (que semiológicamente tan solo significa «dilatación bronquial») no son una enfermedad exclusivamente pulmonar, lo que hace que probablemente sea más correcto hablar de un «síndrome bronquiectásico»2. Por lo tanto, hoy se acepta que la dilatación bronquial existente en la tomografía computarizada de alta resolución (TCAR) debe acompañarse de una clínica compatible (habitualmente tos productiva crónica)7. De esta forma se intentan excluir de su definición las dilataciones bronquiales solo radiológicas, por tracción, o aquellas formas que aparecen en casi un 20% de los individuos sanos en edades avanzadas8,9. Por último, sigue existiendo controversia sobre cuál es el mejor criterio radiológico para el diagnóstico de las bronquiectasias. Los antiguos criterios de Naidich9 (basados sobre todo en un cociente broncoarterial >1) siguen siendo los más utilizados y los actualmente recomendados por las normativas SEPAR10. En este sentido, sin embargo, algunos autores han observado que en pacientes con otras enfermedades pulmonares (como la enfermedad pulmonar obstructiva crónica [EPOC]) pueden existir tanto incrementos del diámetro del vaso adyacente por hipertensión vascular como disminución de este calibre (más frecuente) por vasoconstricción hipóxica, lo que puede llevar al infradiagnóstico o supradiagnóstico de bronquiectasias, respectivamente, con la utilización de estos criterios11,12.
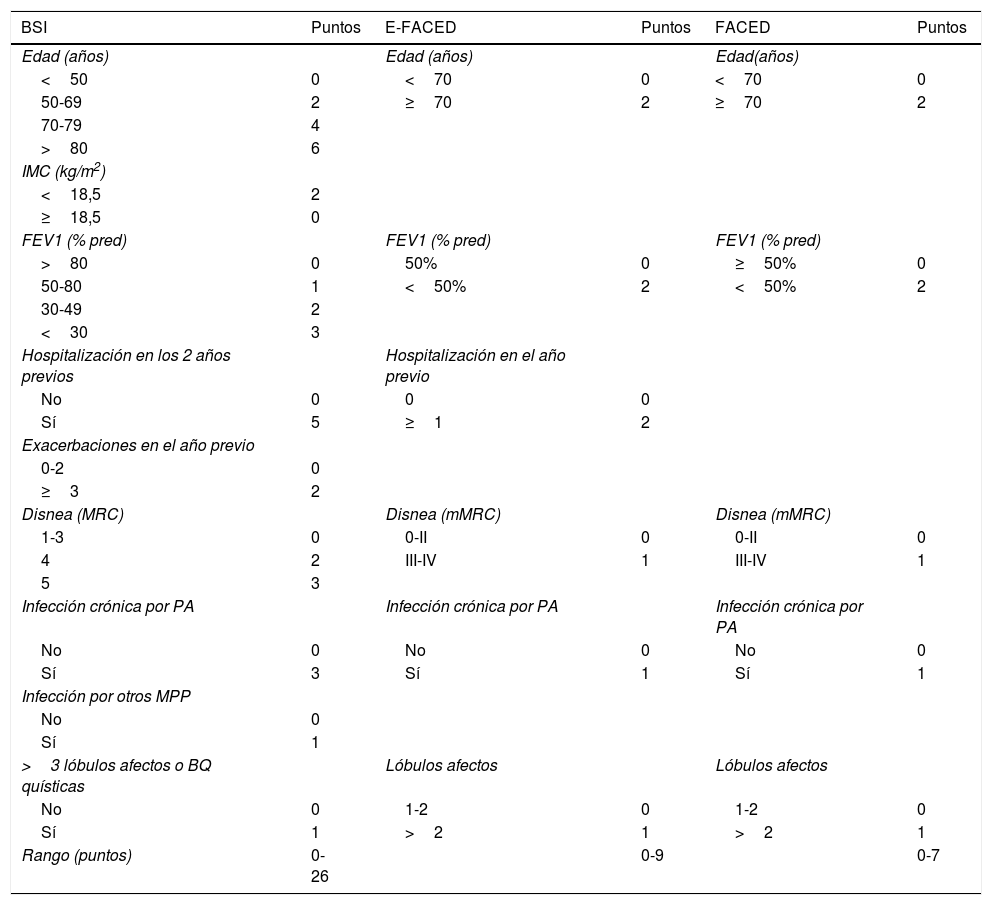
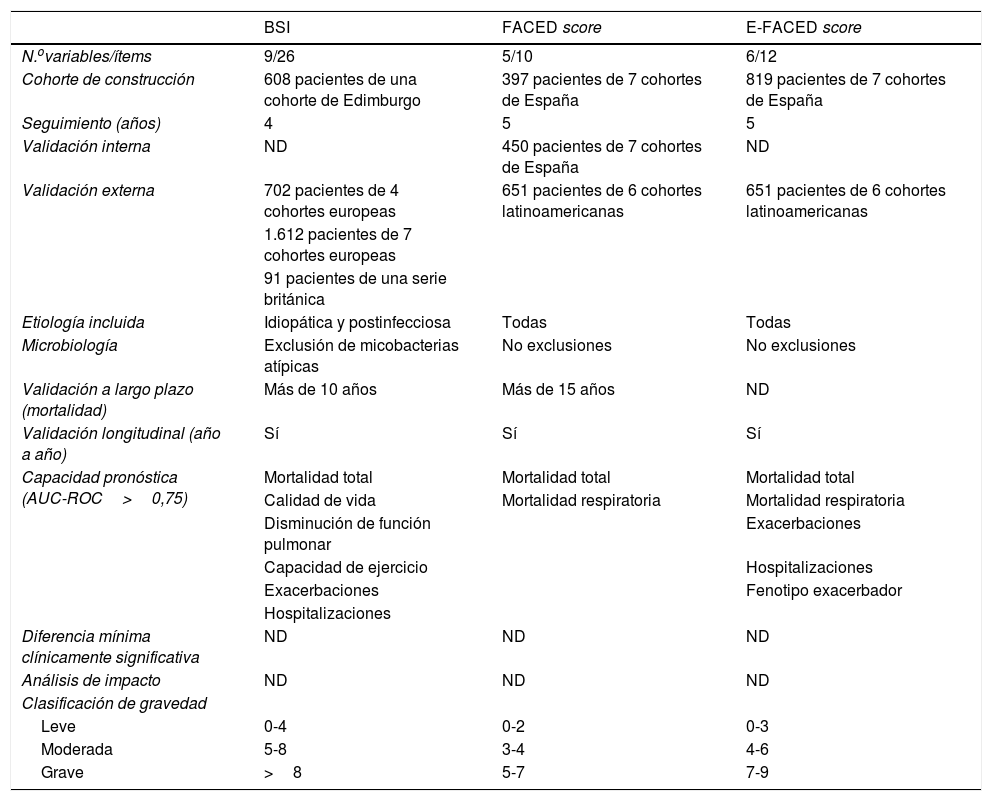
Puntuaciones multidimensionalesEn los últimos años se han ido desarrollando puntuaciones multidimensionales para valorar la gravedad de las bronquiectasias teniendo en cuenta de forma ponderada una serie de dimensiones importantes de la misma. En el caso de las bronquiectasias: clínica (disnea y exacerbaciones), función pulmonar, microbiología, aspectos radiológicos, edad y otras variables antropométricas. En la tabla 1 se observa la composición y significado de las 3 puntuaciones actualmente descritas y mejor validadas en la literatura: E-FACED13 —acrónimo en inglés de Exacerbaciones, FEV1, edad (Age), infección (Colonización) bronquial crónica por Pseudomonas aeruginosa, Extensión radiológica y Disnea—, FACED14 y Bronchiectasis Severity Index (BSI)15. El E-FACED, por su sencillez y su excelente validación interna y externa, es el recomendado por la actual normativa de la SEPAR para el manejo de las bronquiectasias10. Debido a las características de cada uno de las puntuaciones, es posible que su utilidad dependa de qué queremos evaluar exactamente y del entorno en el que se pretenda aplicar. En la tabla 2 se pueden ver las características comparativas de las 3 puntuaciones.
BSI, FACED y E-FACED. Variables y descripción de la cuantificación
| BSI | Puntos | E-FACED | Puntos | FACED | Puntos |
|---|---|---|---|---|---|
| Edad (años) | Edad (años) | Edad(años) | |||
| <50 | 0 | <70 | 0 | <70 | 0 |
| 50-69 | 2 | ≥70 | 2 | ≥70 | 2 |
| 70-79 | 4 | ||||
| >80 | 6 | ||||
| IMC (kg/m2) | |||||
| <18,5 | 2 | ||||
| ≥18,5 | 0 | ||||
| FEV1 (% pred) | FEV1 (% pred) | FEV1 (% pred) | |||
| >80 | 0 | 50% | 0 | ≥50% | 0 |
| 50-80 | 1 | <50% | 2 | <50% | 2 |
| 30-49 | 2 | ||||
| <30 | 3 | ||||
| Hospitalización en los 2 años previos | Hospitalización en el año previo | ||||
| No | 0 | 0 | 0 | ||
| Sí | 5 | ≥1 | 2 | ||
| Exacerbaciones en el año previo | |||||
| 0-2 | 0 | ||||
| ≥3 | 2 | ||||
| Disnea (MRC) | Disnea (mMRC) | Disnea (mMRC) | |||
| 1-3 | 0 | 0-II | 0 | 0-II | 0 |
| 4 | 2 | III-IV | 1 | III-IV | 1 |
| 5 | 3 | ||||
| Infección crónica por PA | Infección crónica por PA | Infección crónica por PA | |||
| No | 0 | No | 0 | No | 0 |
| Sí | 3 | Sí | 1 | Sí | 1 |
| Infección por otros MPP | |||||
| No | 0 | ||||
| Sí | 1 | ||||
| >3 lóbulos afectos o BQ quísticas | Lóbulos afectos | Lóbulos afectos | |||
| No | 0 | 1-2 | 0 | 1-2 | 0 |
| Sí | 1 | >2 | 1 | >2 | 1 |
| Rango (puntos) | 0-26 | 0-9 | 0-7 |
BQ: bronquiectasias; BSI: Bronchiectasis Severity Index; E-FACED: acrónimo de: Exacerbaciones, FEV1, edad (Age), infección (Colonización) bronquial crónica por Pseudomonas aeruginosa, Extensión radiológica y Disnea; IMC: índice de masa corporal; mMRC: Modified Medical Research Council; MPP: microorganismos potencialmente patógenos; PA: Pseudomonas aeruginosa.
Tabla comparativa de las características principales de los scores multidimensionales existentes
| BSI | FACED score | E-FACED score | |
|---|---|---|---|
| N.ovariables/ítems | 9/26 | 5/10 | 6/12 |
| Cohorte de construcción | 608 pacientes de una cohorte de Edimburgo | 397 pacientes de 7 cohortes de España | 819 pacientes de 7 cohortes de España |
| Seguimiento (años) | 4 | 5 | 5 |
| Validación interna | ND | 450 pacientes de 7 cohortes de España | ND |
| Validación externa | 702 pacientes de 4 cohortes europeas | 651 pacientes de 6 cohortes latinoamericanas | 651 pacientes de 6 cohortes latinoamericanas |
| 1.612 pacientes de 7 cohortes europeas | |||
| 91 pacientes de una serie británica | |||
| Etiología incluida | Idiopática y postinfecciosa | Todas | Todas |
| Microbiología | Exclusión de micobacterias atípicas | No exclusiones | No exclusiones |
| Validación a largo plazo (mortalidad) | Más de 10 años | Más de 15 años | ND |
| Validación longitudinal (año a año) | Sí | Sí | Sí |
| Capacidad pronóstica (AUC-ROC>0,75) | Mortalidad total | Mortalidad total | Mortalidad total |
| Calidad de vida | Mortalidad respiratoria | Mortalidad respiratoria | |
| Disminución de función pulmonar | Exacerbaciones | ||
| Capacidad de ejercicio | Hospitalizaciones | ||
| Exacerbaciones | Fenotipo exacerbador | ||
| Hospitalizaciones | |||
| Diferencia mínima clínicamente significativa | ND | ND | ND |
| Análisis de impacto | ND | ND | ND |
| Clasificación de gravedad | |||
| Leve | 0-4 | 0-2 | 0-3 |
| Moderada | 5-8 | 3-4 | 4-6 |
| Grave | >8 | 5-7 | 7-9 |
BSI: Bronchiectasis Severity Index; E-FACED: acrónimo de Exacerbaciones, FEV1, edad (Age), infección (Colonización) bronquial crónica por Pseudomonas aeruginosa, Extensión radiológica y Disnea; ND: no disponible.
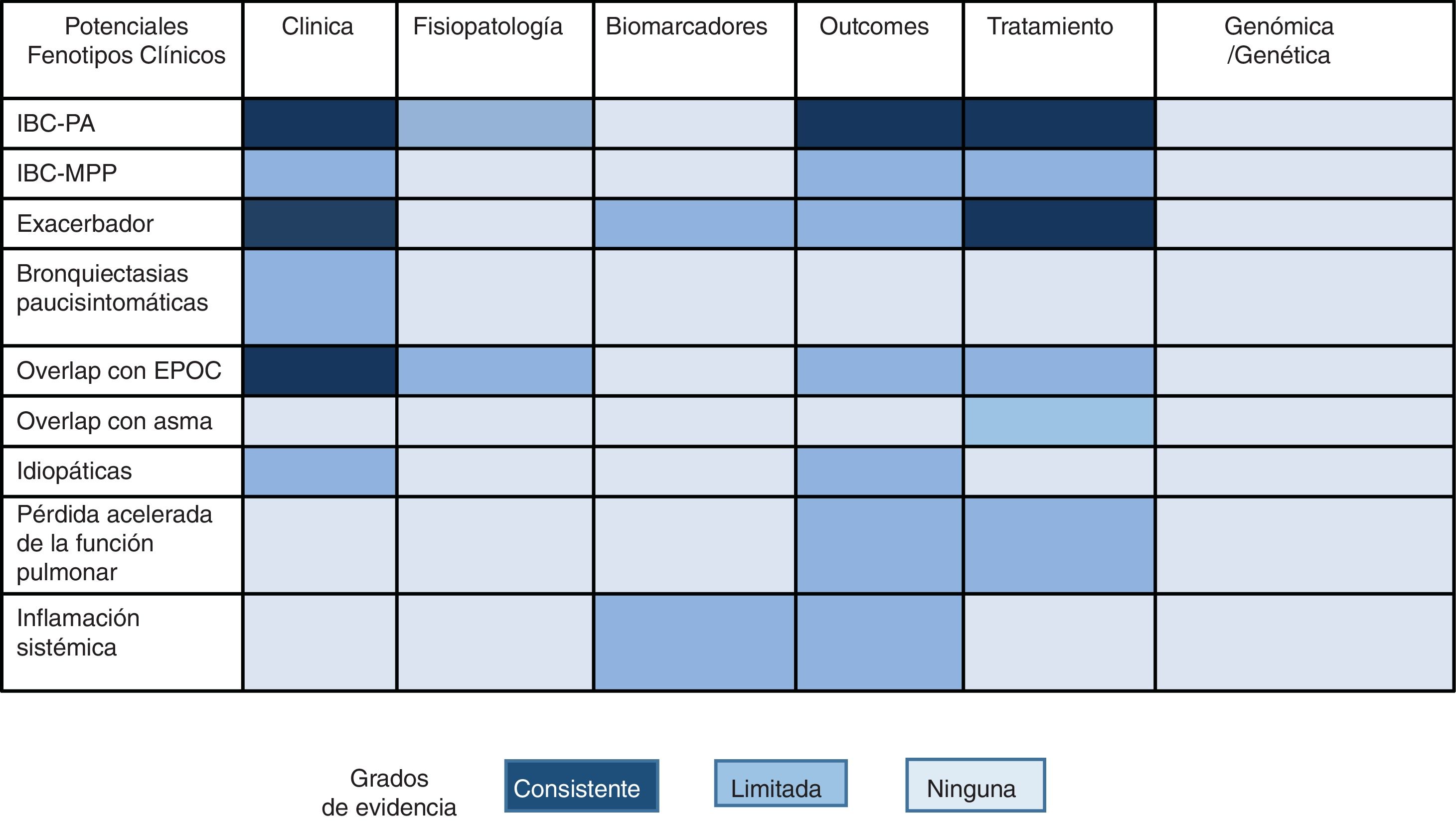
Algunos estudios han intentado agrupar a pacientes con características clínicas o pronósticas más homogéneas en un intento por ofrecerles un tratamiento y seguimiento más personalizado (medicina estratificada) llamados fenotipos clínicos. Dada la enorme heterogeneidad de las bronquiectasias, algunos estudios han conseguido este objetivo utilizando técnicas estadísticas adecuadas como la agrupación por clústeres. Aliberti et al.16 analizaron 1.145 pacientes de la cohorte europea de bronquiectasias y observaron 4 clústeres o grupos de pacientes con características similares y diferenciadas del resto de grupos: 1) pacientes con infección bronquial crónica por Pseudomonas aeruginosa (PA); 2) pacientes con infección bronquial crónica por otros microorganismos potencialmente patógenos (MPP); 3) pacientes con abundante expectoración, y 4) pacientes con escasos síntomas. Por su parte, Martinez-Garcia et al.17, utilizando una técnica metodológica semejante en 468 pacientes de diferentes cohortes españolas, observaron asimismo 4 clústeres bien diferenciados: 1) pacientes jóvenes con bronquiectasias clínicamente leves; 2) pacientes de edad avanzada con escasos síntomas; 3) pacientes de edad avanzada con exacerbaciones frecuentes, y 4) pacientes de edad avanzada con escasas exacerbaciones. Al igual que en el anterior estudio, estos grupos se diferenciaban entre sí en la gravedad de la enfermedad, etiología, presencia de infección bronquial crónica y mortalidad.
Sin embargo, es evidente que el «fenotipado» de los pacientes con bronquiectasias no es sino un paso intermedio hacia la verdadera comprensión de la heterogeneidad de la enfermedad, ya que todavía queda mucho por comprender sobre los mismos, como la existencia de otros fenotipos no identificados, la presencia de varios de estos fenotipos en un mismo paciente, su estabilidad en el tiempo, y sobre todo si responden a un mecanismo fisiopatológico (endotipo) particular y un tratamiento específico18.
Otros estudios se han centrado en el análisis de supuestos fenotipos clínicos específicos en los que se ha observado un comportamiento clínico, pronóstico o terapéutico diferente siguiendo la definición propuesta por Han et al.19. De ellos, quizá son 3 los que más evidencia clínica han alcanzado hasta el momento: el paciente con infección bronquial crónica por PA, el paciente overlap con EPOC y el fenotipo exacerbador.
Infección bronquial crónica por Pseudomonas aeruginosaNo cabe duda de que se trata del fenotipo mejor caracterizado. Diferentes estudios demuestran que la presencia de PA en las vías respiratorias de los pacientes, en especial en las formas de infección bronquial crónica sintomática, está relacionada con una mayor gravedad clínica, peor calidad de vida, un mayor número y gravedad de las agudizaciones, un peor pronóstico y un tratamiento específico20-25. Algunos aspectos clave quedan por esclarecer, como la historia natural del paciente con infección bronquial crónica por PA asintomático, o el endotipo que subyace a este fenotipo, dado que a día de hoy se desconoce si la infección por PA es la causa o la consecuencia de este peor pronóstico26. Por último, este tipo de pacientes son una diana idónea para la investigación de nuevos fármacos específicos27.
Síndrome overlap bronquiectasias-EPOCProbablemente, después del fenotipo anterior, este sea el mejor caracterizado. Su importancia epidemiológica es evidente dado que enlaza 2 enfermedades de enorme prevalencia28. Existen en la literatura más de una veintena de estudios que evidencian una prevalencia de bronquiectasias mayor de la esperada en pacientes con EPOC (especialmente graves)29. Estos pacientes presentan un mayor número y gravedad de exacerbaciones y gravedad clínica30. Más controvertido es el papel que juegan las bronquiectasias en el pronóstico de los pacientes con EPOC o la existencia de una relación de causalidad entre ambas entidades, si bien los datos hasta la fecha publicados apoyan el hecho de que existe plausibilidad biológica como para pensar que aquellos pacientes con EPOC e infección bronquial crónica por MPP pudieran generar bronquiectasias, y que estas empeoraran el pronóstico de los pacientes30. Por último, estos pacientes precisan de una terapia combinada de ambas patologías siguiendo las recomendaciones de las normativas correspondientes a cada una de ellas23-25,31,32. Quedan por dilucidar muchos otros aspectos, especialmente aquellos que hacen mención a una posible prevención en la aparición de bronquiectasias mediante el tratamiento precoz de la infección bronquial crónica del paciente con EPOC.
Exacerbador frecuenteLas exacerbaciones, especialmente las graves, han demostrado impactar en el pronóstico de los pacientes con bronquiectasias. Existe un grupo particular de pacientes que permanecen con un número elevado de exacerbaciones anuales a pesar del tratamiento administrado, si bien es un fenotipo poco estudiado. Estos individuos presentan unas características clínicas propias. Se desconoce cuál es el mejor punto de corte en el número de exacerbaciones para considerar este fenotipo. Destacan 2 estudios a tal respecto. Chalmers et al.33 observaron un peor pronóstico en aquellos pacientes con un mayor número de exacerbaciones y que este fenotipo permanecía estable con el tiempo, es decir, que el parámetro que mejor pronosticaba una futura exacerbación era el número y gravedad de las exacerbaciones pasadas. Por otro lado, en un reciente estudio prospectivo de Martinez-Garcia et al.34 se indica que, de entre todas las combinaciones posibles, aquella consistente en al menos 2 agudizaciones o una hospitalización por agudización anuales era la que se relacionaba con un peor pronóstico y que la puntuación E-FACED era capaz de pronosticar su aparición34. Siguiendo las normativas actuales, existen tratamientos más específicos para este tipo de pacientes, como los macrólidos, las formulaciones hipertónicas, o diferentes combinaciones de tratamientos antibióticos.
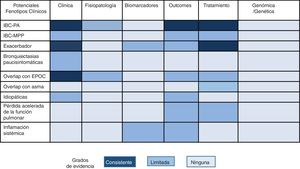
Otros posibles fenotipos muy poco estudiados pero candidatos a futuros estudios pueden ser las dry bronchiectasis (bronquiectasias paucisintomáticas), las bronquiectasias con inflamación sistémica, las formas idiopáticas, la infección bronquial crónica por microorganismos diferentes a PA o los «declinadores» rápidos de la función pulmonar35. Es importante destacar que la existencia de diferentes fenotipos no debe confundirse con la gravedad, actividad o impacto de la enfermedad sobre el paciente (cada fenotipo clínico puede tener un amplio rango de estos 3 aspectos, que serán abordados en el próximo punto).
En la figura 1 se pueden observar en una gradación de colores diferentes propuestas de posibles fenotipos clínicos (no confirmados) y la mayor o menor evidencia científica existente hasta el momento sobre los mismos (más evidencia a mayor intensidad de color).
Existen además otras variables que sin conformar estrictamente un fenotipo clínico sí son capaces de alterar la expresión fenotípica del paciente y que se podrían denominar variables modificadoras: edad, sexo, comorbilidades36,37 (obesidad, ansiedad/depresión, etc.), la etiología y el estatus socioeconómico.
Las bronquiectasias son una enfermedad complejaLa complejidad de una enfermedad viene determinada por las relaciones no lineales y dinámicas que existen entre las diferentes variables que la conforman38. La no linealidad se entiende como la falta de proporcionalidad en los cambios que se producen entre las mismas. Un ejemplo es la frecuente aparición en un paciente con bronquiectasias de una disociación clínico-funcional y radiológica39. Por lo tanto, la complejidad de una enfermedad es mucho más difícil de controlar que la propia heterogeneidad en su presentación, ya que finalmente su existencia depende de la interacción genómica (muy poco conocida en bronquiectasias) y de los múltiples factores ambientales a los que se expone el paciente. Sin embargo, es enormemente importante intentar aproximarse tanto como sea posible al conocimiento de esta complejidad ya que, a la postre, es la base de la verdadera medicina de precisión en bronquiectasias (y en cualquier otra enfermedad).
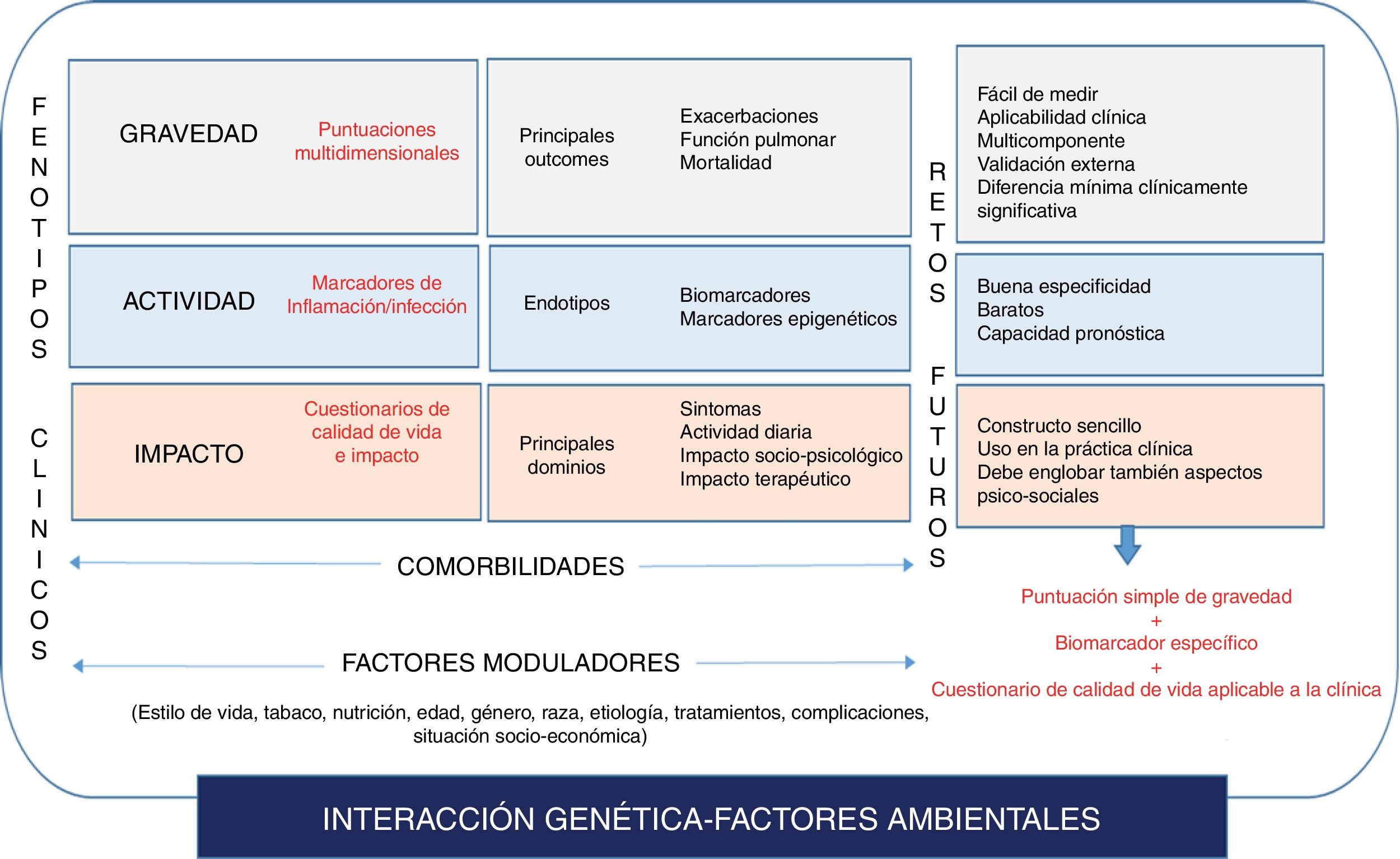
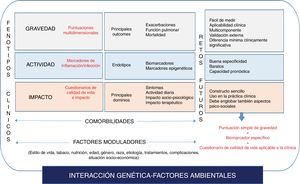
Una primera aproximación a la complejidad de las bronquiectasias sería identificar las principales dimensiones de la enfermedad, o aspectos que aportan información independiente de aquello que conocemos como «síndrome bronquiectásico»: su gravedad, su actividad (biológica) y su impacto sobre el paciente.
GravedadEsta dimensión estaría formada por aquellas variables (y su medición) asociadas al daño de la enfermedad sobre los órganos diana a los que afecta. En el caso de las bronquiectasias serían variables importantes a medir: la alteración de la función pulmonar (probablemente la medida del FEV1 sea la más aceptada como marcador de obstrucción al flujo aéreo)13-15, el daño estructural pulmonar (extensión en la TCAR)9, la etiología de la enfermedad40, o las posibles comorbilidades asociadas que pueden modificar la evolución de la enfermedad y de las cuales disponemos de herramientas para cuantificarlas, como el índice de Charlson41, o el índice BACI (Bronchiectasis Aetiology and Comorbidities Index)42.
ActividadEste parámetro hace referencia al nivel de activación biológica de la enfermedad en un momento determinado y que es independiente de su gravedad43,44. Por lo tanto, la «actividad» va a poder ser medida por un biomarcador (sea o no biológico) y va a tener una relación estrecha con el sustrato endotípico, que en el caso de las bronquiectasias se centraría en el binomio inflamación-infección45. Algunos marcadores de inflamación-infección son relativamente fáciles de obtener y se utilizan en la práctica diaria para medir la actividad de la enfermedad, como la purulencia (escala de Murray)46 y el volumen de esputo (valoración semicuantitativa). Otro aspecto que también puede marcar la actividad de la enfermedad es la propia inflamación sistémica que se ha asociado a un mayor grado de inflamación local y gravedad47; si bien no se ha determinado todavía un biomarcador específico y válido, quizá la proteína C reactiva48 o la elastasa neutrofílica49 puedan tener utilidad probada en el futuro. Finalmente, el número y gravedad de las exacerbaciones también podría considerarse como un parámetro de actividad de la enfermedad no controlada a pesar del tratamiento33,34. Por ello su registro es muy importante, y es posible que estos pacientes «agudizadores» conformen un fenotipo especial con unas peculiaridades pronósticas propias.
ImpactoEl impacto que la enfermedad causa sobre el individuo es un aspecto crucial, y la cuantificación del mismo también es independiente de la gravedad y la actividad biológica de la enfermedad. Los cuestionarios de calidad de vida, de tos o síntomas como la disnea o algunas alteraciones psiquiátricas como la ansiedad y depresión son fundamentales en este sentido. Para todas estas variables existen diferentes herramientas, algunas de las cuales son específicas para bronquiectasias, como los cuestionarios de calidad de vida Bronchiectasis Health Questionnaire50, QoL-B51,52, Leicester Cough Questionnaire53, o de forma genérica para valorar la ansiedad-depresión, como el Hospital Anxiety-Depression Scale (HADS)54, o la disnea (mediante la escala Medical Research Council [MRC])55. Un estudio demostró como el grado de ansiedad/depresión en bronquiectasias, aspecto muy poco estudiado56, no depende de la severidad de las mismas medidas por las clásicas puntuacionesmultidimensionales.
Por último, todo ello además puede verse modulado por factores modificadores como la edad, el sexo, el origen geográfico, la raza y otros factores ambientales, como las interacciones farmacológicas o el estilo de vida de los pacientes, lo que viene a añadir una mayor complejidad a la situación.
Bronquiectasias. Una visión holística de la enfermedadPor lo tanto, hasta donde el actual conocimiento y tecnología nos permiten, podría realizarse una doble propuesta para acercar los conceptos de heterogeneidad y complejidad (también terapéutica) de las bronquiectasias hacia una visión más holística de la enfermedad, más integradora en cuanto a su tratamiento y en definitiva más cercana hacia una verdadera medicina de precisión.
Por un lado, sería interesante centrar los esfuerzos en encontrar futuras herramientas de fácil uso que integraran en una única medición la gravedad, la actividad y el impacto sobre el paciente, lo que podría aportar un perfil mucho más adecuado del estado de la enfermedad en un momento dado, una especie de «huella dactilar» del estado de salud referido a las bronquiectasias de cada paciente. Esta herramienta podría ayudar al médico a decidir sobre qué parámetros debería actuar para intentar mejorar todos y cada uno de los aspectos de la enfermedad, y cómo estas dimensiones pueden cambiar con el tiempo con el tratamiento seleccionado. En este sentido, es de crucial importancia una mayor simplicidad y especificidad de las herramientas disponibles. Tres ejemplos serían: la simplificación máxima de las puntuaciones multidimensionales para valorar la gravedad de la enfermedad, la validación de cuestionarios específicos muy sencillos y aplicables en la práctica clínica (un buen ejemplo sería el COPD Assessment Test [CAT] en la EPOC57) y el hallazgo de biomarcadores específicos de bronquiectasias con capacidad pronóstica o de respuesta al tratamiento.
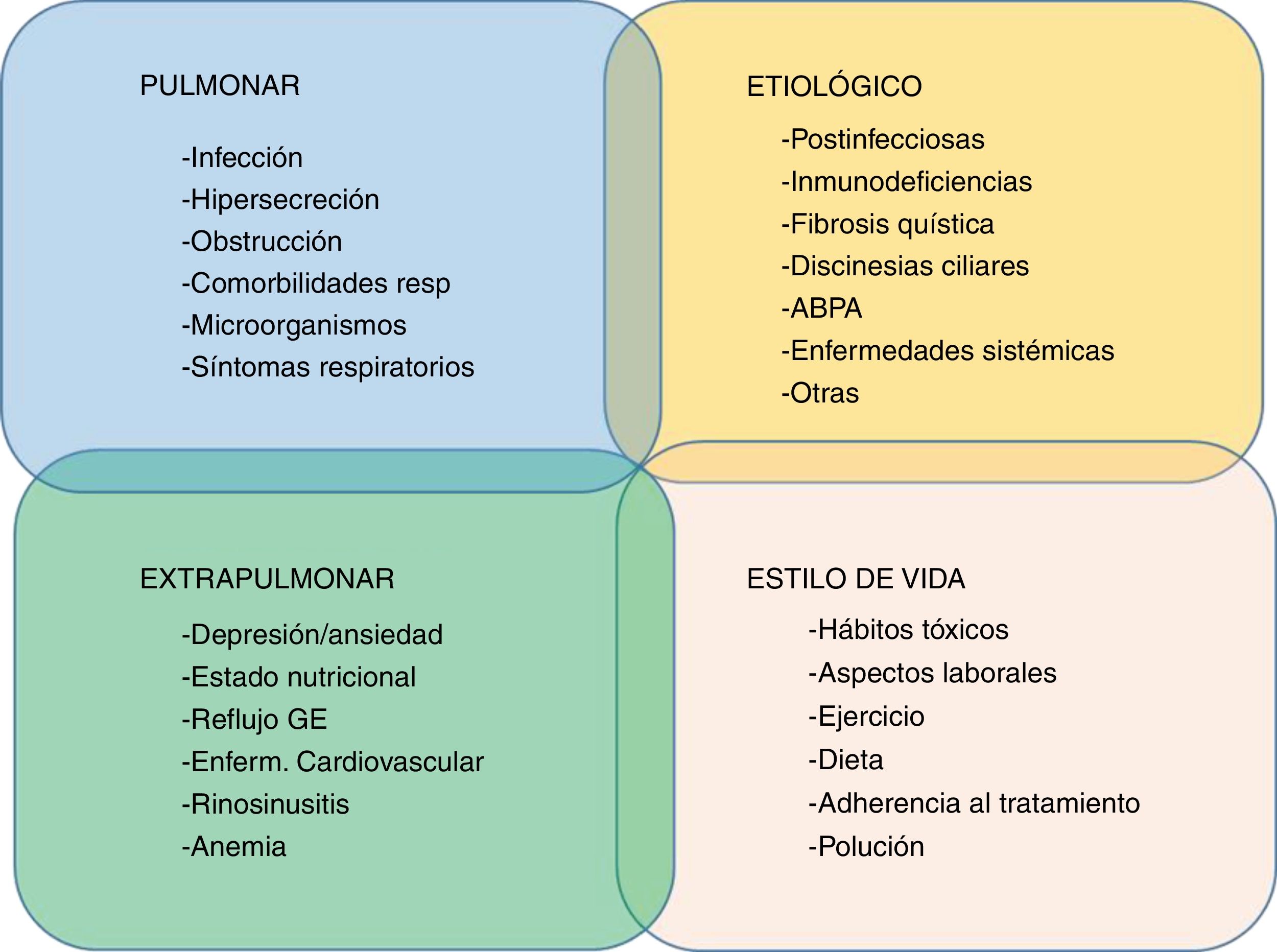
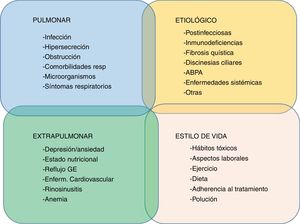
Por otro lado, una reciente propuesta, ya realizada en EPOC y recientemente reeditada en bronquiectasias, es el concepto de «rasgos tratables» (treatable traits)58. Este concepto se basa fundamentalmente en el tratamiento multidimensional de las bronquiectasias dependiendo del perfil específico del paciente, lo que nos acerca algo más a una medicina personalizada59. Una reciente publicación propone que existen 4 grupos de rasgos tratables en las bronquiectasias altamente relacionados entre sí: alteraciones pulmonares, extrapulmonares, estilos de vida y etiología60 (fig. 2).
ConclusiónA modo de resumen de la presente revisión, la figura 3 trata de ilustrar la heterogeneidad y la complejidad de las bronquiectasias (o mejor, como ya ha sido comentado, del «síndrome bronquiectásico») y la posición de los diferentes puntos clave (fenotipos clínicos, endotipos, gravedad-actividad-impacto de la enfermedad, rasgos tratables, etc.) dentro del esquema que conduciría al reconocimiento de la enfermedad de una forma más holística y más dirigida hacia la identificación de patrones homogéneos que llevaran hacia una medicina de precisión. La necesidad de entender esta enfermedad bajo este punto de vista, y de emprender el camino hacia su comprensión, supone una amplia investigación de biomarcadores, comprensión de mecanismos fisiopatológicos, de manejo de las ingentes cantidades de información (big data y biología de sistemas) y del abaratamiento de costes para hacer factible su implementación en la práctica clínica. Este siglo es el siglo de la complejidad y de la medicina de precisión, «un paciente, un tratamiento, un momento determinado».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.