Concepto de disnea
La disnea se define como la sensación subjetiva de falta de aire o dificultad para respirar. Engloba múltiples sensaciones, cualitativa y cuantitativamente diferentes, que explican la heterogeneidad con la que puede expresarse este síntoma, que se puede presentar en otras enfermedades no respiratorias y en personas sanas. En la enfermedad pulmonar obstructiva crónica (EPOC), generalmente, se presenta en estadios avanzados, cuando hay un daño pulmonar importante. Su presencia con el esfuerzo suele ser el primer síntoma por el cual consultan los pacientes. La disnea en la EPOC, a diferencia de otras enfermedades prevalentes de la vía aérea, como el asma, es progresiva y es el síntoma más relevante por su naturaleza invalidante, que condiciona la calidad de vida de los pacientes1-3.
Puede ser percibida de forma desigual por pacientes con igual grado de obstrucción. Tiene mejor correlación con la hiperinsuflación pulmonar dinámica o con las pruebas de ejercicio4. Esta discordancia con algunos parámetros funcionales se explica porque en su génesis coexisten factores fisiológicos, sociales, ambientales y psicológicos. Este último aspecto es más evidente en fases de mayor gravedad de la EPOC, donde son más prevalentes los trastornos de ansiedad y depresión que llevan a importantes oscilaciones en la valoración de la disnea2,3,5. No obstante, la disnea es un parámetro fácil de medir, con una mayor flexibilidad de respuesta terapéutica que otros parámetros fisiológicos clásicamente empleados6,7. Además, su control o mejoría puede condicionar el cumplimiento del tratamiento farmacológico y/o el planteamiento de otras opciones terapéuticas como la rehabilitación pulmonar8.
La disnea es claramente una dimensión independiente y un pilar fundamental en la valoración y manejo global de nuestros pacientes con EPOC, como bien expresan los consensos y guías actuales, que durante años se han centrado excesivamente en el volumen espiratorio forzado en el primer segundo (FEV1) y en la presión arterial de oxígeno3,9-12. Esta situación es similar a lo que ocurre en el síndrome de apneas-hipopneas obstructivas del sueño, donde la hipersomnia y no sólo el índice de apneas-hipopneas condicionan el manejo de la enfermedad.
Mecanismos fisiopatológicos de la disnea
Existe poca información sobre los receptores exactos que median en la disnea. Se sabe que desde las vías aferentes se envían señales que son procesadas en el córtex cerebral, pero no existe un área cerebral cuya excitación sea capaz de evocar la sensación de disnea. Lo que sí parece claro es que la mayoría de situaciones que producen disnea lo hacen a través de más de un mecanismo. A su vez, las diferentes situaciones fisiopatológicas capaces de ocasionar disnea dan lugar también a distintas sensaciones de molestias respiratorias.
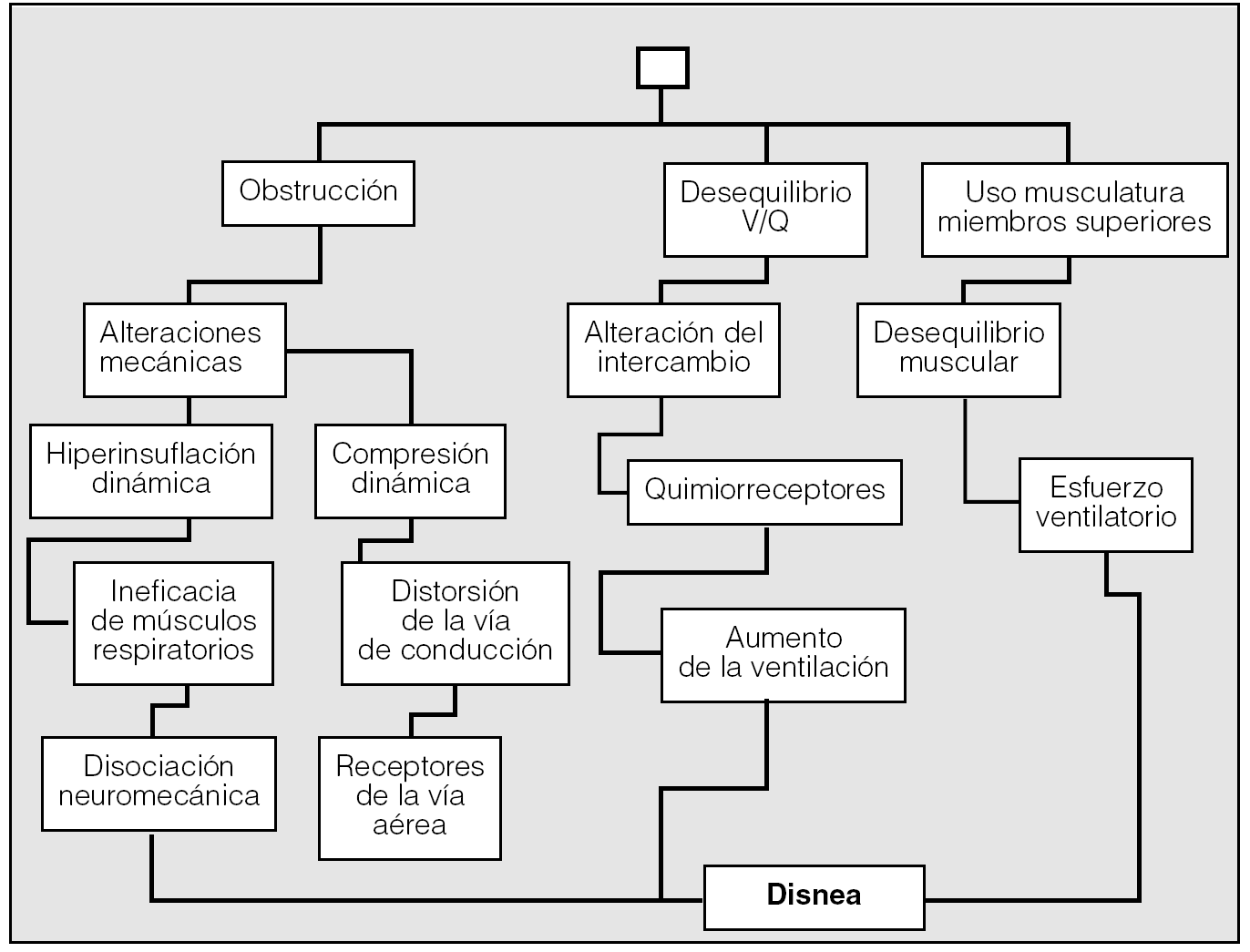
Desde una visión general podemos destacar varios factores determinantes de la disnea (fig. 1)13: a) desequilibrios de la ventilación-perfusión; b) limitación al flujo aéreo; c) receptores pulmonares, torácicos, quimiorreceptores; d) utilización de la musculatura accesoria de las extremidades superiores, y e) factores psicológicos.
Fig. 1. Esquema de los posibles mecanismos fisiopatológicos involucrados en la disnea de la EPOC. (Modificada de Perpiñá y Martínez13.)
En etapas avanzadas de la enfermedad se producen alteraciones importantes en la relación ventilación-perfusión que producen hipoxemia, hipercapnia y un aumento de la ventilación minuto14,15. El incremento de la ventilación durante el ejercicio es mayor que en personas sanas que realicen el mismo ejercicio y se produce a expensas de la frecuencia respiratoria y, en menor grado, por aumento del volumen corriente. También se evidencia un aumento del espacio muerto, por lo que igualmente se precisa incrementar la ventilación minuto con el fin de mantener una ventilación alveolar normal.
En la EPOC, debido a la inflamación, edema, hipersecreción mucosa y disminución de la retracción elástica, se produce limitación al flujo aéreo. Este hecho conduce a una imposibilidad para eliminar todo el aire durante la espiración, por lo que queda retenido, lo que provoca un aumento de la capacidad funcional residual. Este incremento del volumen pulmonar estático se denomina hiperinsuflación pulmonar estática. Esto condiciona una disposición anómala de los músculos respiratorios para contraerse eficazmente, por lo que consumen más energía y se fatigan antes, lo que genera disnea16. Durante el ejercicio disminuye el tiempo espiratorio, por el aumento de la frecuencia respiratoria, y esto lleva a un incremento del atrapamiento aéreo y de la capacidad residual funcional, definido como hiperinsuflación pulmonar dinámica. Esto se puede observar en pruebas de esfuerzo máximo y submáximo como el test de la marcha de 6 min17. El efecto principal de los broncodilatadores sobre la disnea es precisamente a través de la disminución de la hiperinsuflación dinámica con independencia de los cambios en el FEV1, que suelen ser discretos. Por ello, cuando se valora el efecto de los broncodilatadores se debe tener en cuenta el FEV1, pero también la capacidad funcional residual y la capacidad inspiratoria18,19.
Otro factor a destacar es la compresión dinámica que aparece cuando la presión en el interior de la vía aérea es menor que la presión transpulmonar durante una espiración. Durante el reposo y a esfuerzos submáximos puede existir un grado mínimo de compresión, pero en situaciones de mayor esfuerzo este fenómeno puede ser lo suficientemente intenso para producir disnea a través de un mecanismo de distorsión simple de las vías respiratorias durante la espiración que actuaría estimulando los mecanorreceptores4.
La debilidad muscular favorece la fatiga muscular, que induce a su vez sensación de disnea. Esto queda bien reflejado en la debilidad de los músculos respiratorios y de los miembros superiores. Estos músculos tienen inserciones, tanto en la caja torácica como en la cintura escapulohumeral, y ejercen funciones respiratorias o posturales dependiendo del punto de fijación20.
Las alteraciones mecánicas y nutricionales de la musculatura respiratoria condicionan un exceso de esfuerzo muscular para realizar una inspiración, expresado por la fracción presión inspiratoria/presión inspiratoria máxima, la cual se relaciona con la intensidad de la disnea para cada nivel de ventilación durante el esfuerzo21.
Otros factores, como los psicológicos, también influyen en la percepción de disnea. La presencia de ansiedad, depresión, el estado emocional y los rasgos de la personalidad pueden ser determinantes en la aparición de disnea. Su control a través de diversas psicoterapias ha conseguido mejorar la disnea en pacientes con EPOC22.
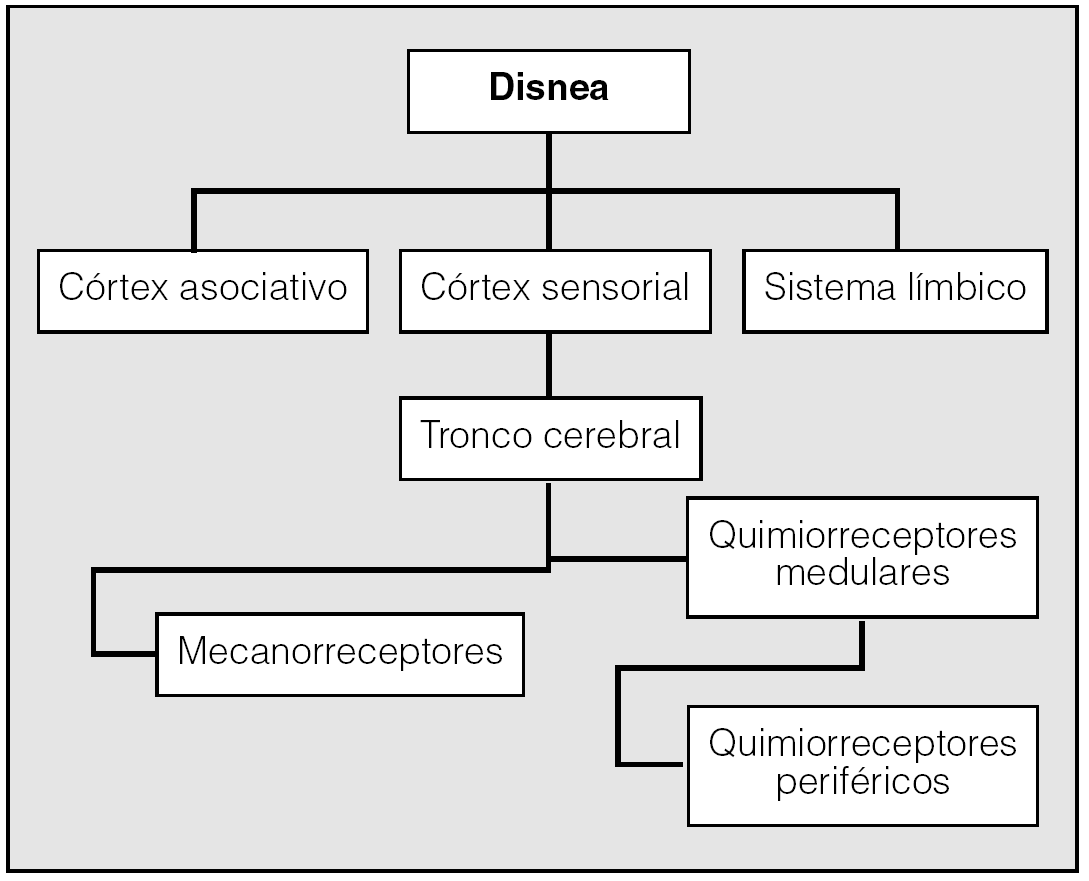
Los centros superiores descargan información que llega a los músculos ventilatorios, que expanden la caja torácica y permiten la ventilación. Pero esta respuesta se ve influida o modificada por información aferente de quimiorreceptores periféricos carotídeos y centrales medulares y de mecanorreceptores bronquiales, pulmonares y de la pared torácica (fig. 2). Independientemente de la causa de la disnea, la intensidad de la orden motora central para activar los músculos respiratorios está íntimamente relacionada con la sensación de la misma. La medida del esfuerzo ventilatorio es una forma de cuantificar la disnea. Los músculos respiratorios son los únicos músculos esqueléticos que son regulados por un control automático, desde el tronco del encéfalo, y voluntario, desde el córtex5. Las descargas enviadas a la corteza cerebral se procesan, y traducen, en sensación de esfuerzo ventilatorio. Este esfuerzo dependerá también del tipo de control establecido, voluntario o automático, y de los músculos implicados. La sensación de esfuerzo y de disnea es mayor cuando se activan los músculos accesorios.
Fig. 2. Fisiología del control de la respiración. (Modificada de Perpiñá y Martínez13.)
La teoría de la disociación neuromecánica propone que la disnea es también consecuencia de un desequilibrio entre la tensión generada en la activación muscular y los cambios obtenidos en el volumen pulmonar23,24. Es decir, la disnea está modulada por mecanismos de retroalimentación desde mecanorreceptores periféricos. Cuando se produce un desacoplamiento entre la orden motora y la información de receptores pulmonares, se genera disnea. Los impulsos aferentes, desde receptores vagales de las vías aéreas y pulmón, también intervienen en el nivel y patrón respiratorio. Los músculos respiratorios están también inervados por una gran variedad de receptores sensoriales que parten, desde los músculos intercostales y el diafragma, hacia controles superiores y ejercen, además, un efecto inhibitorio sobre la respuesta central25-27.
La disnea asociada a hipercapnia e hipoxia demuestra el papel que tienen los quimiorreceptores en la percepción del esfuerzo respiratorio28. La hipoxemia provoca estimulación de quimiorreceptores que conducen a percepción de disnea, si bien el grado de ésta puede no corresponderse con la gravedad de aquélla. El aporte de oxígeno se acompaña de una disminución de la disnea incluso sin cambios en la ventilación.
En pacientes con EPOC, en quienes hay hiperinflación, se produce una disminución de la fuerza de los músculos inspiratorios. Esta disfunción mecánica contribuye de forma importante a la sensación de disnea. La mejoría de la disnea después de la cirugía de reducción de volumen puede explicarse, en parte, por los cambios en la forma y el tamaño de la caja torácica. Cambios en el patrón respiratorio, como en la respiración con los labios fruncidos, pueden reducir la sensación de disnea al aumentar el tiempo espiratorio y disminuir la frecuencia respiratoria.
La consecuencia de sentir disnea es evitar las situaciones que la desencadenan. El resultado, a largo plazo, será el desentrenamiento de los músculos periféricos, que a su vez aumentará la disnea, con lo que se cerrará un peligroso círculo vicioso. La pérdida de actividad progresiva y la disnea de esfuerzo constituyen los principales factores que limitan la actividad física29-31. Además de las alteraciones neurorrespiratorias, la disfunción cardíaca, frecuentemente asociada a la EPOC, y la hipertensión pulmonar son otras causas desencadenantes de la disnea.
Medición de la disnea
La importancia de la cuantificación de la disnea ha crecido de forma paralela al protagonismo que ha alcanzado en la EPOC. Existen varios instrumentos de medida y valoración de la disnea. Pueden ser unidimensionales o multidimensionales y valoran la disnea tras pruebas de ejercicio de diferente intensidad o durante la actividad diaria habitual de los pacientes (tabla I). Su graduación se puede expresar de forma nominal, ordinal, intervalo y como un índice o cociente. Para su consistencia, estas escalas deben tener capacidad discriminativa (diferenciar a pacientes con mayor o menor grado de disnea) y evaluativa (apreciar pequeños cambios que puedan correlacionarse con modificaciones en otras variables)32. Por su sencillez, fiabilidad y haber demostrado predecir la calidad de vida y la supervivencia, se recomienda su cuantificación mediante la escala modificada del Medical Research Council (MRC)2,3,33.
A pesar de los avances que ha supuesto la utilización de las escalas de disnea, éstas pueden perder precisión en pacientes de edad avanzada (es posible que la graduación de las escalas necesite modificarse por encima de los 70 años), o cuando existen importantes factores de comorbilidad como la obesidad, la enfermedad degenerativa articular, el síndrome de ansiedad-depresión, etc. En estas situaciones a veces es necesario medir la disnea tras un ejercicio específico para tener una interpretación más real de la cuantía y el tipo de limitación del paciente.
A continuación, describiremos las diferentes escalas o cuestionarios específicos que habitualmente empleamos para valorar la disnea en los pacientes con EPOC.
Escala modificada del MRC
Esta escala, inicialmente propuesta por la sociedad británica a comienzos de la década de los sesenta34,35, contemplaba 5 rangos, desde el 1 al 5, donde la puntuación más alta expresa una mayor limitación funcional. Con la misma interpretación pero variando la graduación de 0 hasta 4 se emplea con mayor frecuencia en la actualidad (tabla II). Es de fácil administración a los pacientes, lo que sin duda ha permitido su introducción en el manejo de una enfermedad de elevada prevalencia como la EPOC. No obstante, su simplicidad, derivada de su unidimensionalidad, y corta graduación comportan cierta rigidez temporal, de modo que resulta difícil obtener cambios tras una intervención terapéutica. Aunque está descrita para expresar la actividad diaria, muestra muy buena correlación con la prueba de la marcha de 6 min, como hemos podido objetivar en un estudio multicéntrico reciente realizado por nuestro grupo sobre una cohorte muy amplia de pacientes, en los que la disnea en la escala modificada del MRC alcanzó una correlación de 0,73, claramente superior al resto de los parámetros fisiológicos pulmonares36.
Escala de Borg
Tiene una graduación de 0 a 10, donde el 0 representa la ausencia de disnea y el 10 es la máxima disnea. Hay niveles intermedios entre las unidades y cada unidad no representa su cuantificación real, de tal forma que la puntuación 2 no es el doble de la puntuación 1 y, por tanto, no se puede considerar que esta escala sea cuantitativa37. Es de gran utilidad durante las pruebas de esfuerzo, donde ha demostrado una buena correlación con el consumo de oxígeno. En la actualidad se recomienda su uso en la realización de la prueba de la marcha de 6 min38.
Se ha descrito una versión modificada, que puntúa el 10 como disnea casi máxima y deja abierta la posibilidad de una puntuación superior (disnea máxima) para obtener una mejor diferencia respecto a una basal muy alta y evitar el "efecto techo"39.
Escala visual analógica
Se configura a través de una línea recta de 100 mm. Un extremo (izquierdo o inferior) expresa la ausencia de disnea y el otro, la disnea máxima. El paciente señala, o cruza con una línea, el punto en el que cree encontrarse en ese momento40. Estas medidas son habitualmente difíciles de obtener en pacientes con bajo nivel cultural, lo cual no es infrecuente en nuestros pacientes con EPOC. Además, existe una gran variabilidad entre pacientes en la graduación de esta escala, lo que dificulta la comparación de resultados41. La escala visual analógica se utiliza en las pruebas de esfuerzo tanto para expresar la disnea de origen cardiorrespiratorio como para valorar la sensación de fatiga de las extremidades inferiores. La variación de 20 mm se suele considerar significativa.
Diagrama de coste de oxígeno
Consiste en una línea vertical de 100 mm, similar a una escala visual analógica, con un listado de 13 actividades cotidianas distribuidas según el coste de oxígeno, de mayor a menor y desde arriba hasta abajo. El individuo debe señalar con un punto el límite por encima del cual estima que su disnea no le permite actuar de forma satisfactoria, y la puntuación del diagrama de coste de oxígeno se obtiene midiendo la distancia desde la base o límite más inferior hasta este umbral indicado. Esta escala es de uso muy reducido en la actualidad42.
Índice de disnea basal de Mahler (BDI)
A diferencia de las escalas unidimensionales previamente descritas, que sólo indican la magnitud de la tarea capaz de provocar disnea, introduce 2 nuevos aspectos como son la cuantía del esfuerzo asociado y la alteración funcional que comporta. Cada uno de ellos se valora desde 0 (intensa) hasta 4 (nula) y la suma total ofrece una puntuación que oscila entre 0 y 12; cuanto menor es la puntuación, mayor es la gravedad de la disnea. Permite recoger también la posibilidad de respuesta no cuantificable, ya sea por información incierta, desconocida o debida a comorbilidad. Variaciones de 1 punto en esta escala, generalmente, se consideran significativas43.
Índice de cambio de disnea o de disnea transicional
Es una escala complementaria a la anterior y, partiendo de una misma estructura, evalúa los cambios en el tiempo de la BDI. Éstos se cuantifican entre 3 y +3. La suma resultante aporta una puntuación global que oscila entre 9 (gran deterioro de la disnea) a +9 (gran mejoría de la disnea), siendo 0 indicativo de ausencia de cambio. Una variación de la puntuación en una unidad se considera clínicamente significativa. Esta escala y la BDI, aunque poseen validez, reproducibilidad y no son de difícil aplicación, consumen más tiempo que la modificada de la MRC y son más utilizadas en programas de rehabilitación pulmonar o en proyectos de investigación que en la práctica clínica habitual43.
Cuestionario de respiración entrecortada (Shortness of Breath Questionnaire, SOBQ)
Este cuestionario, diseñado por Archibald y Guidotti de la Universidad de San Diego, California, consta de 24 ítems que valoran la disnea en diversas situaciones de la vida diaria durante la semana previa. Cada una de las preguntas se puntúa de 0 a 5, y este último valor expresa la máxima intensidad de disnea44,45. Este cuestionario se empleó en el primer estudio prospectivo y controlado a largo plazo sobre rehabilitación pulmonar en la EPOC8.
Cuestionario de enfermedad respiratoria crónica (CRQ)
Se pide al paciente que, bien espontáneamente o tras la lectura de un listado de 27 situaciones, indique el grado de disnea para las 5 actividades más importantes de su vida diaria en las últimas 2 semanas. La disnea es una de las 5 dimensiones que posee este cuestionario. Cada una de ellas tiene 7 grados46.
Cuestionario de disnea de Lareau
Categoriza de 0 (sin disnea) a 10 (disnea máxima) la intensidad de disnea que provocan 79 actividades47. Se utiliza en los programas de rehabilitación pulmonar.
Expresión diferencial de la disnea por sexo
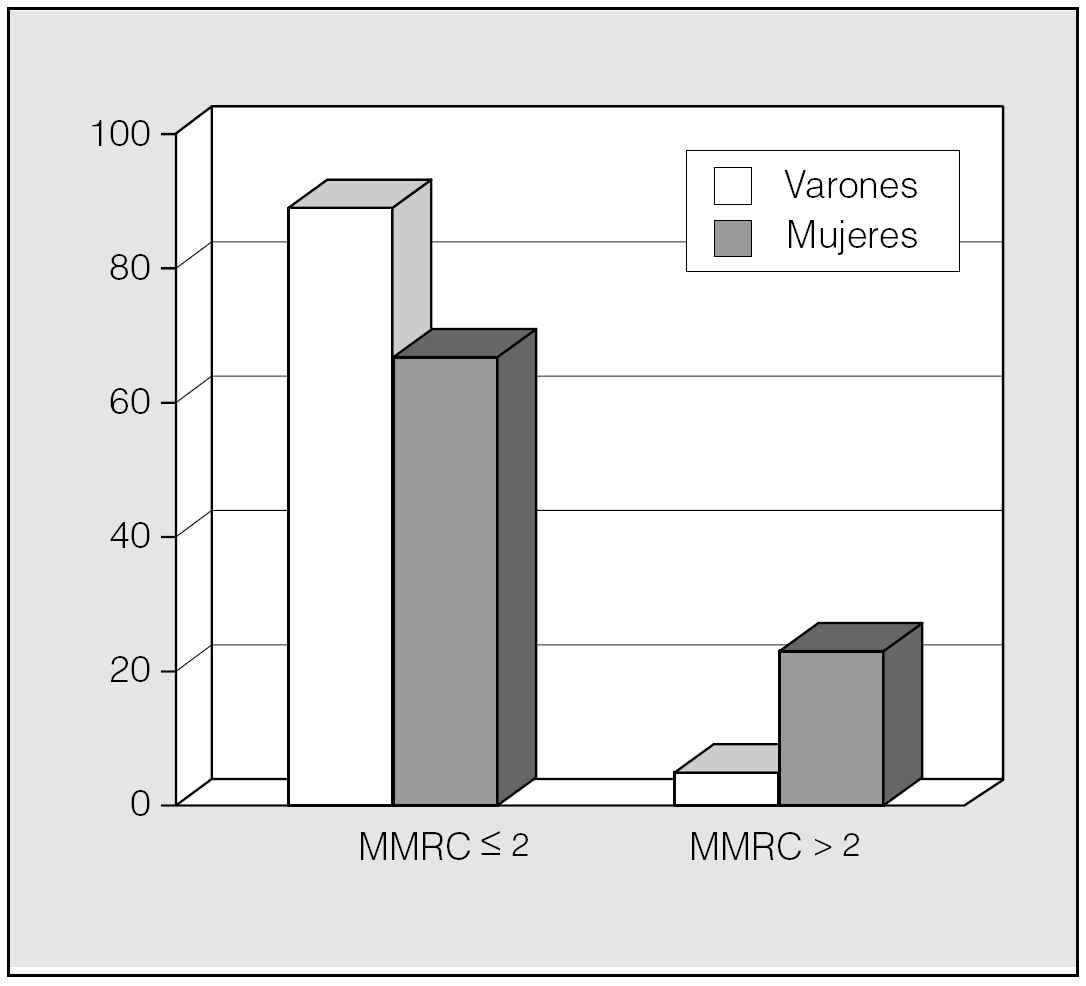
Un aspecto novedoso e interesante de la disnea en los pacientes con EPOC es que ya existe la información suficiente para afirmar que ésta tiene una expresión diferencial por sexo. Nuestro grupo investigó a una cohorte de pacientes con EPOC (55 varones y 55 mujeres), pareados por su mismo valor porcentual de FEV1, y encontró que para el mismo grado de obstrucción bronquial era mayor el porcentaje de mujeres que expresaban disnea mayor de 2 puntos en la escala modificada del MRC (fig. 3) y que ésta se manifestaba de manera más temprana. Este hallazgo forma parte de un estudio que apuntaba a que la expresión clínica de la enfermedad es diferente en varones y mujeres48. Nuestro trabajo confirma estudios previos que observaron también que para el mismo grado de obstrucción bronquial las mujeres expresaban más disnea49,50.
Fig. 3. Porcentaje de pacientes con puntuación de 2 o menos y mayor de 2 en la escala de disnea modificada del Medical Research Council (MMRC) divididos por sexo. El porcentaje de mujeres con MMRC superior a 2 es mayor que el de varones para el mismo grado de obstrucción bronquial.
Los mecanismos por lo cuales las mujeres manifiestan más disnea están aún por esclarecer. Sin embargo, es probable que en ellas los dominios perceptivos y sistémicos de la enfermedad tengan una mayor repercusión. Asimismo, pensamos que factores socioculturales o psicológicos podrían tener un papel preponderante en la expresión de la disnea en las mujeres con EPOC. No obstante, hay que destacar que, a pesar de que las mujeres con EPOC manifiestan más disnea y consultan por dicha causa con mayor frecuencia, los médicos se plantean el diagnóstico de EPOC en menor medida que ante los varones51.
Tratamiento de la disnea en los pacientes con EPOC
La disnea es el síntoma más frecuente y, a veces, el único síntoma de los pacientes con EPOC. Por lo tanto, su tratamiento es fundamental para el correcto seguimiento de estos pacientes. Por fortuna, a lo largo de los últimos 15 años se han demostrado numerosas maneras de tratar eficazmente la disnea en los pacientes con EPOC, lo que ha cambiado la perspectiva negativa que se tenía de esta enfermedad y su tratamiento52. La mejoría de la disnea optimiza la calidad de vida de dichos pacientes y tiene una gran importancia sociosanitaria, ya que predice el uso de recursos sanitarios53.
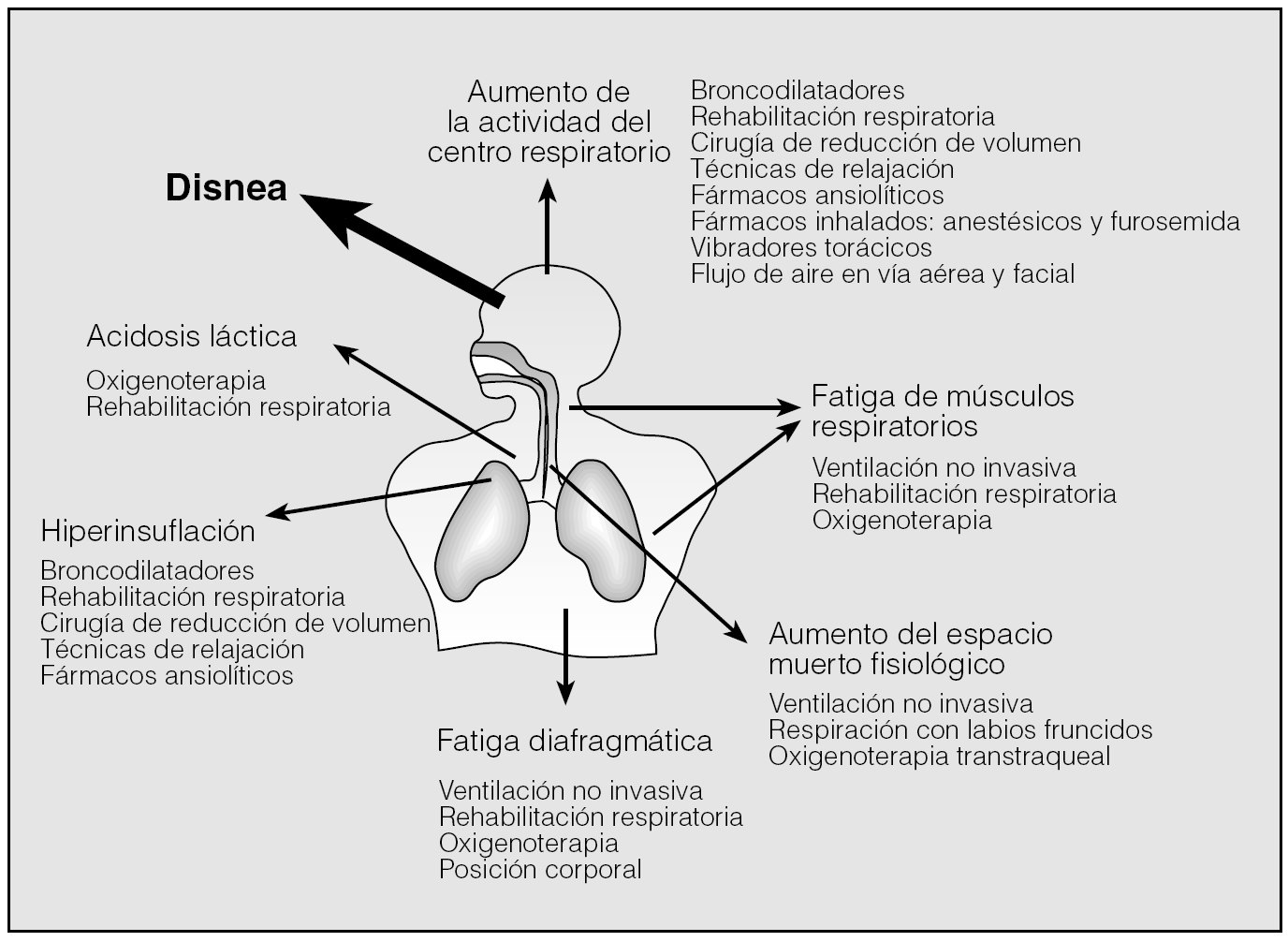
El tratamiento de la disnea se basa, fundamentalmente, en el tratamiento de los mecanismos fisiopatológicos que la causan (en reposo o durante el ejercicio), como son la hiperventilación, el esfuerzo inspiratorio, la hiperinsuflación dinámica, ya comentados en el apartado previo (fig. 4). La modificación de estos factores contribuye a disminuir los niveles ventilatorios y, por consiguiente, la sensación de disnea5.
Fig. 4. Esquema terapéutico de la disnea en relación con sus posibles mecanismos fisiopatológicos.
Oxigenoterapia
La oxigenoterapia crónica domiciliaria, además de aumentar la supervivencia de los pacientes con EPOC, es un elemento fundamental del tratamiento de la disnea a través de los siguientes mecanismos: aumenta el aporte tisular de oxígeno, con la consiguiente reducción de la acidosis láctica y mejoría de la función de los músculos ventilatorios, lo que favorece una disminución del estímulo respiratorio central54; reduce el estímulo hipóxico de los quimiorreceptores periféricos en los cuerpos carotídeos55; disminuye el ascenso de la presión arterial pulmonar asociado al ejercicio, reduciendo el estímulo inspiratorio central.
Rehabilitación respiratoria
Entrenamiento muscular. El entrenamiento muscular de las extremidades inferiores y superiores es uno de los pilares fundamentales en el tratamiento de la disnea en los pacientes con EPOC1-3. La rehabilitación respiratoria mejora la eficiencia en la utilización de oxígeno y reduce la producción de anhídrido carbónico para el mismo grado de trabajo, lo que se asocia con una mejoría de la capacidad aeróbica y un retraso en la acumulación de ácido láctico56. Asimismo, el entrenamiento muscular reduce la ventilación minuto, a expensas de disminuir la frecuencia respiratoria, y consigue una mejora en la eficiencia ventilatoria durante el ejercicio.
Vibradores de la pared torácica. Algunos estudios han demostrado que la aplicación de dichos vibradores mejora la disnea en pacientes con EPOC en reposo, o a los que se había provocado hipercapnia aguda57. Los mecanismos por los que la vibración de la pared torácica mejora la disnea no están muy claros, pero se han propuesto los siguientes: la modulación de la respuesta aferente de los músculos intercostales sobre el centro respiratorio y/o la supresión refleja del estímulo central en el mesencéfalo.
Alteración del patrón ventilatorio. Algunos pacientes recurren a la estrategia de aumentar la presión positiva de la vía aérea superior respirando con los labios entreabiertos para prolongar el tiempo espiratorio (respiración con los labios fruncidos). Asimismo, se han postulado el uso y el entrenamiento de la respiración diafragmática como beneficiosos en el alivio de la disnea en pacientes con EPOC58. Sin embargo, la variabilidad de la respuesta a estas técnicas entre sujetos es muy alta.
Es bien conocido que los pacientes con EPOC modifican su posición corporal para mejorar la disnea. La posición típica de inclinar hacia delante el tórax mejora la fuerza de los músculos inspiratorios, reduce la participación de los músculos del cuello y disminuye el reclutamiento diafragmático y la respiración paradójica abdominal, con la consiguiente mejora de la disnea59.
Educación. Educar a los pacientes sobre la correcta utilización de la oxigenoterapia, los inhaladores, las necesidades nutricionales y en la administración de sus energías ha demostrado disminuir el grado de ansiedad y depresión habituales en los pacientes con EPOC, con la consiguiente mejoría de la disnea y de su calidad de vida2. El beneficio sobre el grado de ansiedad conduce a un descenso de los niveles de descarga del centro respiratorio y de los niveles ventilatorios, con la consiguiente disminución del atrapamiento aéreo durante situaciones de aumento del trabajo respiratorio, como el ejercicio o durante las exacerbaciones.
Tratamiento inhalatorio
Broncodilatadores. En los últimos años diversos estudios han demostrado que la utilización de broncodilatadores (agonistas β2 y anticolinérgicos de larga duración) puede mejorar el atrapamiento aéreo y aumentar la capacidad inspiratoria sin necesidad de mejorar el FEV118,19,60. Esta mejora de la mecánica ventilatoria explica su efecto beneficioso en la disnea y en la capacidad de ejercicio, y redunda en una valoración más positiva de este tipo de fármacos.
Anestésicos. La lidocaína y la bupivacaína pueden alterar la información que se emite desde los receptores pulmonares. Los estudios realizados en pacientes con EPOC no han demostrado los mismos efectos beneficiosos que se encuentran en los pacientes asmáticos.
Furosemida. Recientemente Ong et al61 han probado, en un estudio aleatorizado y controlado, que el tratamiento inhalatorio con furosemida mejora la disnea inducida por ejercicio con carga mantenida en pacientes con EPOC. Dichos autores plantean diversos posibles mecanismos de acción: un efecto broncodilatador que les permite trabajar en volúmenes pulmonares menores; un descenso de la actividad vagal; una disminución de los receptores C de estrechamiento pulmonar.
Flujo de aire fresco
Se ha observado, de forma empírica, que el movimiento con ventiladores de aire fresco en la zona facial mejora la disnea en los pacientes con EPOC. La estimulación de mecanorreceptores o el descenso de la temperatura cutánea facial puede alterar, a través del nervio trigémino, el estímulo aferente central y modificar la sensación de la disnea. A pesar de haberse probado su efecto sólo en individuos sanos62, podría ser una opción válida en pacientes con EPOC.
Ventilación no invasiva
En teoría, la ventilación no invasiva podría ser beneficiosa en la EPOC a través de los mecanismos siguientes: facilitando el reposo de los músculos respiratorios con incremento de su fuerza y resistencia; aumentando la respuesta del centro respiratorio (EPOC estable) y mejorando la mecánica ventilatoria a través de la disminución de la autopresión positiva al final de la espiración, el aumento del flujo inspiratorio y la disminución de la relación tiempo inspiratorio/duración total del ciclo respiratorio. La eficacia de la ventilación no invasiva con sistemas de presión positiva es incuestionable en la EPOC agudizada3,63,64. Sin embargo, sus resultados sobre la disnea de los pacientes con EPOC estable son controvertidos y, en la actualidad2,3,65-67, no existen evidencias suficientes para recomendar esta clase de tratamiento en su manejo clínico habitual.
Cirugía de reducción de volumen pulmonar
En los pacientes candidatos a cirugía de reducción de volumen pulmonar, la eliminación de los espacios aéreos no funcionales aumenta la capacidad de ejercicio y alivia el grado de disnea de esfuerzo en paralelo a la reducción de la hiperinsuflación dinámica y la mejoría de la eficiencia de los músculos inspiratorios68. Esta intervención quirúrgica se considera en los pacientes con enfisema no homogéneo, predominantemente apical y con escasa respuesta al tratamiento de rehabilitación respiratoria.
Fármacos ansiolíticos
Existen numerosos fármacos que actúan sobre el centro respiratorio y disminuyen su descarga, con lo que reducen el nivel ventilatorio y, por lo tanto, el atrapamiento aéreo. Los opiáceos, al disminuir la ansiedad y deprimir el impulso central ventilatorio de forma primaria, reducen el nivel de ventilación, con la consiguiente mejoría de la disnea, sobre todo en pacientes con alteraciones mecánicas importantes. Numerosos estudios han probado que los opiáceos administrados de forma sistémica mejoran la disnea en los pacientes con EPOC69. Sin embargo, la información es limitada en cuanto a su eficacia administrados de forma inhalada70.
Las benzodiacepinas podrían ser una opción atractiva al modificar la respuesta emocional a la disnea. Sin embargo, múltiples estudios controlados no han conseguido demostrar su eficacia en la disnea. No obstante, es razonable administrar ansiolíticos en los pacientes con trastornos de ansiedad y ataques de pánico, monitorizando sus posibles efectos adversos (alteración del estado de conciencia y retención de anhídrido carbónico).
Abordaje con técnicas alternativas
Existen numerosas técnicas no tradicionales, como la acupuntura, la autorrelajación, la meditación o el yoga, que han demostrado ser efectivas en el alivio del grado de ansiedad y, por lo tanto, en el de disnea71.
Soporte nutricional
Las alteraciones del balance energético en los músculos respiratorios puede llevar a su debilidad temprana, a la fatiga y al empeoramiento de la disnea. El bajo peso en los pacientes con EPOC está asociado a una disminución de la masa diafragmática, del tamaño de las fibras musculares y del grosor de los músculos esternocleidomastoideos. Hasta el momento, son pocos los estudios que han evaluado el impacto del suplemento nutricional sobre la disnea, sin que hayan podido demostrar algún efecto beneficioso.
La disnea como factor pronóstico
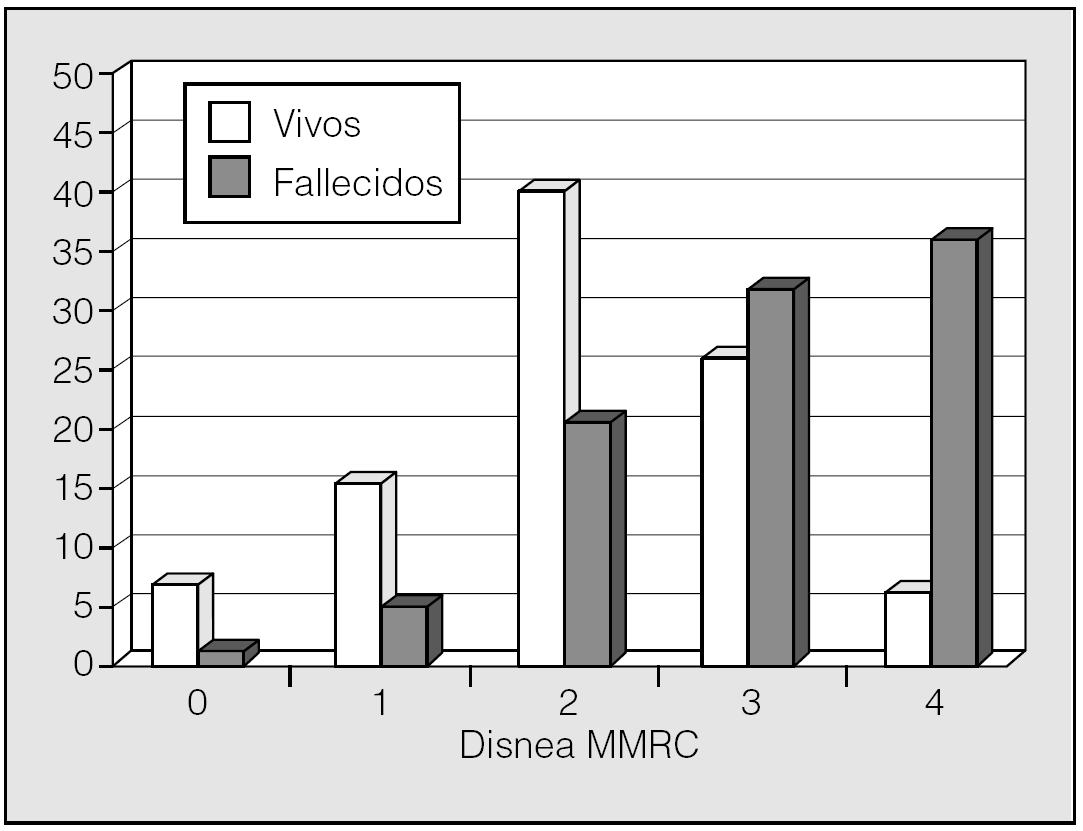
Ries et al8 fueron los primeros que evidenciaron la importancia de la disnea como factor pronóstico en su amplio estudio multicéntrico de rehabilitación pulmonar. Midieron la disnea a través del SOBQ y observaron su influencia en la supervivencia. No obstante, la disnea mostró ser inferior al FEV1 y no mantuvo su poder pronóstico en el análisis multivariable. Posteriormente, otros estudios han objetivado que la graduación de la disnea expresa mejor que el FEV1 la discapacidad física de los pacientes con EPOC y tiene una relación más estrecha con los tests de calidad de vida y las pruebas de ejercicio9. En algunos de estos trabajos, las importantes diferencias entre la disnea y los parámetros fisiológicos dejan entrever las múltiples dimensiones de la EPOC. Estas buenas expectativas de la disnea como factor pronóstico se confirmaron en el estudio de Nishimura et al72, quienes observaron que la categorización de sus pacientes en función de la disnea, valorada por la escala del MRC, tenía un poder de predicción de mortalidad superior al FEV1. Aunque el estudio fue prospectivo, con 5 años de seguimiento, y tuvo una estratificación adecuada de la cohorte según los valores de FEV1, el tamaño de la muestra resultó muy pequeño en el subgrupo con mayor gravedad de disnea. Recientemente nuestro grupo, con una muestra de pacientes sensiblemente superior a la de Nishimura et al (689 pacientes), y con una representación suficiente de todos los rangos de gravedad de la disnea (fig. 5), corrobora la importancia de la disnea en la evolución de los pacientes con EPOC, con un mayor peso pronóstico en la mortalidad de origen respiratorio36.
Fig. 5. Distribución de la graduación de la disnea escala modificada del Medical Research Council (MMRC) en una cohorte de 689 pacientes con EPOC en relación con la supervivencia.
No obstante, la mayor parte de los estudios donde se han analizado los posibles factores pronósticos en la EPOC están realizados sobre población masculina y no sabemos si los resultados son extensibles a las mujeres. Aunque en nuestro estudio el 21% de los pacientes recibían oxigenoterapia crónica, quizá hagan falta más datos para evaluar el papel de la disnea en este subgrupo de pacientes, como se ha demostrado recientemente con el índice de masa corporal.
Conclusiones
La disnea es el síntoma más relevante en la EPOC. Aunque aparece en etapas avanzadas de la enfermedad, tiene importantes consecuencias ya que es la causa más frecuente de consulta y el principal condicionante de la calidad de vida de estos pacientes. Además, ha demostrado ser un factor pronóstico de mortalidad de gran fortaleza e independiente del FEV1. Este notable protagonismo ha quedado plasmado en los nuevos consensos que han considerado que, para una manejo correcto de la EPOC, no sólo se tiene que intentar que no aumente el daño pulmonar, sino que es extraordinariamente relevante "el paciente globalmente", siendo uno de los objetivos principales la disminución de la disnea. Existen múltiples opciones terapéuticas para el manejo de la disnea de los pacientes con EPOC. Su abordaje debe ser multidisciplinario (neumólogos, rehabilitadores, cirujanos torácicos, fisioterapeutas, nutricionistas, etc.) actuando sobre cada uno los componentes que la provocan y adaptándose al perfil etiológico de cada paciente.
Correspondencia: Dr. C. Casanova Macario.
Unidad de Neumobiología. Servicio de Neumología. Instituto de Investigación. Hospital Universitario La Candelaria.
Ctra. del Rosario, s/n. 38010 Santa Cruz de Tenerife. España.
Correo electrónico: ccasanova@canarias.org