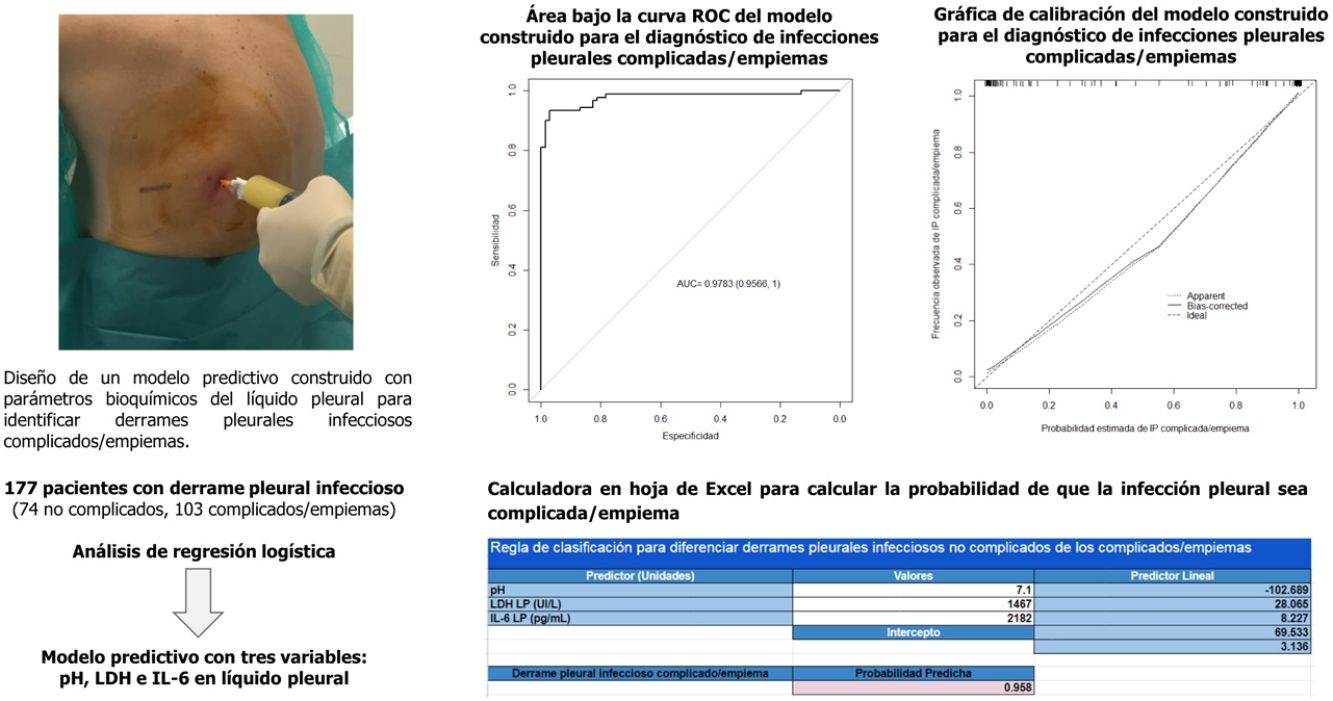
Predecir cuándo un derrame pleural infeccioso puede evolucionar hacia una infección complicada/empiema es difícil de establecer. Nuestro propósito es analizar si un modelo predictivo construido con parámetros bioquímicos del líquido pleural puede ayudar a identificar estos derrames.
MétodosSe estudió de forma prospectiva a todos los pacientes diagnosticados de derrame pleural infeccioso y se clasificaron en no complicados y complicados/empiemas. Se realizó un análisis de regresión logística para estimar la probabilidad de infección pleural complicada/empiema. Con base en parámetros bioquímicos del líquido pleural, se construyó un modelo predictivo y se determinaron su discriminación (áreas bajo la curva ROC), calibración y precisión diagnóstica.
ResultadosSe incluyó a 177 pacientes (74 infecciones pleurales no complicadas y 103 complicadas/empiemas). El área bajo la curva del modelo construido (pH, lactato deshidrogenasa e interleucina 6) fue 0,9783, significativamente mejor que cualquiera de las variables bioquímicas utilizadas de forma individual (0,921, 0,949 y 0,837, respectivamente; p <0,001 usando todos los parámetros). La tasa de clasificación correcta fue del 96% de los derrames (170/177; 72/74 [97,3%] de los no complicados y 98/103 [95,1%] de los complicados/empiemas).
ConclusiónEl modelo predictivo analizado tiene una buena rentabilidad para el diagnóstico de las infecciones pleurales complicadas/empiemas, superior a la de cualquiera de las variables individuales que lo componen.
Identifying infectious pleural effusions (IPE) that will progress to complicated infection or empyema is challenging. The purpose of this study was to determine whether a model based on multiple biochemical parameters in pleural fluid can predict which IPEs will produce empyema.
MethodsA prospective study was performed of all cases of IPEs treated in our unit. IPEs were classified as uncomplicated or complicated (empyema). Logistic regression was used to estimate the risk for complicated pleural infection (empyema). A predictive model was developed using biochemical parameters in pleural fluid. Discriminatory power (areas under the ROC curve), calibration, and diagnostic accuracy of the model were assessed.
ResultsA total of 177 patients were included in the study (74 with uncomplicated infectious pleural effusion, and 103 with complicated pleural effusion/empyema). The area under the curve (AUC) for the model (pH, lactate dehydrogenase and interleukin 6) was 0.9783, which is significantly superior to the AUC of the individual biochemical parameters alone (0.921, 0.949, and 0.837, respectively; P<.001 using all parameters). The rate of correct classification of infectious pleural effusions was 96% [170/177: 72/74 (97.3%) for uncomplicated and 98/103 (95.1%) for complicated effusion (empyema)].
ConclusionThe multiple-marker model showed better diagnostic performance for predicting complicated infectious pleural effusion (empyema) compared to individual parameters alone.
La infección pleural (IP) es un hallazgo frecuente en la práctica clínica, ya que un 57% de los pacientes con neumonía pueden presentar un derrame pleural (DP) infeccioso (DPI)1. En la fase inicial (exudativa), las características del líquido pleural (LP) son las de un exudado neutrofílico, sin otros datos bioquímicos que lo identifiquen, su cultivo suele ofrecer un bajo rendimiento y habitualmente responden favorablemente al tratamiento antibiótico2. Sin embargo, en los últimos años se ha observado que cada vez más pacientes desarrollan una IP complicada/empiema, sobre todo en niños y ancianos3,4. Estos enfermos necesitarán, además de antibióticos, un drenaje torácico y, en ocasiones, fibrinolíticos intrapleurales y manejo quirúrgico2. Como consecuencia, las tasas de hospitalización por empiema son más altas3, las estancias hospitalarias más prolongadas5 y las tasas de mortalidad pueden alcanzar el 30% en pacientes inmunocomprometidos3,5,6.
Las características bioquímicas del LP en las fases fibrinopurulenta y organizada de la IP son totalmente distintas de las de la fase exudativa y suelen indicar claramente la necesidad de colocar un drenaje torácico2. Pero, hasta la fecha, no se han desarrollado predictores clínicos, analíticos o radiológicos suficientemente consistentes que identifiquen qué pacientes con una IP simple pueden evolucionar hacia una IP complicada/empiema.
El objetivo del estudio es valorar si una combinación de biomarcadores de respuesta inflamatoria del LP, a través de modelos predictivos, pueden predecir qué pacientes con un DPI evolucionarán hacia fases más complicadas de la IP.
Material y métodosPacientesEntre junio del 2013 y diciembre del 2016 se estudió de forma prospectiva a todos los pacientes que acudieron a nuestro servicio por un DPI. Si a un paciente se le realizaban varias toracocentesis, se eligieron los datos bioquímicos de la primera.
DefinicionesEl diagnóstico de DPI se estableció ante la presencia de una infección pulmonar asociada a un cuadro agudo que cursaba con fiebre, infiltrados pulmonares, esputo purulento y respuesta al tratamiento antibiótico, o identificación de un organismo en el LP.
Se consideró que las IP eran no complicadas si se resolvían únicamente con antibióticos; una IP se definió como complicada si el derrame necesitó drenaje torácico para solucionarse, y empiema cuando existía pus en el espacio pleural o el cultivo del LP era positivo7.
Se excluyó a los pacientes menores de 18 años y los que habían tenido un empiema previo, cirugía mayor en los 5 días anteriores, neumonectomía en el lado infectado, embarazo o lactancia, y expectativa de vida menor de 3 meses.
MuestrasEl LP se obtuvo mediante una toracocentesis, dirigida por ecografía, antes de comenzar ningún tratamiento y con el enfermo en ayunas. Las muestras de LP se enviaron a microbiología (para tinción de Ziehl-Neelsen y cultivo en medios aeróbico, anaerobio y de Löwenstein), citología y bioquímica. Una vez centrifugadas las muestras a 1.500×g a 4°C durante 15 min, los sobrenadantes se procesaron antes de las 2 h de su extracción y posteriormente se almacenaron a –80° C. La interleucina 6 (IL-6) y la proteína C reactiva (PCR) se determinaron mediante el IMMULITE® 2000 (Siemens Healthcare Diagnostics Products Ltd., Llanberis, Gwynedd LL55 4EL, United Kingdom). Los resultados se expresaron en pg/ml y mg/l, respectivamente, y estuvieron disponibles en menos de una hora.
Análisis estadísticoLas variables continuas se expresaron en medias±DE o medianas (percentiles 25-75), según las distribuciones eran o no normales. Las variables cualitativas se expresaron en frecuencias absolutas y porcentajes. La normalidad de las distribuciones se estudió mediante el test de Kolmogorov-Smirnov. Se utilizó el test de la chi al cuadrado para comparar las variables categóricas, y para las variables continuas se empleó el test U de Mann-Whitney. Para determinar la rentabilidad diagnóstica de los parámetros estudiados se estimaron: sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razones de verosimilitud positiva y negativa, y precisión diagnóstica. Los puntos óptimos de corte se obtuvieron utilizando el criterio de Youden8. Se construyeron curvas ROC y se determinaron las áreas bajo la curva (AUC)9 para hallar la capacidad de discriminación. La interpretación de estos valores se determinó de acuerdo con los siguientes límites: 0,60-0,69, pobre valor discriminatorio; 0,70-0,79: moderado valor discriminatorio; 0,80-0,89: buen valor discriminatorio, y 0,90-1,00: excelente valor discriminatorio.
Se confeccionaron modelos de regresión logística binaria, en los que inicialmente se introdujeron todas las variables potencialmente predictoras y, posteriormente, mediante el test de razón de verosimilitud, se fueron eliminando aquellas con escasa o nula contribución a la capacidad de explicación del modelo (p <0,05). A partir de los coeficientes de regresión se estimaron las odds ratios y sus intervalos de confianza del 95%. Se estudiaron los diferentes aspectos de la performance del modelo: discriminación, calibración y seguridad diagnóstica10,11. La calibración se valoró mediante el score de Brier y se graficaron las estimaciones no paramétricas de las frecuencias observadas versus las predichas por el modelo. Las curvas ROC y sus correspondientes AUC también se utilizaron para verificar la capacidad de discriminación de los modelos. Para determinar el valor de los modelos, se utilizó la relación teórica entre la probabilidad del umbral de DPI y el valor relativo de los resultados de falsos positivos y falsos negativos. Para este propósito, la regla de clasificación se definió de la siguiente manera: cada paciente se clasificó como perteneciente al grupo infeccioso para aquellas probabilidades predichas iguales o superiores al umbral seleccionado y negativas de otro modo. Esto significa que los sujetos en los que el modelo predijo DPI y no lo tenían, serían falsos negativos, mientras que si el modelo no predice DPI y lo tienen, serían falsos positivos. Para corregir el posible sobreoptimismo se utilizaron técnicas de bootstrap, tanto para las estimaciones de discriminación como para las de clasificación de los pacientes. Finalmente, con base en los coeficientes de los modelos obtenidos en la regresión logística, se construyeron nomogramas para los modelos de predicción. El análisis de los datos se llevó a cabo utilizando los paquetes «mgcv»12, «MASS»13, «rms»10, «OptimalCutpoints»13 y «pROC»14, todos ellos libremente disponibles en R15.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital (código de registro 2013/013).
ResultadosDurante el periodo del estudio se llevaron a cabo 813 toracocentesis. Se excluyeron 107 derrames debido a: no se llegó a un diagnóstico definitivo (27), tenían algún criterio de exclusión (33), los datos correspondían a pacientes repetidos (21), había un posible doble diagnóstico (18) o bien los datos no estaban completos (8). De los 706 pacientes a los que finalmente se llegó a un diagnóstico, 177 eran DPI. De estos, 74 fueron IP no complicadas, 65 IP complicadas y 38 empiemas (suma complicadas/empiemas, 103).
El cultivo del LP fue positivo en 34/177 pacientes (19,2%). El grupo de Streptococcusmilleri(Streptococcus intermedius, constellatus y mitis) fue el que se cultivó con mayor frecuencia (13 pacientes; 7,3%), seguido del Streptococcus pneumoniae (5 pacientes; 2,8%), Streptococcus oralis (4 casos; 2,3%), otros tipos de Streptococcus (viridans, betahemolítico grupo C y especies) (3; 1,7%), Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa (2 casos cada uno; 1,1%), nocardia, Fusobacterium nucleatum y Parvimonas micra (un caso cada uno; 0,6%). Cincuenta pacientes (28,2%) habían recibido tratamiento antibiótico previamente a realizar la toracocentesis.
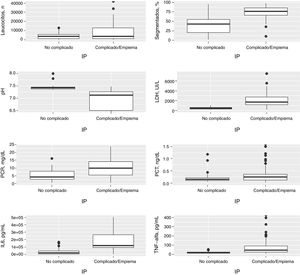
En la tabla 1 se observan las características de los pacientes estudiados de acuerdo con su clasificación como IP no complicada, complicada, empiema o la agrupación de estas 2últimas. Los valores de porcentaje de segmentados, lactato deshidrogenasa (LDH), PCR, IL-6 y factor de necrosis tumoral alfa (TNF-α) en LP aumentan significativamente a medida que lo hace la complejidad del derrame y disminuyen en el caso del pH. Si la IP es complicada o existe un empiema, se observa un aumento significativo en el tamaño del DP, el hábito alcohólico, la positividad del cultivo del LP, la necesidad de drenaje torácico y de tratamiento con fibrinolíticos y la presencia de septos y tabiques en el espacio pleural. No se encontraron diferencias significativas, entre otros, en el CURB-65, PSI, duración de la estancia hospitalaria, necesidad de ingreso en la UCI y mortalidad. Por el contrario, la insuficiencia cardiaca es significativamente más frecuente en los pacientes con un DP no complicado que en los complicados/empiemas (9,5% vs. 1,9%; p=0,029). En la tabla 2 se muestra la rentabilidad de cada parámetro en LP para el diagnóstico de las IP complicadas/empiemas. Los parámetros que mejor AUC mostraron para su diagnóstico fueron la LDH (0,949), el pH (0,921), el porcentaje de segmentados (0,866) y la IL-6 (0,837).
Características basales de los pacientes con derrame pleural infeccioso
| IP no complicada | IP complicada/empiema | p | |
|---|---|---|---|
| n | 74 | 103 | |
| Edad, años | 67,5 (49,8, 82,3) | 59 (50, 76) | 0,070 |
| Hombres, n (%) | 42 (56,8) | 84 (81,6%) | 0,000 |
| Leucocitos LP (células/μl) | 4.010 (1.752, 6.688) | 3.760 (1.213, 17.353) | 0,317 |
| Segmentados (%) | 31 (15,5, 55,5) | 76 (65, 85) | 0,000 |
| pH | 7,42 (7,38, 7,49) | 7,08 (6,52, 7,26) | 0,000 |
| LDH LP (U/l) | 395,5 (249,3, 592,5) | 1.958 (1.127, 4.749) | 0,000 |
| PCR LP (mg/dl) | 3,9 (2,3, 6,3) | 9 (5,1, 14,4) | 0,000 |
| PCT LP (ng/ml) | 0,15 (0,09, 0,23) | 0,23 (0,08, 0,37) | 0,180 |
| IL-6 LP (pg/ml) | 9.807 (2.593, 37.252) | 100.000 (54.724, 226.400) | 0,000 |
| TNF-α LP (pg/ml) | 17,5 (11,6, 22,5) | 45,4 (24,9, 101,3) | 0,000 |
| CURB-65, n (%) | 0,583 | ||
| 1 | 38 (52,8) | 62 (60,2) | |
| 2 | 28 (38,9) | 35 (34) | |
| 3 | 6 (8,3) | 6 (5,8) | |
| Clase PSI, n (%) | 0,475 | ||
| I | 9 (12,5) | 10 (9,7) | |
| II | 13 (18,1) | 22 (21,4) | |
| III | 17 (23,6) | 32 831,1) | |
| IV | 29 (40,3) | 30 (29,1) | |
| V | 4 (5,6) | 9 (8,7) | |
| Tamaño del derrame, n (%) | 0,000 | ||
| <1/3 | 53 (71,6) | 30 (29,1) | |
| > 1/3 y <2/3 | 19 (25,7) | 60 (58,3) | |
| > 2/3 | 2 (2,7) | 12 (12,6) | |
| Tiempo de evolución | |||
| Precoces (< 72 h) | 83 (80,6) | ||
| Tardíos (> 72 h) | 20 (19,4%) | ||
| APACHE II (score medio) | 9 (6, 12) | 8 (6, 13) | 0,709 |
| SIRS (score medio) | 2 (1, 2) | 2 (1, 3) | 0,126 |
| SEWS (score medio) | 2 (1, 3) | 2 (1, 4) | 0,203 |
| Drenaje torácico, n (%) | 2 (2,7) | 90 (87,4) | 0,000 |
| Fibrinolíticos, n (%) | 0 (0) | 76 (87,4) | 0,001 |
| Cultivos líquido pleural, n (%) | 0 (0) | 34 (33) | 0,000 |
| Días de ingreso (mediana) | 11 (7, 19) | 13 (10, 20) | 0,093 |
| Mortalidad 30 días, n (%) | 3 (4,1) | 4 (3,9) | 0,954 |
| Fumador (IPA) | 12 (1, 37,5) | 16 (1, 30) | 0,458 |
| Alcohol, n (%) | 6 (8,1) | 23 (22,3) | 0,009 |
| EPOC, n (%) | 12 (16,2) | 9 (8,7) | 0,101 |
| Hepatopatía crónica, n (%) | 4 (5,4) | 3 (2,9) | 0,323 |
| Insuficiencia cardiaca, n (%) | 7 (9,5) | 2 (1,9) | 0,029 |
| Accidente cerebrovascular, n (%) | 7 (9,5) | 6 (5,8) | 0,265 |
| Insuficiencia renal crónica, n (%) | 5 (6,8) | 6 (5,8) | 0,678 |
| Enfermedad reumática, n (%) | 4 (5,4) | 4 (3,9) | 0,448 |
| Diabetes mellitus, n (%) | 15 (20,3) | 15 (14,6) | 0,289 |
| Tiempo, n (%) | 0,128 | ||
| <30 (1) | 71 (95,9) | 93 (90,3) | |
| >30 días (2) | 3 (4,1) | 10 (9,7) | |
| Fiebre, n (%) | 46 (62,2) | 71 (68,9) | 0,218 |
| Tratamiento antibiótico previo, n (%) | 0,484 | ||
| No o 1 día | 60 (81,1) | 79 (76,7) | |
| ≥2 días | 14 (18,9) | 24 (23,3) | |
| Septos libres, n (%) | 11 (3) | 41 (64,1) | 0,000 |
| Tabiques, n (%) | 2 (6,1) | 35 (53,0) | 0,000 |
| Ingreso en UCI, n (%) | 9 (12,2) | 8 (7,8) | 0,481 |
APACHE II: Acute Physiology and Chronic Health Evaluation II; IL-6: interleucina 6; IP: infección pleural; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; PCT: procalcitonina; SEWS: Standardised Early Warning Score; SIRS: Systemic Inflammatory Response Syndrome; TNF-α: factor de necrosis tumoral alfa; UCI: Unidad de Cuidados Intensivos.
Sensibilidad, especificidad, valores predictivos positivo y negativo y AUC para el diagnóstico de la infección pleural complicada/empiema
| Parámetro | Cutoff | AUC | S (%) | E (%) | VPP (%) | VPN (%) | RVP | RVN |
|---|---|---|---|---|---|---|---|---|
| Leucocitos LP | 12.690 cél/μl | 0,545 (0,458, 0,633) | 31,3 | 95,8 | 90,9 | 51,1 | 7,5 | 0,72 |
| Segmentados | 61% | 0,866 (0,807, 0,924) | 79,1 | 85,5 | 87,8 | 75,6 | 5,46 | 0,24 |
| pH LP | 7,35 | 0,921 (0,881, 0,961) | 85,5 | 84,8 | 81,4 | 88,2 | 5,81 | 0,18 |
| LDH LP | 1.004 UI/l | 0,949 (0,913, 0,984) | 85,6 | 100 | 100 | 84,1 | – | 0,14 |
| PCR LP | 6,7 mg/dl | 0,766 (0,692, 0,839) | 67,4 | 78,5 | 81 | 63,9 | 3,14 | 0,41 |
| PCT LP | 0,25 ng/ml | 0,574 (0,467, 0,682) | 48,6 | 79,5 | 79,5 | 48,6 | 2,37 | 0,64 |
| IL-6 LP | 64.560 pg/ml | 0,837 (0,772, 0,901) | 73,7 | 92,9 | 93,3 | 72,5 | 10,5 | 0,28 |
| TNF-α LP | 25 pg/ml | 0,808 (0,741, 0,875) | 75,5 | 83,3 | 85,5 | 72,2 | 4,53 | 0,29 |
AUC: área bajo la curva ROC; cél: células; E: especificidad; LDH: lactato deshidrogenasa; IL-6: interleucina 6; LDH: lactato deshidrogenasa; IL-6: interleucina 6; PCR: proteína C reactiva; PCT: procalcitonina; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva; S: sensibilidad; TNF-α: factor-alfa de necrosis tumoral; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En la figura 1 se muestra la distribución de las concentraciones de las principales variables en las IP no complicadas, complicadas y empiemas, y en la tabla 2 se observan las AUC ROC de todas las variables para el diagnóstico de las IP complicadas/empiemas.
Distribución de las concentraciones del número de leucocitos, segmentados (%), pH, LDH, PCR, PCT, IL-6 y TNF-α en el líquido pleural en las infecciones pleurales no complicadas, complicadas y empiemas.
IL-6: interleucina 6; LDH, lactato deshidrogenasa; LP: líquido pleural; PCR: proteína C reactiva; PCT: procalcitonina; TNF-α: factor de necrosis tumoral alfa.
Se utilizó un análisis de regresión logística para diferenciar las IP no complicadas de las complicadas/empiemas. El modelo incluyó 3variables: pH, LDH LP e IL-6 LP. Los coeficientes obtenidos en el análisis de regresión para el modelo evaluado se presentan en la tabla 3. La capacidad de discriminación que se obtuvo fue un AUC de 0,9783, significativamente mejor que la de cualquiera de las variables individuales que lo componen (p <0,001). La AUC corregida por bootstrap fue ligeramente inferior a la AUC aparente (0,9757), lo que tampoco refleja ningún optimismo. Este modelo clasifica correctamente el 96% (170/177) de los derrames (72/74 [97,3%] de los no complicados y 98/103 [95,1%] de los complicados/empiemas).
Modelo de regresión logística para el diagnóstico de las infecciones pleurales complicadas/empiemas
| Coeficientes (SE) | p | OR (IC del 95%) | |
|---|---|---|---|
| Intercepto | 62,69 (29,86) | 0,024 | |
| pH | –11.45 (3,81) | 0,002 | 1,06 * 10–5 (6,08 * 10–9, 0,018) |
| LDH LP (UI/l) log | 5,10 (1,24) | 0,000 | 164,02 (14,43, 1.863,85) |
| IL-6 LP (pg/ml) log | 1,52 (0,62) | 0,014 | 4,57 (1,35, 15,41) |
R2=0,843, Brier=0,052, AUC=0,978 (0,956, 1).
IC: intervalo de confianza; IL-6: interleucina 6; LDH: lactato deshidrogenasa; LP: líquido pleural; OR: odds ratio; SE: error estándar.
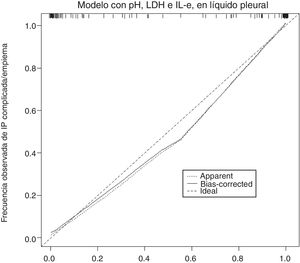
La gráfica de calibración del modelo construido se observa en la figura 2. La calibración demuestra una buena concordancia entre la probabilidad estimada y la frecuencia observada. Finalmente, la figura 3 muestra el nomograma construido.
La tabla 4 muestra la rentabilidad para diferentes puntos de corte de la probabilidad predicha para el diagnóstico de una IP complicada/empiema obtenida a través del modelo construido. En la práctica clínica, el cálculo de la probabilidad de que la IP sea complicada/empiema se puede llevar a cabo fácilmente a través de un modelo de calculadora en formato Excel (material suplementario [anexo], e-figura 1).
Sensibilidad, especificidad, valores predictivos positivo y negativo y razones de verosimilitud positiva y negativa para diferenciar una infección pleural no complicada de la complicada/empiema a través del modelo construido
| Probabilidad (%) | S (IC) | E (IC) | VPP (IC) | VPN (IC) | LR+ (IC) | LR– (IC) |
|---|---|---|---|---|---|---|
| 10 | 98,9 (93,9, 99,9) | 68,1 (55,8, 78,8) | 80 (70,5, 99,3) | 97,9 (89,1, 98,7) | 3,1 (2,2, 4,4) | 0,01 (0,00, 0,1) |
| 20 | 98,9 (93,9, 99,9) | 75,3 (63,5, 84,9) | 83,9 (74,8, 99,5) | 98,1 (90,1, 98,9) | 4 (2,6, 6,1) | 0,01 (0,00, 0,1) |
| 30 | 94,4 (87,5, 98,1) | 82,6 (71,5, 90,6) | 87,6 (78,9, 95,7) | 91,9 (82,4, 95,9) | 5,4 (3,2, 9,1) | 0,06 (0,02, 0,1) |
| 40 | 93,3 (86,1, 97,5) | 86,9 (76.6, 93,8) | 90,3 (82,1, 96,3) | 90,9 (81,5, 95,8) | 7,1 (3,9, 13,2) | 0,07 (0,03, 0,16) |
| 50 | 93,3 (86,1, 97,5) | 89,8 (80,2, 95,8) | 92,3 (84,5, 97,1) | 91,1 (81,9, 96,4) | 9,2 (4,5, 18,6) | 0,07 (0,03, 0,16) |
| 60 | 93,3 (86,1, 97,5) | 97,1 (89,9, 99,6) | 97,6 (91,7, 99,1) | 91,7 (83,1, 98,9) | 32,2 (8,2, 126,3) | 0,06 (0,03, 0,14) |
| 70 | 87,8 (79,1, 93,7) | 98,5 (92,1, 99,9) | 98,7 (93,2, 99,3) | 86,1 (76,6, 99,6) | 60,5 (8,6, 424,5) | 0,12 (0,07, 0,21) |
| 80 | 83,3 (74, 90,3) | 98,5 (92,1, 99,9) | 98,6 (92,8, 99,2) | 81,9 (72,1, 99,4) | 57,5 (8,2, 403,3) | 0,16 (0,1, 0,26) |
| 90 | 78,9 (69, 86,7) | 100 (94,7, NaN) | 100 (94, 100) | 78,4 (68,4, NaN) | Inf (NaN, Inf) | 0,21 (0,14, 0,31) |
E: especificidad; IC: intervalo de confianza; Inf: infinito; LR+: razón de verosimilitud positiva; LR–: razón de verosimilitud negativa; NaN: not a number; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
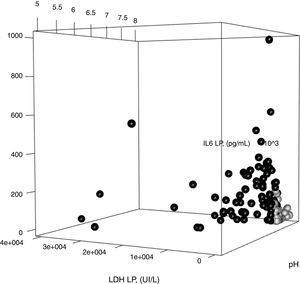
En la figura 4 se observa la distribución de los valores del pH, IL-6 y LDH en LP, según la IP sea no complicada (líneas negras) o complicada/empiema (líneas rojas), así como sus puntos de corte óptimos.
Con los parámetros del modelo construido para diferenciar las IP no complicadas de las complicadas/empiemas, se construyó una gráfica tridimensional que muestra la relación entre los valores en LP del pH, LDH e IL-6 (figura 5). Las IP no complicadas, en círculos negros, se agrupan mayoritariamente en la zona de la gráfica que ocupan los casos con valores más bajos de LDH e IL-6 y más elevados de pH.
La tabla 5 muestra los errores que se producen (falsos positivos y falsos negativos) para diferentes puntos de corte de las probabilidades obtenidas después de aplicar el modelo construido.
DiscusiónEste estudio confirma que un modelo predictivo construido con una combinación de variables bioquímicas del LP tiene un excelente valor discriminativo para predecir IP complicadas/empiemas, ya que consigue diferenciarlas de las no complicadas en el 96% de los casos.
Diferenciar entre IP no complicada e IP complicada/empiema tiene implicaciones pronósticas y terapéuticas. Al contrario que las IP no complicadas, las complicadas/empiemas no se resuelven, en la mayoría de los casos, solamente con antibióticos, sino que, habitualmente, necesitan drenaje torácico y, en ocasiones, fibrinolíticos intrapleurales o, incluso, manejo quirúrgico. Esto conduce a la necesidad de utilizar un mayor número de recursos sanitarios y a ingresos hospitalarios con estancias prolongadas, lo que puede conducir a un aumento de la morbimortalidad. Si el LP tiene un aspecto purulento es relativamente sencillo diagnosticar el empiema, pero líquidos de aspecto seroso pueden tener un cultivo positivo y necesitar drenaje torácico para resolverse16. Lo relevante es poder identificar, de forma precoz, qué pacientes pueden presentar una IP complicada/empiema, pero hasta la fecha no hay datos clínicos o radiológicos que identifiquen a estos enfermos. Valores en LP del pH, LDH o glucosa pueden ayudar a hacer esta diferenciación, pero sus errores no son desdeñables2. Otros autores han intentado identificar estas IP mediante análisis multivariante y han observado que determinadas características clínicas (edad, alcoholismo, dolor torácico, taquicardia, uso de fármacos por vía intravenosa) o analíticas (albúmina, sodio, plaquetas, PCR, leucocitos) pueden contribuir a hacerlo7,17.
Las variables que de forma individual mejor discriminaron las IP complicadas/empiemas de las no complicadas fueron la LDH (AUC 0,949), el pH (AUC 0,921), el porcentaje de segmentados (AUC 0,866) y la IL-6 (AUC 0,837) (tabla 2). Tanto la LDH como el pH son parámetros ampliamente utilizados con este fin16,18 y la rentabilidad obtenida puede considerarse en el rango de la observada en otras series19-22. El porcentaje de neutrófilos suele utilizarse habitualmente en el diagnóstico de los DPI. En estos casos, aunque específico, no es un parámetro sensible debido a que factores como el momento de la evolución en que se realiza la toracocentesis y la toma previa de antibióticos pueden influir en el resultado23. Sin embargo, para el diagnóstico de las IP complicadas/empiemas sí que ha demostrado una buena rentabilidad diagnóstica (punto de corte 61,1%; sensibilidad 79,1%; especificidad 85,5%; AUC 0,866), probablemente porque todos los casos están en una fase avanzada de la infección (fibrinopurulenta u organizada). Con la IL-6 existe muy poca experiencia. Solamente se ha utilizado en un estudio y únicamente para diagnosticar los DPI24. La IL-6 es un mediador del sistema inmunológico y puede presentar valores séricos elevados en algunas enfermedades autoinmunes, infecciones y sepsis, y en el rechazo a los trasplantes. Su AUC tiene un buen valor discriminante (0,837), superior a la del estudio mencionado (0,70) y con una sensibilidad y especificidad también más elevadas (el 73,7 y el 92,9%, respectivamente). Por el contrario, el valor discriminante de la PCR fue moderado (AUC 0,766). Eso podría significar que una vez alcanzado un cierto nivel de inflamación en el LP, los valores de IL-6 no siguen aumentando en la misma proporción que lo hace la infección. Por otra parte, como sugerían estudios previos25-27, el poder discriminante de la procalcitonina fue muy pobre (AUC 0,574).
Para la predicción del resultado, se consideró la presencia o ausencia de IP complicada/empiema. En este contexto, el modelo de regresión logística es la técnica estadística más utilizada para resultados médicos binarios10. Al desarrollar un modelo de predicción, se pretende cuantificar qué tan buenas son las predicciones del modelo (rendimiento del modelo) y, para ello, se realizaron la calibración, la discriminación, la precisión diagnóstica y la validez de las predicciones para nuevos pacientes. El modelo construido para diferenciar ambas IP utiliza las variables pH, LDH e IL-6. Las probabilidades de que la IP sea complicada/empiema aumentan a medida que lo hacen los valores de LDH e IL-6, y disminuyen los del pH. La AUC del modelo, una vez corregida por bootstrap, es ligeramente inferior al AUC aparente (0,9757 vs. 0,9783), lo que refleja que no hay sobreoptimismo en la estimación. Llama la atención que el modelo construido no utilice la variable porcentaje de segmentados, cuya AUC es superior a la de la IL-6. Es posible que esto se deba a que el mecanismo por el que se eleva sea similar al de alguna de las variables elegidas y, por tanto, su determinación no aporte ninguna ventaja en aumentar el rendimiento del modelo.
La gráfica de calibración (figura 2) muestra que la concordancia entre las probabilidades predichas y las frecuencias observadas fue excelente, lo que demuestra la solidez del modelo. El nomograma representa el peso de cada una de las variables seleccionadas y estima la probabilidad de que una IP sea complicada/empiema, de acuerdo con la puntuación total obtenida con todas las variables (figura 3, parte inferior).
El diagnóstico erróneo de una IP no complicada como complicada conducirá a someter al paciente a pruebas invasivas innecesarias. Sin embargo, la situación contraria llevará a retrasos diagnósticos y, por consiguiente, a un potencial aumento de la morbimortalidad. Con este enfoque, quizá la mejor estrategia a la hora de clasificar a estos pacientes sería obtener el menor número de falsos negativos. Es decir, intentar evitar que las IP complicadas se clasifiquen erróneamente como no complicadas a fin de evitar las complicaciones mencionadas. Para cada probabilidad predicha, se obtiene una determinada rentabilidad. Una probabilidad predicha del 60% parece ser la de mayor rentabilidad, ya que es donde menos posibilidades de error se cometen a la hora de establecer el diagnóstico de DPI (tabla 5).
El estudio tiene algunas limitaciones. En primer lugar, el número de DPI no ha sido elevado (177); en segundo, los pacientes se han reclutado en un único centro. Aunque se han utilizado técnicas de bootstrap para corregir el sobreoptimismo, se necesita realizar una validación externa en otros centros. Por último, el cálculo de la probabilidad estimada de tener una IP complicada/empiema es compleja, pero la construcción de una calculadora Excel facilita la aplicación práctica por parte de los clínicos y está disponible en el material suplementario.
En resumen, el modelo predictivo construido tiene una rentabilidad superior a la de cualquiera de las variables individuales que lo componen para identificar las IP complicadas/empiemas. Aunque se necesitan nuevos estudios para validar estos hallazgos, los resultados obtenidos parecen justificar el que se pudiera comenzar a aplicar en la práctica clínica.
FinanciaciónEste estudio fue financiado por una beca de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR 126/2012).
AutoríaLucía Ferreiro. Concepción y diseño del estudio. Autora. Recogida de los datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Óscar Lado-Baleato. Análisis estadístico. Revisión crítica del artículo. Aprobación final del manuscrito.
Juan Suárez-Antelo. Coautor. Adquisición de datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
María E. Toubes. Coautora. Adquisición de datos. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Esther San José. Responsable de las determinaciones en líquido pleural de los parámetros estudiados. Coautora. Análisis e interpretación de los datos. Aprobación final del manuscrito.
Adriana Lama. Coautora. Adquisición de datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Nuria Rodríguez-Núñez. Coautora. Adquisición de datos. Revisión crítica del artículo. Aprobación final del manuscrito.
José Manuel Álvarez Dobaño. Coautor. Adquisición de datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Francisco Javier González Barcala. Coautor. Adquisición de datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Jorge Ricoy. Coautor. Adquisición de datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Francisco Gude. Análisis estadístico. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Luis Valdés. Autor principal. Concepción y diseño del estudio. Análisis e interpretación de los datos. Revisión crítica del artículo. Aprobación final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.