En los últimos años se observa un aumento de la prevalencia de colonización e infección por Scedosporium spp. en pacientes con fibrosis quística (FQ). En el presente estudio se registra la frecuencia de aislamiento de Scedosporium spp. en una Unidad de FQ de adultos, analizándose las características de los pacientes y los factores predisponentes.
MétodosSe realizó un estudio observacional retrospectivo en 87 pacientes adultos con FQ en los que se valoró la presencia de cultivo positivo para Scedosporium spp. durante 5 años (enero de 2012-julio de 2017). Se recogieron las siguientes variables clínicas: edad, sexo, índice de masa corporal, genotipo, presencia de insuficiencia pancreática, colonizaciones bacterianas, función pulmonar, complicaciones, exacerbaciones y tratamiento, así como puntuación Bhalla modificada de la última tomografía computarizada axial de alta resolución. Los resultados se analizaron con el paquete estadístico IBM SPSS Statistics Version 22.0.
ResultadosEn un 25,3% de los pacientes se aisló Scedosporium spp. En el análisis bivariante se observó en estos enfermos más frecuencia de Pseudomonas aeruginosa, peor puntuación en la clasificación de Bhalla (destacando los ítems presencia de bronquiectasias, tapones mucosos y generaciones bronquiales), un descenso leve en la capacidad de difusión pulmonar (DLCO) y que recibían con más frecuencia antibioterapia inhalada. En el análisis multivariante de regresión logística únicamente el ítem generaciones bronquiales fue significativo.
ConclusionesScedosporium spp. debe considerarse un patógeno oportunista emergente en pacientes con FQ del que se desconoce su implicación clínica, factores de riesgo o necesidad de tratamiento.
In recent years an increase in the prevalence of colonization and infection by Scedosporium spp. in patients with cystic fibrosis (CF) has been observed. In this article, we study the frequency of isolation of Scedosporium spp. in an adult CF Unit, analyzing characteristics of the patients and predisposing factors.
MethodsA retrospective observational study was conducted in 87 adult CF patients in whom the presence of positive culture for Scedosporium spp. was tested for a 5-year period (January 2012-July 2017). We recorded the following clinical variables: age, sex, body mass index, genotype, presence of pancreatic insufficiency, bacterial colonization, lung function, other complications, exacerbations and treatment, and the modified Bhalla score from the last high-resolution computed tomography. Results were analyzed with IBM SPSS Statistics Version 22.0 software.
ResultsScedosporium spp. was isolated in 25.3% of patients. In the bivariate analysis, these patients showed a higher rate of Pseudomonas aeruginosa infection, worse score in the Bhalla classification (highlighting the following items: bronchiectasis, mucus plugs and bronchial generations), a slight decrease in the lung diffusion capacity and more frequently received inhaled antibiotics. In the logistic regression multivariate analysis, only the bronchial generations item was significant.
ConclusionScedosporium spp. must be considered an emerging opportunistic pathogen in patients with CF whose clinical involvement, risk factors or need for treatment is unknown.
El estudio de las infecciones respiratorias en pacientes con fibrosis quística (FQ) es complejo debido a la multitud de microorganismos implicados. Además de la infección bronquial crónica bacteriana, los pacientes con FQ están predispuestos a la colonización fúngica por la capacidad que tienen algunos hongos de multiplicarse en el aparato respiratorio inferior y por los frecuentes ciclos antibióticos que reciben para el control de su enfermedad1. Mientras que la relevancia clínica de bacterias, como Pseudomonas aeruginosa (P. aeruginosa) y Staphylococcus aureus (S. aureus) en relación con el deterioro pulmonar está claramente establecido, el papel de algunos hongos está aún por determinar2.
A pesar de que Scedosporium spp. es un patógeno humano muy poco frecuente se considera el segundo hongo filamentoso en frecuencia después de Aspergillus spp., en pacientes con FQ. A diferencia de Aspergillus spp., sus esporas se encuentran raramente en el ambiente y los mecanismos de transmisión y colonización crónica no están claros3. La inhalación de esporas tiene escasos efectos en sujetos sanos mientras su sistema inmune funcione correctamente. Por el contrario, en pacientes con enfermedades crónicas respiratorias, como bronquiectasias, puede facilitar la persistencia de los hongos debido a un deterioro en el aclaramiento mucociliar, secreciones espesas y la capacidad del hongo para evadir el sistema inmune del huésped.
Aunque se describe una alta variabilidad de la prevalencia de colonización por Scedosporium spp. en los enfermos con FQ, en los últimos años se observa un aumento debido a una mejoría en los procedimientos de detección, entre otras causas. No hay publicados muchos estudios acerca de la prevalencia real de la coinfección por hongos y bacterias en FQ. En la mayoría de los casos, los hongos son aislados junto con bacterias como Haemophilus influenzae (H. influenzae) o P. aeruginosa, lo cual hace difícil determinar su poder patogénico real. Si bien se sabe que están asociados con una respuesta inflamatoria persistente en las vías respiratorias2. Hasta la fecha, existen pocos estudios que analicen la repercusión clínica y posibles factores predisponentes para la colonización por Scedosporium spp. en pacientes con FQ4.
Debido a cambios recientes en la taxonomía, Scedosporium apiospermum complex, hoy en día se considera un complejo formado por 5 especies distintas: Scedosporiumapiospermum(S. apiospermum), Scedosporium boydii, Scedosporium aurantiacum, Scedosporium minutispora y Scedosporium dehoogii. En cuanto a Scedosporiumprolificans se sabe que es genéticamente diferente de otras especies de Scedosporium spp., como recientemente se ha visto en estudios de Lackner et al.5. Es por esto que se considera de un género distinto y se ha reasignado al género Lomentospora. Hoy en día se denomina Lomentospora prolificans.
El objetivo de este estudio fue analizar la frecuencia de aislamientos de Scedosporium spp. y sus factores predisponentes en una cohorte de pacientes con diagnóstico de FQ en seguimiento en una Unidad de adultos.
Material y métodosSe recogieron todos los aislamientos de Scedosporium spp. a partir de secreciones respiratorias de los pacientes atendidos en la Unidad de FQ de Adultos del Hospital Universitario de La Princesa de Madrid (España) durante los últimos 5 años, en el periodo comprendido entre enero de 2012 y julio de 2017. Este servicio proporciona asistencia sanitaria a un total de 87 pacientes, con un minucioso seguimiento de la evolución de cada uno de ellos. Las revisiones fueron mensuales o trimestrales en función de la gravedad, así como en el caso de una exacerbación clínica. En cada visita se evaluó el estado general, la función pulmonar, el control del tratamiento antibiótico y los hallazgos microbiológicos obtenidos en las muestras respiratorias. Los pacientes fueron clasificados en función de si habían tenido aislamientos previos o no de Scedosporium spp.
Se recogieron muestras de esputo en las visitas de control de cada paciente. Dada su viscosidad, el procesamiento microbiológico habitual se llevó a cabo mediante homogeneización previa con acetilcisteína. La siembra se realizó de forma cuantitativa para conseguir un recuento de los distintos patógenos y facilitar el reconocimiento de los diferentes morfotipos bacterianos. Los medios selectivos empleados fueron Manitol-sal, MacConkey y Burkholderia cepacia Selective Agar. Además se sembró en agar chocolate con bacitracina, agar Saboureaud y agar sangre como medio general para el recuento total de la microflora respiratoria. La incubación se prolongó durante 5 días. La identificación de los hongos filamentosos aislados se realizó mediante el análisis estructural macroscópico/microscópico y confirmado con MALDI-TOF (Bruker-Daltonics).
Se analizó el primer aislamiento de Scedosporium spp. de cada uno de los enfermos así como la presencia o no de aislamientos sucesivos. Se definieron dos grupos de acuerdo con los resultados microbiológicos: pacientes que tuvieron al menos un cultivo positivo para Scedosporium spp. en las secreciones respiratorias durante todo el tiempo que duró el estudio, y aquellos que nunca tuvieron aislamiento de Scedosporium spp. La definición de infección bronquial por hongos no está claramente establecida. Sin embargo, aunque no hay una definición consensuada, se estableció como infección bronquial el aislamiento de un mínimo de 3 cultivos separados al menos de un mes durante un periodo de 6 meses.
Para la valoración de la función pulmonar se seleccionó el volumen espiratorio forzado en el primer segundo (FEV1) y el porcentaje del FEV1, coincidiendo con el primer aislamiento de Scedosporium spp. También se valoró la existencia de exacerbaciones respiratorias (ER), entendidas como el incremento de la sintomatología basal que obliga a la prescripción adicional de antibióticos; se consideraron leves-moderadas cuando precisaron tratamiento antibiótico por vía oral (vo) y graves si era intravenoso (iv). Se recogieron de forma retrospectiva los ciclos de antibioterapia oral o intravenosa en el año previo al primer aislamiento de Scedosporium spp. y en el año posterior.
Así mismo recogimos las siguientes variables clínicas: género de los participantes, edad, el índice de masa corporal (IMC); genotipo, según la información del estudio genético, clasificándolos en tres grupos: F508del homocigótico, F508del heterocigótico y otras mutaciones; existencia de insuficiencia pancreática, definida por el requerimiento de enzimas pancreáticas con niveles menores de elastasa fecal (<200μg/g), diabetes relacionada con FQ (DRFQ) con hiperglucemia en ayunas: glucemia en ayunas superior a 126mg/dl y a las 2 h superior a 200mg/dl, aspergilosis broncopulmonar alérgica (ABPA) y la infección bacteriana crónica definida según los criterios de Leeds, aislamiento de una bacteria en más del 50% de las muestras cultivadas en los 12 meses previos, clasificando a los pacientes como aislamiento único o infección crónica6. Se seleccionó la puntuación de Bhalla modificada según la última tomografía computarizada axial de alta resolución más próxima al último aislamiento. Este sistema permite valorar el grado de afectación pulmonar y la evolución de los daños pulmonares provocados por la enfermedad en función de distintos hallazgos radiológicos: la puntuación global se obtiene restando a una puntuación máxima de 25, que correspondería a la mejor situación radiológica posible7. Se recogió la presencia de hemoptisis grave definida como aquella superior a 400ml/día o 150ml/h, independientemente de si fue tratada de modo conservador o si requirió broncoscopia o embolización.
Se valoró el tratamiento crónico que se definió como aquel que recibía el paciente en un tiempo ≥ 3 meses y que incluía: macrólidos, antibioterapia en aerosol (colistina, tobramicina, aztreonam u «otros»), corticoides orales, corticoides inhalados, ibuprofeno, antibiótico oral, aerosolterapia con DNasa, suero salino hipertónico y fisiológico al 0,9%.
Los resultados se analizaron en el paquete estadístico IBM SPSS Statistics Version 22.0. El análisis descriptivo de las variables cuantitativas se realizó mediante el cálculo de las medias y las desviaciones estándar; y el de las variables cualitativas, por el cálculo de las frecuencias y porcentajes. Los test de Student y U-Mann-Whitney se han utilizado para la comparación de variables continuas, según estudio de normalidad correspondiente. El test de chi cuadrado se ha utilizado para comparar variables categóricas. Se evaluó el efecto de la variable dependiente con la odds ratio (OR) y su intervalo de confianza, ajustando por las diferentes covariables con un modelo condicional de regresión logística. Se consideró que existía significación estadística cuando p ≤ 0,05.
ResultadosDurante el periodo estudiado de 5 años se obtuvo al menos un cultivo positivo para Scedosporium spp. en 22 de los 87 pacientes atendidos en la unidad de FQ. En 5 de los enfermos se aisló Lomentospora prolificans, en 12 Scedosporium apiospermum complex, y en 5 se aislaron ambos. Respecto a los aislamientos por paciente, la media de cultivos positivos en cada paciente fue de 10,7 ± 16,3. Únicamente 4 de ellos tuvieron un único aislamiento, mientras que en los 18 restantes se aisló en más de 2 ocasiones. En concreto, 7 de ellos presentaron infección bronquial crónica por Scedosporium spp. con aislamientos sucesivos como mínimo durante 6 meses y hasta la actualidad.
En cuanto a las características clínicas de los pacientes incluidos en el estudio, la media de edad fue de 26,14 años, con un rango comprendido entre 18,5 y 34 años (tabla 1). El genotipo de la mutación más prevalente fue F508 del heterocigótico. Al comparar los dos grupos de enfermos, con y sin Scedosporium spp., no se encontraron diferencias estadísticamente significativas por sexo, ni en la función pulmonar. Aunque aquellos pacientes con cultivo positivo para Scedosporium spp. presentaron un leve descenso en la capacidad de difusión pulmonar (DLCO) (p=0,043).
Características clínicas de los pacientes
| Media ± DE/n (%) | Scedosporium spp. en cultivo | p | ||
|---|---|---|---|---|
| Total (n = 87) | No (n = 65) | Sí (n = 22) | ||
| Sexo | ||||
| Varón | 46 (52,9%) | 37 (56,9%) | 9 (40,9%) | 0,193 |
| Mujer | 41 (47,1%) | 28 (43,1%) | 13 (59,1%) | |
| Edad | 26,14±7,67 | 25,5±7,78 | 27,86±7,25 | 0,157 |
| IMC (kg/m2) | 22,10±2,89 | 22,14±3,09 | 21,98±2,21 | 0,825 |
| Mutación | ||||
| F508 del homocigótico | 23 (26,4%) | 17 (26,2%) | 6 (28,6%) | 0,300 |
| F508 del heterocigótico | 40 (46%) | 33 (50,8%) | 7 (33,3%) | |
| Otras mutaciones | 23 (26,4%) | 15 (23,1%) | 8 (38,1%) | |
| FEV1 ml | 2529±916 | 2599±954 | 2290±744 | 0,185 |
| FEV1 (%) | 71,53±21,25 | 72,38±22,83 | 68,59±14,73 | 0,497 |
| FVC ml | 3781±1024 | 3870±1035 | 3476±945 | 0,141 |
| FVC (%) | 91,03±17,22 | 92,1±17,83 | 87,34±14,73 | 0,291 |
| FEV1/FVC | 66,25±11,45 | 66,33±12,39 | 65,95±7,63 | 0,900 |
| DLCO% | 79,20±15,59 | 80,56±16,68 | 74,12±9,33 | 0,043 |
| Insuficiencia pancreática | 64 (73,6%) | 45 (69,2%) | 19 (86,3%) | 0,115 |
| DRFQ | 18 (20,7%) | 14 (21,5%) | 4 (18,2%) | 0,737 |
| Neumotórax | 3 (3,4%) | 2 (3%) | 1 (1,5%) | 0,744 |
| Hemoptisis | 9 (10,3%) | 6 (9%) | 3 (13,6%) | 0,558 |
| ABPA | 20 (23%) | 14 (21,5%) | 6 (27,2%) | 0,581 |
| ER previas | 2,29 ± 1,57 | 2,17 ± 1,59 | 2,67 ± 1,49 | 0,195 |
| Antibiótico vo | 1,72 ± 1,403 | 1,58 ± 1,36 | 2,14 ± 1,49 | 0,146 |
| Antibiótico iv | 0,52 ± 0,979 | 0,52 ± 1,05 | 0,52 ± 0,75 | 0,564 |
| ER posteriores | 2,67 ± 2,20 | 2,57 ± 1,87 | 2,95 ± 2,99 | 0,863 |
| Antibiótico vo | 2,20 ± 1,84 | 2,16 ± 1,67 | 2,29 ± 2,33 | 0,699 |
| Antibiótico iv | 0,44 ± 0,86 | 0,36 ± 0,80 | 0,67 ± 1,02 | 0,089 |
| Azitromicina | 42 (48,3%) | 38 (58,5%) | 13 (59%) | 0,095 |
| Suero salino hipertónico | 51 (58,6%) | 36 (55,4%) | 15 (68,2%) | 0,292 |
| Corticoides inhalados | 51 (58,6%) | 38 (58,5%) | 13 (58%) | 0,959 |
| Corticoides orales | 3 (3,4%) | 1 (1,5%) | 2 (9%) | 0,083 |
| Antibiótico en aerosol | 64 (73,6%) | 44 (67,7%) | 20 (90,9%) | 0,033 |
| Tobramicina | 16 (18,4%) | 14 (21,5%) | 2 (9,1%) | |
| Colistina | 33 (37,9%) | 20 (30,8%) | 13 (59,1%) | |
| Aztreonam | 6 (6,9%) | 5 (7,7%) | 1 (4,5%) | |
ABPA: aspergilosis broncopulmonar alérgica; DE: desviación estándar; DLCO: capacidad de difusión pulmonar; DRFQ: diabetes relacionada con FQ; ER: exacerbaciones respiratorias; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; iv: intravenoso; n: número; vo: vía oral.
En nuestra muestra, la mayor parte de los enfermos recibían tratamiento crónico (93,1%). Solamente la antibioterapia inhalada reveló diferencias estadísticamente significativas (p=0,033). El antibiótico inhalado pautado con mayor frecuencia en pacientes con Scedosporium spp. fue la colistina inhalada (tabla 1).
Respecto a los factores pronósticos, la puntuación global en la clasificación de Bhalla, fue peor en los enfermos con aislamiento de Scedosporium spp., con resultados estadísticamente significativos (p=0,047). En el análisis bivariante, entre los ítems de Bhalla destacaron: extensión de bronquiectasias, extensión de tapones mucosos y generaciones bronquiales afectadas por las bronquiectasias (tabla 2).
Puntuación Bhalla modificada
| Media ± DE | Scedosporium spp. en cultivo | p | |
|---|---|---|---|
| No (n = 65) | Sí (n = 22) | ||
| Puntuación global BHALLA | 15,48±4,25 | 13,37±2,11 | 0,047 |
| Severidad bronquiectasias | 2,02±1,01 | 1,89±0,74 | 0,450 |
| Engrosamiento peribronquial | 1,18±0,83 | 1,16±0,37 | 0,947 |
| Extensión bronquiectasias (n.° segmentos) | 2,45±1,00 | 3,00±0,00 | 0,014 |
| Extensión tapones mucosos (n.° segmentos) | 0,86±0,83 | 1,32±0,82 | 0,028 |
| Saculaciones o abscesos (n.° segmentos) | 0,12±0,33 | 0,16±0,37 | 0,694 |
| Generaciones de divisiones bronquiales implicadas (bronquiectasias/tapones) | 1,77±0,93 | 2,42±0,69 | 0,006 |
| Número de bullas | 0,20±0,64 | 0,16±0,50 | 0,952 |
| Enfisema (n.° segmentos) | 0,77±0,84 | 1,11±0,81 | 0,114 |
| Atelectasias/consolidaciones | 0,32±0,64 | 0,47±0,70 | 0,272 |
DE: desviación estándar; n: número.
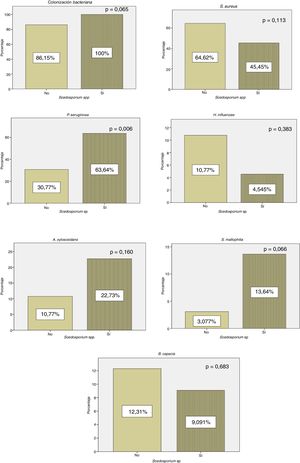
Todos los enfermos con cultivo positivo para Scedosporium spp. presentaron colonización concomitante por otros microorganismos, mientras que 56 (86,15%) pacientes en los que no se aisló Scedosporium spp. presentaron coinfección por otro patógeno. En nuestros resultados pudo observarse un aumento estadísticamente significativo (p=0,006) de la colonización crónica por P. aeruginosa en pacientes con cultivo positivo frente a los controles (fig. 1).
Respecto al tratamiento para el Scedosporium spp., únicamente fueron tratados 3 de los 22 pacientes con una duración media del tratamiento de 16,5 meses, con un rango comprendido entre 3 y 30 meses. El tratamiento prescrito fue: voriconazol, voriconazol + terbinafina, e itraconazol + terbinafina, en cada uno de los casos.
En el análisis multivariante se estudiaron los factores de riesgo estadísticamente significativos tras el análisis bivariante, aquellos con p ≤ 0,05 (P. aeruginosa, DLCO%, puntuación global en la clasificacion de Bhalla, generaciones bronquiales afectadas por las bronquiectasias, extensión de bronquiectasias y extensión de tapones mucosos). Tras el análisis multivariante solo mostró significación estadística las generaciones bronquiales afectadas por las bronquiectasias (OR: 3,315; IC (95%): 1,317-8,344; p=0,011) (tabla 3).
Análisis de regresión logística
| Variable independiente | p | OR | 95%IC para OR | |
|---|---|---|---|---|
| Inferior | Superior | |||
| P. aeruginosa | 0,052 | 3,224 | 0,990 | 10,498 |
| Generaciones de divisiones bronquiales implicadas | 0,011 | 3,315 | 1,317 | 8,344 |
| DLCO% | 0,342 | |||
| Puntuación global Bhalla | 0,633 | |||
| Extensión bronquiectasias | 0,282 | |||
| Extensión tapones mucosos | 0,230 | |||
IC: intervalo de confianza; OR: odds ratio.
Este es uno de los pocos trabajos que valora la prevalencia de Scedosporium spp. en una muestra de pacientes con FQ y analiza los posibles factores de riesgo. En él se destaca la alta prevalencia de este hongo, así como su relacion con P. aeruginosa, junto con un mayor daño estructural y funcional en el intercambio de gases. No podemos concluir que este hecho sea causa del propio hongo o consecuencia de la evolución de la enfermedad, que hace que este hongo aparezca más en este tipo de pacientes. A pesar de esto, sí que se ha observado que, en el caso de mayor número de generaciones bronquiales afectadas, puede verse aumentada la prevalencia de Scedosporium spp. en estos enfermos.
Los pacientes con FQ tienen una elevada predisposición para la colonizacion-infeccion broncopulmonar cronica, causa principal de la elevada morbilidad y temprana mortalidad de estos enfermos3. Mientras que la relevancia clínica de bacterias como P. aeruginosa y S. aureus en relación con el deterioro pulmonar esta más establecida, el papel de los hongos filamentosos esta aún por determinar excepto por A. fumigatus2. En nuestro estudio se vio que aquellos pacientes con aislamiento de Scedosporium spp. tenían una peor puntuación en la clasificacion de Bhalla, especialmente en el ítem tapones mucosos, lo cual podría justificar el mayor deterioro en la DLCO que en el FEV1.
Recientemente Schwarz et al.8 han realizado una revisión sobre la epidemiologia de los hongos en pacientes con FQ en distintos países europeos. Han detectado importantes diferencias geográficas y recalcan la necesidad de realizar más estudios de forma local. En Holanda, Engel et al.9 han observado que Aspergillus spp. es el hongo filamentoso más habitual. Estos datos coinciden con los nuestros donde Aspergillus spp. crecio en un 45,9% (datos no mostrados). Se estima una prevalencia global de Scedosporium spp. por encima del 14%, en el presente trabajo fue de 25,3%, considerándose los segundos hongos filamentosos en las vías respiratorias de pacientes con FQ, después de A. fumigatus10. En cohortes alemanas la prevalencia estimada es del 3,1%11 al 5,3%12. En Francia del 8,6%13, y en Australia del 17,4% al 25%14,15. En general se ha visto que se encuentra de manera ubicua en el agua y tierra contaminados, es por esto que los pacientes jóvenes tienen mayor riesgo de colonización ya que suelen pasar más tiempo al aire libre y es más fácil su adquisición. Si bien es cierto que los mecanismos de transmisión y colonización no están claros, sí que se ha visto mayor predisposición geográfica y climática4. En concreto Lomentospora prolificans predomina en Australia, Estados Unidos y España.
Otro factor que puede influir en su prevalencia heterogénea es la falta de estandarización en los procedimientos de detección y al hecho de que otros hongos filamentosos como A. fumigatus presentan un crecimiento más rápido que Scedosporium spp. en medios no selectivos. Con la reciente aplicación de medios de cultivo semiselectivos, los cuales inhiben el rápido crecimiento de A. fumigatus, se puede detectar colonias con crecimiento más lento. Las técnicas moleculares como el loop-mediated isothermal amplification (LAMP) o de hibridación reversa pueden ser alternativas potentes a los medios de cultivo, aumentando su porcentaje de detección en muestras de esputo16. El crecimiento de ambos hongos es posible, de esta forma hemos podido ver que en 9 de los 22 pacientes con Scedosporium spp., se aisló también Aspergillus spp.
En nuestra serie se observa un aumento de la colonización por P. aeruginosa en los pacientes con cultivo positivo para Scedosporium spp. (fig. 1). Estos resultados concuerdan con los datos de Schwarz et al.4, en los que se consideró la colonización por P. aeruginosa como un probable factor de riesgo para el aislamiento de Scedosporium spp. Al igual que en el estudio de Schwarz et al.4, en nuestra cohorte se objetivó una reducción de H. influenzae en pacientes con cultivo positivo para Scedosporium spp. (fig. 1). En ese trabajo se encontró una relación estadísticamente significativa entre las exacerbaciones y la colonización por H. influenzae. Esta bacteria tiene la capacidad de producir un biofilm que ayuda a su persistencia en el sistema respiratorio. Por lo que se sugiere que la reducción de H. influenzae en pacientes con FQ y cultivo positivo para Scedosporium spp. está relacionado con el tratamiento antibiótico repetido.
El tratamiento de Scedosporium spp. supone un reto ya que estudios in vitro muestran una alta resistencia o baja sensibilidad a la mayoría de los tratamientos antifúngicos disponibles. Los primeros casos de colonización por Scedosporium spp. fueron detectados tras la erradicación de A. fumigatus con itraconazol17. Al inicio del tratamiento, es crucial detectar la especie de Scedosporium spp., ya que han mostrado distinta susceptibilidad in vitro. Por tanto, el planteamiento lógico es iniciar el tratamiento con dos o incluso tres antifúngicos, para una mejor respuesta terapéutica y también evitar el desarrollo de resistencias. Voriconazol ha mostrado la mejor sensibilidad in vitro en el tratamiento de Scedosporium spp., fármaco con el que fueron tratados la mayoría de nuestros pacientes. Sin embargo la reciente guía de tratamiento del Hospital Royal Brompton de 201718, desaconseja su uso por sus efectos secundarios, alta fotosensibilidad a pesar del uso de protección solar, y el riesgo de toxicidad hepática. Es por esto que actualmente, debido a la mejor tolerancia, se recomienda posaconazol en Scedosporium apiospermum complex. Como Lomentospora prolificans es altamente resistente a todos los antifúngicos, sugieren la asociación de posaconazol más terbinafina. Respecto a la terapia nebulizada, recientemente Solé et al.19 han presentado tres casos de pacientes trasplantados con enfermedad invasiva por S. apiospermum tratados con posaconazol nebulizado como uso compasivo. En su experiencia, posaconazol nebulizado es efectivo y muestra una tolerancia similar a otros antifúngicos nebulizados. Además lo consideran una opción terapéutica alternativa en el caso de no haya una progresión adecuada con el tratamiento convencional o si la infección es debida a hongos muy resistentes. En cuanto al tiempo recomendado de tratamiento una vez iniciado, no hay nada establecido.
La pregunta acerca de si la colonización del tracto respiratorio por Lomentospora prolificans en pacientes con FQ es una contraindicación para el trasplante pulmonar está todavía en discusión20. Sí que se ha demostrado que los enfermos colonizados presentan peor pronóstico tras el trasplante21. También se ha visto que es frecuente que cause enfermedad invasiva en pacientes inmunodeprimidos receptores de trasplante pulmonar. El tiempo para el establecimiento de la micosis invasiva es de 12 meses postrasplante. En un estudio se ha descrito un 3,5% de infección por Scedosporium spp. tras trasplante pulmonar22.
Las limitaciones principales de nuestro trabajo eran que todos los enfermos pertenecían a un único centro y que el número de pacientes incluidos era escaso, por lo que se requeriría estudios multicéntricos para conocer la prevalencia real de este hongo, así como intentar dilucidar algunas cuestiones.
En el presente estudio concluimos que Scedosporium spp. es un hongo emergente en pacientes con FQ con el que existen muchos interrogantes, como su implicación clínica, factores de riesgo o necesidad de tratamiento, por lo que son necesarios más trabajos. Hasta la fecha recomendamos vigilar estrechamente a estos enfermos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.