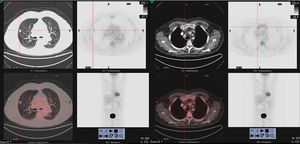
Se presenta el caso de un paciente de 77 años, exfumador con un índice acumulado de 50 paquetes/año, con antecedentes de dislipemia, gammapatía monoclonal de significado incierto (GMSI) IgG lambda (componente monoclonal [CM]: 4,8g/l) diagnosticado en 2014, estable y sin evidencia de progresión, controlado anualmente por hematología, y EPOC moderada no agudizador frecuente, en tratamiento broncodilatador, con grado de disnea mMRC 1, y sin ingresos previos por exacerbación. Asintomático desde el punto de vista respiratorio, y sin cuadro constitucional acompañante, en noviembre de 2017, tras los hallazgos en la radiografía de tórax de un nódulo pulmonar en un control rutinario se realizó una tomografía axial computarizada (TAC) de tórax que evidenció un nódulo espiculado de 13mm en segmento anterior de lóbulo superior derecho (fig. 1), con contacto pleural y retracción de la cisura menor adyacente. La analítica (bioquímica, incluyendo proteínas totales, dosificación de inmunoglobulinas, proteinograma e índice de cadenas ligeras libres, hemograma y coagulación) fue normal. Se realizó una tomografía por emisión de positrones (18F-FDG-PET/TC) que mostró un nódulo sólido hipermetabólico (SUVmáx 7,5) espiculado de 14mm con contacto puntiforme con pleura y cisura, sugestivo de etiología neoplásica primaria (fig. 1) y múltiples lesiones óseas hipermetabólicas, de componente lítico en el extremo distal de la clavícula derecha (SUVmáx 8,4) (fig. 1) y en el cuerpo vertebral de D3 y de aspecto blástico en la unión cabeza/cuello femoral izquierdo (SUVmáx 12). Estas lesiones fueron atribuidas inicialmente a etiología metastásica. Además, se describía una irregular distribución del trazador en otras estructuras óseas, no concordante con lesiones morfológicas y con discreta actividad metabólica en manubrio esternal, que no permitían descartar una etiología secundaria. Se procedió a hacer una biopsia transtorácica guiada por TAC de la lesión pulmonar que fue positiva para adenocarcinoma de origen pulmonar. Con la intención de completar la estadificación (T1bN0Mx) se decidió hacer una biopsia de la lesión lítica de la clavícula derecha que fue positiva para neoplasia de células plasmáticas, compatible con plasmocitoma/mieloma múltiple (MM).
Imágenes de 18F-FDG PET/TC que muestran (a la izquierda) un nódulo sólido hipermetabólico (SUVmáx 7,5), espiculado, que presenta contacto puntiforme con pleura y con la cisura, de unos 14mm, situado en el LSD en el segmento anterior. Lesión ósea hipermetabólica (a la derecha), con componente lítico en el extremo distal de la clavícula derecha (SUVmáx 8,4).
Tras los resultados de la biopsia ósea, se realizó una reevaluación de la enfermedad que mostró un CM estable (6,6g/l), sin otras alteraciones analíticas, con estudio de orina de 24h negativo y aspirado de médula ósea (MO) con infiltración por el 15% de células plasmáticas de morfología atípica (anisocitosis con predominio de elementos de gran tamaño, multinucleadas y ocasionalmente con nucléolo visible), irregularmente distribuidas, con áreas de hasta el 25%, de fenotipo anómalo. Se completó el estudio con resonancia magnética de cuerpo entero que mostró lesiones focales en cuerpo de T3 y en extremo distal de clavícula derecha altamente sugestivas de proceso infiltrativo, con dudosa infiltración medular vertebral difusa en el segmento T4-L4.
El paciente fue diagnosticado de forma concomitante de adenocarcinoma de pulmón T1bN0M0 (TNM 7.a edición) y GMSI transformada a mieloma múltiple IgG lambda oligosecretor, sintomático con afectación ósea, ISS 1.
El paciente presentaba una GMSI IgG lambda, entidad con una prevalencia que varía entre el 1 y el 3%, que se define como el hallazgo casual de componente monoclonal en suero, en un paciente sin criterios diagnósticos de mieloma múltiple, enfermedad de Waldenström, amiloidosis u otros síndromes linfoproliferativos, y debe cumplir los siguientes criterios diagnósticos: CM sérico <30g/l, células plasmáticas en MO<10% y ausencia de lesiones en órganos diana (CRAB: hipercalcemia, insuficiencia renal, anemia, lesiones óseas, amiloidosis). El riesgo de progresión a mieloma múltiple o amiloidosis es del 1% anual, con una probabilidad real de transformación maligna a los 20 años de seguimiento del 11%. Los factores descritos asociados a mayor riesgo de progresión son la cuantía del CM, el tipo IgA, la alteración del índice de cadenas ligeras libres (kappa/lambda), el tipo progresivo y la presencia de >90% de células plasmáticas en médula ósea de fenotipo aberrante1,2.
El mieloma múltiple se caracteriza por la infiltración de células plasmáticas en MO>10%, que segregan un CM en suero y/u orina, junto a citocinas que pueden producir lesiones óseas. Su incidencia es de 3-5 casos/100.000 habitantes/año, con una edad media de 65 años. Se define como mieloma múltiple sintomático la presencia de CM en suero y/u orina, la infiltración por células plasmáticas en MO o plasmocitoma y la evidencia de daño orgánico (CRAB), y el mieloma múltiple asintomático la presencia de CM en suero y/u orina y la infiltración por células plasmáticas en MO/plasmocitoma sin daño orgánico (CRAB)1–4.
El paciente recibió 5 sesiones de radioterapia estereotáctica sobre la lesión pulmonar (dosis total: 55Gy), manteniéndose libre de enfermedad a los 15 meses, y posteriormente inició tratamiento con intención curativa con lenalidomida y dexametasona, consiguiendo remisión completa del MM tras 12 ciclos de tratamiento.
En conclusión, en los pacientes con antecedentes de GMSI, que presenten lesiones óseas, aunque inicialmente se atribuyan a origen metastásico, y aun manteniéndose asintomáticos, siempre que sea posible, debería realizarse una biopsia ósea dirigida, con el objetivo de descartar enfermedad metastásica y/o progresión a MM, dado que la actitud terapéutica a seguir y el pronóstico de la enfermedad difiere mucho, pasando de proponerse tratamientos paliativos a curativos. En estos casos es imprescindible el estudio y seguimiento multidisciplinar de los pacientes con el fin de optimizar el procedimiento diagnóstico y terapéutico.