La fibrosis pulmonar es una enfermedad que puede estar causada por agentes externos como determinados fármacos. Desde hace un tiempo se utilizan fármacos antagonistas del factor de necrosis tumoral (TNF) para ciertas enfermedades autoinmunitarias, siendo un ejemplo de estos fármacos el etanercept. Las fibrosis secundarias a medicamentos se caracterizan por la respuesta a la retirada del fármaco y a esteroides. En muy raras ocasiones se produce una fibrosis irreversible. Presentamos el caso de un paciente que desarrolló una fibrosis pulmonar tras iniciar tratamiento con etanercept y que tuvo un curso clínico nefasto a pesar de la retirada del anti-TNF y dosis altas de esteroides.
Pulmonary fibrosis can be caused by external agents, including certain drugs. For some time now, tumor necrosis factor antagonists such as etanercept have been used to treat certain autoimmune diseases. Fibrosis caused by medication responds to withdrawal of the drug and treatment with corticosteroids. Very rarely, fibrosis is irreversible. We present the case of a patient who developed pulmonary fibrosis after initiating treatment with etanercept. The clinical course was fulminant despite withdrawal of the drug and high doses of corticosteroids.
La fibrosis pulmonar es una enfermedad del parénquima pulmonar que cursa generalmente de forma lenta y progresiva. Puede asociarse a enfermedades inmunológicas como, por ejemplo, la artritis reumatoide. Guarda muy poca relación con la psoriasis y/o la artritis psoriásica. En otros casos, el inicio de la enfermedad está, en el contacto repetido con una sustancia que provoca una alveolitis alérgica extrínseca y que, si se mantiene en el tiempo, puede evolucionar a una fibrosis ya establecida. El factor de necrosis tumoral (TNF) es una citocina proinflamatoria que existe en forma circulante y en forma transmembranaria y que, como cualquier citocina, está implicada en funciones de defensa del huésped1. Los fármacos antagonistas del TNF han demostrado su eficacia y seguridad en enfermedades como la artritis reumatoide y la artritis psoriásica2, 3. Actualmente hay en el mercado 2 fármacos anti-TNF útiles para estas 2 enfermedades reumatológicas: una proteína de fusión dimérica, compuesta por la porción extracelular del receptor humano p75 del TNF unido a la fracción Fc de la inmunoglobulina humana G1 (etanercept), y un anticuerpo monoclonal derivado murino (infliximab)4. Los problemas de seguridad de estas moléculas antagonistas del TNF son: infecciones (comunes y oportunistas), citopenias, enfermedad desmielinizante, síndromes seudolúpicos, insuficiencia cardíaca congestiva y enfermedades malignas, principalmente linfoma5. También pueden provocar neumonitis por hipersensibilidad de tipos I y III6. En la literatura científica se han descrito pocos casos de daño pulmonar en relación con el tratamiento con etanercept7, 8, y no hemos encontrado referencia alguna de lesiones que ocasionen el fallecimiento del paciente.
Presentamos el caso de un paciente diagnosticado de artritis psoriásica que desarrolló fibrosis pulmonar tras comenzar tratamiento con un anti-TNF (etanercept). La evolución fue muy desfavorable, hasta el fallecimiento del paciente, a pesar de la retirada del citado medicamento y del inicio de tratamiento intensivo para la fibrosis.
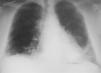
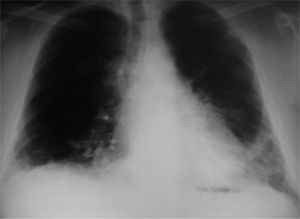
Observación clínicaPaciente de 34 años, que fue derivado a nuestras consultas para el estudio de una disnea de esfuerzo progresiva, con radiografía de tórax que mostraba un patrón intersticial reticular y bibasal (fig. 1). Trabajaba de albañil, era exfumador de 40 cigarrillos/día desde hacía 8 meses (30 paquetes-año) y entre sus antecedentes personales destacaban psoriasis, artritis psoriásica, rinoconjuntivitis y asma alérgica extrínseca con prueba de punción positiva para polen de gramíneas, por lo que había realizado inmunoterapia durante varios años (había finalizado el tratamiento 12 años antes), meningitis sin diagnóstico microbiológico y sin secuelas que había requerido ingreso en la unidad de cuidados intensivos. La clínica consistía en tos seca y disnea a grandes esfuerzos de un año de evolución (grado 1 de la escala del Medical Research Council), que había pasado a ser de grado 2 en los últimos 8 meses y de grado 3 en el último mes. En el momento de la consulta recibía tratamiento con indometacina de liberación lenta (un comprimido al día) y deflazacort (15mg/ día), prescritos por el Servicio de Reumatología. Había recibido tratamiento durante más de un año con metotrexato, que había abandonado hacía 2 por iniciativa propia, y con etanercept en el último año, hasta 15 días antes de acudir a nuestra consulta.
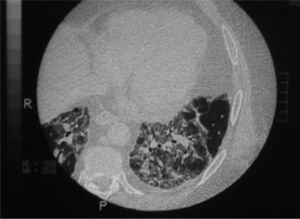
Se solicitó una tomografía computarizada (TC) de tórax que mostró imágenes bilaterales y parcheadas en ambos lóbulos superiores e inferiores, así como en el lóbulo medio, con pérdida de volumen; en las bases se observaban áreas de vidrio deslustrado (fig. 2). En la analítica básica los resultados fueron: 7.450 leucocitos/μl (polimorfonucleares: 46%; linfocitos: 37,7%; eosinófilos: 7%); hemoglobina, 16,6g/dl; hematocrito del 48,2%; 261.000 plaquetas; velocidad de sedimentación globular en la primera hora, 41mm/h; lactatodeshidrogenasa, 622IU/L; triglicéridos, 157mg/dl; colesterol, 202mg/dl; proteína C reactiva, 0,7mg/dl; el resto de los parámetros se hallaban en el rango de la normalidad. La gasometría basal inicial indicó: presión arterial de oxígeno de 78mmHg, presión arterial de anhídrido carbónico de 35,2mmHg, pH de 7,43 y HCO3 de 23,4mmol/l. Los valores de las pruebas de función respiratoria se exponen en la tabla I. El electrocardiograma mostraba un sinusal a 90 lat/min, sin imágenes de sobrecarga ni alteraciones de la repolarización. Se realizó una fibrobroncoscopia sin hallazgos endoscópicos relevantes, un lavado broncoalveolar en el lóbulo medio e intentos de biopsia transbronquial, que se interrumpieron por intolerancia del paciente y episodio de vómito. Los resultados del lavado broncoalveolar demostraban celularidad inflamatoria mixta con predominio de linfocitos (un 79% de histiocitos, un 15% de linfocitos, un 4% de neutrófilos y un 2% de eosinófilos) y negatividad para células malignas.
Evolución de los parámetros de la función respiratoria del paciente
| 2001a | Febrero 2004b | Junio 2004b | Octubre 2004c | Enero 2005c | |
| FVC (ml) | 3.460 | 2.790 | 2.820 | 2.290 | 1.990 |
| FVC (%) | 74 | 63 | 59 | 47,4 | 41,3 |
| FEV1 (ml) | 3.340 | 3.620 | 2.220 | 2.010 | 1.400 |
| FEV1 (%) | 88 | 67 | 59 | 52,7 | 36,7 |
| FEV1/FVC | 96,5 | 77,07 | 78,7 | 87,67 | 70,12 |
| DLCO (ml/min/mmHg) | 4.080 | 3.540 | |||
| DLCO (%) | 39,5 | 34,3 | |||
| KCO (ml/min/mmHg/l) | 1.190 | 1.130 | |||
| KCO (%) | 73 | 69,5 | |||
| TLC (ml) | 2.720 | 2.530 | |||
| TLC (%) | 43 | 39,9 | |||
| VR (ml) | 460 | 670 | |||
| VR (%) | 26,5 | 38,2 |
DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; FEV1/FVC: relación entre FEV1 y FVC; KCO: relación DLCO/volumen alveolar; TLC: capacidad pulmonar total VR: volumen residual.
El paciente se decantó por la opción de cirugía de tórax para biopsia pulmonar diagnóstica. Se efectuó la biopsia pulmonar por toracotomía y el diagnóstico fue de neumonía intersticial crónica avanzada. La presencia de histiocitos espumosos en el intersticio septal indicaba que la lesión inicial podría corresponder a neumonitis por hipersensibilidad. Se aumentó la dosis de deflazacort a 30mg/día y se prescribieron tiotropio (una cápsula inhalada al día) y salbutamol a demanda.
En la revisión llevada a cabo a los 2 meses se realizaron nuevas pruebas de función respiratoria, cuyos resultados se recogen en la tabla I. La saturación basal era del 94% y la situación clínica del paciente no había sufrido ningún cambio. En esta consulta se solicitaron las pruebas para el estudio pretrasplante (TC de control, ecocardiografía, prueba de la marcha, serología de virus de la inmunodeficiencia humana y hepatitis y Mantoux). En el curso de 3 meses, mientras se realizaban las pruebas solicitadas, el paciente experimentó un deterioro importante de la disnea y estado general, por lo que requirió ingreso, durante el cual se completó el estudio. En la TC de tórax se apreciaban bronquiectasias de tracción en los lóbulos superiores e inferiores, así como signos de actividad sobre todo en los lóbulos inferiores. El ecocardiograma mostraba una buena contractilidad y ausencia de dilatación de cavidades y de hipertensión pulmonar. Se inició tratamiento con azatioprina a dosis de 50mg/12h y prednisona (30mg/día), con buena tolerancia. No obstante, el paciente precisó flujos de oxígeno cada vez más elevados para mantener una saturación arterial de oxígeno mayor del 90%. Se aumentaron las dosis de azatioprina y corticoides intravenosos, pero la insuficiencia respiratoria se hizo extrema, a pesar de administrar flujos de oxígeno al 100%, por lo que ingresó en la Unidad de Cuidados Intensivos para ventilación mecánica. Se inició tratamiento con bolos de metotrexato, pero tampoco se obtuvo respuesta, y presentó una insuficiencia hepática, que precipitó el desenlace fatal.
DiscusiónLa fibrosis pulmonar se caracteriza por tos, disnea de esfuerzo, patrón restrictivo en las pruebas de función pulmonar y patrón en panal de abeja en la TC de alta resolución (como más característico). Suele tener un curso lento pero inexorable, y la mayoría de los pacientes fallecen por insuficiencia respiratoria en un período de 3–8 años desde el diagnóstico.
Se han propuesto múltiples teorías sobre el origen de la fibrosis pulmonar, como la susceptibilidad hereditaria a la enfermedad, la fibrosis en respuesta a una infección vírica u otra lesión pulmonar y la inflamación mediada por mecanismos inmunológicos. Es esta última teoría la que podría explicar el origen de la enfermedad de nuestro paciente, dado que estaba diagnosticado de enfermedades en que hay una alteración inmunológica, como la artritis psoriásica o la atopia.
Algunos artículos ponen de manifiesto la infrecuente asociación de la psoriasis vulgar con la neumonía intersticial usual9, 10. En ninguno de estos casos el curso es fulminante, como ocurrió en el aquí descrito.
Los efectos secundarios más frecuentes del etanercept son reacciones cutáneas locales, cefalea e infecciones del aparato respiratorio superior. Son muy pocas las publicaciones que demuestran la relación entre la lesión pulmonar y el tratamiento con etanercept. Sí se han documentado frecuentes infecciones del aparato respiratorio superior en los ensayos clínicos de etarnecept comparado con placebo. En los ensayos clínicos previos a la aprobación del medicamento también se detectaron casos de infecciones oportunistas como tuberculosis, histoplasmosis, infecciones por Pneumocystis jiroveci, listeriosis y aspergilosis, lo que refleja la capacidad del fármaco para modular el sistema inmunitario5.
Peno-Green et al7 describieron un caso de granulomas no caseificantes en una paciente diagnosticada de artritis reumatoide que inició tratamiento con etanercept. Tras retirar dicho medicamento e iniciar tratamiento con prednisona experimentó una franca mejoría. En este caso existe una asociación causa-efecto entre el fármaco y la aparición de los síntomas. En nuestro caso ocurre lo mismo, ya que el paciente refirió que los síntomas (tos seca y disnea de esfuerzo) prácticamente comenzaron al iniciar el tratamiento con etanercept. Sin embargo, a diferencia del caso de Peno-Green et al7, tras interrumpir el tratamiento no se observó mejoría alguna de la clínica, de la radiografía ni de las pruebas de función pulmonar, sino que se desencadenó un empeoramiento rápido y fulminante.
Hemos encontrado un caso de neumonitis que tampoco respondió a la retirada del fármaco causante (gefitinib) y a altas dosis de esteroides11. Por lo tanto, pensamos que el etanercept pudo actuar como factor desencadenante de la fibrosis, aunque no podamos demostrar una mejoría tras su retirada, como suele ocurrir con otras neumonitis secundarias a medicamentos.