Describir el perfil clínico de los pacientes con asma e identificar posibles factores de riesgo para su desarrollo en sujetos mayores de 12 años.
MétodosEstudio multicéntrico de casos y controles. Se reclutó como casos a sujetos entre 12 y 40 años con diagnóstico de asma, con inicio de los síntomas después de los 12 años. Se seleccionó como controles a sujetos entre 12 y 40 años que no tenían asma durante la infancia y que no presentaban síntomas de asma en el momento de realizar el estudio.
ResultadosSe evaluó a 923 sujetos, 247 casos y 671 controles. El 54,9% de ellos eran mujeres. La media de edad de los casos era 28,3±8,2 y la de los controles, 30,8±7,1 años (p<0,001). En el análisis de regresión logística se observó que los factores determinantes de la presencia de asma fueron la hipersensibilidad a animales o a otros alérgenos, la presencia de rinitis, los antecedentes familiares de asma, la profesión de riesgo/exposición a irritantes y la hipersensibilidad/intolerancia a AINE. En dicho análisis se demostró también que la edad era un factor de protección, así como el nivel de estudios.
ConclusionesLos factores de riesgo para el desarrollo de asma en la edad adulta son la hipersensibilidad a animales o a otros alérgenos, la rinitis, los antecedentes familiares de asma, la profesión de riesgo/exposición a irritantes y la hipersensibilidad/intolerancia a AINE, mientras que la edad y el nivel de estudios son factores protectores.
To describe the clinical profile of patients with asthma and to identify possible risk factors for its development in subjects over the age of 12.
Patients and methodsA multicenter study of cases and controls. Recruited for inclusion were case subjects between the ages of 12 and 40 diagnosed with asthma, with an onset of symptoms after the age of 12. Control subjects were selected, with ages between 12 and 40, who did not have childhood asthma and did not present symptoms of asthma at the time of the study.
ResultsWe evaluated 923 subjects: 247 cases and 671 controls. 54.9% were women. Mean age of the cases was 28.3±8.2; mean age of controls was 30.8±7.1 (p<0.001). In the logistic regression analysis, it was observed that the determining factors for the of the presence of asthma were hypersensitivity to animals or other allergens, presence of rhinitis, family history of asthma, occupational risk/exposure to irritants and the hypersensitivity/intolerance to NSAIDs. In said analysis, it was also demonstrated that age was a protection factor, as well as level of education.
ConclusionsThe risk factors for the development of asthma at an adult age are hypersensitivity to animals or other allergens, rhinitis, family history of asthma, occupational risk/exposure to irritants and the hypersensitivity/intolerance to NSAIDs, while age and level of education are protection factors.
El asma es una entidad heterogénea resultante de complejas interacciones entre factores ambientales y genéticos. La expresión de la enfermedad puede variar con la edad, el sexo, el patrón de inflamación en la vía aérea o su severidad, la asociación con atopia u otros factores desencadenantes1. En los últimos años se han descrito varios subtipos clínicos de asma y hasta hoy se desconoce si son variantes de una misma enfermedad o si, por el contrario, son distintas enfermedades que cursan con una sintomatología similar2.
El asma afecta a escala mundial aproximadamente a 300 millones de personas y, a pesar de los notables avances terapéuticos, ocasiona en la actualidad alrededor de 250.000 fallecimientos por año. En España, según los resultados del Estudio Europeo de Salud Respiratoria, la prevalencia es elevada, aunque muestra una clara variación geográfica, entre el 5% de Galdácano y el 14,5% de Huelva3.
Dadas la alta prevalencia y la incidencia que tiene dicha afección en el mundo occidental y sus consecuencias socioeconómicas, existe la necesidad de identificar factores de riesgo que permitan definir posibles estrategias de prevención primaria1,4. En la actualidad, son realmente escasas las recomendaciones con suficiente evidencia científica en la prevención del desarrollo del asma5.
El conocimiento actual sobre los factores de riesgo para el desarrollo del asma proviene mayoritariamente de estudios realizados en niños, pero los implicados en el desarrollo del proceso en adultos están menos definidos4. En estos últimos la atopia se ha asociado al desarrollo de asma, así como con la exposición a los posibles alérgenos presentes en el hogar y a los ambientales, como ocurre con el polen de las gramíneas6.
También se ha descrito una relación estrecha entre la rinitis y el asma, coexistiendo ambas entidades en una gran mayoría de los pacientes y compartiendo factores de riesgo comunes, como sucede con la atopia7. La rinitis alérgica tiende a preceder al asma, y algunos autores proponen a aquella como un factor de riesgo independiente para el desarrollo de asma, incluso en personas mayores de 50 años8. Si se excluyen, además, el tabaquismo y la sinusitis crónica, los factores de riesgo para el desarrollo de asma en la edad adulta no están del todo esclarecidos.
El objetivo de este trabajo es describir el perfil clínico de los pacientes asmáticos e identificar posibles factores de riesgo para el desarrollo de asma en sujetos mayores de 12 años de edad.
Material y métodosDiseño del estudioPara la realización del estudio FENASMA (Fenotipos de Asma), se diseñó un estudio multicéntrico, de casos y controles, que se llevó a cabo entre el 13 de mayo y el 21 de octubre de 2009. El estudio fue revisado y aprobado por el Comité de Ensayos Clínicos del Hospital General Universitario Gregorio Marañón de Madrid.
Población y ámbito de estudioPara reclutar a los pacientes, se recurrió a médicos voluntarios especialistas en neumología y alergología distribuidos por todo el territorio español.
Como criterios de inclusión de los casos se eligió a sujetos de entre 12 y 40 años de edad que acudiesen a consulta por cualquier motivo. Los pacientes debían haber sido diagnosticados de asma en los últimos 12 meses, y no necesariamente en el momento de la inclusión en el estudio. Para el diagnóstico de asma bronquial, debían existir historia clínica compatible y pruebas de función respiratoria que demostrasen una limitación al flujo aéreo reversible y variable, cumpliendo los criterios de las guías internacionales4, y cuyos síntomas hubiesen comenzado después de los 12 años de edad. Los criterios de inclusión de los controles comprendían a sujetos entre 12 y 40 años de edad, sin historia de asma durante la infancia y que no presentaran síntomas subjetivos de esa enfermedad en el momento de la realización del estudio, que acudiesen a consulta con independencia del motivo, sin tener antecedentes de ninguna enfermedad respiratoria crónica. Los controles debían ser incluidos en los primeros 7 días desde la identificación de cada caso. Además, no podían estar relacionados familiarmente con aquel.
Se excluyó a los pacientes que presentaban una enfermedad pulmonar obstructiva crónica (EPOC) o una espirometría compatible con un patrón restrictivo o mixto, individuos menores de 12 años, aquellos que habían padecido una exacerbación de su enfermedad pulmonar en las últimas 4 semanas, pacientes con cualquier impedimento físico o psíquico que dificultara la realización de las pruebas diagnósticas y personas que no dieran su consentimiento para participar en el estudio.
Se calculó la muestra a través de un muestreo probabilístico múltiple estratificado sin reemplazo. La muestra se obtuvo de las 17 regiones autónomas de España. La primera fase consistió en seleccionar especialistas de neumología y alergología de cada región sanitaria. El número de especialistas participantes se eligió proporcionalmente a la población de cada región. La probabilidad de selección de cada clínica/hospital estaba relacionada con la población del área de influencia de dicho centro sanitario. La lista completa de los centros sanitarios a los que estaban adscritos los especialistas se detalla en la sección de agradecimientos. En la segunda fase, se seleccionó un especialista, de manera aleatoria en cada centro, entre los profesionales que tuvieran experiencia tanto en investigación clínica como epidemiológica. La tercera fase consistió en la elección de los pacientes. Se seleccionaron a través de un muestreo sistemático obtenido de la lista diaria de los que tenían cita con cada especialista participante en el estudio. Estos pacientes debían cumplir todos los criterios de inclusión y ninguno de los de exclusión anteriormente comentados.
El tamaño muestral se calculó teniendo en cuenta que la presencia de los factores de riesgo en la población control no debería ser inferior al 5%, considerándose relevante una odds ratio (OR) superior a 2,5 en los casos respecto a los controles, para una potencia estadística del 80% (con corrección de Yates) y una significación del 5%. Para 2 casos por control, era necesario evaluar al menos 648 pacientes, de los que 216 eran casos y 432, controles.
Cuestionarios de recogida de datos (CRD)Cada especialista participante cumplimentó un CRD por paciente, que debía completarse en una única visita, donde se recogieron datos sociodemográficos, de hábito tabáquico, antecedentes personales y familiares, comorbilidades, tratamiento, datos espirométricos y de tests de provocación bronquial, diagnóstico y utilización de recursos sanitarios. Los datos de antecedentes personales, familiares y de comorbilidad fueron referidos por los pacientes y/o extraídos de la historia clínica.
En los casos en que fue necesario realizar tests de provocación bronquial, se siguieron las recomendaciones de la European Respiratory Society y la American Thoracic Society9 para garantizar la reproducibilidad de los datos obtenidos. El panel de pruebas cutáneas a neumoalérgenos se decidió, en cada centro, según las características aerobiológicas de cada zona.
En todos los casos, se recogieron también la escala ACT (Asthma Control Test)10, el cuestionario SGRQ (St George's Respiratory Questionnaire)11 y la escala AQ20 (Airways Questionnaire 20)12 para evaluar el control de la enfermedad y la calidad de vida. Estas escalas están validadas internacionalmente y son utilizadas no sólo en la práctica diaria, sino también en ensayos clínicos de asma. La escala ACT consiste en 5 preguntas que se puntúan de 1 a 5. La puntuación total se obtiene de la suma de todas ellas, con un intervalo de 5 a 25, de manera que, cuanto mayor es la puntuación, mejor es el control del asma. El cuestionario SGRQ sirve para cuantificar el impacto de la enfermedad en el estado de salud y el bienestar por los pacientes y refleja los cambios de actividad de la enfermedad. Está compuesto por 50 ítems repartidos en tres dimensiones: síntomas (frecuencia y gravedad), actividad (limitaciones producidas por la disnea) e impacto (problemas relacionados con el funcionamiento social y psicológico). Las puntuaciones obtenidas tienen un intervalo de 0 a 100, representando este último valor la máxima alteración de la calidad de vida. Por último, la escala AQ20 es un cuestionario abreviado de calidad de vida que consta de 20 ítems y que se puntúa entre 0 y 20, de manera que, a mayor puntuación, peor calidad de vida.
Análisis estadísticoLa población que se utilizó para el análisis estadístico incluyó a todos los pacientes seleccionados que cumplieron los criterios de inclusión y ninguno de los criterios de exclusión.
Los CRD presentaban ausencia de información (no cumplimentada por el investigador) en diversas variables de análisis. Por este motivo, los resultados que se muestran se calcularon a partir de los sujetos que presentaban el dato. Los tamaños de muestra pueden oscilar en las distintas variables y son inferiores al tamaño de muestra de la población evaluable.
Se realizó una estadística descriptiva de todos los parámetros, que incluyó mediciones de la tendencia central y de dispersión, con su intervalo de confianza del 95% a dos colas para las variables cuantitativas, así como frecuencias absolutas y relativas para las variables cualitativas.
Se estudió la distribución de las variables cuantitativas y se evaluó su ajuste a la distribución de Gauss a partir del test de Kolmogorov-Smirnov. Si los datos no cumplían las suposiciones de normalidad para el análisis, se usaron métodos estadísticos no paramétricos.
En la comparación de datos independientes (casos versus controles), se obtuvo la razón de odds (odds ratio) con su intervalo de confianza del 95%. Se calculó la significación estadística a partir del test de la χ2. En el caso de variables cuantitativas se utilizó la prueba de la t de Student o, en el caso de que no siguieran una distribución normal, el test de la U de Mann-Whitney.
Para la comparación entre los resultados obtenidos por la escala ACT y el cuestionario SGRQ se utilizó el coeficiente de correlación de Pearson.
Para determinar los factores predictores sociodemográficos y clínicos asociados con el control del asma, se realizó un modelo de regresión logística multivariante. Las pruebas estadísticas se realizaron con un nivel de significación del 5% y fueron bilaterales. Se utilizó el paquete estadístico SAS® versión 8.2 para realizar todos los análisis estadísticos.
ResultadosUn total de 369 investigadores reclutaron a 1.475 sujetos. De ellos, 552 (37,6%) fueron excluidos por no cumplir los criterios de selección. En la muestra final, se incluyó a 918 sujetos (62,6%), de los que 247 eran casos (26,9%) y 671, controles (73,1%). Se excluyeron 490 casos y 62 controles.
Los motivos de exclusión de los casos fueron el diagnóstico de asma anterior a los 12 meses (467), el inicio de síntomas indicativos de asma antes de los 12 años de edad (69), ser menor de 12 o mayor de 40 años de edad (59), tener una espirometría compatible con un patrón restrictivo o mixto (4), datos incompletos (1) y/o falta de consentimiento informado (1). Los controles fueron excluidos por ser de una edad menor de 12 o mayor de 40 años (56), presentar alguna enfermedad respiratoria crónica (6), hallarse los datos incompletos (1) y/o falta de consentimiento informado (1).
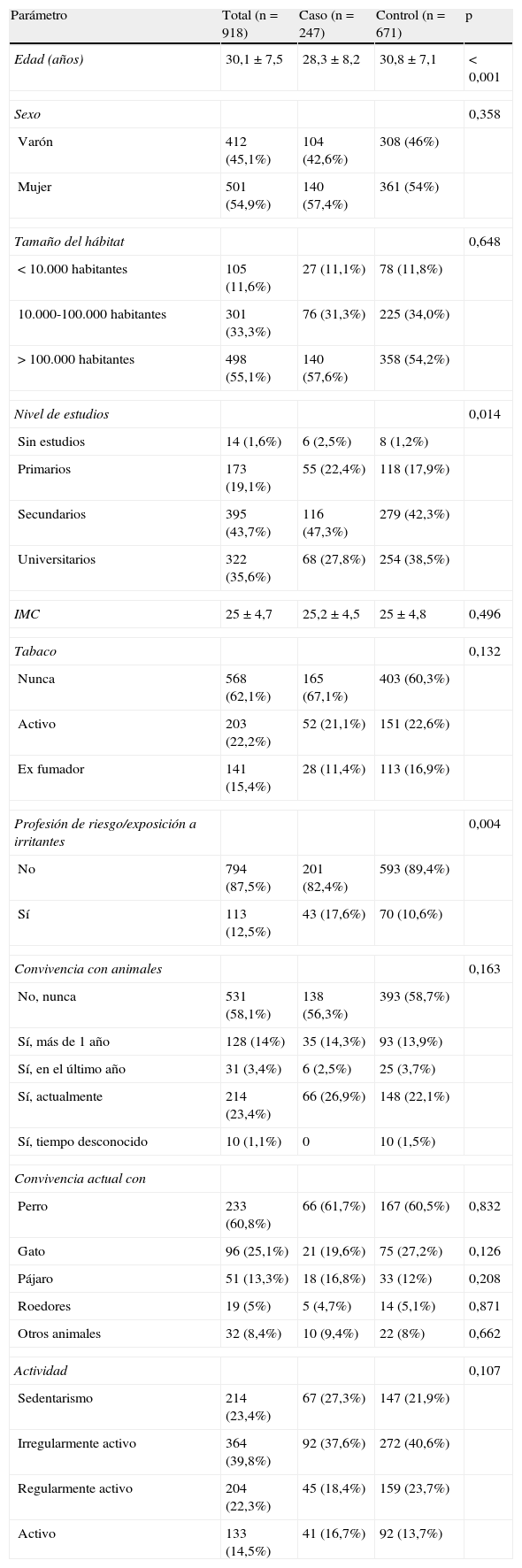
Las características de los pacientes se reflejan en la tabla 1. El 54,9% eran mujeres. La media de edad era de 30,1±7,5 años. En el grupo caso la media de edad era de 28,3±8,2 años (p<0,0001). El 43,7% de los sujetos tenían estudios secundarios; el 35,6%, estudios universitarios, y el 19,1%, estudios primarios.
Datos sociodemográficos de los pacientes incluidos en el estudio. Se realizó una estadística descriptiva de todos los parámetros, que incluyó mediciones de la tendencia central y dispersión con su intervalo de confianza del 95% a dos colas para las variables cuantitativas, así como frecuencias absolutas y relativas para las variables cualitativas
| Parámetro | Total (n=918) | Caso (n=247) | Control (n=671) | p |
| Edad (años) | 30,1±7,5 | 28,3±8,2 | 30,8±7,1 | < 0,001 |
| Sexo | 0,358 | |||
| Varón | 412 (45,1%) | 104 (42,6%) | 308 (46%) | |
| Mujer | 501 (54,9%) | 140 (57,4%) | 361 (54%) | |
| Tamaño del hábitat | 0,648 | |||
| < 10.000 habitantes | 105 (11,6%) | 27 (11,1%) | 78 (11,8%) | |
| 10.000-100.000 habitantes | 301 (33,3%) | 76 (31,3%) | 225 (34,0%) | |
| > 100.000 habitantes | 498 (55,1%) | 140 (57,6%) | 358 (54,2%) | |
| Nivel de estudios | 0,014 | |||
| Sin estudios | 14 (1,6%) | 6 (2,5%) | 8 (1,2%) | |
| Primarios | 173 (19,1%) | 55 (22,4%) | 118 (17,9%) | |
| Secundarios | 395 (43,7%) | 116 (47,3%) | 279 (42,3%) | |
| Universitarios | 322 (35,6%) | 68 (27,8%) | 254 (38,5%) | |
| IMC | 25±4,7 | 25,2±4,5 | 25±4,8 | 0,496 |
| Tabaco | 0,132 | |||
| Nunca | 568 (62,1%) | 165 (67,1%) | 403 (60,3%) | |
| Activo | 203 (22,2%) | 52 (21,1%) | 151 (22,6%) | |
| Ex fumador | 141 (15,4%) | 28 (11,4%) | 113 (16,9%) | |
| Profesión de riesgo/exposición a irritantes | 0,004 | |||
| No | 794 (87,5%) | 201 (82,4%) | 593 (89,4%) | |
| Sí | 113 (12,5%) | 43 (17,6%) | 70 (10,6%) | |
| Convivencia con animales | 0,163 | |||
| No, nunca | 531 (58,1%) | 138 (56,3%) | 393 (58,7%) | |
| Sí, más de 1 año | 128 (14%) | 35 (14,3%) | 93 (13,9%) | |
| Sí, en el último año | 31 (3,4%) | 6 (2,5%) | 25 (3,7%) | |
| Sí, actualmente | 214 (23,4%) | 66 (26,9%) | 148 (22,1%) | |
| Sí, tiempo desconocido | 10 (1,1%) | 0 | 10 (1,5%) | |
| Convivencia actual con | ||||
| Perro | 233 (60,8%) | 66 (61,7%) | 167 (60,5%) | 0,832 |
| Gato | 96 (25,1%) | 21 (19,6%) | 75 (27,2%) | 0,126 |
| Pájaro | 51 (13,3%) | 18 (16,8%) | 33 (12%) | 0,208 |
| Roedores | 19 (5%) | 5 (4,7%) | 14 (5,1%) | 0,871 |
| Otros animales | 32 (8,4%) | 10 (9,4%) | 22 (8%) | 0,662 |
| Actividad | 0,107 | |||
| Sedentarismo | 214 (23,4%) | 67 (27,3%) | 147 (21,9%) | |
| Irregularmente activo | 364 (39,8%) | 92 (37,6%) | 272 (40,6%) | |
| Regularmente activo | 204 (22,3%) | 45 (18,4%) | 159 (23,7%) | |
| Activo | 133 (14,5%) | 41 (16,7%) | 92 (13,7%) | |
El índice de masa corporal (IMC) medio era de 25±4,7. Según la clasificación de la OMS el 54,2% de los pacientes tenía normopeso, mientras que el resto presentaba obesidad en diferentes grados13. No se observaron diferencias estadísticamente significativas entre los distintos grupos.
El 22,2% de los sujetos evaluados eran fumadores activos, sin diferencias significativas entre los grupos. El número medio de cigarrillos diarios en la muestra era de 12,9±8, siendo menor en el grupo caso, que fue de 11,4±7,8, mientras que en el grupo control fue de 13,4±81 (p=0,047). El número medio de años fumando era de 11,3±6,2, sin apreciarse diferencias. El índice paquetes-año de los casos era de 6,1±5,6 y el de los controles, de 8,4±7,4 (p=0,004).
El 12,5% de los individuos estudiados tenía una profesión de riesgo o estaba expuesto a irritantes ambientales, siendo más frecuente en el grupo caso (p=0,004). Entre los agentes irritantes a los que los pacientes referían estar expuestos en el entorno laboral destacaron las sustancias de limpieza (26,1%), los humos (26,2%) y los agentes químicos (15,3%).
Los alérgenos a los que los casos estaban sensibilizados fueron principalmente inhalantes. Los pólenes se reflejaron en un 61,5%, los ácaros en el 59,8% y los epitelios de animales en el 25,5%, respectivamente. Sólo la alergia a los ácaros (p=0,026) y a los animales (p<0,001) arrojó diferencias significativas entre los casos y los controles.
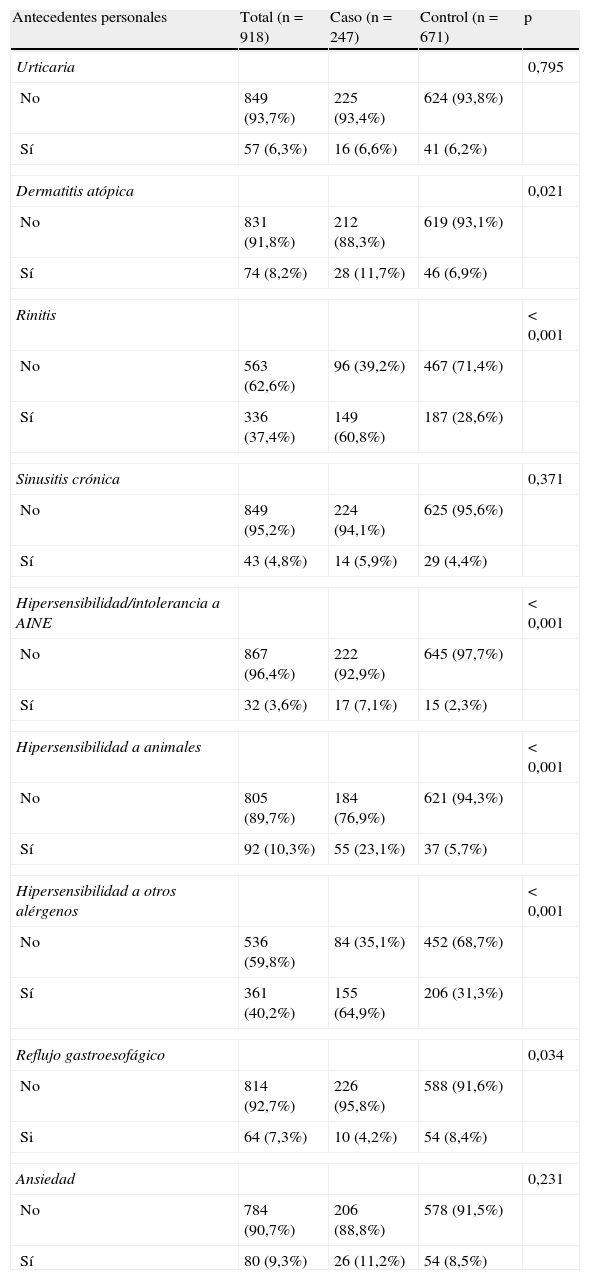
Respecto a los antecedentes personales (tabla 2), la media de edad de inicio de dichos antecedentes fue de 24,1±11,2 años en el caso de la dermatitis atópica; en la rinitis, de 18,9±8 años, en la hipersensibilidad o intolerancia a AINE, de 24,8±10,7 años, y en los trastornos por ansiedad, de 25,6±7,6 años. Se encontraron diferencias estadísticamente significativas en la dermatitis atópica, la rinitis, la hipersensibilidad o intolerancia a antiinflamatorios no esteroideos (AINE), la hipersensibilidad a otros alérgenos y la enfermedad por reflujo gastroesofágico.
Antecedentes personales
| Antecedentes personales | Total (n=918) | Caso (n=247) | Control (n=671) | p |
| Urticaria | 0,795 | |||
| No | 849 (93,7%) | 225 (93,4%) | 624 (93,8%) | |
| Sí | 57 (6,3%) | 16 (6,6%) | 41 (6,2%) | |
| Dermatitis atópica | 0,021 | |||
| No | 831 (91,8%) | 212 (88,3%) | 619 (93,1%) | |
| Sí | 74 (8,2%) | 28 (11,7%) | 46 (6,9%) | |
| Rinitis | < 0,001 | |||
| No | 563 (62,6%) | 96 (39,2%) | 467 (71,4%) | |
| Sí | 336 (37,4%) | 149 (60,8%) | 187 (28,6%) | |
| Sinusitis crónica | 0,371 | |||
| No | 849 (95,2%) | 224 (94,1%) | 625 (95,6%) | |
| Sí | 43 (4,8%) | 14 (5,9%) | 29 (4,4%) | |
| Hipersensibilidad/intolerancia a AINE | < 0,001 | |||
| No | 867 (96,4%) | 222 (92,9%) | 645 (97,7%) | |
| Sí | 32 (3,6%) | 17 (7,1%) | 15 (2,3%) | |
| Hipersensibilidad a animales | < 0,001 | |||
| No | 805 (89,7%) | 184 (76,9%) | 621 (94,3%) | |
| Sí | 92 (10,3%) | 55 (23,1%) | 37 (5,7%) | |
| Hipersensibilidad a otros alérgenos | < 0,001 | |||
| No | 536 (59,8%) | 84 (35,1%) | 452 (68,7%) | |
| Sí | 361 (40,2%) | 155 (64,9%) | 206 (31,3%) | |
| Reflujo gastroesofágico | 0,034 | |||
| No | 814 (92,7%) | 226 (95,8%) | 588 (91,6%) | |
| Si | 64 (7,3%) | 10 (4,2%) | 54 (8,4%) | |
| Ansiedad | 0,231 | |||
| No | 784 (90,7%) | 206 (88,8%) | 578 (91,5%) | |
| Sí | 80 (9,3%) | 26 (11,2%) | 54 (8,5%) | |
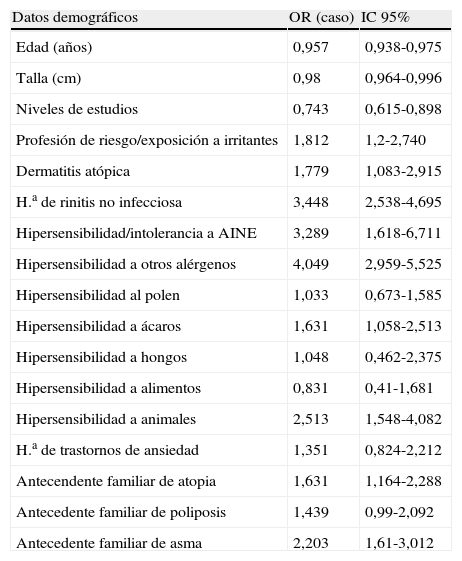
Al correlacionar las odds ratio y el IC del 95% según grupos de análisis, se comprobó que los pacientes con historia de rinitis no infecciosa tenían 3,4 veces más riesgo de desarrollar asma; los que tenían hipersensibilidad o intolerancia a AINE, 3,3 veces más, y aquellos con hipersensibilidad a otros alérgenos (polen, ácaros, hongos, animales), 4 veces más (tabla 3). Entre las variables analizadas, la edad (OR=0,969; IC95%, 0,948-0,991) y el nivel de estudios (OR=0,684; IC95%, 0,546-0,856) demostraron ser factores protectores. De las comorbilidades investigadas, sólo la urticaria, la sinusitis crónica y los trastornos de ansiedad no demostraron relacionarse con el diagnóstico de asma bronquial.
Odds ratio (OR) e IC 95% según grupos de análisis. Las OR superiores a 1 indican que los pacientes con la característica analizada tienen más riesgo de padecer asma que los que no la presentan
| Datos demográficos | OR (caso) | IC 95% |
| Edad (años) | 0,957 | 0,938-0,975 |
| Talla (cm) | 0,98 | 0,964-0,996 |
| Niveles de estudios | 0,743 | 0,615-0,898 |
| Profesión de riesgo/exposición a irritantes | 1,812 | 1,2-2,740 |
| Dermatitis atópica | 1,779 | 1,083-2,915 |
| H.a de rinitis no infecciosa | 3,448 | 2,538-4,695 |
| Hipersensibilidad/intolerancia a AINE | 3,289 | 1,618-6,711 |
| Hipersensibilidad a otros alérgenos | 4,049 | 2,959-5,525 |
| Hipersensibilidad al polen | 1,033 | 0,673-1,585 |
| Hipersensibilidad a ácaros | 1,631 | 1,058-2,513 |
| Hipersensibilidad a hongos | 1,048 | 0,462-2,375 |
| Hipersensibilidad a alimentos | 0,831 | 0,41-1,681 |
| Hipersensibilidad a animales | 2,513 | 1,548-4,082 |
| H.a de trastornos de ansiedad | 1,351 | 0,824-2,212 |
| Antecendente familiar de atopia | 1,631 | 1,164-2,288 |
| Antecedente familiar de poliposis | 1,439 | 0,99-2,092 |
| Antecedente familiar de asma | 2,203 | 1,61-3,012 |
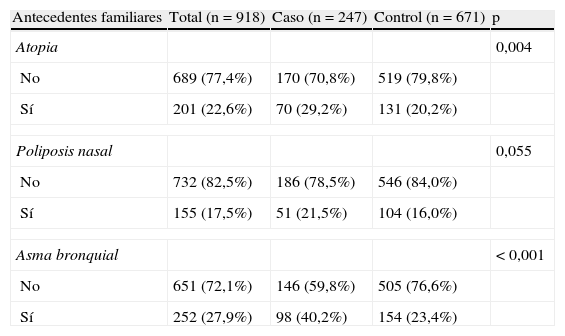
En la tabla 4 se recogen los antecedentes familiares. El 29,2% de los pacientes con asma tenía antecedentes familiares de atopia. De estos, el 80,6% eran familiares de primer grado, sin diferencias entre los grupos. El más frecuente fue el de asma bronquial, presente en el 27,9% de los sujetos. El antecedente familiar de asma estaba presente en un 40,2% de los casos, frente a un 23,4% de los controles (p<0,001). Este antecedente se detectaba con mayor frecuencia en los familiares de primer grado en los casos (77,6%) en comparación con los controles (64,9%) (p=0,0333).
Antecedentes familiares
| Antecedentes familiares | Total (n=918) | Caso (n=247) | Control (n=671) | p |
| Atopia | 0,004 | |||
| No | 689 (77,4%) | 170 (70,8%) | 519 (79,8%) | |
| Sí | 201 (22,6%) | 70 (29,2%) | 131 (20,2%) | |
| Poliposis nasal | 0,055 | |||
| No | 732 (82,5%) | 186 (78,5%) | 546 (84,0%) | |
| Sí | 155 (17,5%) | 51 (21,5%) | 104 (16,0%) | |
| Asma bronquial | < 0,001 | |||
| No | 651 (72,1%) | 146 (59,8%) | 505 (76,6%) | |
| Sí | 252 (27,9%) | 98 (40,2%) | 154 (23,4%) | |
La edad media del inicio de los síntomas del asma fue 24±8 años y la edad media del diagnóstico, de 27,4±8,2. El 31,9% de los pacientes presentaban asma intermitente; el 41,5%, asma persistente leve, y el 25,8%, asma persistente moderada. Sólo el 0,9% presentaba asma persistente grave.
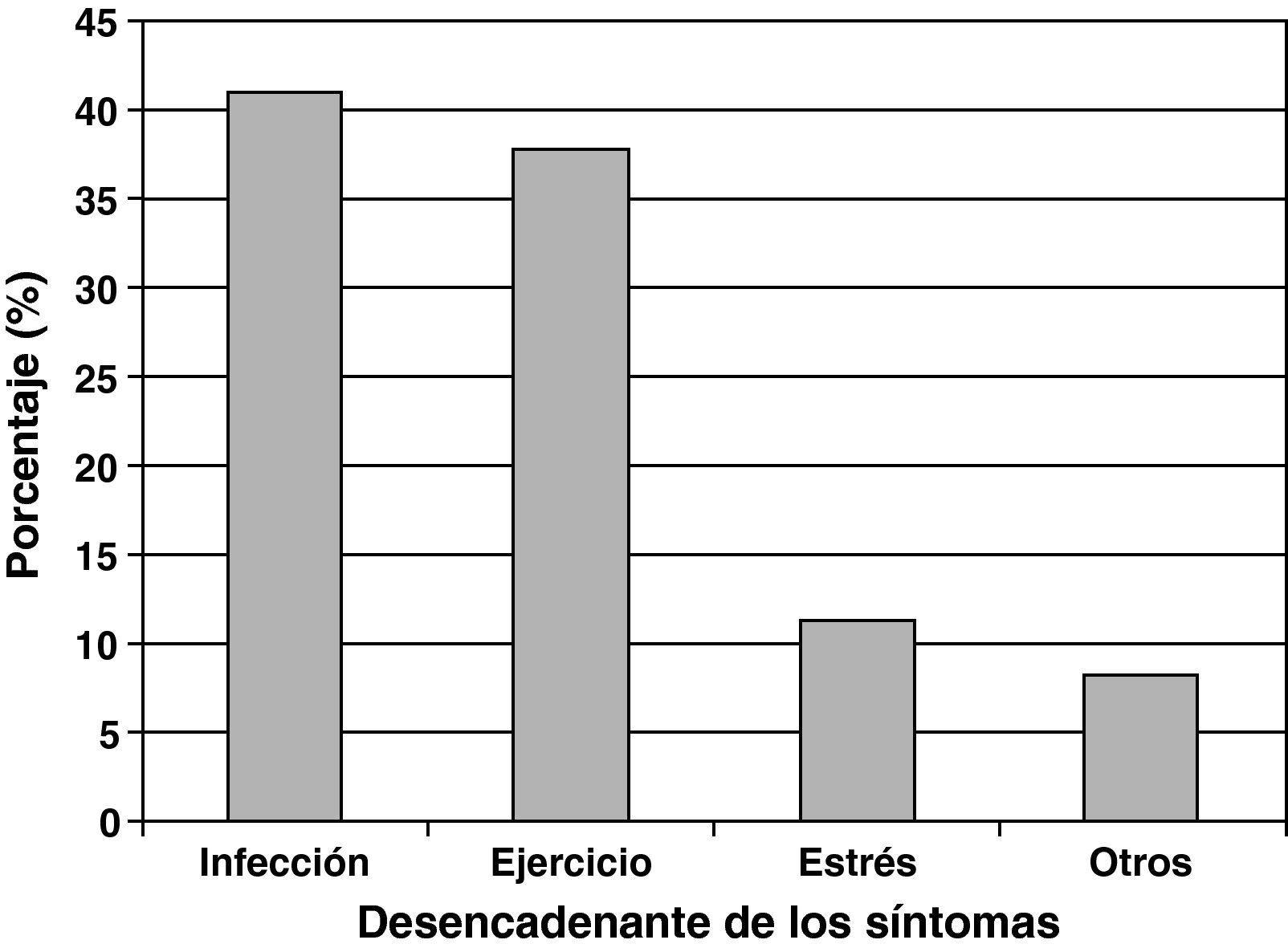
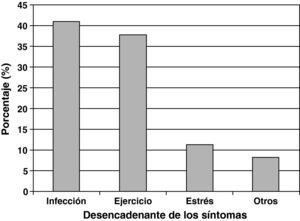
Los agentes más frecuentemente referidos como precipitantes de exacerbaciones de asma fueron las infecciones respiratorias (40,9%), seguidos por el ejercicio físico (37,7%) y el estrés emocional (11,3%) (fig. 1).
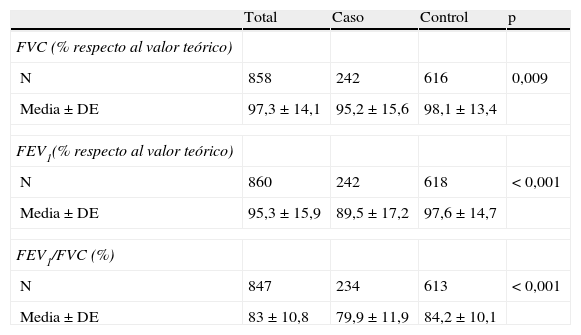
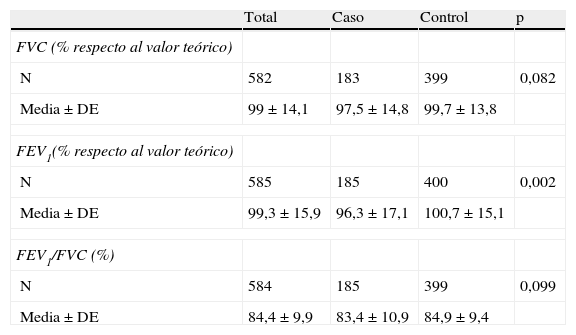
En las tablas 5 y 6 se describen las espirometrías antes y después de la broncodilatación, respectivamente. La relación entre el volumen espiratorio forzado en el primer segundo y la capacidad vital forzada (FEV1/FCV) presentó diferencias estadísticamente significativas (p<0,001). La relación FEV1/FVC en la espirometría tras la broncodilatación no mostró diferencias que fueran estadísticamente significativas. Al correlacionar las odds ratio y el IC95% según grupos de análisis, se observó que los pacientes con una relación FEV1/FVC prebroncodilatación menor tenían 1,04 veces más riesgo de desarrollar asma y aquellos con menor FEV1 posbroncodilatación tenían 1,02 veces más riesgo de padecer asma.
Espirometría prebroncodilatación
| Total | Caso | Control | p | |
| FVC (% respecto al valor teórico) | ||||
| N | 858 | 242 | 616 | 0,009 |
| Media±DE | 97,3±14,1 | 95,2±15,6 | 98,1±13,4 | |
| FEV1(% respecto al valor teórico) | ||||
| N | 860 | 242 | 618 | < 0,001 |
| Media±DE | 95,3±15,9 | 89,5±17,2 | 97,6±14,7 | |
| FEV1/FVC (%) | ||||
| N | 847 | 234 | 613 | < 0,001 |
| Media±DE | 83±10,8 | 79,9±11,9 | 84,2±10,1 | |
Espirometría posbroncodilatación
| Total | Caso | Control | p | |
| FVC (% respecto al valor teórico) | ||||
| N | 582 | 183 | 399 | 0,082 |
| Media±DE | 99±14,1 | 97,5±14,8 | 99,7±13,8 | |
| FEV1(% respecto al valor teórico) | ||||
| N | 585 | 185 | 400 | 0,002 |
| Media±DE | 99,3±15,9 | 96,3±17,1 | 100,7±15,1 | |
| FEV1/FVC (%) | ||||
| N | 584 | 185 | 399 | 0,099 |
| Media±DE | 84,4±9,9 | 83,4±10,9 | 84,9±9,4 | |
Se realizó una prueba de provocación bronquial con metacolina o histamina al 15,7% de los pacientes del grupo caso y al 5,5% de los sujetos del grupo control, a la edad de 26,8±7,5 años y 28,9±8,3, respectivamente. El resultado fue positivo en 43 de los 68 pacientes a los que se les realizó una prueba de provocación bronquial (63,2%), más frecuentemente en el grupo caso (94,4%) que en el grupo de los controles (p<0,001). Los pacientes a quienes se realizó una prueba de provocación con metacolina o histamina tuvieron 3,2 veces más riesgo de desarrollar asma, y aquellos en los que la prueba tuvo un resultado positivo tuvieron 43,5 veces más riesgo.
Todos los pacientes a los que se realizó test de provocación bronquial contaban con una prueba broncodilatadora previa, por lo que el número de sujetos sometidos a todos los estudios fue de 38 casos y 35 controles.
Otro de los aspectos evaluados en este estudio fueron las escalas de control y calidad de vida del asma. La puntuación media de la escala ACT en el grupo de pacientes con esta enfermedad fue de 20,5±3,8. El 30,9% presentaba un control insuficiente del asma. En relación con el cuestionario SGRQ, la puntuación media del dominio de «síntomas» fue de 41,2±17,4; la del dominio «actividad», de 26,7±21,7, y la del dominio «impacto», de 34,4±12,1, siendo la puntuación total media de 33,1±13,7. Por último, la puntuación media total en la escala AQ20 fue de 6±3,9.
DiscusiónEn este estudio se demuestra que las variables asociadas con la presencia de asma en la población entre 12 y 40 años son la hipersensibilidad a animales, el nivel de estudios, la hipersensibilidad a otros alérgenos, la rinitis, la edad, los antecedentes familiares de asma, la exposición laboral a irritantes y la hipersensibilidad o intolerancia a AINE. Mientras que la edad más avanzada y el mayor nivel de estudios se comportan como factores protectores para la aparición de asma bronquial, la hipersensibilidad a epitelios de animales y otros alérgenos, la rinitis, los antecedentes familiares de asma, la exposición laboral a irritantes y la hipersensibilidad o intolerancia a AINE se comportan como factores de riesgo independientes.
Uno de los hallazgos más interesantes entre los sujetos de nuestra muestra es el hecho de que el riesgo de presentar asma disminuye con la edad de los pacientes. Este dato está acorde con los que se desprenden de estudios previos, como los llevados a cabo en el Reino Unido y Australia, que efectuaron un seguimiento hasta la edad de 33 y 35 años, respectivamente, de niños que habían comenzado a padecer asma en edades tempranas de la vida14,15.
Según los resultados de nuestro trabajo, cuanto menor es el nivel cultural del paciente, mayor riesgo tiene de presentar asma. Se ha argumentado en este sentido, por parte de algunos autores, que el menor estatus socioeconómico y el bajo nivel cultural podrían explicar la mayor prevalencia de asma en ciertos grupos étnicos, como los portorriqueños que residen en Norteamérica16. Sin embargo, en la actualidad no hay datos consistentes que establezcan un nexo claro entre el riesgo de padecer asma y el nivel socioeconómico17.
La sensibilización a epitelios de animales parece tener una clara relación con el asma en adultos. Se ha demostrado que los aeroalérgenos procedentes de los perros y los gatos se asocian a partículas de menor tamaño que otras fuentes alergénicas, lo que facilita su penetración en las vías aéreas inferiores y aumenta su potencial patogénico18. Pero, paradójicamente, la presencia de animales en el domicilio no parece relacionarse con el diagnóstico de asma, lo que concuerda con las notificaciones que se han realizado acerca de la inocuidad del epitelio de perro, o incluso su papel protector. En el caso de los gatos, los resultados hasta el momento han sido más dispares19.
En los sujetos evaluados en el presente estudio, es notable la incidencia de rinitis y poliposis nasal en pacientes con asma, que a su vez condicionan una mayor severidad de esta última. Estudios prospectivos de hasta 20 años de seguimiento permiten afirmar que la rinitis es un factor de riesgo para el desarrollo y la gravedad del asma. Numerosos estudios muestran que ambas entidades a menudo coexisten en el mismo paciente, presentando gran parte de los asmáticos síntomas de rinitis. La rinitis aparece en el 75% de los pacientes con asma alérgica y en el 80% con asma no alérgica20,21. Un estudio multicéntrico español sobre la coexistencia de rinitis y asma corrobora la alta prevalencia de la referida asociación en pacientes alérgicos, afectando al 89,5% de un total de 942 incluidos en el estudio22.
En nuestro estudio, queda patente la importancia de los antecedentes familiares como factor de riesgo para el diagnóstico de asma en el adulto. Si bien, hasta la actualidad, esta tendencia a la agregación familiar deja poco lugar a la duda23–25, los intentos por establecer un patrón de herencia han sido infructuosos, probablemente debido a que el asma bronquial pueda ser la expresión fenotípica de diferentes genotipos26.
En lo que respecta a la exposición a ciertos agentes irritantes del medio ambiente, el presente estudio ha demostrado que es un factor de riesgo para el desarrollo de asma en adultos. En el caso del asma ocupacional, se ha comprobado que la exposición continuada al agente causal está asociada con un peor pronóstico y con una disminución más acelerada de la función pulmonar27,28.
La relación entre el asma del adulto y la intolerancia a AINE es bien conocida. Entre el 5 y el 10% de los adultos asmáticos presentan exacerbaciones tras la administración de ácido acetilsalicílico29, asociándose en la característica tríada ASA (asma, intolerancia a AINE y poliposis nasosinusal). Nuestro hallazgo corrobora esta relación en la misma línea que otros estudios ya lo habían hecho antes29–31.
De acuerdo con numerosos estudios previos, también nosotros hemos podido constatar que en nuestros pacientes las infecciones respiratorias pueden exacerbar el asma bronquial, pues es sabido que tienen la capacidad de incrementar el grado de hiperreactividad bronquial32 y de producir diversas alteraciones en las vías aéreas que comprometen el mantenimiento de su función33.
Aunque en nuestro estudio el hábito de fumar no ha mostrado diferencias estadísticamente significativas entre casos y controles, es conocida la mayor severidad del asma en los fumadores activos34. Asimismo, tanto el tabaquismo como el padecimiento de rinitis predicen un gran riesgo de desarrollar asma bronquial en el futuro35.
Aunque es sabido que la menor actividad física y el riesgo de desarrollar obesidad están estrechamente relacionados, en nuestro estudio no se observaron diferencias estadísticamente significativas entre los casos y los controles a este respecto. Este hecho contrasta con los datos obtenidos por la National Asthma Survey36,37 en cuanto al nivel de sedentarismo y sobrepeso u obesidad y su influencia en el asma, que establece una relación entre la obesidad y la severidad del asma en los adultos norteamericanos que los padecen. En este sentido, en un estudio multicéntrico publicado recientemente en Norteamérica, efectuado en una población de 368 adolescentes entre 12 y 20 años con asma moderada-severa, se ha observado que la adiposidad se asocia con un peor control del asma únicamente en mujeres, habiéndose evidenciado un mejor control de la enfermedad en los varones por influjo de la adiponectina38. Sin embargo, en 2002 Phelan et al. publicaron un estudio sobre factores de riesgo en el asma del adulto efectuado en gemelos monocigóticos y dicigóticos, en el cual se halló un efecto protector del estilo de vida sedentario en el riesgo de padecer asma, señalando que un exceso de actividad física se consideraría un factor de riesgo para que un sujeto tenga episodios de broncospasmo39, lo a su vez podría relacionarse con nuestro hallazgo.
El presente estudio posee algunas limitaciones que deben tenerse en cuenta. Puesto que es un estudio transversal, no podemos establecer relaciones causales ni realizar una evaluación temporal en las conclusiones. Por otra parte, dado, que se ha seleccionado a pacientes entre 12 y 40 años, hemos dejado de evaluar un porcentaje elevado de pacientes asmáticos, por lo que las conclusiones obtenidas solo pueden extrapolarse a este grupo de edad.
Asimismo, el estudio se encuentra limitado por el hecho de que el reclutamiento de casos se apoya en que estos aseguren no haber presentado síntomas antes de los 12 años. En este punto puede aparecer un sesgo de memoria evidente, dado que especialmente los pacientes con historia de asma a edades tempranas es posible que no sean capaces de referirlo durante el interrogatorio médico. Esto cobra más importancia al tener en cuenta que un 31% de la muestra presenta síntomas de forma intermitente, entre los que sería más frecuente el sesgo de memoria.
También el hecho de que no todos los pacientes se sometiesen a la prueba de broncodilatación y al test de provocación bronquial con metacolina o histamina podría hacer incurrir al estudio en un sesgo de selección, puesto que pacientes considerados asmáticos podrían no serlo, a pesar de contar con un cuadro clínico compatible. Esto no parece afectar al grupo de controles, ya que estos no contaban con clínica subjetiva de asma bronquial.
En conclusión, existen diferentes variables asociadas con el desarrollo de asma en la edad adulta. El conocimiento de estas puede ayudar a prevenir la aparición de esta enfermedad en dicha población. Por ello, se requieren estudios longitudinales que permitan dilucidar el papel de estos factores en el desarrollo del asma en el adulto.
FinanciaciónPfizer.
Conflicto de interesesVerónica Sanz de Burgoa Gómez-Piñán es trabajadora de Pfizer. El resto de los autores no tienen conflicto de intereses.
Los autores del estudio quieren agradecer la colaboración prestada por los diferentes centros en los que se ha reclutado a los casos y controles: Hospital USP La Esperanza (Álava), Centro de Salud Amurrio (Álava), Hospital General de Almansa (Albacete), Hospital del Perpetuo Socorro (Albacete), Hospital General de Albacete (Albacete), Hospital Virgen de la Altagracia (Albacete), Hospital de Levante (Alicante), Hospital General de Elda (Alicante), CSI Villena (Alicante), Hospital General Universitario de Elche (Alicante), Hospital General de Alicante (Alicante), Hospital Universitario San Juan de Alicante (Alicante), Hospital Vega Baja (Alicante), Hospital de Alcoy (Alicante), Hospital San Vicente (Alicante), Hospital Torrevieja Salud (Alicante), Hospital de Denia (Alicante), Hospital Torrecárdenas (Almería), Hospital del Poniente (Almería), Hospital La Inmaculada (Almería), Hospital Valle del Nalón (Asturias), Hospital de Avilés (Asturias), Hospital de San Agustín (Asturias), Hospital Universitario Central de Asturias (Asturias), Hospital Alvarez Buylla (Asturias), Hospital de Cabueñes (Asturias), Hospital de Jove (Asturias), CE Ávila Estación (Ávila), Hospital Infanta Cristina (Badajoz), Hospital Comarcal de Zafra (Badajoz), Hospital Infanta Cristina (Badajoz), CS San José de Almendralejo (Badajoz), Hospital de Llerena (Badajoz), Corporación Parc Taulí (Barcelona), Hospital ABS Sant Fèlix (Barcelona), CAP Pare Claret (Barcelona), Hospital Santa Creu i Sant Pau (Barcelona), CAP Central (Barcelona), Hospital de Mataró (Barcelona), Hospital de Viladecans (Barcelona), Hospital de Sant Boi (Barcelona), Hospital General de Granollers (Barcelona), Hospital General de Vic (Barcelona), CAP Sant Feliu (Barcelona), Hospital Germans Trias i Pujol (Barcelona), CS Can Mora (Barcelona), Hospital ABS Numancia (Barcelona), CAP Poble Nou (Barcelona), Hospital General de Hospitalet (Barcelona), Hospital Espirit Sant (Barcelona), Hospital Universitario de Bellvitge (Barcelona), Clínica d’Especialitats (Barcelona), CAP Pineda de Mar (Barcelona), CAP Sant Andreu (Barcelona), Hospital Vall d’Hebron (Barcelona), Hospital Sant Joan de Déu (Barcelona), Hospital del Mar (Barcelona), CS Gava (Barcelona), Hospital de Terrassa (Barcelona), Centro Médico Cataluña (Barcelona), CAP Maragall (Barcelona), CAP Roger de Flor (Barcelona), Complejo Asistencial Burgos (Burgos), Hospital General Yagüe (Burgos), Hospital Ciudad de Coria (Cáceres), Hospital Navalmoral de la Mata (Cáceres), Hospital Virgen del Puerto (Cáceres), Hospital San Pedro de Alcántara (Cáceres), CS Argel (Cáceres), Ambulatorio de Especialidades San Benito (Cáceres), Hospital Puerta del Mar (Cádiz), CS Barrio Bajo (Cádiz), Hospital de La Línea (Cádiz), Hospital Virgen del Camino (Cádiz), Hospital Punta Europa (Cádiz), Hospital General de la Defensa San Carlos (Cádiz), Centro Médico API (Cádiz), Hospital Marqués de Valdecilla (Cantabria), Hospital Sierrallana (Cantabria), Hospital General de Castellón (Castellón), Hospital Comarcal de Vinaroz (Castellón), Complejo Hospitalario Provincial de Castellón (Castellón), Hospital Ingesa (Ceuta), Hospital General de Ciudad Real (Ciudad Real), Hospital General de La Mancha (Ciudad Real), Hospital Santa Bárbara (Ciudad Real), Hospital Universitario Reina Sofía (Córdoba), Hospital Infanta Margarita (Córdoba), Hospital Virgen de la Luz (Cuenca), Hospital de Palamós (Gerona), Hospital Dr. Josep Trueta (Gerona), CS Santa Caterina (Gerona), Hospital de Blanes (Gerona), Hospital de Figueres (Gerona), CS Armilla (Granada), Hospital Universitario San Cecilio (Granada), Hospital Ruiz de Alda (Granada), Hospital Virgen de las Nieves (Granada), Hospital General de Guadalajara (Guadalajara), CS Ondarreta (Guipúzcoa), CS Lasarte (Guipúzcoa), CS Irún (Guipúzcoa), Policlínica Alto Aragón (Huesca), CE Virgen de la Cinta (Huelva), Policlínica Miramar (Baleares), Hospital Son Llàtzer (Baleares), Clínica Palma Planes (Baleares), Clínica Juaneda (Baleares), Hospital Son Dureta (Baleares), Hospital de Manacor (Baleares), Centro USP Sa Pobla (Baleares), EPH Alto Guadalquivir (Jaén), Ambulatorio Virgen de la Capilla (Jaén), Hospital de Úbeda (Jaén), Hospital Médico Quirúrgico (Jaén), Hospital de San Agustín (Jaén), CS Federico del Castillo (Jaén), Hospital Naval (La Coruña), Complejo Hospitalario de Ferrol (La Coruña), Hospital Modelo (La Coruña), Complejo Hospitalario Universitario A Coruña (La Coruña), Hospital Arquitecto Marcide (La Coruña), CHU A Coruña (La Coruña), Hospital Provincial de Conxo (La Coruña), Complejo Hospitalario Universitario de Santiago (La Coruña), Hospital San Pedro (La Rioja), Hospital Insular (Las Palmas), CS Maspalomas (Las Palmas), Hospital Dr. Negrín (Las Palmas), Centro Médico Finlay (Las Palmas), CS Casa del Mar (Las Palmas), CS Mogan (Las Palmas), Hospital Sur (Las Palmas), Hospital de León (León), Centro Médico Gran Vía (León), Hospital El Bierzo (León), CS Alcarras (Lérida), Hospital Sta. María de Lleida (Lérida), Hospital Xeral Calde (Lugo), CS Valadouro (Lugo), CS Foz (Lugo), Hospital Puerta del Hierro (Madrid), Hospital del Tajo (Madrid), Hospital Infanta Elena (Madrid), Hospital La Paz (Madrid), Hospital General Universitario Gregorio Marañón (Madrid), CEP Hermanos Sangro (Madrid), Hospital Príncipe de Asturias (Madrid), Ambulatorio Vicente Soldevilla (Madrid), Hospital 12 de Octubre (Madrid), Hospital de Fuenlabrada (Madrid), Hospital Ramón y Cajal (Madrid), CS Los Pedroches (Madrid), Hospital Severo Ochoa (Madrid), Hospital Clínico San Carlos (Madrid), Hospital de Móstoles (Madrid), Fundación Jiménez Díaz (Madrid), Hospital del Henares (Madrid), Hospital Clínico (Málaga), Hospital Axarquía (Málaga), CS Torre del Mar (Málaga), Hospital La Serranía (Málaga), Hospital Benalmádena (Málaga), Hospital Costa del Sol (Málaga), Hospital Virgen de la Victoria (Málaga), Hospital General Carlos Haya (Málaga), Hospital de Antequera (Málaga), Hospital Morales Meseguer (Murcia), Hospital de Yecla (Murcia), Hospital de Cieza (Murcia), Hospital Comarcal Noroeste de Caravaca (Murcia), Hospital General Reina Sofía (Murcia), Hospital Virgen de la Arrixaca (Murcia), Hospital Santa María del Rosell (Murcia), Hospital Los Arcos (Murcia), Hospital Rafael Méndez (Murcia), CS Fustiñana (Navarra), CS Tudela Este (Navarra), Hospital San Juan de Dios (Navarra), Clínica Universidad de Navarra (Navarra), Complejo Hospitalario Ourense (Orense), CS Novoa Santos (Orense), Hospital de Verin (Orense), Hospital de Cristal (Orense), Hospital Río Carrión (Palencia), Complejo Hospitalario de Palencia (Palencia), Hospital Provincial de Pontevedra (Pontevedra), Hospital Xeral Cíes (Pontevedra), Hospital Povisa (Pontevedra), Complejo Hospitalario de Pontevedra (Pontevedra), CS Pontevedra (Pontevedra), Hospital de la Santísima Trinidad (Salamanca), Hospital Los Montalvos (Salamanca), Hospital Nuestra Sra. de la Candelaria (Tenerife), Hospital Sur (Tenerife), Hospital Universitario de Canarias (Tenerife), CE Rumeo Hardisson (Tenerife), Hospital de Valme (Sevilla), Hospital Virgen Macarena (Sevilla), Ambulatorio María Auxiliadora (Sevilla), Hospital de la Merced (Sevilla), Mar Écija (Sevilla), Clínica Sagrado Corazón (Sevilla), Hospital Virgen del Rocío (Sevilla), CS Tomares (Sevilla), Clínica Andaluza de Alergia y Asma (Sevilla), Hospital Joan XXIII (Tarragona), Hospital San Joan de Déu (Tarragona), Clínica Monegal (Tarragona), Hospital de Tortosa (Tarragona), CAP Calafell (Tarragona), Hospital Ntra. Sra. del Prado (Toledo), Hospital Virgen del Valle (Toledo), Hospital Lluís Alcanyis (Valencia), Hospital Clínico (Valencia), Hospital de la Ribera (Valencia), Hospital General de Requena (Valencia), Hospital Dr. Peset (Valencia), Hospital General Universitario de Valencia (Valencia), Hospital Francesc de Borja (Valencia), Hospital de Sagunto (Valencia), Hospital de Manises (Valencia), Hospital General de Hellín (Valencia), Hospital de la Fe (Valencia), Hospital Arnau de Vilanova (Valencia), Hospital Clínico Universitario (Valladolid), Hospital de Basurto (Vizcaya), Hozpital de Zumárraga (Vizcaya), Hospital de Cruces (Vizcaya), Hospital de San Eloy (Vizcaya), CS Landako (Vizcaya), Hospital de la Cruz Roja (Zaragoza), Hospital Royo Villanova (Zaragoza), CAR Casar (Zaragoza), Consultorio Adeslas (Zaragoza), Hospital Clínico Universitario (Zaragoza), Hospital Miguel Servet (Zaragoza).