La discinesia ciliar primaria (DCP) es una enfermedad caracterizada por disfunción de las células ciliadas que se manifiesta con una sintomatología muy variable, principalmente respiratoria. Trabajos recientes que basan el diagnóstico en el estudio ultraestructural ciliar calculan una prevalencia mayor de la estimada previamente, situándola en 1/10.000 nacidos vivos. Nuestro objetivo es definir unos criterios clínicos de sospecha de DCP que sirvan de indicación para dicho estudio, lo que permitiría optimizarlo y realizar un diagnóstico precoz.
MétodosRevisión retrospectiva de los pacientes diagnosticados de DCP en la Unidad de Neumología Infantil del hospital entre 1994 y 2010. La inclusión de los casos se determinó a partir de criterios clínicos de sospecha. El diagnóstico se confirmó con la observación de cambios ultraestructurales característicos en el estudio ciliar por microscopia electrónica.
ResultadosSe analizaron 63 muestras y se confirmaron 34 casos de DCP y un caso de acilia. La edad media del diagnóstico fue de 3,6 años (rango de un mes a 19 años). La clínica inicial más frecuente fue taquipnea neonatal prolongada en los recién nacidos (20%) y cuadros de vías respiratorias bajas en los pacientes en edad escolar: neumonías recurrentes (46%), asma de difícil control (26%), bronquiectasias (8,6%) y atelectasia masiva (2,9%). En el 46% de los casos existían síntomas asociados.
ConclusionesSe propone la aplicación de un determinado número de criterios clínicos dependiendo de la edad de presentación que indiquen la búsqueda activa de una alteración en el epitelio ciliar en centros de referencia.
Primary ciliary dyskinesia (PCD) is a congenital disease characterized by impaired ciliary function, which involves a wide range of symptoms that are mainly respiratory. Recent articles that base diagnosis on ciliary ultrastructural studies have estimated its prevalence to be 1/10,000 newborns, which is higher than previously thought. Our objective is to define criteria for clinical suspicion of DCP that would indicate ultrastructural studies, while optimizing these and providing early diagnoses.
MethodsOurs is a descriptive, retrospective review of patients diagnosed with DCP in the Pediatric Pulmonology Unit at our hospital, from 1994 to 2010. The inclusion of cases was based on clinical suspicion criteria. Diagnosis was confirmed by characteristic ultrastructural changes observed in the electron microscopic study of the cilia.
ResultsSixty-three samples were analyzed, and 34 cases of DCP and one case of acilia were confirmed. Mean age at diagnosis was 3.6 (range: 1 month to 19 years of age). The most frequent initial symptom was prolonged neonatal tachypnea in the newborns (20%) and lower respiratory tract episodes in the school-aged patients: recurrent pneumonia (46%), difficult-to-control asthma (26%), bronchiectasis (8.6%) and massive atelectasis (2.9%). Associated symptoms were present in 46% of the cases.
ConclusionOur publication proposes the implementation of several clinical criteria depending on the age of presentation that would indicate the active search for alterations in the ciliary epithelium at reference centers.
La discinesia ciliar primaria (DCP) es una enfermedad de herencia principalmente autosómica recesiva, caracterizada por disfunción de las células ciliadas presentes en los tejidos respiratorio y gonadal, entre otros. La prevalencia estimada por estudios radiográficos y observaciones clínicas en la etapa previa al microscopio electrónico es de 1/15.000-20.000 nacidos vivos. Según estos datos, la prevalencia aproximada de síndrome de Kartagener sería de 1/30.000 a 1/40.000, y el 50% de los casos de DCP presentarían situs inversus. Sin embargo, trabajos recientes que basan el diagnóstico en el estudio ultraestructural ciliar calculan una cifra mayor de la estimada previamente, situándola en 1/10.000 nacidos vivos1,2.
La DCP incluye un grupo de enfermedades en las que los cilios respiratorios son inmóviles (síndrome de inmotilidad ciliar), el movimiento ciliar es discinético e ineficaz (DCP) o no hay cilios (aplasia ciliar), este último extremadamente infrecuente1,3,4. En 1976, Afzelius5 describió como origen del trastorno la ausencia de brazos de dineína en los microtúbulos de los cilios bronquiales y de los flagelos de los espermatozoides.
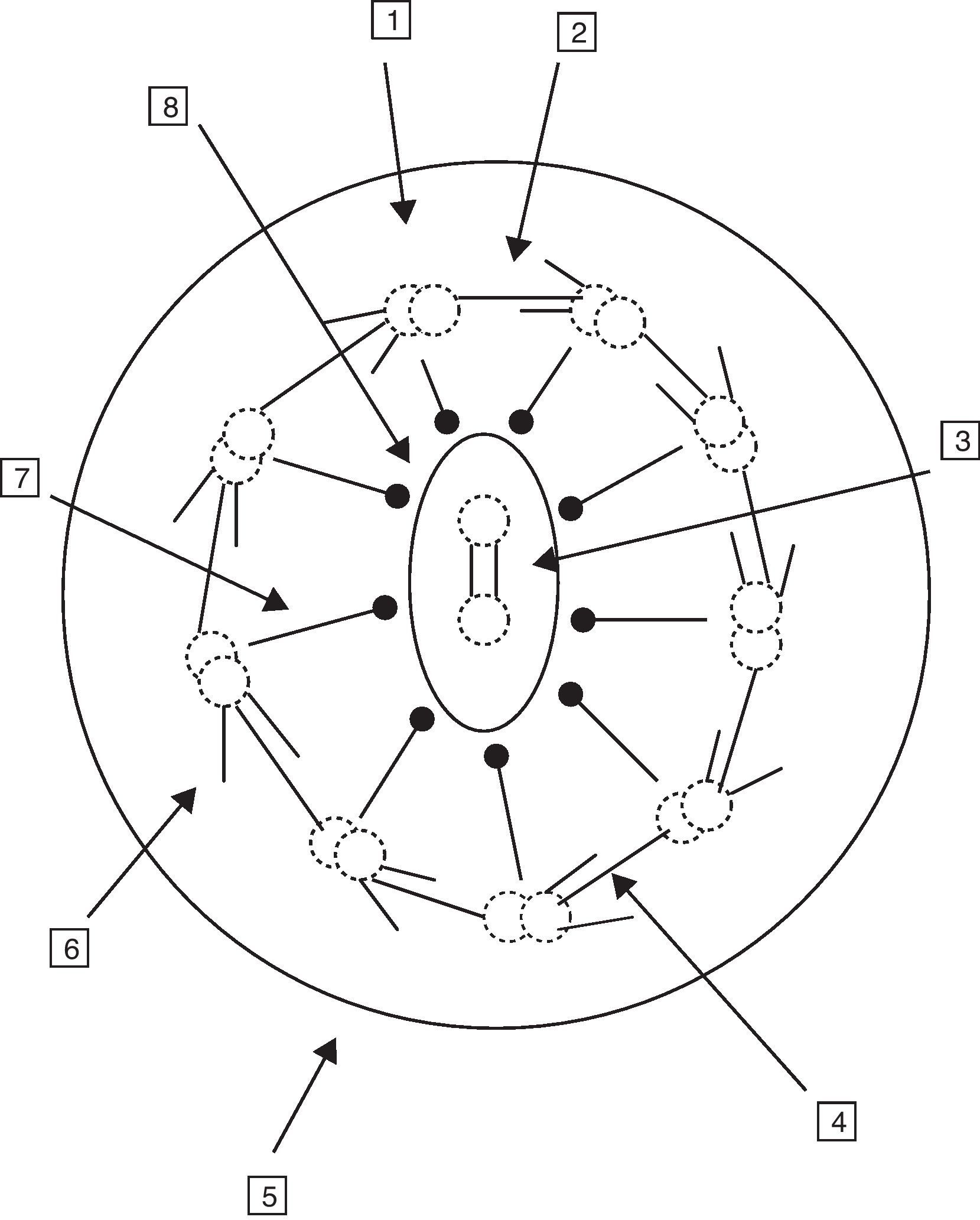
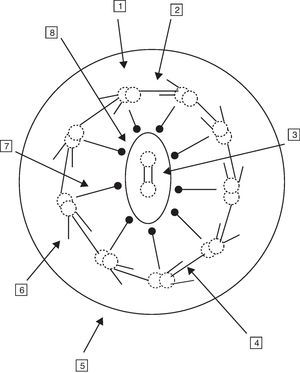
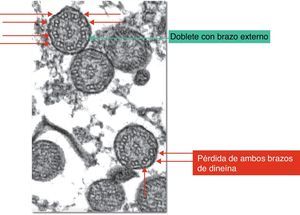
La célula ciliada normal está compuesta por unas 250 proteínas organizadas en torno a un axonema o conjunto de microtúbulos que se extienden desde el citoplasma hasta el extremo final del cilio. El cilio normal consiste en un par central de microtúbulos rodeados por una vaina y otros 9 dobletes externos formando la organización característica «9+2». Los complejos de dineína se asocian a los dobletes periféricos, los puentes de nexina sostienen los dobletes periféricos entre sí y los rayos radiales (radial spoke) unen el par central con los periféricos. Los microtúbulos y sus proteínas asociadas están anclados en el citoplasma apical de la célula por un complejo de 9 tripletes de microtúbulos. La función de los cilios respiratorios es realizar un batido coordinado con una frecuencia y patrón correctos para el aclaramiento de las secreciones y eliminación de los desechos de la vía aérea (fig. 1)6-8.
Existen células ciliadas móviles en el epitelio respiratorio (incluyendo los senos paranasales y el oído medio), el epéndimo del cerebro, los conductos deferentes y ováricos, y el epidídimo, entre otras localizaciones, por lo que existe una gran variabilidad fenotípica de esta patología. El trastorno de la motilidad de los cilios compromete el aclaramiento mucociliar (que supone uno de los mecanismos de defensa de la vía respiratoria), lo que explica la mayor predisposición de estos pacientes a desarrollar infecciones respiratorias crónicas desde el nacimiento. Este trastorno también afecta al flagelo del espermatozoide y a los cilios de la trompa de Falopio, por lo que es común la esterilidad en los varones y una fertilidad reducida en las mujeres. La ineficacia de los cilios nodales presentes de forma transitoria durante el desarrollo embrionario hace que la asimetría de los órganos internos se disponga al azar, por lo que aproximadamente el 50% de estos pacientes tienen un situs inversus total9.
La DCP es un trastorno muy heterogéneo en el que están implicados múltiples genes y proteínas y que, por lo tanto, se manifiesta con una sintomatología muy variable. Actualmente se conocen al menos 10 genes relacionados con esta patología10-13. Sin embargo, estas mutaciones solo pueden estudiarse en laboratorios especializados y la mayoría de los genes involucrados aún no se han identificado, por lo que la posibilidad de un diagnóstico molecular parece todavía lejana.
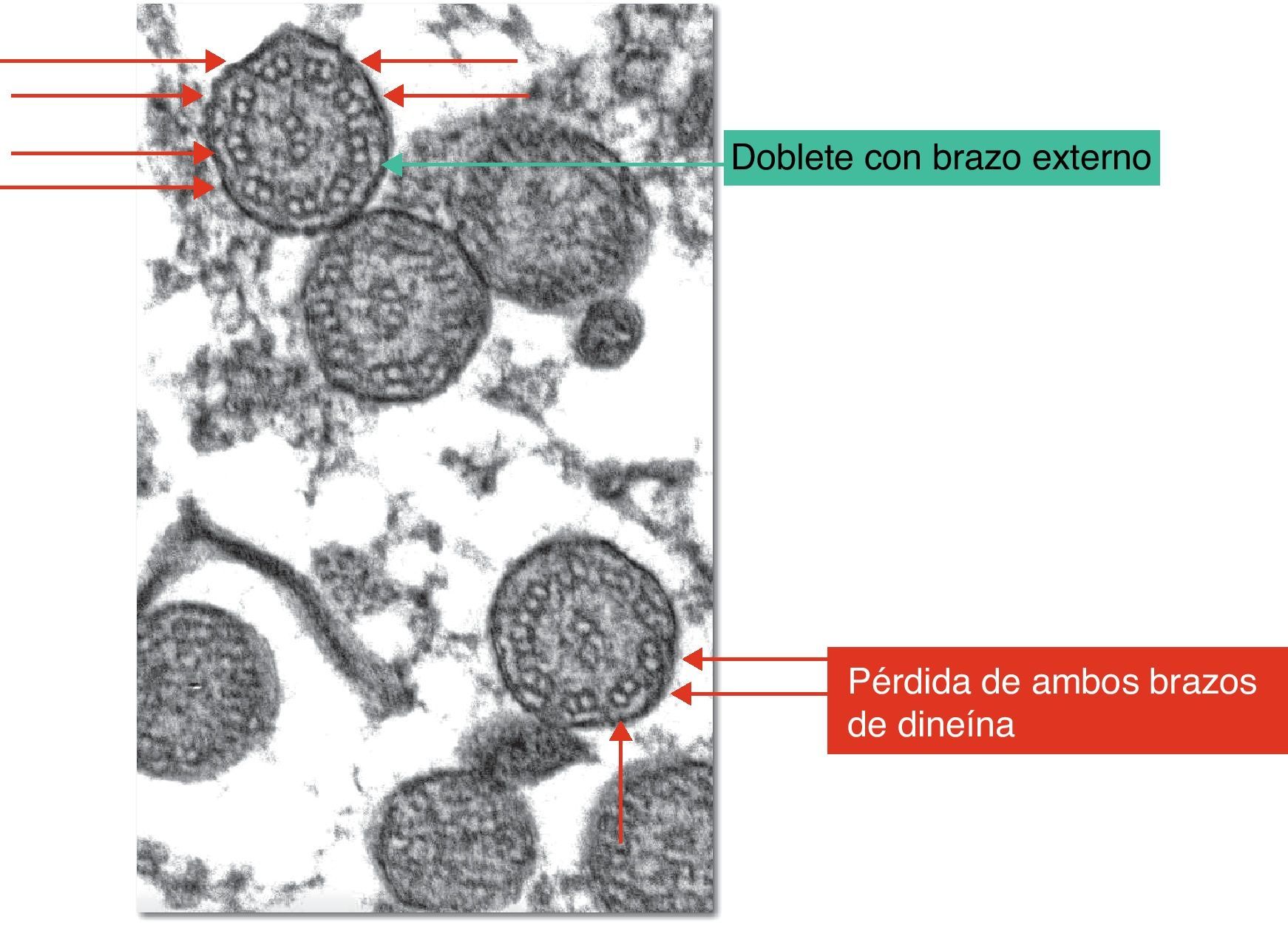
El diagnóstico de DCP se basa actualmente en el estudio funcional y estructural de los cilios obtenidos de muestras de la mucosa nasal (fig. 2)14,15.
Nuestro objetivo es definir unos criterios clínicos de sospecha de DCP que sirvan de indicación para el estudio ultraestructural, lo que permitiría la optimización del mismo y la realización de un diagnóstico lo más precoz posible. Esto posibilitaría el inicio temprano del tratamiento y el seguimiento clínico que, si bien no podrán evitar el desarrollo de la enfermedad, permitirían un mejor control de la misma ya que, según demuestran publicaciones previas, la función pulmonar en el momento del diagnóstico es significativamente peor cuando el diagnóstico se realiza en la edad adulta4.
Entre las medidas terapéuticas disponibles destacan la monitorización del estado general y las funciones respiratoria y auditiva, la instauración de fisioterapia y ejercicio físico para favorecer el drenaje de las secreciones y el tratamiento adecuado de las infecciones respiratorias, con la elección, en su caso, del antibiótico indicado según los cultivos de esputo o el lavado broncoalveolar16.
Material y métodosEstudio retrospectivo, descriptivo, a partir de revisión de historias clínicas de pacientes valorados por sospecha diagnóstica de DCP en la Unidad de Neumología Infantil del Hospital del Mar, desde 1994 hasta 2010. El objetivo es determinar criterios clínicos de sospecha de DCP que sirvan de indicación para la realización de pruebas complementarias. El diagnóstico se confirmó con la observación de cambios ultraestructurales característicos en el estudio ciliar por microscopia electrónica.
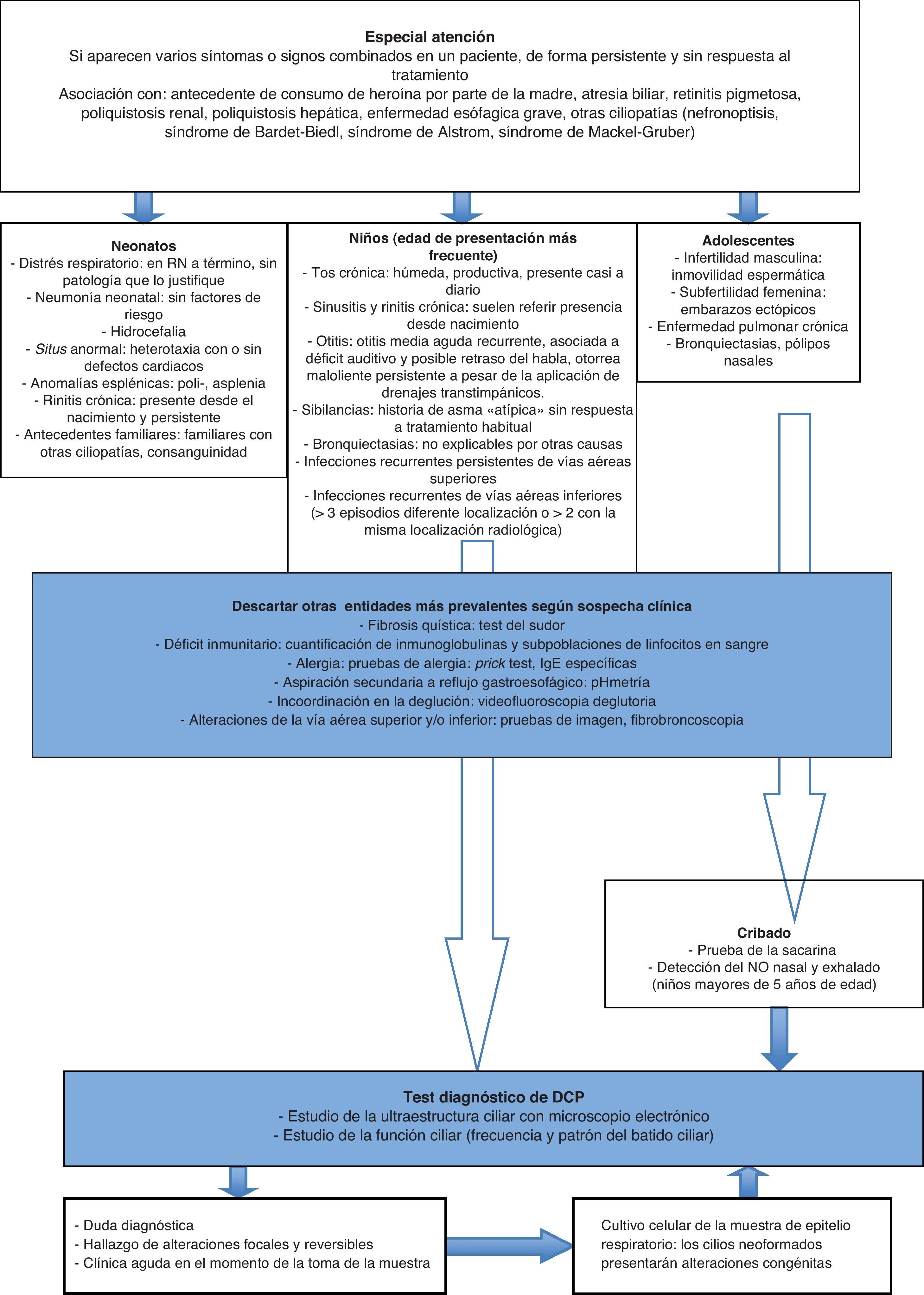
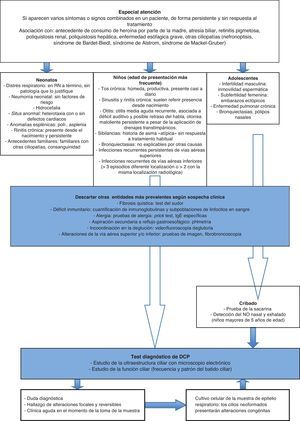
La inclusión de los casos se determinó a partir de criterios clínicos de sospecha de DCP (fig. 3), excluyendo aquellos con diagnóstico previo de otra patología, clínica activa de rinitis, clínica de infección respiratoria aguda o administración de tratamiento tópico nasal en las 4 semanas previas, y la obtención de muestra inválidas13.
A los pacientes con sospecha de DCP se les practicó radiografía de tórax, determinación en sangre de alfa-1-antitripsina, test del sudor, pruebas alérgicas, cuantificación de inmunoglobulinas y, en determinados casos, tomografía computarizada de alta resolución, con el objetivo de descartar previamente otras patologías más frecuentes según la clínica en cada caso. Se obtuvo una muestra de epitelio respiratorio mediante cepillado de la región del meato nasal inferior o septo nasal, tras lavado de las fosas nasales con suero fisiológico, para estudio de la ultraestructura ciliar con microscopio electrónico. En el cepillado se empleó para cada fosa nasal un citocepillo endocervical, que se guardó en glutaraldehído al 2% para su conservación y se transportó al laboratorio del servicio de anatomía patológica en un tiempo máximo de 2h. Las muestras fueron preparadas para su análisis ultramicroscópico mediante fijación con tetróxido de osmio al 1%, lavado con solución tampón e inclusión en resina. Se realizaron cortes de 150nm que se tiñeron con citrato de plomo y acetato de uranilo. Se observaron al microscopio electrónico (Philips CM 100) con goniómetro angular para ajustar la angulación de la muestra, considerando válidas aquellas muestras en las que se observaron más de 100 cilios. Se diagnosticaron como alteraciones de la ultraestructura ciliar compatibles con DCP aquellas muestras en las que más del 50% de los cilios presentaban las anomalías características según los criterios de Afzelius (fig. 2) y de la European Respiratory Society6,13. Las alteraciones estructurales que se consideran signo de DCP son la pérdida de uno o ambos brazos de dineína. Entre las otras anomalías de la estructura ciliar que han sido descritas y que se consideran como causas de ciliopatías se encuentran: ausencia o defecto de los brazos radiales, ausencia o dislocación de los microtúbulos centrales y anomalías en la disposición de los microtúbulos periféricos, dobletes supranumerarios, ausencia del axonema y desorganización de la orientación de los cilios3,9. Si el grado de afectación es menor del 50%, las anomalías observadas podrían ser un hallazgo fisiológico (anomalías en menos del 10% de los cilios estudiados) o ser secundarias, por ejemplo, a infecciones víricas, inflamación de la vía aérea o exposición a tóxicos. A pesar de que algunos de los hallazgos que se observan en la discinesia ciliar secundaria son parecidos a las alteraciones características de la discinesia ciliar primaria, el hecho de que dichas modificaciones sean focales y reversibles orienta hacia el tipo secundario17.
ResultadosSe analizaron 63 muestras, entre las que se confirmaron 34 casos de DCP y un caso de acilia (este elevado porcentaje de resultados positivos muy superior a otras series se justifica por el elevado índice de sospecha en nuestro centro y porque se trata de un grupo de pacientes muy seleccionados). El resto (28 muestras) resultaron negativas. La edad media del diagnóstico fue de 3,6 años (rango de un mes a 19 años). Entre los pacientes diagnosticados hubo 23 varones (65,7%) y 12 mujeres (34,3%). Un único recién nacido de sexo masculino con dextrocardia presentaba además ectasia piélica bilateral, hipospadias balánico y trigonocefalia parcial por cierre precoz de la sutura metópica.
Se encontraron 8 casos (22,86%) en recién nacidos, 7 de ellos hijos de madres consumidoras de heroína durante la gestación18 y el diagnosticado a raíz del hallazgo casual de dextrocardia (con situs inversus). La clínica inicial más frecuente fue taquipnea neonatal prolongada en los recién nacidos, con 7 casos (20%).
En los pacientes en edad escolar predominaron los cuadros de vías respiratorias bajas, entre los que cabe destacar: neumonías recurrentes, 15 casos (46%); asma de difícil control, 9 casos (26%); bronquiectasias, 3 casos (8,6%), y atelectasia masiva, un caso (2,9%). El 46% de los pacientes presentaron síntomas asociados, y la asociación más frecuente fue la de crisis de broncoespasmo y neumonías recurrentes.
La determinación de alfa-1-antitripsina y el test del sudor fue normal en todos los niños.
El análisis ultramicroscópico de las muestras de epitelio respiratorio de mucosa nasal demostró en todos los pacientes alteraciones ultraestructurales de los cilios sugestivas de DCP: pérdida de ambos brazos de dineína, interno y externo, en 20 casos (57%); pérdida del brazo interno de dineína en 13 casos (37,1%); pérdida del brazo externo de dineína en un caso (2,9%), y acilia en un caso (2,9%). El porcentaje medio de pérdida fue del 74% (rango, 50-100%). Además, en 10 pacientes se observaron otras alteraciones ultraestructurales de los cilios, como desorganización de la distribución de los dobletes en 7 casos, pérdida de un túbulo en 2 casos y pérdida del doblete central en un caso.
DiscusiónEn ausencia de hallazgos muy característicos de DCP como el situs inversus, la presentación es muy inespecífica, pudiendo manifestarse como infecciones de vías aéreas superiores de repetición, cuadros propios de la edad pediátrica y que difícilmente harán sospechar de entrada la posibilidad de DCP. Sin embargo, hay una serie de peculiaridades clínicas de estos cuadros que son muy características. Los síntomas suelen presentarse desde el nacimiento, con tendencia a la cronicidad y ausencia de respuesta a los tratamientos habituales. Además, dada la amplia distribución de las células ciliadas en el organismo, resulta característica la presentación simultánea de varios síntomas en un mismo paciente9. El situs inversus, si bien es un dato muy característico, no se asocia a todos los fenotipos de DCP. En la mayoría de pacientes las alteraciones ciliares se encuentran en el tracto respiratorio, lo que explica la sintomatología predominante. Por último, se han descrito casos de síndrome de Kartagener en los que la ultraestructura ciliar es normal19.
La infección crónica respiratoria es la manifestación más habitual, pero hay que considerar otros diagnósticos de mayor prevalencia antes de iniciar el estudio ciliar. Hay que descartar fundamentalmente la fibrosis quística con el test del sudor, los déficits inmunitarios con la cuantificación de inmunoglobulinas y las subpoblaciones de linfocitos en sangre, la alergia respiratoria con el prick test y las IgE específicas, y la aspiración pulmonar secundaria a reflujo gastroesofágico con pHmetría, entre otros (fig. 3).
Como pruebas de cribado se utilizan el test de sacarina y/o el óxido nítrico nasal y exhalado. El test de sacarina valora el aclaramiento mucociliar, y su positividad indica el estudio de discinesia ciliar. Sin embargo, no es útil en niños pequeños o no colaboradores, pues deben permanecer sentados durante una hora y realizar una valoración subjetiva, ya que se basa en el reconocimiento del sabor de la sacarina4,20,21. El test del óxido nítrico nasal y exhalado consiste en detectar la disminución del mismo que se produce en la DCP. El nasal es más discriminativo que el exhalado, aunque es difícil de realizar en niños muy pequeños7,22, y también puede disminuir en otras enfermedades como fibrosis quística, bronquiectasias, sinusitis crónica y síndrome de Young4. Dada esta baja especificidad, el hallazgo de un valor bajo de óxido nítrico nasal requiere la realización de otras exploraciones complementarias23,24, Los valores altos van en contra del diagnóstico de DCP, aunque no permiten descartarla de forma concluyente si existen datos clínicos muy sugestivos de esta enfermedad. No obstante, su determinación se incluye en el algoritmo diagnóstico en algunos casos (niños mayores de 5 años de edad y adolescentes).
Para la confirmación del diagnóstico de DCP se realizan estudios de función y ultraestructura ciliar. Estas pruebas han de llevarse a cabo tras el resultado positivo en el cribado para DCP en adultos. Sin embargo, la dificultad para la ejecución de las mismas en pacientes pediátricos hace que estén indicadas una vez establecida la sospecha clínica y tras descartar otras entidades más frecuentes con similar presentación, tal y como se hizo en nuestra serie de casos. El estudio confirmatorio aplicado en ellos fue el análisis ultraestructural de los cilios con microscopio electrónico, técnica con alta especificad disponible en centros de referencia.
Los hallazgos más habituales en el mismo son la ausencia de los brazos de dineína, los defectos de los puentes radiales y las anomalías en la disposición de los microtúbulos, observaciones que coinciden con las encontradas en nuestra serie de casos. Afzelius25 propone diferentes subgrupos dentro de la DCP según las características de la afectación ciliar. El subgrupo típico se caracteriza por la ausencia de los brazos de dineína y/o disposición anómala de los microtúbulos, que constituyeron también los hallazgos más prevalentes en nuestra muestra. Otro subgrupo muestra un cilio con estructura aparentemente normal pero que no funciona correctamente. En otros casos, el epitelio tiene células con microvilli pero no se observan cilios (síndrome de acilia o aplasia ciliar), alteración diagnosticada en uno de nuestros pacientes.
El estudio de la ultraestructura ciliar como método diagnóstico de DCP presenta como limitación la posibilidad del hallazgo de anomalías debidas en realidad a una alteración ciliar secundaria a un daño epitelial por exposición a cambios de temperatura, humedad o infecciones. Por este motivo, en la selección de los pacientes de nuestro estudio se consideraron como criterios de exclusión el diagnóstico previo de otra patología, clínica activa de rinitis, clínica de infección respiratoria aguda o administración de tratamiento tópico nasal en las 4 semanas previas. Otra posibilidad para subsanar esta limitación es la realización de un cultivo de la muestra de epitelio obtenida, pues los cilios de nueva generación reproducirán únicamente los defectos congénitos y no los adquiridos26.
El examen de la función ciliar se basa en el análisis de la frecuencia y el patrón del batido ciliar mediante la obtención de imágenes con una cámara de vídeo de alta resolución digital y alta velocidad acoplada al microscopio, y el posterior análisis de las mismas con un programa informático. Al igual que en el estudio ultraestructural, existe la posibilidad de obtener células ciliadas neoformadas tras el cultivo de la muestra, que presentarán únicamente las alteraciones congénitas.
Ante una alta sospecha clínica de DCP, el estudio ultraestructural de los cilios mediante microscopia electrónica es una de las técnicas esenciales para el diagnóstico. Este estudio se recomienda incluso en casos con una frecuencia y un patrón de batido ciliar normales según la prueba funcional. Sin embargo, entre el 10 y el 28% de los pacientes con DCP muestran una ultraestructura normal9. Esto sugiere que los estudios funcional y ultraestructural deberían complementarse para llegar al diagnóstico definitivo.
Un dato a destacar de nuestra serie es que en los 7 casos correspondientes a recién nacidos hijos de madres consumidoras de heroína durante la gestación, la manifestación clínica que motivó el estudio estructural de los cilios fue la taquipnea persistente no atribuible al síndrome de abstinencia a drogas ni a otras causas. La incidencia de alteraciones ciliares entre los recién nacidos expuestos prenatalmente a la heroína fue más alta que entre los recién nacidos no expuestos a ella. Esto sugiere que, sobre una cierta susceptibilidad genética, la exposición prenatal a la heroína podría actuar como noxa, afectando al proceso normal de desarrollo de los cilios y dando lugar a alteraciones ultraestructurales compatibles con DCP18.
ConclusionesActualmente se realiza con más frecuencia el diagnóstico de DCP, debido tanto al mayor conocimiento de esta entidad como a la disponibilidad de los medios necesarios para el mismo en centros de referencia. Sin embargo, la gran variabilidad de su expresión fenotípica dificulta el establecimiento de la sospecha necesaria para iniciar su estudio. Nuestro trabajo propone la aplicación de un determinado número de criterios clínicos dependiendo de la edad de presentación que, tras descartar otras causas como inmunodeficiencias y fibrosis quística, indiquen la búsqueda activa de una alteración en el epitelio ciliar en centros de referencia (fig. 3)13,27,28. Esto permitirá seleccionar mejor a los pacientes a los que solicitar el estudio ultraestructural con una mayor probabilidad de que resulte positiva y, de esta forma, aumentar el diagnóstico de esta patología aún infradiagnosticada29. La detección temprana de estos pacientes posibilitará la aplicación de una serie de recursos terapéuticos que mantengan una adecuada función pulmonar durante el mayor tiempo posible, con la consecuente disminución de la morbilidad y mejoría de la calidad de vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.