El derrame pleural tuberculoso (DPTB) es la causa más frecuente de tuberculosis (TB) extrapulmonar en nuestro país y uno de los motivos más habituales de derrame pleural. Si bien la incidencia disminuye progresivamente (4,8 casos/100.000habitantes en el año 2009), el porcentaje de DPTB se mantiene estable con respecto al número de casos totales de TB (14,3-19,3%). Casi las dos terceras partes son hombres, más del 60% tienen edades entre los 15-44años y es más frecuente en los pacientes infectados por el virus de la inmunodeficiencia humana. La patogenia suele ser una reacción de hipersensibilidad retardada. La clínica varía dependiendo de la población (más aguda en los jóvenes y más prolongada en los ancianos). El derrame es casi invariablemente un exudado unilateral (según los criterios de Light), más frecuentemente del lado derecho, y la prueba de la tuberculina es negativa en la tercera parte de los casos.
Los diagnósticos de certeza tienen limitaciones, por lo que para ello se han utilizado diversos biomarcadores en el líquido pleural. La asociación de la adenosina desaminasa y del porcentaje de linfocitos puede ser útil para el diagnóstico. El tratamiento es el de cualquier TB. No parece recomendable añadir corticoides y el drenaje torácico podría contribuir, en los grandes derrames, a una mejoría más rápida de los síntomas.
Tuberculous pleural effusion (TBPE) is the most common form of extrapulmonary tuberculosis (TB) in Spain, and is one of the most frequent causes of pleural effusion. Although the incidence has steadily declined (4.8 cases/100,000population in 2009), the percentage of TBPE remains steady with respect to the total number of TB cases (14.3%-19.3%). Almost two thirds are men, more than 60% are aged between 15-44years, and it is more common in patients with human immunodeficiency virus. The pathogenesis is usually a delayed hypersensitivity reaction. Symptoms vary depending on the population (more acute in young people and more prolonged in the elderly). The effusion is almost invariably a unilateral exudate (according to Light's criteria), more often on the right side, and the tuberculin test is negative in one third of cases.
There are limitations in making a definitive diagnosis, so various pleural fluid biomarkers have been used for this. The combination of adenosine deaminase and lymphocyte percentage may be useful in this respect. Treatment is the same as for any TB. The addition of corticosteroids is not advisable, and chest drainage could help to improve symptoms more rapidly in large effusions.
La tuberculosis (TB) es una de las enfermedades infecciosas con mayor morbimortalidad a nivel mundial, por lo que constituye un auténtico problema de salud pública. La Organización Mundial de la Salud estima que durante el año 2011 se produjeron 8,7 millones de nuevos casos de TB, lo que equivale a una incidencia global de 125/100.000habitantes/año y que murieron 1,4millones de personas1. La co-infección de la TB con el virus de la inmunodeficiencia humana (VIH), junto con la inmigración, han hecho que la TB resurgiera en los países desarrollados2 y que aumente la carga de la enfermedad en los que están en desarrollo1. El derrame pleural tuberculoso (DPTB) constituye un problema clínico frecuente en muchos países3 y es particularmente relevante en la etapa actual de infección por VIH, situación en la que es más frecuente en la práctica clínica4.
EpidemiologíaEn Galicia, lugar donde trabajan los autores, se registraron en el año 2011 hasta 690 nuevos casos de TB (incidencia, 24,6/100.000habitantes/año)5, mientras que en España se diagnosticaron 6.746 (incidencia, 14,6/100.000habitantes/año)6. El DPTB es en nuestra región la causa más frecuente de TB extrapulmonar7, y en el año 2011 se diagnosticaron 109 nuevos casos, el 15,8% del total de TB registradas5. La tendencia epidemiológica de los DPTB sigue una disminución significativa, ya que durante el periodo 2000-2009 tanto el número de casos como la incidencia se redujeron a la mitad en nuestra comunidad (262 a 133 y 9,6 a 4,8, respectivamente)7. Sin embargo, la proporción de pacientes con un DPTB sobre el total de casos de TB no ha cambiado de forma significativa (entre el 14,3 y el 19,3%)8. Estos porcentajes son considerablemente mayores que los registrados en Estados Unidos (3,6%)9 e inferiores a los de algunos países africanos (mayores del 20%)10,11. Estas diferencias pueden atribuirse a las distintas prevalencias de TB en la población general12 o a que, al ser el cultivo del líquido pleural (LP) habitualmente negativo, la incidencia de DPTB puede subestimarse13. El DPTB es más frecuente en hombres (63,5%)8, en edades entre los 15-44años (61,2%)7 y en los pacientes VIH positivos8,10,11. Aunque sería esperable que fuera más frecuente en los pacientes inmunocompetentes que en los que presenten una alteración de la inmunidad celular, generalmente no es así10,11,14,15.
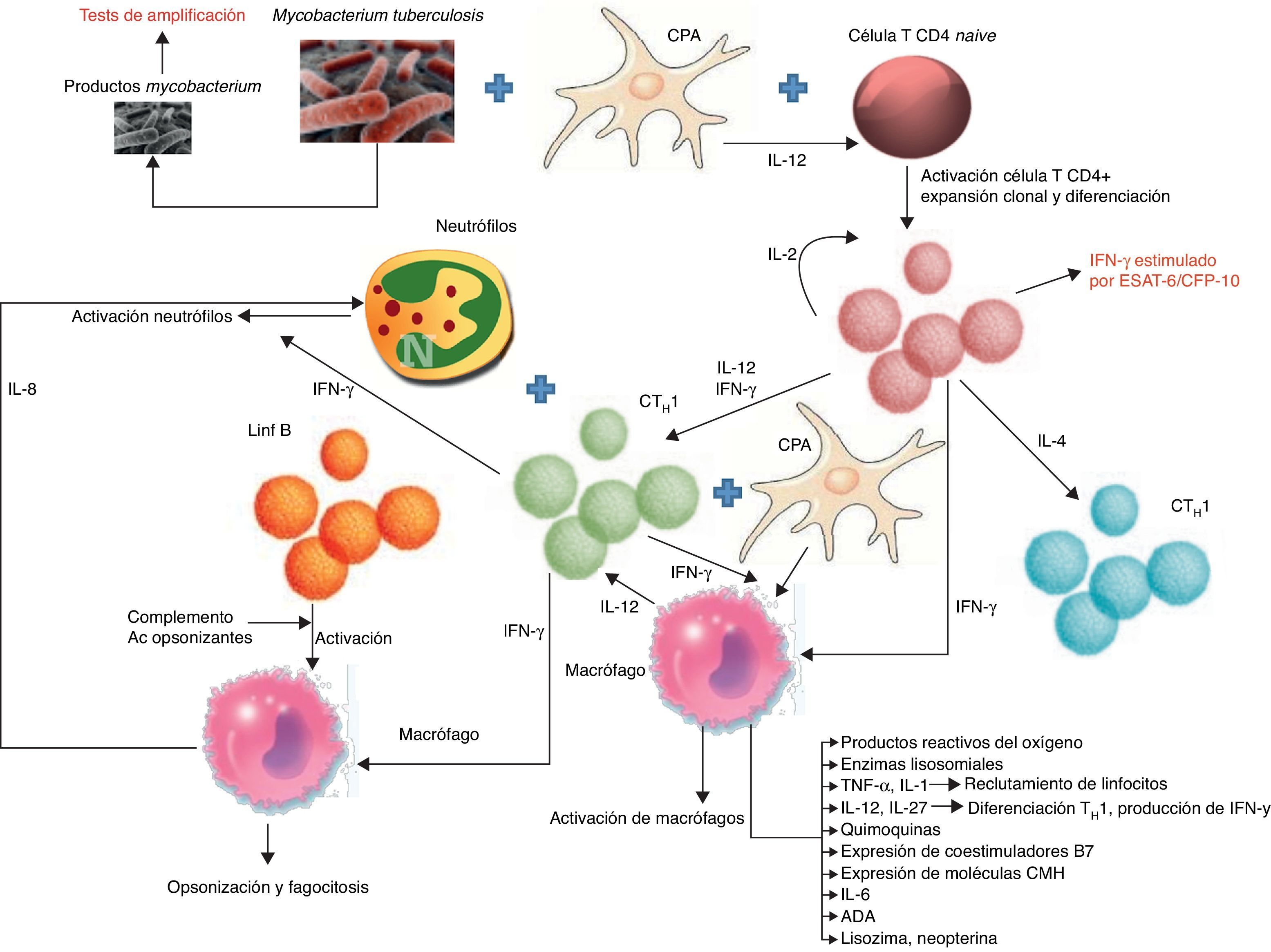
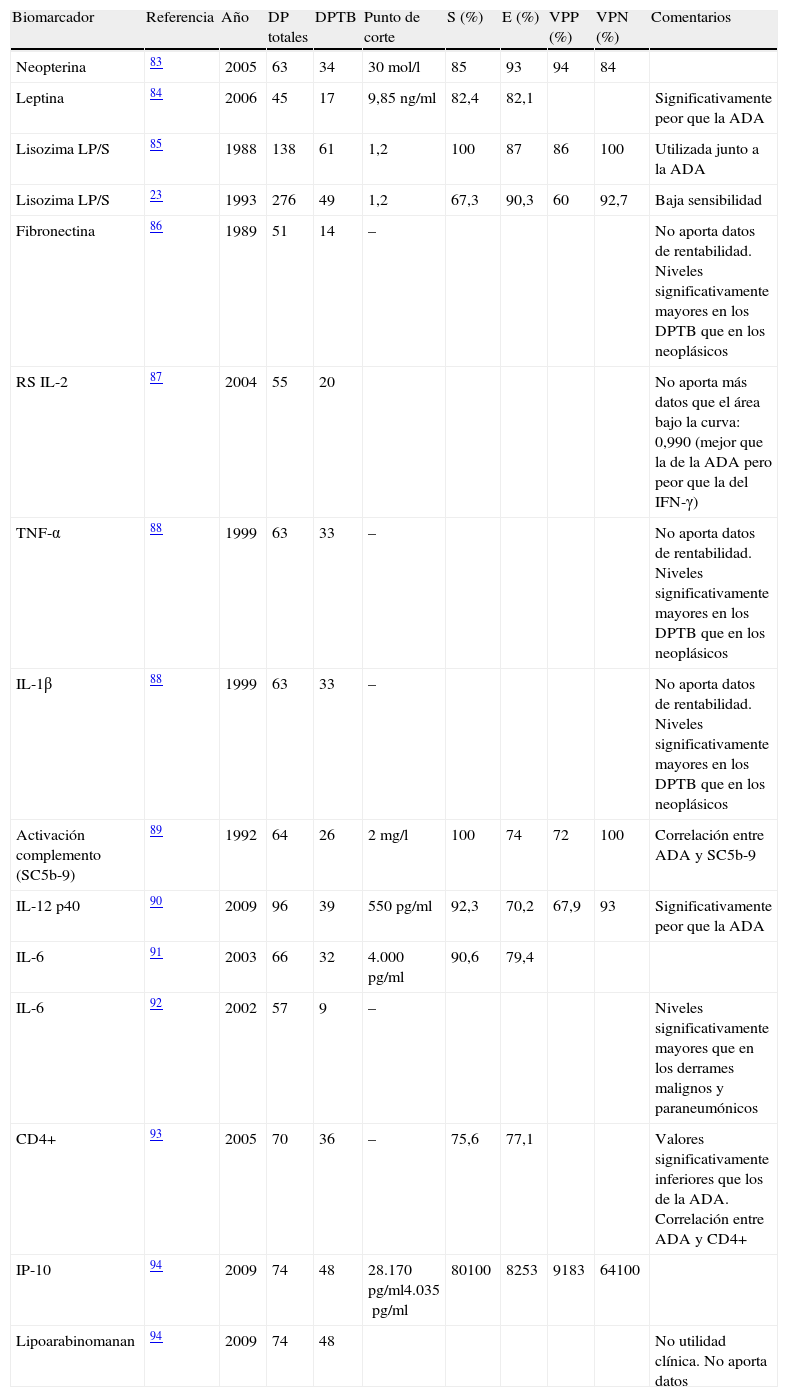
PatogeniaEl DPTB puede ser una manifestación tanto de una infección primaria como de una reactivación de la enfermedad. Esta última es la que predomina en los países desarrollados16. Se cree que el DPTB se origina tras la rotura de un foco caseoso subpleural que libera su contenido en el espacio pleural17. Los antígenos micobacterianos interaccionan con los linfocitosT-CD4+ dando lugar a una reacción de hipersensibilidad retardada en la que intervienen distintas citoquinas que tratan de estimular la acción antimicobacteriana de los macrófagos (fig. 1). Todo ello produce un aumento de la permeabilidad capilar y un deterioro del drenaje linfático, que origina el derrame pleural (DP). Esta teoría se apoya en que el cultivo del LP de estos pacientes suele ser negativo18 y que cuando se inyecta una proteína tuberculosa en el espacio pleural de cobayas previamente sensibilizados con derivados proteicos purificados se produce un DP exudativo19 que desaparece cuando a estos animales se les trata con suero antilinfocítico20.
Esquema de las vías y biomarcadores involucrados en la respuesta inmunológica de los derrames pleurales tuberculosos.
B7: proteínas expresadas por las células presentadoras de antígeno; CFP: culture fíltrate protein; CMH: complejo principal de histocompatibilidad; CPA: célula presentadora de antígeno; CTH1: linfocitoT responsable de la inmunidad celular o retardada; CTH2: linfocitoT responsable de la inmunidad humoral; ESAT: early secreted antigenic target; IFN-γ: interferón-gamma; IL: interleucina; Lin B: linfocito B.
El empiema tuberculoso, una infección activa crónica del espacio pleural, puede producirse como consecuencia de la extensión de la infección desde otras localizaciones, tras una neumonectomía, o cuando una fístula broncopleural vierte el contenido de una cavidad en el espacio pleural21.
Un DPTB también puede originar un engrosamiento fibroso de la pleura visceral que impida la expansión del pulmón (pulmón atrapado). En estos casos se creará una presión negativa en el espacio pleural que favorecerá el desarrollo de un DP crónico, con características propias, aunque la enfermedad no esté activa22.
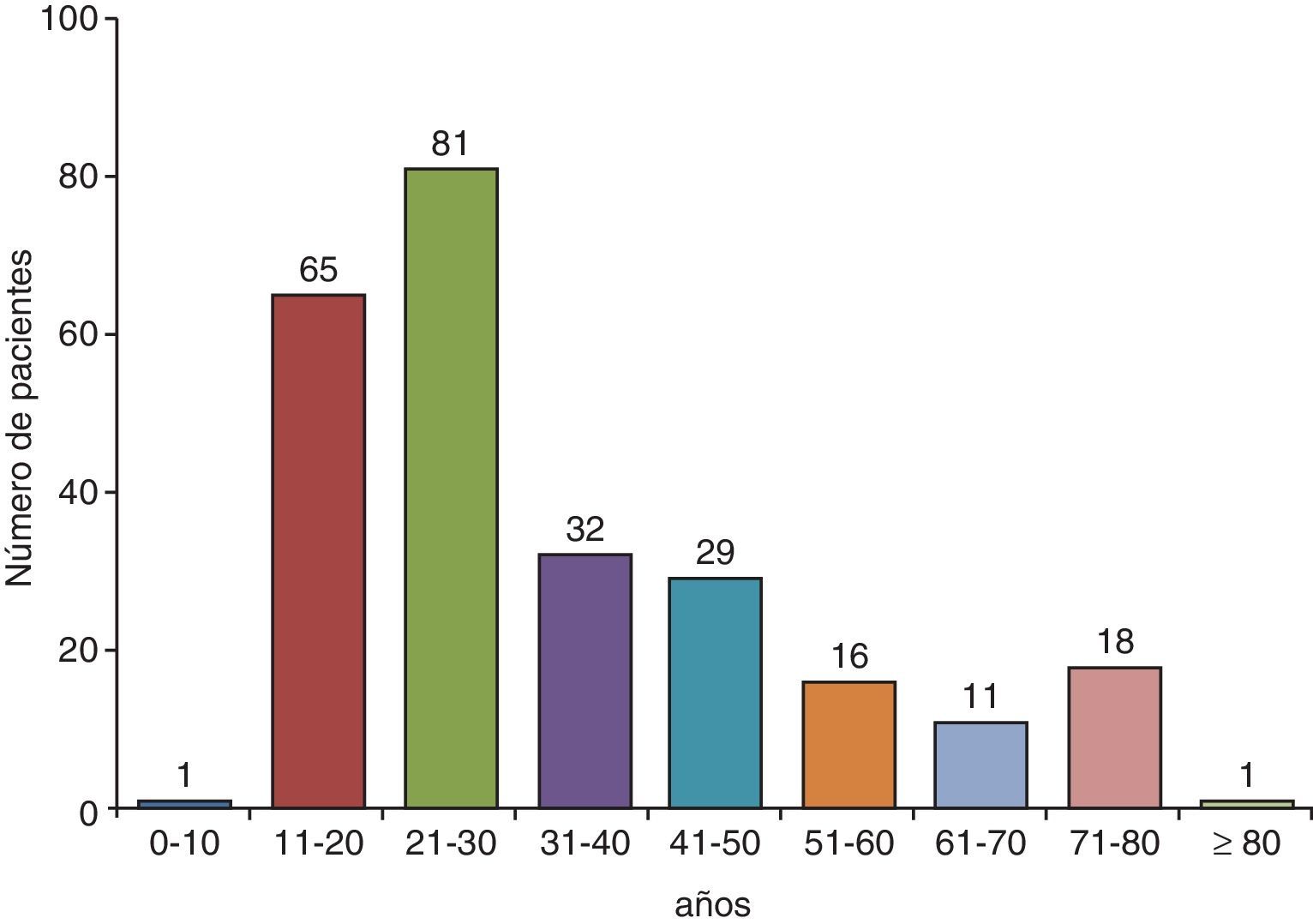
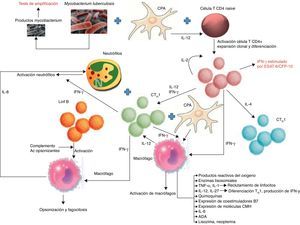
ClínicaEn países con alta incidencia de TB, la edad media de los pacientes con un DPTB oscila entre los 32 y los 34años23-27 y el 70% tienen menos de 40años8,24 (fig. 2). En Estados Unidos la media de edad de presentación es de 49años; solamente el 50% son menores de 45 y el 30% tienen más de 65años9. Para justificar estas diferencias se ha sugerido que en los países desarrollados el DPTB podría ser el resultado de una reactivación, mientras que en los que aparece a edades más tempranas correspondería a una forma primaria de la enfermedad16.
Distribución por edades de los pacientes con un derrame pleural tuberculoso en Galicia (España).
Fuente: Valdés et al.24.
La sintomatología de los pacientes con un DPTB es variable. La fiebre (86% de los casos), el dolor torácico de características pleuríticas (75%) y la tos (70%) suelen estar presentes28,29 y pueden acompañarse de otros síntomas de afectación sistémica. La clínica varía en función de la población. En los ancianos el periodo sintomático tiende a ser más prolongado, mientras que los pacientes VIH positivos son, normalmente, menos sintomáticos. Por el contrario, los jóvenes suelen presentar una clínica más aguda, con fiebre elevada30.
El DPTB suele ser unilateral y de cualquier tamaño. En nuestra serie de 254casos, el 98,5% eran unilaterales (56% del lado derecho). Los DPTB masivos son poco habituales pero, no obstante, son la tercera causa más frecuente de los mismos31. La radiografía de tórax demuestra afectación pulmonar en el 25% de los casos8, pero puede sobrepasar el 50% si se hace una tomografía computarizada (TC) de tórax32. El porcentaje de afectación pulmonar dependerá de si el DPTB se produce como consecuencia de una infección primaria o de una reactivación (donde presumiblemente será más elevado). La tercera parte de los DPTB tendrá un Mantoux negativo. En estos casos debería repetirse a las 2-6semanas, ya que puede volverse positivo17 y ser útil para reforzar el diagnóstico. El porcentaje de pacientes con Mantoux negativo sería mayor en los VIH positivos, sobre todo en los que tienen un recuento de células CD4+ <200células/mm333.
DiagnósticoEl diagnóstico de certeza de DPTB requiere la demostración de bacilos tuberculosos en el esputo, en el LP o en las muestras de biopsia pleural (BP), o bien la observación, en esta última, de granulomas34.
MicrobiologíaUna prueba, frecuentemente subestimada, en el diagnóstico de un DP es el cultivo de esputo para micobacterias, cuyas positividades oscilan entre el 41,7 y el 52%8,35,36.
La tinción del LP para el diagnóstico de un DPTB en un paciente inmunocompetente no parece indicada (rentabilidad del 5%)24. Sin embargo, en los VIH positivos la tinción puede ser positiva en el 20%37 y, por tanto, justificada. El cultivo del LP tiene una mayor rentabilidad, que dependerá del medio de cultivo que se utilice. Con medios sólidos (Löwenstein-Jensen), el bacilo se identifica en el 12-36,6% de los casos24,38. Los medios líquidos son más sensibles. Con el sistema BACTEC la rentabilidad del cultivo aumenta del 12 al 24%38, y Ruan et al.35 alcanzan el 63%, con un tiempo de espera significativamente menor38,39. Dos aspectos pueden influir en el resultado: la infección por VIH y el predominio celular del LP. Tanto la tinción como el cultivo del LP son más frecuentemente positivos en los pacientes VIH positivos que en los negativos (37% vs 0% para la tinción; 43% vs 12% para cultivo en medio sólido; 75% vs 24% en medio líquido)37,38. Es posible que en estos casos el DPTB sea debido, más que a una reacción a las proteínas tuberculínicas, a un fracaso del sistema inmune que permite a las micobacterias permanecer durante más tiempo en el espacio pleural, al ser mínima la actividad micobactericida de los macrófagos. El segundo aspecto que puede influir en el rendimiento del cultivo es el predominio celular. Cuanto mayor es el porcentaje de neutrófilos en el LP, mayor probabilidad de que el cultivo sea positivo35,40, probablemente porque en las fases tempranas de la enfermedad, cuando predominan los neutrófilos, el sistema inmune todavía no es eficaz contra los bacilos. En esta situación, la carga micobacteriana en el LP será mayor. Cuando los macrófagos activados fagocitan el Mycobacterium tuberculosis (MT), la carga micobacteriana intrapleural disminuye, y con ello la probabilidad de que el cultivo sea positivo41.
El cultivo MODS (microscopic-observation drug-susceptibility) es un medio líquido, barato, altamente sensible y relativamente rápido que proporciona simultáneamente datos de susceptibilidad a fármacos. Este cultivo fue más rentable que el de Löwenstein-Jensen, tanto en el LP (20% vs 7%) como en la BP (81% vs 51%), con menor tiempo de espera42.
Al ser el DPTB paucibacilar, los métodos microbiológicos utilizados son poco sensibles. Las técnicas de amplificación de las secuencias de ácidos nucleicos específicas de TB permiten detectar el MT del LP, aunque existan pocos bacilos43, y en menos tiempo. En un metaanálisis que incluye 38artículos, la sensibilidad fue del 62% y la especificidad del 98%44. Es decir, es útil para confirmar el diagnóstico pero no para descartarlo. La baja sensibilidad se atribuye a la baja carga bacilar que contienen las muestras, a la probable presencia de sustancias en el LP que inhiban la amplificación, a la secuencia genómica amplificada y al posible secuestro intracelular de las micobacterias. Esta sensibilidad y el precio de cada determinación hacen que no se realice de rutina en el estudio de un DP.
El Xpert es un método de amplificación de ácidos nucleicos automatizado que detecta simultáneamente MT y resistencia a la rifampicina en menos de 2h45. Su rentabilidad en el diagnóstico de los DPTB es baja (especificidad 100%, pero la sensibilidad oscila entre el 15 y el 27%)46-48.
Biopsia pleuralLa BP cerrada ciega es el método más sensible para el diagnóstico de los DPTB. Se pueden observar granulomas en el 50-97% de los casos17,18,24,49-51. Aunque otras enfermedades producen una pleuritis granulomatosa, más del 95% son debidas a una TB. El cultivo sistemático de la BP contribuye a aumentar la rentabilidad diagnóstica de los DPTB (del 79,8 al 91,5% con el cultivo)24. La toracoscopia también puede ser útil, aunque habitualmente no es necesario recurrir a ella. Si el paciente tiene una TB, la toracoscopia puede llegar al 100% de sensibilidad52.
Por tanto, los diagnósticos de certeza tienen limitaciones: baja rentabilidad de cada una de las pruebas, tiempo de espera prolongado para los resultados de los cultivos, o el uso de técnicas invasoras como la BP. Para mejorar la rentabilidad diagnóstica se ha evaluado la utilidad de la determinación en el LP de los biomarcadores que de alguna forma intervienen en la respuesta inmunológica de la TB (fig. 1).
Adenosina desaminasaLa enzima adenosina desaminasa (ADA), aunque ubicua en su distribución, juega un papel relevante en la proliferación y diferenciación de los linfocitosT. Un metaanálisis de 63estudios que incluye más de 8.000DP, 2.796 con DPTB, muestra que la sensibilidad, la especificidad, las razones de probabilidad positiva (RPP) y negativa (RPN) y la odds ratio fueron 92%, 90%, 9, 0,10 y 110, respectivamente53. La ADA tiene 2isoenzimas: ADA1 y ADA2. La primera se halla en todas las células, mientras que la última solamente se encuentra en los monocitos/macrófagos y se eleva cuando estas células se estimulan por microorganismos vivos en su interior54. En los DPTB predomina la ADA2. Las isoenzimas de la ADA se pueden determinar por 3métodos: a)separación de las fracciones por electroforesis55,56; b)inhibición de la ADA1 mediante eritro-9(2-hidroxi-3-nonil)adenina (EHNA)55,57-59, y c)cálculo de la ADA1 y ADA2 a partir del diferente coeficiente de afinidad de las mismas por los sustratos adenosina y 2’desoxiadenosina60-62. De este se pueden derivar los cocientes 2’desoxiadenosina/adenosina o el ADA1/ADA63; el primero incorpora menos errores, al obtenerse los datos a partir de la actividad enzimática y no por cálculos con factores teóricos.
Aunque la rentabilidad de la ADA2 es ligeramente superior (ADA vs ADA2: sensibilidad 100% para ambas, especificidad 91% vs 96%60; sensibilidad 93,7% vs 97%, especificidad 89% vs 94%64), su uso no parece justificado en la práctica clínica.
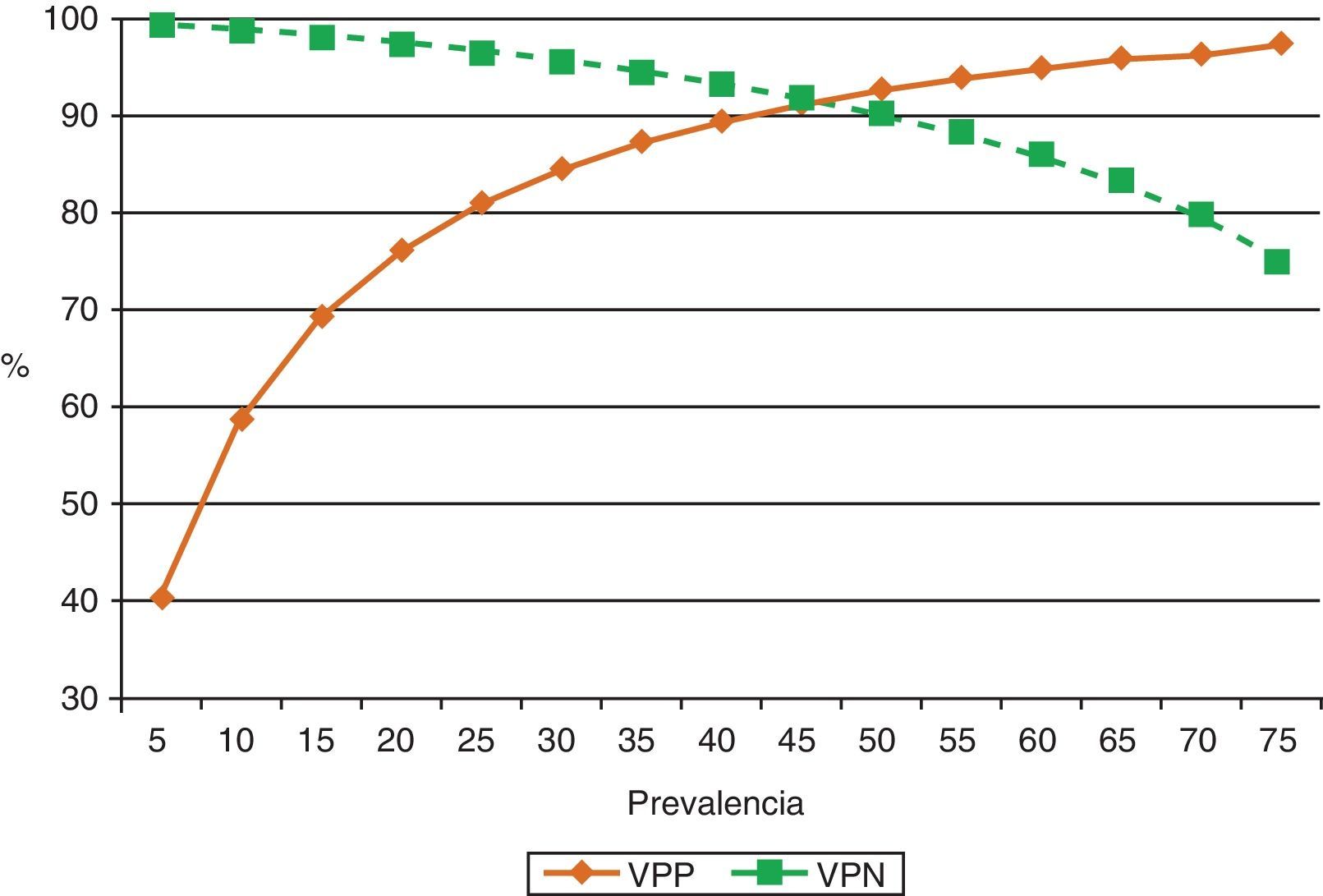
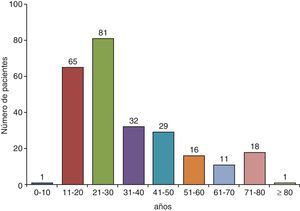
Los niveles de ADA también se elevan tanto en los DPTB con bajo número de células CD4+65 (sensibilidad 94%, especificidad 95%), probablemente porque los monocitos no se ven afectados por la infección retroviral, como en aquellos en los que las células predominantes son los neutrófilos40,66. Una razón podría ser que los neutrófilos liberen citoquinas que atraigan a los monocitos y a los macrófagos, células productoras de ADA-2, al espacio pleural, contribuyendo así a la alta actividad de la ADA en estos derrames67. La ADA en LP se determina de forma rutinaria en países donde la prevalencia de TB como causa de DP es alta/moderada. En estos países, en los menores de 35años la rentabilidad de la ADA es tan elevada que incluso se podría prescindir de la BP para el diagnóstico68. Sin embargo, en países donde la prevalencia es baja, el valor predictivo positivo de este test será también bajo, por lo que su utilidad radicaría en poder descartar la enfermedad (alto valor predictivo negativo)69 (fig. 3).
Efecto de la prevalencia del derrame pleural tuberculoso en los valores predictivos positivo y negativo de adenosina desaminasa, para el diagnóstico del mismo (sensibilidad 90%, especificidad 93%). Cuando la prevalencia de la enfermedad es baja, su valor predictivo positivo también lo es, por lo que su utilidad radica en poder descartar la enfermedad (alto valor predictivo negativo). Si la prevalencia es alta, el valor predictivo positivo también está elevado, por lo que puede ser útil para confirmar la enfermedad.
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La determinación de la ADA tiene varias limitaciones. Al existir diversos métodos de determinación, los resultados pueden no ser extrapolables, lo que a su vez incidirá en la variabilidad de los puntos de corte utilizados, si bien también pueden influir otros factores, como la etnia de la población. Por tanto, el punto de corte debería establecerse según los resultados de cada centro o, al menos, basándose en los estudios de poblaciones similares y con la misma metodología70. En 3estudios de 630pacientes con un DP linfocítico no-TB, el 2,8% de los casos (18pacientes) tenían valores elevados de ADA71-73. Una tercera parte de los derrames paraneumónicos y dos tercios de los empiemas pueden tener valores elevados de esta enzima74, al igual que otros tipos de derrames23,34. La ADA también presenta falsos negativos, pero determinaciones repetidamente bajas parecen descartar la enfermedad75. La ADA no deja de ser un biomarcador inflamatorio, por lo que no sustituye al cultivo ni informa sobre la sensibilidad a los fármacos antituberculosos. Por tanto, en zonas con alto nivel de resistencias micobacterianas, ante un exudado linfocítico con una ADA elevada sería deseable intentar una BP, enviar muestras para cultivo y testar la sensibilidad a fármacos76.
Interferón-gammaEl interferón-gamma (IFN-γ) es una citoquina liberada por los linfocitosT-CD4+ que aumenta la actividad micobactericida de los macrófagos. Podemos determinar el IFN-γ presente en el LP o el liberado por las células mononucleares del LP tras su estimulación con antígenos específicos de MT. En un metaanálisis que incluye 22artículos y 2.101pacientes (782 con un DPTB), la sensibilidad, la especificidad, la RPP, la RPN y la odds ratio fueron 89%, 97%, 23,45, 0,11 y 272,7, respectivamente77. Al igual que con la ADA, no existe un punto de corte universal, porque los métodos de determinación no son siempre los mismos. También pueden cursar con valores elevados de IFN-γ los derrames neoplásicos, especialmente los hematológicos, y los empiemas78. La rentabilidad del IFN-γ en los DPTB es ligeramente superior, aunque no significativa, a la de la ADA79.
La determinación de IFN-γ estimulado con antígenos específicos de MT (ESAT-6 y CFP-10) podría contribuir al diagnóstico de los DPTB80. En un metaanálisis de 7artículos con 366pacientes (213 con DPTB), la sensibilidad, la especificidad, la RPP, la RPN y la odds ratio fueron en LP 75%, 82%, 3,5, 0,24 y 19, respectivamente, y ligeramente inferiores en sangre81. Estos resultados, y su precio, no justifican su determinación en la práctica clínica diaria82.
Otros biomarcadoresLa determinación de otros biomarcadores en el LP para el diagnóstico de los DPTB ha tenido una rentabilidad menor que la de la ADA y el IFN-γ y se resume en la tabla 183–94.
Otros biomarcadores utilizados en el diagnóstico de los derrames pleurales tuberculosos
| Biomarcador | Referencia | Año | DP totales | DPTB | Punto de corte | S (%) | E (%) | VPP (%) | VPN (%) | Comentarios |
| Neopterina | 83 | 2005 | 63 | 34 | 30mol/l | 85 | 93 | 94 | 84 | |
| Leptina | 84 | 2006 | 45 | 17 | 9,85ng/ml | 82,4 | 82,1 | Significativamente peor que la ADA | ||
| Lisozima LP/S | 85 | 1988 | 138 | 61 | 1,2 | 100 | 87 | 86 | 100 | Utilizada junto a la ADA |
| Lisozima LP/S | 23 | 1993 | 276 | 49 | 1,2 | 67,3 | 90,3 | 60 | 92,7 | Baja sensibilidad |
| Fibronectina | 86 | 1989 | 51 | 14 | – | No aporta datos de rentabilidad. Niveles significativamente mayores en los DPTB que en los neoplásicos | ||||
| RS IL-2 | 87 | 2004 | 55 | 20 | No aporta más datos que el área bajo la curva: 0,990 (mejor que la de la ADA pero peor que la del IFN-γ) | |||||
| TNF-α | 88 | 1999 | 63 | 33 | – | No aporta datos de rentabilidad. Niveles significativamente mayores en los DPTB que en los neoplásicos | ||||
| IL-1β | 88 | 1999 | 63 | 33 | – | No aporta datos de rentabilidad. Niveles significativamente mayores en los DPTB que en los neoplásicos | ||||
| Activación complemento (SC5b-9) | 89 | 1992 | 64 | 26 | 2mg/l | 100 | 74 | 72 | 100 | Correlación entre ADA y SC5b-9 |
| IL-12 p40 | 90 | 2009 | 96 | 39 | 550pg/ml | 92,3 | 70,2 | 67,9 | 93 | Significativamente peor que la ADA |
| IL-6 | 91 | 2003 | 66 | 32 | 4.000pg/ml | 90,6 | 79,4 | |||
| IL-6 | 92 | 2002 | 57 | 9 | – | Niveles significativamente mayores que en los derrames malignos y paraneumónicos | ||||
| CD4+ | 93 | 2005 | 70 | 36 | – | 75,6 | 77,1 | Valores significativamente inferiores que los de la ADA. Correlación entre ADA y CD4+ | ||
| IP-10 | 94 | 2009 | 74 | 48 | 28.170pg/ml4.035pg/ml | 80100 | 8253 | 9183 | 64100 | |
| Lipoarabinomanan | 94 | 2009 | 74 | 48 | No utilidad clínica. No aporta datos |
ADA: adenosina deaminasa; DP: derrame pleural; DPTB: derrame pleural tuberculoso; E: especificidad; IFN-γ, interferón-gamma; IP-10: proteína inducible 10; LP/S: líquido pleural suero; RS IL-2: receptores solubles interleuquina-2; S: sensibilidad; TNF-α: factor-α de necrosis tumoral; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Aunque en las 2primeras semanas el recuento diferencial de células puede revelar un predominio de polimorfonucleares95, lo habitual es que sea de linfocitos (>50%)34. Si este recuento supera el 80%, el diagnóstico diferencial estaría entre TB, linfoma y algunos pocos casos de DP metastásicos96, ya que otras posibilidades podrían excluirse por su escasa prevalencia (pleuritis reumatoide y sarcoidosis)97, por la historia clínica (cirugía de revascularización mediante by-pass aorto-coronario98, rechazo pulmonar agudo y síndrome de uñas amarillas), o por el aspecto del líquido (quilotórax). El recuento de células mesoteliales no suele ser >5%99, aunque una cifra superior no excluye el diagnóstico100. Más controvertido es si la presencia de más de un 10% de eosinófilos en el LP reduce la probabilidad de TB101,102.
Combinación de parámetrosVarios estudios han desarrollado test diagnósticos basados en la combinación de múltiples variables (tabla 2)82,103–108. En general, todos logran mejorar la rentabilidad de los parámetros utilizados individualmente, pero son poco útiles en la clínica diaria ya que necesitan aplicar complejos cálculos estadísticos que, por otra parte, no dejan de ser arbitrarios. Por el contrario, Burgess et al.108, utilizando un valor de ADA>50U/l y un cociente linfocitos/neutrófilos >0,75, obtienen una elevada rentabilidad diagnóstica.
Combinación de variables para el diagnóstico de los derrames pleurales tuberculosos
| Referencia | Año | Combinación utilizada | Características | Rentabilidad |
| 81 | 2009 | Edad, proteínas | DPTB vs no-DPTB | Sensibilidad 54%, especificidad 89% |
| 101 | 2003 | ADA, edad, temperatura, recuento de hematíes | DPTB vs DP neoplásicos | Sensibilidad 95%, especificidad 94% |
| 102 | 2001 | Edad, recuento de leucocitos, prueba de la tuberculina, exudado sanguinolento | DPTB vs no-DPPTB | Sensibilidad 90%, especificidad 87% |
| 103 | 2009 | ADA, globulinas, ausencia de células malignas en el líquido pleural | DPTB vs DP neoplásicos | Sensibilidad 94,5%, especificidad 99,5% |
| 104 | 2000 | ADA, IFN-γ, NAAT | DPTB vs no-DPTB | Sensibilidad 90,5%, especificidad 88,2% |
| 105 | 2007 | ADA, proteínas, LDH, recuento leucocitos, linfocitos (%) | DPTB vs no-DPTB | Sensibilidad y especificidad >95% |
| 106 | 1996 | ADA, cociente linfocitos/neutrófilos | DPTB vs no-DPTB | Sensibilidad 88%, especificidad 95% |
ADA: adenosina deaminasa; DPTB: derrame pleural tuberculoso; IFN-γ, interferón-gamma; LDH, lactato deshidrogenasa; NAAT: test de amplificación de ácidos nucleicos.
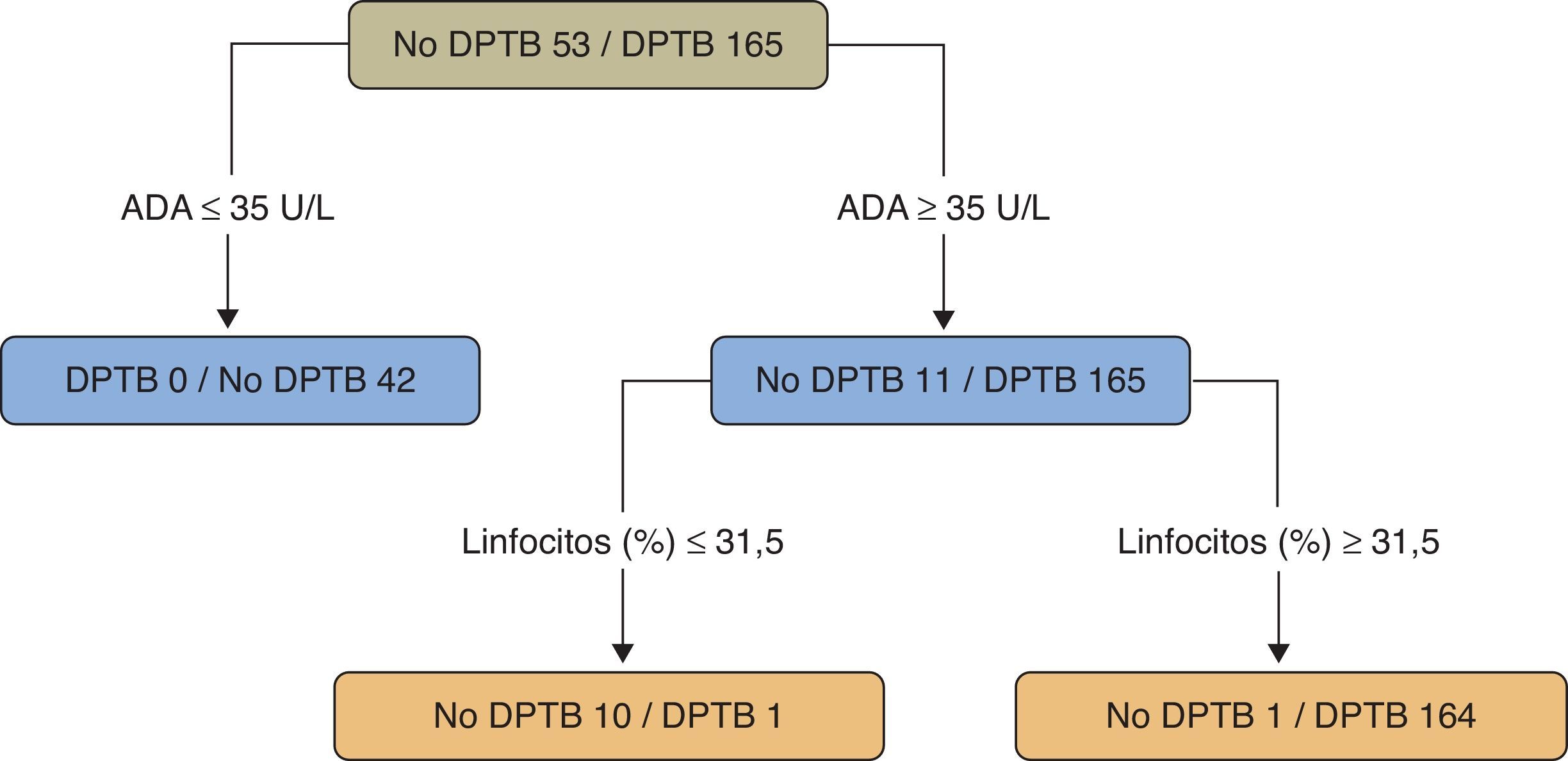
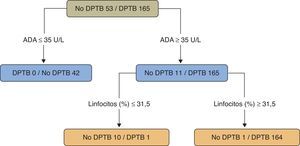
En un estudio sobre pacientes menores de 40años (218casos, 165 con DPTB) se utilizó un árbol de regresión para clasificar los DP como TB o no-TB. Se tuvieron en cuenta 20variables (clínicas, radiológicas, analíticas y la prueba de la tuberculina) y el programa estadístico solamente seleccionó los valores de ADA (como variable principal) (>35U/l) y el porcentaje de linfocitos (>31,5%) (sensibilidad 99,4%, especificidad 98,1%) (fig. 4)109. Un segundo modelo, sin ADA, eligió (por este orden) el porcentaje de linfocitos, la fiebre y la tos (sensibilidad 95,2%, especificidad 94,3%), significativamente peor que el modelo que tenía en cuenta la ADA (p<0,001).
Árbol de regresión para predecir un derrame pleural tuberculoso. Adenosina desaminasa (U/l) y linfocitos (%) fueron las variables elegidas en el árbol de regresión final.
ADA: adenosina desaminasa; DPTB: derrame pleural tuberculoso.
Fuente: Valdés et al.109.
En un estudio diseñado para saber si era posible diagnosticar los DPTB solamente a través del análisis del LP, una ADA>45U/l y un porcentaje de linfocitos >80% obtenían una sensibilidad del 58,4% y una especificidad del 99,5%. La especificidad del 100% se consiguió si a esos 2criterios se sumaban unas proteínas >5g/dl (sensibilidad 34,9%)110.
TratamientoUn DPTB no tratado puede resolverse espontáneamente en 1-4meses, si bien el 65% de los casos pueden desarrollar posteriormente una TB pulmonar111. De acuerdo con las recomendaciones actuales, un DPTB debe tratarse, como la TB pulmonar, con 4fármacos (isoniazida, rifampicina, piracinamida y etambutol) durante 2meses e isoniazida y rifampicina durante 4meses más (2HRZE/4HR)112,113. El etambutol se añade por si la resistencia primaria a isoniazida es elevada (>4%)113. Si esto no sucede y no hay afectación pulmonar, al ser el LP paucibacilar, una pauta sin etambutol sería igualmente útil113. Cañete et al.114 no observaron fallos en el tratamiento con RH durante 6meses en una serie de 130pacientes sin afectación pulmonar. Sin embargo, no hay estudios que hayan confirmado estos resultados, y esta pauta no está aceptada en las normativas112,113.
El tratamiento en la coinfección TB-VIH es el estándar (2HRZE/4HR). Existe una mayor prevalencia de resistencias a fármacos antituberculosos, que se tratan como en los pacientes inmunocompetentes, y puede surgir una interacción de la rifampicina con los inhibidores de la proteasa y algún inhibidor de la transcriptasa inversa no análogo de nucleósido115. En estos casos existirían varias opciones, como completar el tratamiento antituberculoso antes de comenzar con los antirretrovirales o introducir estos a los 2meses, o a las 2-8semanas de haber iniciado el mencionado tratamiento, dependiendo del recuento de células CD4+. Si no se puede utilizar la rifampicina, el tratamiento es menos eficaz y puede utilizarse la rifabutina o prolongar la fase de mantenimiento con isoniazida y etambutol hasta los 18meses116.
Algunos pacientes (16%; 10/61) pueden desarrollar un aumento paradójico del DP durante el tratamiento117. Esto se atribuye a un «rebote inmunológico» al coincidir, al iniciar el tratamiento, una excesiva carga antigénica en el LP, como resultado de una rápida lisis micobacteriana, con una mejoría de la inmunidad celular, lo que produciría una nueva reacción de hipersensibilidad118.
Existe cierta controversia sobre si los corticoides orales podrían, a través de su acción antiinflamatoria, acelerar la reabsorción del líquido y prevenir las adherencias pleurales. En 3ensayos clínicos119-121 no se observaron diferencias en el desarrollo de engrosamientos pleurales residuales, adherencias o deterioro de la función pulmonar, si bien, en uno de ellos, en los tratados con corticoides los días con fiebre fueron menores y la resolución del DP se acortó121. En una serie con DPTB-VIH la administración de corticoides se asoció a un mayor riesgo de sarcoma de Kaposi122, y una revisión de la Cochrane concluye que no hay evidencia para apoyar el uso de corticoides en estos pacientes123.
El drenaje rutinario del DP no parece recomendado124. Sin embargo, si existe disnea por un gran DP, sí podría llevarse a cabo119. Si el DPTB está loculado, el uso de fibrinolíticos aceleraría la resolución del DP y reduciría la incidencia de engrosamiento pleural residual125,126. Este último podría relacionarse con la magnitud del cambio inicial de los niveles de pH, glucosa y del factor-α de necrosis tumoral (TNF-α)127.
ConclusionesLa incidencia de TB, y por tanto de DPTB, está disminuyendo en España, y esta última en Galicia fue, en el año 2009, la mitad que en el año 2000. Afecta fundamentalmente a pacientes jóvenes, mayoritariamente entre 15 y 44años, y casi las dos terceras partes son hombres. La presentación clínica varía dependiendo de la población afectada. Los diagnósticos de certeza presentan limitaciones, por lo que se ha utilizado la determinación en el LP de diversos biomarcadores. La asociación de la ADA y el porcentaje de linfocitos pueden ser útiles para el diagnóstico. La prevalencia de DPTB influye sobre los valores predictivos positivo y negativo de la ADA y el tratamiento es el de cualquier TB. No parece recomendable añadir corticoides y el drenaje torácico podría contribuir, en los grandes derrames, a una mejoría más rápida de los síntomas.
FinanciaciónEl presente manuscrito se llevó a cabo sin becas.
Contribución de los autoresFerreiro L. Autora y redactora. Concepción y diseño. Aprobación final del manuscrito.
San José E. Coautora. Redactora. Aprobación final del manuscrito.
Valdés L. Redactor y autor. Concepción y diseño. Aprobación final del manuscrito.
Conflicto de interesesLos autores no tienen conflicto de intereses.