Se trata de una mujer de 66 años que ingresa en la sala de neumología en marzo de 2020 por neumonía bilateral grave por COVID-19. No presentaba antecedentes respiratorios previos y nunca había sido fumadora o se había expuesto a inhalantes o tóxicos ambientales. Como antecedentes médicos, padecía dislipemia bien controlada farmacológicamente, tiroiditis autoinmune que no precisaba tratamiento y había sido intervenida por un tumor mamario benigno y un linfoma folicular de piel cuyo estudio de extensión fue negativo.
Durante las primeras 24h de ingreso, presenta mala evolución con empeoramiento clínico, radiológico y gasométrico a pesar del tratamiento, por lo que se decide su traslado a la unidad de cuidados intensivos (UCI). Durante su estancia en la UCI, requiere ventilación mecánica invasiva y maniobras de pronación. Dada la fiebre persistente, se optimiza el tratamiento antibiótico (ceftriaxona, azitromicina, ceftarolina, piperacilina/tazobactam) y se instaura tratamiento recomendado por protocolo para COVID-19 (lopinavir/ritonavir, Betaferon® e hidroxicloroquina). Además, se añadió dexametasona y recibió una única dosis de tocilizumab (400mg). Biológicamente destacaban niveles de ferritina >15.000ng/ml e IL-6 previa a tocilizumab de 206pg/ml. Finalmente, tras una estancia prolongada en la UCI, experimenta mejoría y es dada de alta a sala de hospitalización.
Su posterior evolución en neumología fue lenta pero favorable: la mejora clínica se acompaña de una reducción progresiva de las necesidades de oxígeno suplementario y de la disminución de todos los parámetros inflamatorios (PCR, LDH, ferritina, IL-6; CPK, dímero D), así como de los infiltrados radiológicos. En dicho contexto, se decide iniciar programa de rehabilitación en cama y pruebas de progresiva tolerancia a la sedestación tras ingreso prolongado.
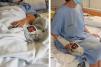
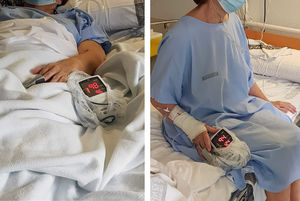
No obstante, y a pesar de la mejora, presenta cuadros de desaturación (hasta SpO2 al 90% con FiO2 al 50%) coincidiendo con la sedestación, junto con taquicardia, taquipnea, cianosis distal e intensa disnea. Sin embargo, los cuadros se resolvían completamente al adoptar de nuevo el decúbito (fig. 1). El primer episodio de desaturación se acompañó de un florido cuadro sincopal, por lo que se solicitó un estudio urgente para descartar un episodio cardiaco agudo (el ECG mostró un BRDHH ya conocido, y el NTproBNP y las troponinas ultrasensibles fueron normales), así como un angio-TC que fue negativo para tromboembolismo pulmonar y trombosis venosa profunda de miembros inferiores. No obstante, la TC detectó numerosas áreas de opacidad en vidrio deslustrado de predominio subpleural, especialmente abundantes en las bases pulmonares, hallazgos todos en relación con el proceso infeccioso en resolución. Ante la sospecha clínica de síndrome platipnea-ortodeoxia (SPO), se solicitó un ecocardiograma con inyección intravenosa de suero agitado que no evidenció signos de shunt intracardiaco ni paso tardío de burbujas. Finalmente, el SPO cedió tras varias semanas de convalecencia.
El hecho fisiopatológico que subyace a la presencia de hipoxemia en el SPO es el efecto shunt1. Las causas asociadas al SPO se clasifican en etiologías intracardiacas, extracardiacas (pulmonares) y en un tercer grupo heterogéneo1. En las enfermedades pulmonares, el shunt puede establecerse bien por la mezcla de sangre arterial y venosa (como en las fístulas arteriovenosas), bien por una alteración grave de la relación V/Q2, como sucede en algunas enfermedades parenquimatosas. Por efecto de la gravedad, el flujo sanguíneo se incrementa hacia las bases pulmonares mientras que disminuye la presión de perfusión en las regiones apicales (efecto espacio muerto en ápex). Esta redistribución vascular contribuye a incrementar las diferencias en la relación V/Q, las cuales son especialmente notables en bipedestación3. Así, se ha descrito el desarrollo de SPO asociado a enfisema, enfermedades intersticiales y consolidaciones especialmente cuando involucran al parénquima basal4. Dentro de esta definición, también tendrían cabida las alteraciones pulmonares propias del síndrome respiratorio agudo del adulto (SDRA).
Por otro lado, los datos analizados hasta el momento sugieren que el nuevo coronavirus tiene especial tropismo por el endotelio vascular. El SARS-CoV-2 inicia la infección celular mediante su unión al receptor de la enzima convertidora de angiotensina II, un receptor ampliamente distribuido en el organismo, incluyendo el endotelio. Algunas series de autopsias han demostrado inclusiones virales en las células endoteliales con acúmulos de células inflamatorias, hallazgos sugestivos de endotelitis5. Así, la activación endotelial inducida por el virus puede dar lugar tanto a fenómenos trombóticos como a una marcada vasodilatación. A nivel pulmonar, la vasodilatación y la disfunción endotelial agravan el efecto shunt observado en algunos pacientes6. En una revisión de manifestaciones radiológicas por COVID 19 detectadas por TC, se observó como hallazgo frecuente la dilatación de vasos pulmonares, especialmente aquellos más próximos o dentro de áreas de vidrio deslustrado7. Dicho fenómeno parece estar en relación directa con la producción de mediadores inflamatorios, en especial IL-1 e IL-6, citoquinas que han demostrado tener un potente efecto vasodilatador in vivo8. La vasodilatación inducida tanto por los mediadores inflamatorios como por la lesión endotelial vírica directa, podría ser la causa del efecto shunt.
El interés del presente caso radica, no solo en la infrecuencia del SPO, sino en su asociación con la infección por SARS-CoV-2. Existe reporte de casos de SPO asociados a agentes infecciosos durante el periodo de convalecencia tras un episodio de SDRA por Pseudomonas aereguminosa9 y neumonías por Pneumocystis jirovecii y citomegalovirus10, aunque también se ha descrito en SDRA asociado a agentes no infecciosos como el síndrome antisintetasa11. Sin embargo, no existe bibliografía hasta el momento que relaciones el SPO con las alteraciones anatomofuncionales propias de una neumonía grave por COVID-19.