Introducción
La cirugía sigue siendo el tratamiento de elección en determinados grupos de pacientes diagnosticados de carcinoma broncogénico no anaplásico de células pequeñas (CBNACP), en los que consigue una supervivencia a los 5 años del 80% aproximadamente en los tumores clasificados en estadio IA patológico1-3. Sin embargo, esta buena esperanza de vida puede verse condicionada por la comorbilidad asociada, debida fundamentalmente al hábito tabáquico4,5, o por la aparición de un segundo carcinoma pulmonar1,6. Por otro lado, algunos autores, basándose en el análisis retrospectivo de su experiencia, han llegado a la conclusión de que la práctica de la disección ganglionar sistemática puede ser prescindible en determinadas circunstancias7-11. Trabajos recientes12,13 han comprobado que el número de ganglios extirpados condiciona significativamente el pronóstico en el estadio I patológico.
El objetivo de nuestro trabajo es, dada la elevada esperanza de vida, comprobar las causas de mortalidad en los pacientes operados de un CBNACP en estadio IA y el impacto que tiene en la supervivencia el hecho de no realizar una disección ganglionar sistemática, así como el número de ganglios resecados.
Pacientes y métodos
Desde 1981 hasta 2001, un total de 158 pacientes afectados de un CBNACP fueron resecados y clasificados en el estadio IA de acuerdo con el sistema tumor, nódulo, metástasis patológico, según la normativa propuesta por la Sociedad Española de Neumología y Cirugía Torácica14. Se excluyó del estudio a 2 enfermos (1,2%) que fallecieron en el postoperatorio. Al resto (156 pacientes) se les practicó una resección completa, definida como tal cuando los bordes de resección no estaban invadidos macro o microscópicamente. Durante todo el período de estudio nuestra actitud quirúrgica no cambió, es decir, no practicamos disección ganglionar sistemática y sólo se procedió a extirpar los ganglios palpables o visibles; por tanto, los pacientes clasificados como N0 lo fueron porque no se visualizaron o palparon ganglios durante el tiempo quirúrgico, o bien porque, si existieron y se extirparon, el estudio histológico demostró que no estaban invadidos por el tumor. Ningún paciente recibió tratamiento adyuvante a la cirugía.
El sexo, la edad, la amplitud de la exéresis pulmonar practicada, la estirpe histológica, el diámetro tumoral, el número de ganglios extirpados y la causa de muerte fueron las variables seleccionadas para el estudio. Establecimos que había recidiva local cuando el tumor apareció en el mismo pulmón o en el muñón bronquial; recidiva locorregional cuando la enfermedad se manifestó en el mediastino o en los ganglios supraclaviculares, y metástasis a distancia cuando apareció en el pulmón contralateral o en otro órgano1. La aparición de un segundo carcinoma broncogénico se consideró como tal cuando la estirpe histológica fue diferente o, si fue idéntica, cuando el intervalo entre ambos tumores fue de al menos 2 años o cuando el segundo tumor se localizó en un lóbulo o pulmón diferente sin afectación linfática común o metástasis en el momento del diagnóstico15.
En cuanto al análisis estadístico, se utilizó el método de Kaplan-Meier para el cálculo de la supervivencia, y las curvas se compararon mediante el test de rangos logarítmicos. La fecha de observación fue el 1 de enero de 2004.
Resultados
Entre los pacientes incluidos en el estudio había 149 varones y 7 mujeres. La edad media (± desviación estándar) fue de 61,6 ± 8,8 años (rango: 36-81 años). En 83 ocasiones el tumor se encontró casualmente, mientras que 73 pacientes presentaron síntomas. El tumor se localizó en el pulmón derecho en 93 pacientes y en el izquierdo en 63. Se realizaron 133 lobectomías, 9 bilobectomías y 14 segmentectomías. En cuanto a la estirpe histológica, 92 fueron epidermoides, 56 adenocarcinomas y 8 anaplásicos de células grandes. El tamaño medio fue de 2,2 ± 0,8 cm (rango: 0,1-3 cm). En 32 pacientes no se extirpó ningún ganglio y en 124 sí se resecaron. La media del número de ganglios extirpados fue de 3,7 ± 3,4 (rango: 0-18 ganglios). En el momento del estudio, 85 pacientes (54,4%) habían fallecido, 4 (2,5%) se habían perdido durante el seguimiento y 67 (42,9%) estaban vivos.
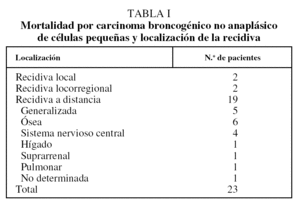
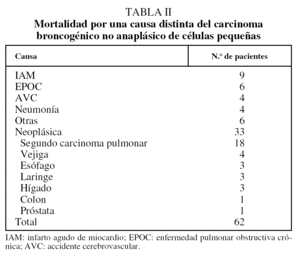
En la tabla I se exponen las causas de muerte por recidiva del CBNACP. Dos pacientes (1,2%) presentaron una recidiva local, uno por generalización homolateral de un carcinoma bronquioloalveolar a los 15 meses de la intervención, y otro por aparición de un carcinoma epidermoide en el bronquio principal derecho a los 7 meses de habérsele practicado una lobectomía inferior derecha. Otros 2 pacientes (1,2%) presentaron recidiva locorregional, uno en la región ganglionar de la ventana interaortopulmonar a los 18 meses de una lobectomía inferior izquierda con ganglio del hilio lobar negativo por un carcinoma epidermoide, y el segundo en ganglio paratraqueal derecho a los 45 meses de haber experimentado una lobectomía inferior derecha por un adenocarcinoma con ganglio del hilio lobar negativo. Diecinueve (12,1%) fallecieron de metástasis a distancia. El tiempo medio de aparición de la recidiva fue de 2,7 años, la mediana de 1,2 años y el rango de 0,3-16,2 años. En 3 pacientes la metástasis se manifestó después de los 5 años de seguimiento. En 62 pacientes (39,7%) la causa de fallecimiento no estuvo relacionada con el CBNACP del que se les había operado (tabla II): 29 (15,6%) fallecieron por causa no tumoral y 33 (21,1%) por la aparición de un segundo carcinoma, 18 de los cuales fueron broncogénicos (11,5%). El tiempo medio hasta el fallecimiento por otra causa distinta del CBNACP fue de 7,5 años, la mediana de 6,8 años y el rango de 0,2-16,9 años. El tiempo medio de aparición de un segundo carcinoma broncogénico fue de 5,7 años, la mediana de 4,7 años y el rango de 0,7-13 años.
En el momento del estudio 67 pacientes (42,9%) permanecían vivos y libres de enfermedad. Dos pacientes sobrevivían 4 años después de habérseles practicado una resección de metástasis cerebral única y radioterapia adyuvante. Seis pacientes desarrollaron un segundo carcinoma broncogénico y otros 3 desarrollaron tumores malignos en otra localización. El tiempo medio de supervivencia fue de 8,4 años, la mediana de 6,9 años y el rango de 2,2-20,7 años.
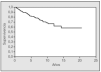
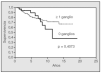
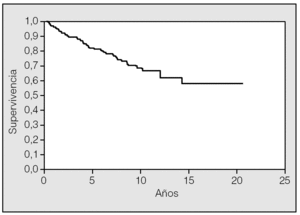
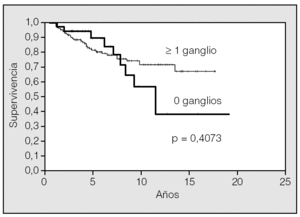
La supervivencia a los 5 y 10 años fue del 81,4 y el 68%, respectivamente (fig. 1). Cuando no se extirpó ningún ganglio, la supervivencia a los 5 años fue del 88,9%, mientras que fue del 79,9% cuando sí se extirparon (fig. 2), aunque la diferencia no fue significativa (p = 0,4073).
Fig. 1. Supervivencia global de la serie.
Fig. 2. Supervivencia y número de ganglios extirpados.
Discusión
Los pacientes a los que se les ha practicado cirugía por un CBNACP en estadio IA tienen un buen pronóstico a largo plazo, lo que nos permite valorar determinados aspectos de los patrones de mortalidad. En la actualidad existe un interés creciente por el impacto que tiene la comorbilidad en el pronóstico de los pacientes operados de un CBNACP, y algunos autores incluyen determinados indicadores de comorbilidad4,5 cuando analizan los factores que condicionan la supervivencia. Ciertamente, y coincidiendo con otros autores4,5,16, hemos podido comprobar que un número importante de los pacientes intervenidos fallecen de una causa distinta del CBNACP del que se les había operado; en nuestra experiencia, un 39,7%.
En cuanto a la mortalidad debida al CBNACP hemos constatado, como apunta algún autor1,6, que existen 2 patrones. El primero se caracteriza por la aparición de metástasis, fundamentalmente a distancia, las cuales suelen manifestarse tempranamente tras la cirugía, en nuestro caso, con una media de 2,7 años. El segundo está determinado por la aparición de un segundo carcinoma, que suele manifestarse más tardíamente (media de 5,7 años en nuestra serie).
Uno de los aspectos más importantes, a nuestro juicio, es valorar los patrones de recidiva tumoral en pacientes sometidos o no a una disección ganglionar sistemática. Dejando al margen la morbilidad que puede producir la realización de dicha linfadenectomía17, el beneficio que puede comportar se plantea desde la doble perspectiva de la correcta estadificación del paciente y del impacto que puede tener en la supervivencia. En cuanto a la primera cuestión, existen diversos procedimientos, que van desde no realizar ningún tipo de muestreo hasta la disección ganglionar extendida18,19. Parece obvio que cuanto más amplia sea la linfadenectomía practicada mayor será la probabilidad de acierto de la estadificación patológica20. Sin embargo, este punto es conflictivo, ya que algunos autores no han comprobado que el porcentaje de N1 o N2 encontrados mediante la disección ganglionar sistemática sea significativamente diferente del obtenido mediante muestreo ganglionar de determinadas estaciones hiliares y mediastínicas8,20,21; por ello algunos grupos proponen que sería suficiente el muestreo ganglionar de un número mínimo de ganglios22 o de determinadas estaciones preestablecidas según la localización del tumor23. Contrariamente, otros grupos concluyen que es necesaria la disección ganglionar sistemática para una correcta estadificación1,24,25. Esta técnica, impulsada principalmente por el grupo del National Cancer Center Hospital de Tokio26, es la que ha obtenido un mayor grado de aceptación e incluye, junto a la extirpación de todos los ganglios del pulmón, la exéresis de todas las adenopatías mediastínicas homolaterales incluidas en bloque con la grasa mediastínica.
Parece existir una tendencia a considerar que la realización de la disección ganglionar sistemática podría obviarse en determinadas circunstancias (tamaño, localización o estirpe tumoral), si el muestreo intraoperatorio de los ganglios hiliares es negativo. Este punto de vista, basado en el análisis retrospectivo de la experiencia de determinados autores, fundamentalmente de la escuela japonesa8,9,10,27, incluido el National Cancer Center Hospital de Tokio7,11,28, no es compartido por otros que concluyen que es preciso realizarla en todos los pacientes, ya que el muestreo intraoperatorio de los ganglios hiliares no garantiza que no exista afectación ganglionar mediastínica, independientemente de la localización, el tamaño o la estirpe histológica1,24,25.
Como hemos comentado anteriormente, nosotros realizamos una linfadenectomía "a demanda", por lo que existiría la posibilidad de que determinados pacientes clasificados como N0 fueran, en realidad, N1 o N2. Si analizamos el patrón de recidiva tumoral de nuestra serie, sólo en 2 casos (1,2%) la recidiva se localizó en el ganglio mediastínico, a los 18 y 45 meses, respectivamente, de la intervención. Por otra parte, la realización de una disección ganglionar sistemática no garantiza que la recidiva no aparezca en el ganglio mediastínico1,29.
El impacto de la linfadenectomía ganglionar sistemática sobre la supervivencia de los pacientes clasificados en estadio I es incierto según el análisis de algunos estudios aleatorios. Izbicki et al30 y Sugi et al8 no han observado diferencia alguna en la supervivencia, mientras que en el estudio de Wu et al31, que incluía a 321 pacientes clasificados en estadio I y recogidos prospectivamente, la supervivencia fue significativamente mejor en los pacientes sometidos a una disección ganglionar sistemática con respecto a los pacientes sometidos a muestreo. Por el contrario, en una serie de pacientes con tumores clasificados en estadio IA clínico, Funatsu et al32 observan que 61 pacientes sometidos a disección ganglionar sistemática tuvieron una supervivencia a los 5 años del 70%, significativamente peor que la de 64 pacientes a los que no se practicó dicha disección, en quienes fue del 90%. En nuestra experiencia, la supervivencia a los 5 años fue del 81,4%, similar a la observada por otros grupos que practican disección ganglionar sistemática1-3.
Recientemente algunos autores12,13 han comprobado que el número de ganglios extirpados condiciona de forma significativa el pronóstico en el estadio IA patológico, con una supervivencia a los 5 años en torno al 70%, siendo significativamente mejor cuanto mayor es el número de ganglios resecados. En nuestra serie, el número de ganglios extirpados no mostró influencia alguna sobre la supervivencia, que, como ya hemos comentado, fue algo superior a la comunicada por estos autores.
En conclusión, un número importante de pacientes operados de un CBNACP en estadios tempranos fallecen por causas distintas de éste, por lo que sería recomendable incluir variables de comorbilidad en el estudio de los factores pronósticos4,5. Por otro lado, el papel de la linfadenectomía en la cirugía oncológica continúa siendo un tema a debate33, del cual no puede sustraerse el CBNACP19. Esperemos que los resultados de un ensayo aleatorizado, cerrado recientemente por el American College of Surgeons Oncology Group, arrojen algo de luz sobre este polémico tema34.