El uso de la manometría pleural (MP) durante la toracocentesis terapéutica es motivo de controversia1,2. Un pequeño estudio realizado hace 20 años en derrames pleurales (DP) malignos (DPM) sugiere que la elastancia pleural (PEL) [capacidad que tiene el pulmón de volver a su posición natural a medida que se extrae el líquido pleural (LP)]3 puede predecir el éxito de una pleurodesis4. Esto ha llevado a que en estos derrames se recomiende identificar si existe un pulmón no expansible (PNE)3 para decidir su manejo5. El objetivo del estudio ha sido valorar si se puede predecir el éxito de una pleurodesis en los DPM mediante la determinación de distintos parámetros bioquímicos en el LP y la PEL.
Realizamos un estudio retrospectivo de los DPM (citología o biopsia pleural positivas para malignidad) a los que se les practicó, entre enero-2014 y octubre-2016, una toracocentesis terapéutica con MP y posterior pleurodesis. Fue motivo de exclusión haber recibido previamente quimioterapia/radioterapia, tener una expectativa de vida <1 mes, o presentar un DP loculado. Los pacientes firmaban un consentimiento informado antes de realizar la toracocentesis terapéutica con MP. El estudio fue aprobado por el comité ético del hospital (registro 2016/518).
La presión pleural se midió con un manómetro digital (Compass; Mirador Biomedical6) y la técnica utilizada fue la previamente descrita7. La toracocentesis finalizaba cuando ya no era posible extraer líquido, la presión pleural alcanzaba los –20cmH2O, o aparecía dolor torácico8. La PEL se calculó en base a la fórmula: [presión de apertura–presión de cierre (cmH2O)]/volumen de líquido retirado (en L). El diagnóstico de PNE se estableció si en la radiografía de tórax postoracocentesis no se observaba reexpansión pulmonar completa.
La pleurodesis (suspensión de 4 g de talco en 50 cc de suero salino al 0,9% inyectada lentamente) se realizó tras evacuar el DP a través de un drenaje torácico (16F) y comprobar radiológicamente la reexpansión pulmonar, independientemente de la cantidad de líquido drenado diariamente9. El drenaje se mantenía cerrado durante 2-3h y posteriormente se conectaba a aspiración suave progresiva. A las 24h se retiraba el tubo torácico sin tener en cuenta el volumen de líquido drenado ni realizar un control radiológico10. Se consideró que la pleurodesis había tenido éxito si, hasta su fallecimiento, el DP no se había vuelto a acumular o lo hacía parcialmente, pero sin necesidad de realizar más toracocentesis11. Se consideraba fracaso si el derrame recurría o era necesario hacer nuevos procedimientos para aliviar los síntomas. La decisión de realizar la pleurodesis se tomó al margen de los resultados del análisis del LP y de la PEL.
Las muestras de LP y sangre se obtuvieron simultáneamente, con el paciente en ayunas. Los parámetros bioquímicos que se determinaron en LP fueron los incluidos en el protocolo de nuestro centro. Los datos se describen como medias±desviación estándar, o medianas y percentiles 25-75%, según las distribuciones de las muestras fueran normales o no. Para la comparación entre los grupos se utilizó la prueba chi-cuadrado de Pearson si las variables eran cualitativas, y la prueba no paramétrica de Mann-Whitney si eran cuantitativas. Para evaluar la capacidad de discriminación de los marcadores en el pronóstico de la pleurodesis (éxito/fracaso) se calcularon las curvas ROC y el área bajo la curva.
Se llevaron a cabo 148 MP, de las que 110 lo fueron en DPM. La pleurodesis se realizó a 36 pacientes [20 mujeres y 16 hombres (edad media: 65,2±12,9 años; rango, 18-89)]. Se excluyeron 74 pacientes por quimioterapia/radioterapia previa (31), corta expectativa de vida (28), DP loculado (8) y no firmar el consentimiento informado (7). Un PNE se diagnosticó en 8 pacientes (22,2%).
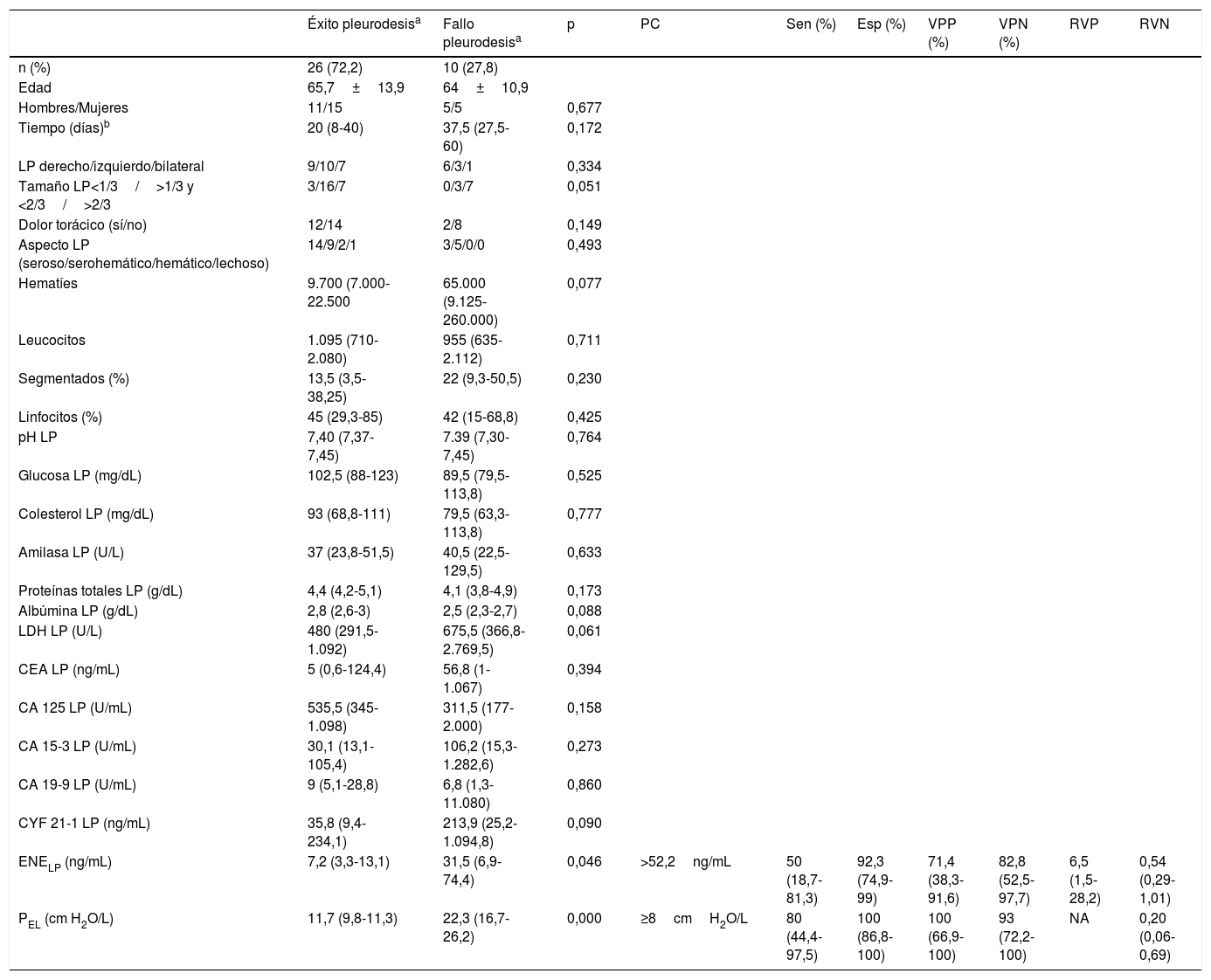
En 26 enfermos (72,2%), la pleurodesis tuvo éxito y en 10 (27,8%), fracasó (tabla 1). Solamente se encontraron diferencias significativas entre ambos grupos para la enolasa neuroespecífica en LP (ENELP) (p=0,046) y la PEL (p=0,000). La rentabilidad diagnóstica para predecir el fracaso de la pleurodesis de estas dos variables se muestra en la misma tabla [áreas bajo las curvas ROC de la ENELP y de la PEL de 0,717 (0,526-0,908) y 0,935 (0,842-1,027), respectivamente].
Características del total de pacientes de acuerdo con la respuesta a la pleurodesis y rentabilidad diagnóstica de las variables con diferencias significativas entre ambos grupos de respuesta a la pleurodesis, para predecir su fracaso [porcentajes (IC95%)]
| Éxito pleurodesisa | Fallo pleurodesisa | p | PC | Sen (%) | Esp (%) | VPP (%) | VPN (%) | RVP | RVN | |
|---|---|---|---|---|---|---|---|---|---|---|
| n (%) | 26 (72,2) | 10 (27,8) | ||||||||
| Edad | 65,7±13,9 | 64±10,9 | ||||||||
| Hombres/Mujeres | 11/15 | 5/5 | 0,677 | |||||||
| Tiempo (días)b | 20 (8-40) | 37,5 (27,5-60) | 0,172 | |||||||
| LP derecho/izquierdo/bilateral | 9/10/7 | 6/3/1 | 0,334 | |||||||
| Tamaño LP<1/3/>1/3 y <2/3/>2/3 | 3/16/7 | 0/3/7 | 0,051 | |||||||
| Dolor torácico (sí/no) | 12/14 | 2/8 | 0,149 | |||||||
| Aspecto LP (seroso/serohemático/hemático/lechoso) | 14/9/2/1 | 3/5/0/0 | 0,493 | |||||||
| Hematíes | 9.700 (7.000-22.500 | 65.000 (9.125-260.000) | 0,077 | |||||||
| Leucocitos | 1.095 (710-2.080) | 955 (635-2.112) | 0,711 | |||||||
| Segmentados (%) | 13,5 (3,5-38,25) | 22 (9,3-50,5) | 0,230 | |||||||
| Linfocitos (%) | 45 (29,3-85) | 42 (15-68,8) | 0,425 | |||||||
| pH LP | 7,40 (7,37-7,45) | 7.39 (7,30-7,45) | 0,764 | |||||||
| Glucosa LP (mg/dL) | 102,5 (88-123) | 89,5 (79,5-113,8) | 0,525 | |||||||
| Colesterol LP (mg/dL) | 93 (68,8-111) | 79,5 (63,3-113,8) | 0,777 | |||||||
| Amilasa LP (U/L) | 37 (23,8-51,5) | 40,5 (22,5-129,5) | 0,633 | |||||||
| Proteínas totales LP (g/dL) | 4,4 (4,2-5,1) | 4,1 (3,8-4,9) | 0,173 | |||||||
| Albúmina LP (g/dL) | 2,8 (2,6-3) | 2,5 (2,3-2,7) | 0,088 | |||||||
| LDH LP (U/L) | 480 (291,5-1.092) | 675,5 (366,8-2.769,5) | 0,061 | |||||||
| CEA LP (ng/mL) | 5 (0,6-124,4) | 56,8 (1-1.067) | 0,394 | |||||||
| CA 125 LP (U/mL) | 535,5 (345-1.098) | 311,5 (177-2.000) | 0,158 | |||||||
| CA 15-3 LP (U/mL) | 30,1 (13,1-105,4) | 106,2 (15,3-1.282,6) | 0,273 | |||||||
| CA 19-9 LP (U/mL) | 9 (5,1-28,8) | 6,8 (1,3-11.080) | 0,860 | |||||||
| CYF 21-1 LP (ng/mL) | 35,8 (9,4-234,1) | 213,9 (25,2-1.094,8) | 0,090 | |||||||
| ENELP (ng/mL) | 7,2 (3,3-13,1) | 31,5 (6,9-74,4) | 0,046 | >52,2ng/mL | 50 (18,7-81,3) | 92,3 (74,9-99) | 71,4 (38,3-91,6) | 82,8 (52,5-97,7) | 6,5 (1,5-28,2) | 0,54 (0,29-1,01) |
| PEL (cm H2O/L) | 11,7 (9,8-11,3) | 22,3 (16,7-26,2) | 0,000 | ≥8cmH2O/L | 80 (44,4-97,5) | 100 (86,8-100) | 100 (66,9-100) | 93 (72,2-100) | NA | 0,20 (0,06-0,69) |
[mediana (percentiles 25-75%)].
CA125: antígeno cáncer 125; CA15-3: antígeno carbohidrato 15-3; CA19-9: antígeno carbohidrato 19-9; CEA: antígeno carcinoembrionario; CYF 21-1: fragmento de citoqueratina 21-1; ENE: enolasa neuroespecífica; Esp: especificidad; LDH: lactato deshidrogenasa; LP: líquido pleural; NA: no aplicable; PC: punto de corte; PEL: elastancia pleural; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva; Sen: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo
Este estudio confirma que la PEL es un parámetro útil para predecir la respuesta a la pleurodesis en un DPM, de tal forma que valores ≥18cmH2O/L sugieren su fracaso al existir una mala aposición de ambas hojas pleurales12 y no ser capaz el pulmón de volver a su posición natural a medida que se extrae el LP. En los enfermos con un pulmón expansible y con una PEL inferior al punto de corte, la pleurodesis también puede fallar (2/28; 7,1%). Esto parece indicar que existen otras causas que influyen en el fracaso de la pleurodesis (respuesta inflamatoria insuficiente para causar fibrosis y provocar sínfisis pleural, o el tiempo transcurrido entre el diagnóstico y el inicio del drenaje13).
El único parámetro bioquímico que demostró cierto valor discriminante para predecir el fallo de la pleurodesis fue la ENELP, sin diferencias significativas con la de la PEL (p=0,07564), probablemente por el pequeño tamaño muestral de la serie y por la amplitud de los intervalos de confianza. Así, el límite inferior de la razón de verosimilitud positiva de la ENELP (1,5) no cambia mucho la probabilidad de diagnosticar un fracaso de la pleurodesis. Desconocemos el motivo por el que la ENELP está elevada en estos pacientes. Es posible que, como en la artritis reumatoide, se genere una situación de hipoxia que origine una activación de la glucólisis anaeróbica y se eleve este marcador14,15. Las principales limitaciones del estudio son su naturaleza retrospectiva, el pequeño número de casos incluidos y que los pacientes han sido reclutados en un único centro.
Nuestro estudio sugiere que en los DPM, la determinación de la ENELP y la medición de la PEL pueden predecir la respuesta a la pleurodesis. En pacientes con una PEL elevada (≥18cmH2O/L), la probabilidad de fallo de la pleurodesis es muy elevada y, por tanto, deberían considerarse otras alternativas terapéuticas con posibilidades de éxito para controlar, con prontitud, la sintomatología del paciente.