El propósito de nuestro estudio ha sido evaluar la sobreexpresión proteica de c-erbB-2 mediante técnicas de inmunohistoquímica y la amplificación del oncogén mediante hibridación in situ fluorescente, en una serie de carcinomas microcíticos, correlacionándola con las posibles implicaciones pronósticas.
Pacientes y métodosSe incluyó a 99 pacientes con tumores microcíticos clasificados en 2 grandes grupos: enfermedad limitada o localmente avanzada y enfermedad diseminada. El material para estudio se obtuvo mediante biopsia endoscópica en el 97% de los casos (96/99) o mediante punción guiada por tomografía computarizada en el 3% restante (3/99). La supervivencia se analizó con el método de Kaplan-Meier.
ResultadosLa media de edad ± desviación estándar de los pacientes fue de 62,9±10,4 años (rango: 36-81). El 92,9% (n=92) eran varones y el 7,1% mujeres (n=7). Un 39,4% (n=39) presentaba enfermedad limitada y el 60,6% (n=60) enfermedad diseminada. La sobreexpresión proteica de c-erbB-2 se observó en el 26,3% de los casos (n=26), de los cuales un 15,4 % (n=4) presentaba enfermedad limitada y el 84,6 % restante (n=22) enfermedad diseminada (p=0,005). La media de supervivencia fue ligeramente mayor para los pacientes con c-erbB-2 negativo que en aquéllos con c-erbB-2 positivo, pero esta diferencia no fue estadísticamente significativa. La técnica de hibridación in situ fluorescente mostró amplificación génica en el 6,3% (1/16) de los casos estudiados, con un índice de 2,3.
ConclusionesEl producto proteico del oncogén c-erbB-2 se sobreexpresa en un 33,3% de los carcinomas microcíticos pulmonares y se asocia a la presencia de enfermedad diseminada. Son necesarios nuevos estudios para evaluar el posible beneficio del tratamiento específico.
Our objective was to evaluate ERBB2 oncogene amplification using fluorescence in situ hybridization (FISH) and protein overexpression using immunohistochemical techniques, and to explore their possible prognostic value in a series of patients with small cell carcinoma.
Patients and methodsIncluded in the study were 99 patients with small cell tumors, classified in 2 broad groups: patients with limited locally advanced disease and patients with disseminated disease. Material for study was obtained in 97% of the cases (96/99) by means of endoscopic biopsy and by tomography-guided needle biopsy in the remaining 3% (3/99). Survival was analyzed using the Kaplan-Meier method.
ResultsThe 92 men (92.9%) and 7 women (7.1%) in the study had a mean (SD) age of 62.9 (10.4) years (range, 36-81 years); 39.4% (n=39) and 60.6% (n=60) of the subjects had limited and disseminated disease, respectively. ERBB2 protein overexpression was observed in 26.3% of the patients (n=26), 15.4% (n=4) of whom had limited disease and 84.6% (n=22) of whom had disseminated disease (P=.005). Although mean survival was slightly longer for patients who were negative for ERBB2 protein overexpression, the difference was not statistically significant. FISH identified gene amplification in 6.3% (1 in 16) of the studied cases (ratio, 2.3).
ConclusionsThe protein product of the ERBB2 oncogene is overexpressed in 33.3% of small cell lung carcinomas and is associated with the presence of disseminated disease. Further studies are necessary to evaluate the possible benefits of specific treatment.
El carcinoma microcítico de pulmón representa aproximadamente el 15-25% de todas las neoplasias pulmonares malignas1. Sus características principales son su naturaleza neuroendocrina, la mayor agresividad en el comportamiento biológico y la buena respuesta a la quimioterapia2, a pesar de lo cual menos del 10% de los pacientes tiene una supervivencia superior a 2 años tras el inicio del tratamiento. La supervivencia a los 5 años alcanza únicamente al 3-7% de los pacientes3.
El oncogén c-erbB-2 es el segundo miembro de la familia del receptor del factor de crecimiento epidérmico, que codifica la proteína p185, la cual actúa como receptor tirosincinasa asociado a múltiples vías de traducción de señales4. La sobreexpresión proteica y amplificación del gen de c-erbB-2 se ha encontrado en diversos tumores, incluido el de pulmón5. Está mejor establecida en el carcinoma de mama, donde se ha observado sobreexpresión en el 15-40% de estos tumores, considerándose además un factor de mal pronóstico6,7. En tumores pulmonares no microcíticos se ha evidenciado sobreexpresión en un porcentaje variable, que oscila entre el 20 y el 30%, particularmente en adenocarcinomas8,9, y todavía son objeto de debate las posibles implicaciones pronósticas. Un estudio reciente sobre el carcinoma microcítico de pulmón ha puesto de manifiesto con técnicas de inmunohistoquímica la sobreexpresión de c-erbB-2 en el 17,9% de los casos (12/67), con un valor pronóstico desfavorable para estos pacientes10.
El uso del anticuerpo monoclonal trastuzumab para el tratamiento de las pacientes con cáncer metastásico de mama con sobreexpresión de c-erbB-2ha abierto una gran expectativa para el tratamiento de otros tumores que sobreexpresan c-erbB211.
El propósito de nuestro estudio ha sido evaluar la prevalencia de sobreexpresión del oncogén c-erbB-2, mediante técnicas de inmunohistoquímica e hibridación in situ fluorescente (FISH), y su posible implicación pronóstica o terapéutica en la supervivencia de los pacientes con carcinoma pulmonar microcítico.
Pacientes y métodosPacientesSe incluyó en el estudio a 99 pacientes con carcinoma microcítico de pulmón, diagnosticados de manera consecutiva en el período 1997-2004 y procedentes del archivo del Servicio de Anatomía Patológica del Hospital Gregorio Marañón. Los tumores se clasificaron en 2 grandes grupos de acuerdo con los criterios de Stahel12: enfermedad limitada o localmente avanzada y enfermedad diseminada. En el grupo de enfermedad limitada se incluyeron los tumores limitados a un hemitórax; el subgrupo de enfermedad localmente avanzada incluyó los tumores limitados con metástasis ganglionares hiliares contralaterales, y el grupo de enfermedad diseminada comprendió a los pacientes con metástasis a distancia.
La evaluación del estadio se realizó por radiografía torácica, broncoscopia con biopsia, tomografía computarizada torácica, craneal y abdominal, bioquímica sanguínea, que incluyó recuento de células sanguíneas, escintigrafía ósea y biopsia de médula ósea. Según el sistema TNM, los tumores hasta el estadio IIIb se consideran enfermedad limitada, y el estadio IV, enfermedad diseminada.
Material de estudioSe obtuvo a partir de biopsia endoscópica durante la broncoscopia en el 97% de los casos (96/99) o por punción guiada por tomografía computarizada en el 3% restante (3/99). Tras la obtención, el material se fijó en formol tamponado al 10%. Posteriormente se incluyó en parafina y se cortó en secciones de 3μm, que se montaron en portaobjetos cubiertos de silano y se incubaron a 60°C toda la noche. Después se desparafinaron con xileno y se rehidrataron en alcoholes sucesivamente degradados (100°, 96°, 70°) durante 5min. Por último se lavaron durante 5min en agua destilada.
Técnica inmunohistoquímicaLa determinación de c-erbB-2 se realizó con el equipo HercepTest™ (Dako, Glostrup, Dinamarca), que utiliza un anticuerpo policlonal (AO485). La técnica se realizó en material fijado en formaldehído e incluido en parafina. El protocolo se desarrolló en 2 etapas: el primer paso consistió en la utilización de un anticuerpo primario de conejo frente a la proteína humana HER-2/neu; en el segundo paso se utilizó un anticuerpo secundario de cabra anticonejo y peroxidasa de rábano como enzima trazadora de la reacción. Como cromógeno se utilizó la diaminobencidina, y como sistema de visualización, EnVision (Dako, Hamburg, Alemania). La visualización e interpretación de la tinción se realizó siguiendo el protocolo recomendado en el manual de interpretación de HercepTest de Dako. Los resultados se expresaron de 0 a 3+. Cero y 1+ se consideraron negativos, mientras que 2+ y 3+ se consideraron positivos. Cero significó ausencia de tinción de membrana; 1+ se interpretó como una débil e incompleta tinción en al menos un 10% de las células tumorales; 2+ se interpretó como una tinción de intensidad moderada y completa en toda la membrana en más del 10% de las células tumorales, y 3+ se interpretó como un tinción intensa en toda la membrana celular en más del 10% de la población tumoral. Los casos fueron evaluados por 2 anatomopatólogos de forma independiente y la concordancia interobservador se valoró a través del índice kappa.
Técnica de hibridación in situ fluorescenteSe utilizó para la detección de la amplificación genética de HER-2/neu en el carcinoma microcítico. Se empleó el equipo PathVision (Abbott Molecular Inc., Wiesbaden, Alemania), que es útil en material fijado en formol y conservado en parafina, y que incluye una sonda de ADN LSI HER-2/neu reactiva en naranja, específica para el locus del gen HER-2/neu (17q11.2-q12), y una sonda de ADN CEP 17 reactiva en verde, específica para la secuencia alfa del ADN satélite de la región centromérica del cromosoma 17 (17p11.1-q11.1). La técnica comprendió un primer paso de preparación del material similar al descrito en la inmunohistoquímica. Para el proceso de la hibridación in situ en sí se efectuaron los siguientes procedimientos: desnaturalización del ADN de las muestras; hibridación, y lavados posthibridación. Para la interpretación de los resultados, éstos se consignaron en una tabla de 2 × 2, con el número de señales por núcleo de LSI HER-2/neu y CEP 17. Se recogieron los resultados de 60 núcleos en interfase de células tumorales, comparando el número de copias de HER-2/neu y de CEP 17. Los tumores con amplificación genética deben presentar un cociente de señal HER-2/neu:CEP 17 mayor o igual a 2. Los tejidos normales tienen un cociente inferior a 2. Los resultados cercanos al punto de corte (1,8-2,2) fueron observados y contabilizados por otro técnico y, si la duda persistía, el proceso se repetía.
Análisis estadísticoLas variables cualitativas se expresaron en frecuencias absolutas y porcentajes. La comparición entre ellas se realizó mediante la prueba de la χ2 o el test exacto de Fisher. La supervivencia se midió desde el momento del diagnóstico hasta la fecha del fallecimiento o la última fecha de seguimiento. Se utilizó el método de Kaplan-Meier para el cálculo de la supervivencia y las curvas se compararon mediante el test de rangos logarítmicos. En todos los cálculos se consideró estadísticamente significativo un valor de p < 0,05. Los análisis se realizaron con el paquete estadístico SPSS versión 11.5 (Chicago Illinois, EE.UU.) para Windows.
ResultadosEl grupo de estudio estuvo constituido por 99 pacientes con diagnóstico de carcinoma microcítico de pulmón, en cuya valoración histopatológica por 2 anatomopatólogos se evidenció un cociente de correlación de 0,99 (índice kappa).
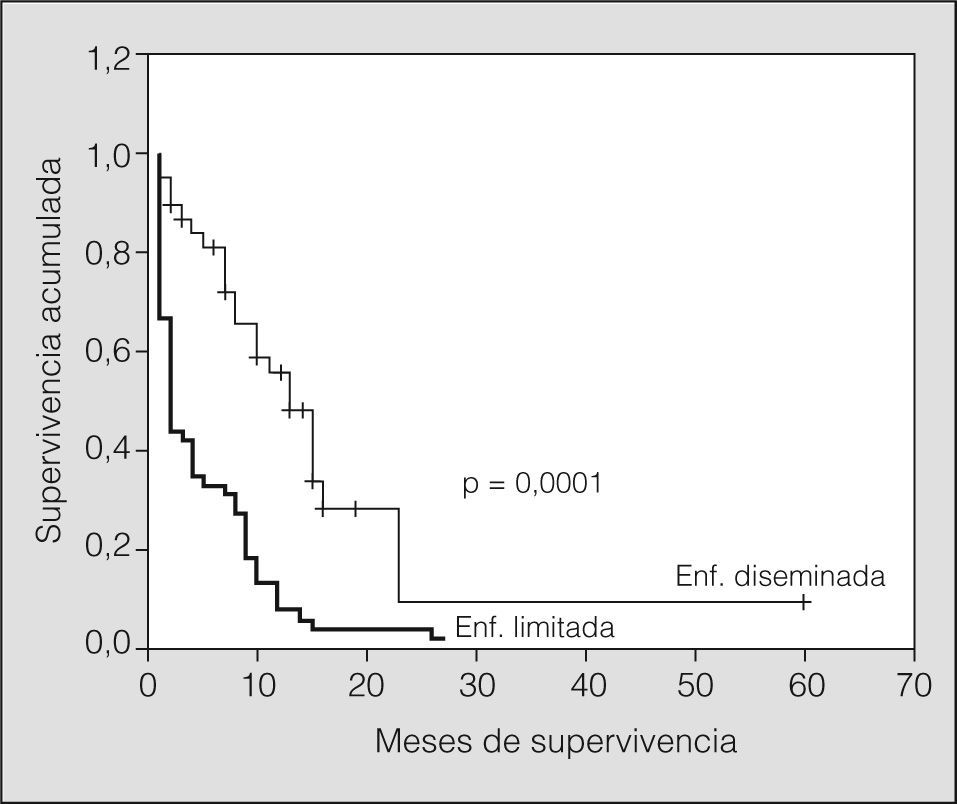
El índice de supervivencia a los 2 años para los pacientes con enfermedad limitada o localmente avanzada fue del 9%, con una media de 17 meses y un intervalo de confianza (IC) del 95% entre 9 y 24 meses; para los pacientes con enfermedad diseminada fue del 0%, con una media de 5 meses y un IC del 95% de 4-7 meses (p < 0,001; test de rangos logarítmicos) (fig. 1).
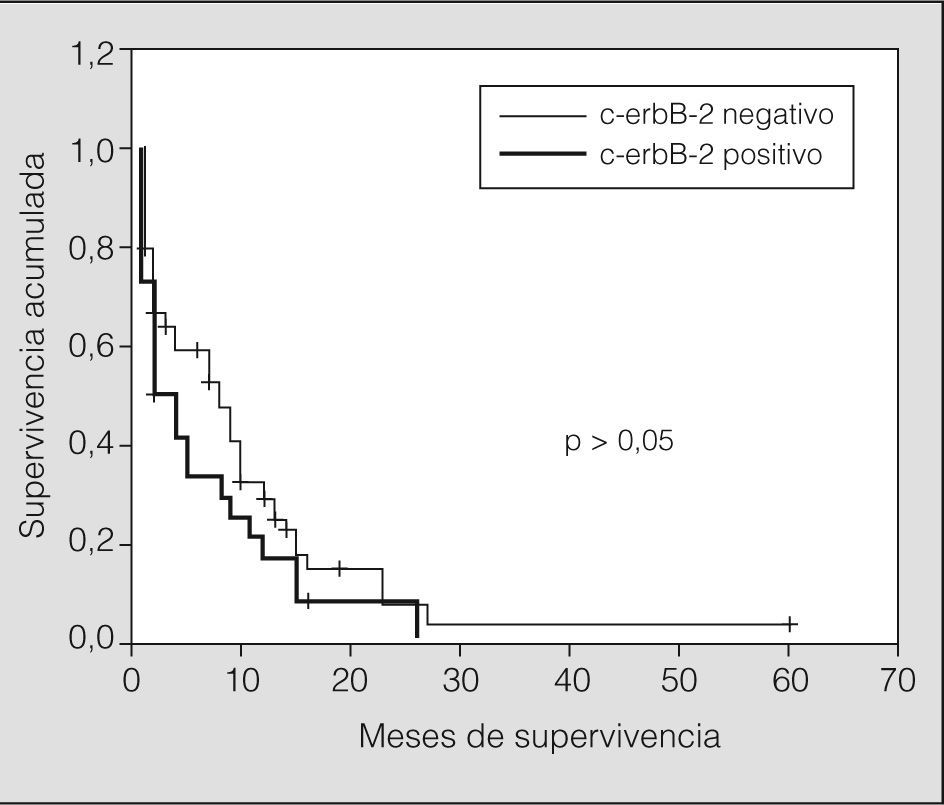
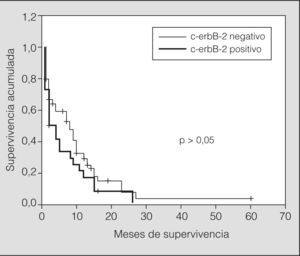
Las características clínicas de los pacientes según la expresión de c-erbB-2 se resumen en la tabla I. La expresión de c-erbB-2 en los tumores microcíticos (2+ y 3+) se asoció de forma estadísticamente significativa al estadio de enfermedad diseminada (p = 0,005). Sin embargo, al comparar los índices de supervivencia de los tumores cerbB-2 positivos y negativos no se evidenciaron diferencias estadísticamente significativas (p > 0,05) (fig. 2).
Características de los pacientes según la expresión de c-erbB-2
| c-erbB-2 | ||
| Negativo | Positivo | |
| N.° de pacientes | 73 (73,7%) | 26 (26,3%) |
| Promedio de edad ± DE (años) | 62,8 ± 9,9 | 63,4 ±11,9 |
| Sexo | ||
| Masculino | 67 (91,8%) | 25 (96,2%) |
| Femenino | 6 (8,2%) | 1 (3,8%) |
| Estadio | ||
| Enfermedad limitada | 35 (47,9%) | 4 (15,4%) |
| Enfermedad diseminada | 38 (52,1%) | 22 (84,6%) |
| Índice de supervivencia | ||
| 1 año | 28% | 16% |
| 2 años | 7% | 0% |
| Media de supervivencia | ||
| (IC del 95%) (meses) | 10 (7-14) | 7 (4-10) |
DE: desviación estándar; IC: intervalo de confianza.
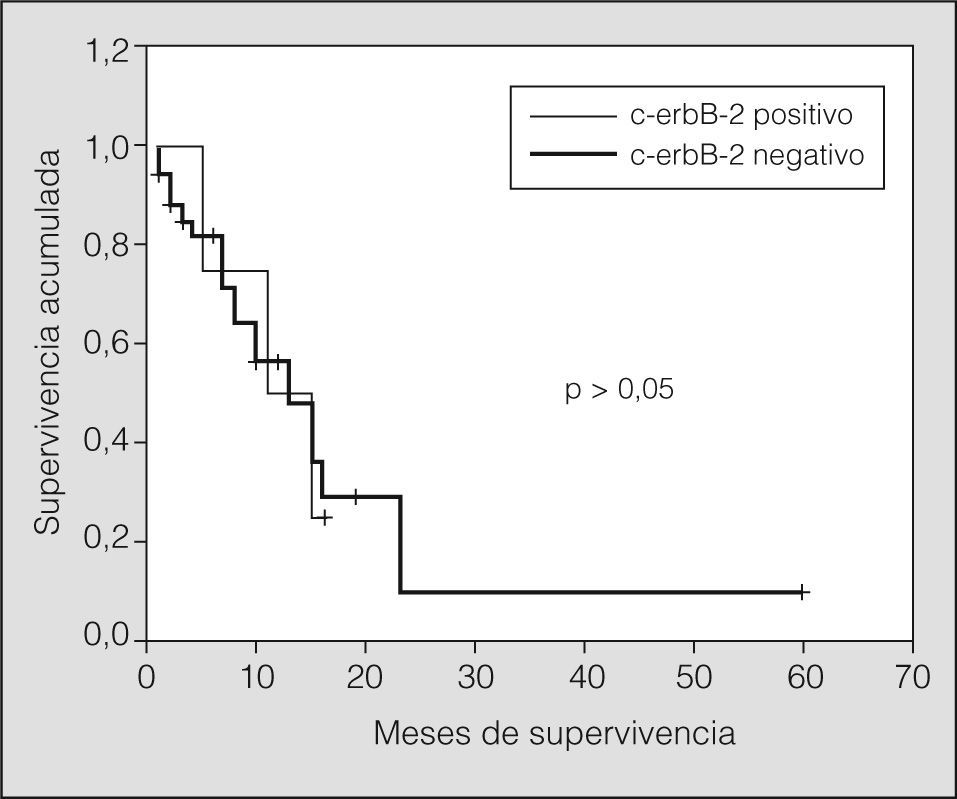
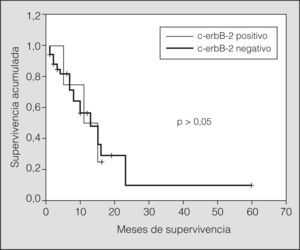
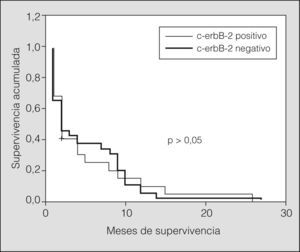
Estratificando los índices de supervivencia según el estadio clínico y la expresión de c-erbB-2 observamos los siguientes resultados: en pacientes con enfermedad limitada y c-erbB-2 positivo, el índice de supervivencia tanto al año como a los 2 años fue del 25%, con una media de 12 meses (IC del 95%, 8-16) (p > 0,05), y para los tumores c-erbB-2 negativo fue del 56 y el 9%, respectivamente, con una media de 17 meses (IC del 95%, 9-24) (p > 0,05). En pacientes con enfermedad diseminada y c-erbB-2 positivo el índice de supervivencia al año y a los 2 años fue del 5 y el 0%, respectivamente, con una media de 5 meses (IC del 95%, 2-8) (p > 0,05), y para los tumores c-erbB-2 negativo fue del 5 y el 0% respectivamente, con una media de 5 meses (IC del 95%, 3-7) (p > 0,05) (figs. 3 y 4).
Se logró obtener material adecuado para la técnica de FISH en el 33,3% (33/99) de los casos. La distribución de los casos según la expresión inmunohistoquímica de c-erbB-2 se muestra en la tabla II. Fueron evaluables un 48,5% (16/33) de los casos, de los cuales un 93,8% (15/16) no presentó amplificación y un 6,3% (1/16) mostró amplificación, con un índice 2,3 (rango bajo).
Distribución de los casos con técnica de hibridación in situ fluorescente (FISH) según la expresión de c-erbB-2
| c-erbB-2 | |
| Expresión IMQ | Técnica de FISH (n = 33) |
| 0 | 2 (6,1%) |
| + | 17 (51,5%) |
| ++ | 12 (36,4%) |
| +++ | 2 (6,1%)* |
IMQ: inmunohistoquímica.
La sobreexpresión de la proteína del oncogén c-erbB2 es un hecho que se ha estudiado en múltiples tumores malignos de diferente localización, especialmente los de mama6,7,13, colon y recto14, aparato genital femenino15 y, más recientemente, pulmón5,8,9,16. Un reciente metaanálisis evaluó el valor pronóstico de la expresión de c-erbB-2 en la supervivencia de los pacientes con cáncer de pulmón y concluyó que podría ser un factor de mal pronóstico en los carcinomas no microcíticos17.
En estudios de líneas celulares de carcinomas pulmonares microcíticos, las células no expresaron ARN mensajero ni la proteína de c-erbB-218,19. Sin embargo, Sloman et al20 encontraron sobreexpresión en 19 de 28 pacientes (68%) y, al considerar a aquéllos con una supervivencia menor de 2 años, la sobreexpresión fue del 93%. Posteriormente Micke et al21 evidenciaron expresión de c-erbB-2 en 14 de 107 pacientes como un factor independiente de peor pronóstico en la supervivencia. Potti et al16, en una serie de 193 pacientes con estadio de enfermedad diseminada, observaron expresión de c-erbB-2 en el 29,5%, y más recientemente Canoz et al10 la encontraron en un 17,9% (12/67) de pacientes con carcinoma microcítico. En ambos estudios la sobreexpresión de c-erbB-2 mostró ser un factor de peor pronóstico. Nuestros resultados coinciden con los de Sloman et al20 y Canoz et al10 en que la expresión de c-erbB-2 se asocia estadísticamente al estadio clínico de enfermedad diseminada.
En nuestra serie la sobreexpresión de la proteína se observó en un 26,3% y se asoció de forma estadísticamente significativa a tumores en estadios avanzados con enfermedad diseminada. Sin embargo, estos resultados deben observarse con cuidado, ya que la mayoría de los pacientes con enfermedad avanzada presentan factores clínicos adicionales, que contribuyen a un peor pronóstico en la supervivencia16.
Al analizar la supervivencia de los pacientes según la expresión de c-erbB-2 y el estadio clínico observamos que en aquéllos con enfermedad limitada, a pesar de que la media de supervivencia fue ligeramente mayor en los pacientes con c-erbB-2 negativo que en aquéllos con c-erbB-2 positivo, esta diferencia no fue estadísticamente significativa. En los pacientes con enfermedad diseminada se observaron índices de supervivencia similares, independientemente de la expresión de la proteína c-erbB-2. Por tanto, la expresión de la proteína cerbB-2 no presentó valor pronóstico en la supervivencia de los pacientes estudiados en nuestra serie.
Todos los estudios previos de c-erbB-2 en carcinomas microcíticos de pulmón se han basado en técnicas de inmunohistoquímica, por lo que consideramos importante completar la investigación con el estudio de la amplificación genética mediante técnicas de FISH. La amplificación de c-erbB-2 se observó en un 6,3% de los casos estudiados; este bajo porcentaje puede deberse a que éste sea un hecho propio de esta enfermedad o a una de las limitaciones de nuestro estudio, como es el tipo de material, ya que el 100% de los casos se diagnosticó por biopsia endoscópica o guiada por tomografía computorizada, lo cual, obviamente, influye en la obtención de cortes histológicos adecuados tanto para estudio inmunohistoquímico como, más específicamente, para la aplicación de técnicas de hibridación in situ. En la actualidad el trastuzumab (Herceptin©), un anticuerpo monoclonal que reconoce la proteína receptora de c-erbB-2, está siendo investigado para el tratamiento de los cánceres pulmonares que expresan c-erbB-2. La elección del método de detección y el nivel de expresión de c-erbB-2 requerido para obtener un potencial efecto terapéutico aún no se han establecido en el cáncer de pulmón.
En conclusión, la presencia de un grupo de tumores microcíticos pulmonares con expresión de la proteína c-erbB-2 abre la posibilidad de nuevas líneas terapéuticas. Por otro lado, la técnica de FISH no es el método más apropiado para la evaluación de la amplificación del gen c-erbB-2 en las muestras obtenidas por broncoscopia de tumores microcíticos pulmonares.
Son necesarios estudios prospectivos para evaluar el valor pronóstico de la expresión de c-erbB-2 en el cáncer microcítico de pulmón, a fin de definir un grupo de alto riesgo que pudiera ser susceptible de recibir un tratamiento más específico.