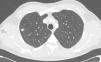
La presencia de un nódulo pulmonar solitario (NPS) en el paciente trasplantado siempre conlleva la posibilidad de que se trate de una lesión maligna, pero la causas del NPS son muy diversas, siendo la infección otra de la etiologías frecuentes1. La infección pulmonar por Cryptococcus neoformans tiene una baja incidencia y su presentación con afectación pulmonar aislada no es tan frecuente2.
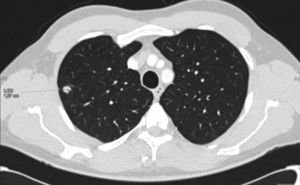
Presentamos el caso de un varón de 46 años con enfermedad renal crónica terminal secundaria a nefropatía por reflujo, trasplantado renal de donante cadáver hace 10 años y bajo tratamiento inmunosupresor con prednisona, tacrolimus y micofenolato sódico. Acude a su control rutinario totalmente asintomático, sin clínica respiratoria ni infecciosa sospechosa y con una exploración física no relevante. En la radiografía de tórax de control se objetiva una lesión ovoidea en el segmento posterior del lóbulo superior derecho (LSD) de 12mm de diámetro, no observada en el control previo un año antes. Se decide completar el estudio para filiar la lesión con TAC de tórax, donde se describe un nódulo pulmonar indicativo de neoplasia en el LSD (fig. 1), compatible con un estadio IA (T1a N0Mx). En el estudio PET se mostraba una captación patológica de la lesión descrita por lo que resultaba sospechosa de malignidad. Se decide realizar la exéresis quirúrgica del nódulo mediante una segmentectomía atípica con intención diagnóstica y terapéutica.
En el estudio histológico se describe una inflamación granulomatosa necrosante con presencia de estructuras pequeñas redondeadas, heterogéneas en tamaño y con fragmentación frecuente, de localización predominantemente intracitoplasmática y con signos indicativos de gemación, grisáceas o eosinófilas con la tinción de hematoxilina-eosina. Se realizaron tinciones para estructura fúngicas, siendo positivas para ácido peryódico de Schiff (PAS), metanamina-plata de Grocott, mucicarmín y azul alcián, y negativa para la tinción de Ziehl-Neelsen, por lo que morfológicamente los microorganismos eran indicativos de criptococo.
Se completa el estudio microbiológico con serología frente a C. neoformans y virus de la inmunodeficiencia humana, que resulta negativo en ambos casos. Se realiza una TAC cerebral sin objetivar hallazgos patológicos, por lo que se decide no realizar punción lumbar ni iniciar tratamiento antifúngico adicional. El paciente presenta buena evolución clínica posterior y actualmente permanece totalmente asintomático.
Las infecciones fúngicas son la tercera causa de infección en el trasplantado de órgano sólido3. Concretamente, la infección por C. neoformans en el trasplantado renal tiene una baja prevalencia, afecta al 0,5-2,8% de los trasplantados, pero supone la tercera causa de infección por hongos después de Candida spp. y Aspergillus spp.3.
C. neoformans es una levadura encapsulada presente en el suelo contaminado con excrementos de aves y murciélagos4. La infección se adquiere por la inhalación del microorganismo2,4 y la inmunidad innata y la mediada por células T constituye el pilar fundamental de defensa del hospedador5, lo que probablemente explica la predisposición de la población bajo tratamiento inmunosupresor6 y que la forma más frecuente de infección sea la reactivación de microorganismo latentes adquiridos en una infección previa.
La incidencia anual de la crioptococosis se ha calculado en más de 2:1.000 trasplantados renales. Algunos autores consideran que está en aumento debido al incremento de la supervivencia de estos pacientes7, mientras que otros refieren por el contrario que la incidencia se mantiene estable8. El tiempo medio transcurrido entre el trasplante y la aparición de la criptococosis es de 25 a 33 meses, por lo que nuestro caso constituye una forma de presentación inusual o tardía (120 meses). Su mortalidad alcanza el 20%7 y esta parece ser mayor si la infección aparece en el primer año postrasplante8, situándose entre el 20 y el 27%9.
Las manifestaciones clínicas de la infección por criptococo en la población trasplantada a menudo son inespecíficas y van a depender del órgano comprometido. La afectación del sistema nervioso central (SNC) como meningoencefalitis subaguda es la forma de presentación clínica más frecuente10. El segundo órgano más afectado es el pulmón2, cuyas manifestaciones clínicas abarcan un amplio espectro, desde procesos agudos como la neumonía o pleuritis, hasta hallazgos radiológicos en pacientes asintomáticos, sobre todo el nódulo simple o nódulos múltiples en una radiografía de tórax de rutina11. La importancia de esta forma de presentación radica en que el pulmón es la puerta de entrada a la infección diseminada, por lo que se debe tomar una actitud diagnóstica y terapéutica intensiva incluso en la infección asintomática. En nuestro caso, tras la revaloración clínica, con ausencia de sintomatología neurológica, la negatividad de la prueba de imagen cerebral, la ausencia de captación en la prueba de PET a otros niveles y la existencia de una serología negativa frente al criptococo, se consideró descartada la afectación diseminada y del SNC.
El diagnóstico microbiológico de la criptococosis pulmonar se puede confirmar mediante el cultivo del hongo en una muestra de esputo o mediante la detección del antígeno criptocócico en suero12. La detección serológica suele suponer la presencia una infección diseminada, lo que obliga siempre a descartar la afectación a otros niveles, especialmente del SNC13.
Otra forma de diagnosticar la infección, como en el caso presentado, es mediante el estudio histológico de una biopsia o pieza quirúrgica, demostrando la presencia de las levaduras encapsuladas con las tinciones micóticas habituales como PAS y Grocott, y sobre todo las tinciones para mucina, mucicarmín y azul alcián, ya que el género Cryptococcus constituye el único hongo frecuentemente patógeno que produce material capsular mucinoso14.
En las formas leves de infección pulmonar por criptococo puede utilizarse el fluconazol. En casos graves con infiltrados pulmonares difusos o en el contexto de una infección diseminada, el tratamiento se basa en anfotericina B combinado con flucitosina15. El tratamiento quirúrgico, como se ha descrito, puede indicarse ante la incertidumbre diagnóstica o fracaso terapéutico. Finalmente, debido a lo excepcional y tardío de la infección tras el trasplante, no está indicada la profilaxis antifúngica.
En conclusión, se debe considerar la infección por criptococo en el diagnóstico diferencial del NPS en pacientes inmunodeprimidos, como la población trasplantada, y mantener una actitud diagnóstica y terapéutica activa al considerarse el tracto respiratorio la puerta de entrada a la infección diseminada.
Los autores desean mostrar su agradecimiento a la Dra. Esparza, la Dra. Báez y el Dr. Pérez-Arellano por su inestimable ayuda.