Se han notificado 18 trasplantadas de pulmón que han tenido hijos. Las complicaciones detectadas son: hipertensión arterial (50%), diabetes mellitus (21%), preeclampsia (13%), infecciones (21%), rechazo (30%), pérdida de función del injerto (23%) y menor porcentaje de nacidos vivos que en portadoras de otros órganos trasplantados.
Otros aspectos a tener en cuenta son: potencial riesgo de alteraciones fetales dado que los fármacos empleados como profilaxis del rechazo atraviesan la barrera placentaria; así como mayor riesgo de infección y alteraciones de lo niveles de fármacos por los cambios en el metabolismo propios del embarazo y el puerperio.
Se describen los 2 casos en España de mujeres trasplantadas de pulmón que han tenido hijos tras el trasplante.
Aunque el embarazo pueda tener una evolución similar a las que experimentan personas no trasplantadas, se debe recomendar evitarlo y la mujer debe conocer el elevado riesgo de morbimortalidad fetal y materna existente.
We contacted and analyzed the data of 18 lung transplant recipients who had had children. The complications we detected included: hypertension (50%), diabetes mellitus (21%), preeclampsia (13%), infection (21%), rejection (30%), loss of graft function (23%) and a lower percentage of live births than in transplant recipients of other organs.
Other aspects to keep in mind are: the potential risk for fetal alterations (caused by drugs used as prophylaxis against rejection crossing the placental barrier); greater risk for infection and alterations in drug levels due to changes in metabolism typical of pregnancy and postpartum period.
We describe the two cases in Spain of female lung transplant recipients who have had children after transplantation.
Although pregnancy in these cases can have a similar evolution as in non-transplanted women, doctors should recommend their transplanted patients to avoid becoming pregnant, while explaining the high risk of both fetal and maternal morbidity and mortality after transplantation.
La mejoría en la supervivencia, en la experiencia y en el seguimiento de los pacientes trasplantados, ha hecho que el deseo de maternidad de muchas de estas pacientes pueda ser atendido con unas expectativas similares a las de la población general, dado que la mayoría de mujeres trasplantadas, mantienen su fertilidad.
Se calcula que puede haber unos 14.000 niños nacidos de madre trasplantada. La inmensa mayoría son portadoras de un injerto renal o hepático en los que se comunican tasas de comorbilidad, pérdidas de injerto, y malformaciones-infecciones neonatales relacionadas con el tratamiento inmunosupresor, similares a las de la población general1–3. No ocurre lo mismo en los casos de pacientes con trasplante pulmonar4–7.
A continuación, se presentan los 2 casos clínicos de mujeres trasplantadas de pulmón que han dado a luz a un recién nacido vivo en España.
Caso 1: Hospital Marqués de ValdecillaSe trata de una paciente de 31 años en la actualidad, que fue diagnosticada de neumonía intersticial no específica en 2002 mediante biopsia pulmonar, desarrollando insuficiencia respiratoria grave a pesar del tratamiento. Se realizó trasplante bipulmonar en mayo de 2003, tratada con tacrolimus, micofenolato mofetil y esteroides, evolucionó satisfactoriamente, quedando asintomática y realizando una vida normal. La función pulmonar fue siempre normal y no presentó rechazo ni infección.
A los 3 años del trasplante expresó su deseo de ser madre, aunque se la convenció para que pospusiese esta decisión hasta el quinto año postrasplante. Llegada esta fecha expresó nuevamente y de forma categórica un intenso deseo de ser madre, se le informo de los riesgos y se procedió al cambio de tratamiento inmunosupresor de micofenolato a azatioprina. Dos meses después quedó embarazada.
El embarazo fue controlado por el Servicio de Obstetricia y la Unidad de Trasplante, transcurrió sin complicaciones y en todo momento la función pulmonar fue normal. No se realizaron controles radiológicos y sí una monitorización estrecha de los niveles plasmáticos de tacrolimus. Precisó un aumento progresivo de la dosis de 1,5 a 3,5mg/día para mantener unos niveles plasmáticos alrededor de 8μg/l. El aumento de peso en este periodo fue de 13kg.
En la semana 37 y sin motivo aparente se detectó un fuerte aumento de niveles hasta 15μg/l, lo que obligó a un rápido descenso de la dosis hasta 2mg/día, que se mantuvo hasta el momento del parto. Con posterioridad se descendió a 1,5mg/día, dosis idéntica a la empleada antes de quedar embarazada.
El parto fue eutócico a la 40 semana de gestación (marzo de 2010) y sin complicaciones. Nació una niña que peso 3.600 g. Los niveles en sangre de cordón fueron 8 μg/l, idénticos a los de la madre. No se detectaron anomalías y únicamente destacó una ligera oliguria en la recién nacida que se resolvió espontáneamente en 72 h. La ecografía renal fue normal.
La niña ha presentado un crecimiento y un desarrollo rigurosamente normales, la madre hace vida normal, presenta función pulmonar normal, la dosis da tacrolimus que precisa es de 1,5mg/día, para mantener niveles de 7μg/l.
Caso 2: Hospital Universitario Puerta de HierroSe trata de una paciente sometida a trasplante cardiopulmonar a los 38 años por hipertensión pulmonar secundaria a miocardiopatía congénita con coartación aórtica y ductus arterioso previamente intervenidos con buena evolución postrasplante salvo por el desarrollo de HTA e intolerancia digestiva al micofenolato, por lo que la inmunosupresión de mantenimiento se basó en tacrolimus, azatioprina y corticoides.
A los 17 meses del trasplante acudió refiriendo gestación incipiente a pesar del consejo médico previo en contra. Tras la información detallada de los riesgos de la gestación la paciente decidió seguir con ella. Se mantuvo el mismo esquema de inmunosupresión previo. En la semana 16 se realizó amniocentesis (con cariotipo normal) por riesgo elevado de síndrome de Down en el cribado combinado de primer trimestre. En el segundo trimestre la paciente presentó episodio de diarrea, asociado a insuficiencia renal moderada y crisis hipertensiva con edema agudo de pulmón secundario. Durante la gestación la función pulmonar se mantuvo estable y normal con cifras de FVC y FEV1 entre el 90 y el 100%.
A las 32 semanas, la paciente presentó amenaza de parto pretérmino. Tras completar la maduración pulmonar fetal con corticoides, y dada la escasa respuesta al tratamiento tocolítico, se decidió finalizar la gestación mediante cesárea por feto prematuro en presentación podálica. El recién nacido presentó hipertrofia miocárdica resuelta, típica de los fetos expuestos al tacrolimus, con buen desarrollo y crecimiento ponderal posterior.
La madre presenta función pulmonar estable y normal, y desde el punto de vista cardiológico precisó colocación de endoprótesis en aorta torácica descendente por recoartación, con buen resultado clínico y hemodinámico.
DiscusiónLa experiencia mundial sobre embarazo y parto en mujeres sometidas a trasplante pulmonar es muy inferior a la de otros trasplantes de órganos sólidos y además, el riesgo de complicaciones materno-fetales y relacionadas con el injerto parece ser superior.
En las 18 pacientes comunicadas, que han dado lugar a 24 embarazos y 15 nacimientos, se detecta HTA (50%), diabetes mellitus (21%), preeclampsia de detección dificultosa por la presencia de HTA y proteinuria previas al embarazo en muchos de estos pacientes (13%), infecciones durante el embarazo (21%), rechazo del injerto (30%) pero también en el puerperio y una significativa pérdida de función del injerto (23%) durante los 2 años posteriores al parto, que no se describe en ningún otro tipo de trasplante8.
El porcentaje de nacidos vivos es del 60%, inferior al 70-80% que se describe para el resto de trasplantadas de otros órganos, con una edad gestacional de 35 semanas. La mayoría (60%) fueron de bajo peso (media de 2.400g), aunque no se ha identificado ningún caso de malformación6,9.
Todos los fármacos empleados como profilaxis del rechazo atraviesan la barrera placentaria lo que induce a pensar en cierto riesgo, no cuantificado, de interferencia en el desarrollo del embrión o feto, que puede ser potenciado por la utilización de otros medicamentos (profilaxis antimicrobiana, antibióticos, antifúngicos, antivirales, inmunomoduladores, bifosfonatos etc)10. La azatioprina atraviesa la placenta como medicamento inactivo ya que el feto no posee la enzima inositol pirofosforilasa, necesaria para convertir la azatioprina en su metabolito activo, a pesar de lo cual la Food and Drug Administration la incluye dentro de los medicamentos de categoría D. Otros antimetabolitos como el micofenolato mofetil o el ácido micofenólico producen una alta tasa de malformaciones estructurales en animales y se han comunicado casos de muerte fetal, por lo que se recomienda su sustitución por azatioprina, al menos 6 semanas antes del embarazo11.
Algunos esteroides atraviesan la placenta y son metabolizados en la misma placenta por lo que no producen efectos secundarios significativos (categoría B) aunque hay ciertas dudas sobre su posible relación con malformaciones orofaciales.
Los anticalcineurínicos (ciclosporina y tacrolimus) atraviesan la placenta y actúan sobre el feto como en el adulto, los posibles efectos secundarios (afectación renal, hiperglucemia etc.) no han podido ser cuantificados. Existen dudas sobre la posible afectación neuro-cognitiva. Se utilizan como tratamiento inmunosupresor de base (categoría C).
Otros inmunosupresores como sirolimus, everolimus y ciclofosfamida no se recomiendan por su evidencia de efectos adversos y malformaciones sobre el feto.
En algunos casos, es necesario ajustar las dosis de tacrolimus durante el embarazo y existe un caso de interrupción de la gestación por vómitos incoercibles y dificultad para mantener los niveles de inmunosupresión en rango terapéutico12. Se han descrito 2 muertes maternas por abandono de la medicación debido al miedo a los efectos secundarios del tratamiento sobre el feto.
El tiempo de espera desde el trasplante hasta el embarazo, no debe ser inferior a 3 años13 y mejor superior a 5 años. Durante estos años de evolución, la paciente debe estar estable, con función pulmonar normal, sin comorbilidad destacable ni rechazo agudo previo (datos no contrastados).
Además de las complicaciones y precauciones relacionadas con el pulmón trasplantado y sus cuidados, es importante tener en cuenta las peculiaridades propias del embarazo y del parto en estas pacientes como la preeclampsia cuyo tratamiento consiste en el control de la hipertensión con alfametil dopa y/o labetalol por vía intravenosa y la prevención y tratamiento de las convulsiones mediante sulfato de magnesio. El tratamiento definitivo es la finalización de la gestación en todos los casos con grave afectación materno-fetal.
Durante el trabajo de parto, es imprescindible adoptar normas adecuadas de asepsia y el empleo de antibióticos en las situaciones de riesgo (aparición de fiebre intraparto, profilaxis antibiótica en caso de cesárea, etc) para evitar el riesgo de infección. Otro aspecto importante es la inmunosupresión en el puerperio. Debido a las modificaciones en el metabolismo y a la biodisponibilidad de fármacos que presenta el organismo materno tras el parto, el ajuste de estos niveles es vital para evitar la toxicidad de los inmunosupresores y el riesgo de rechazo.
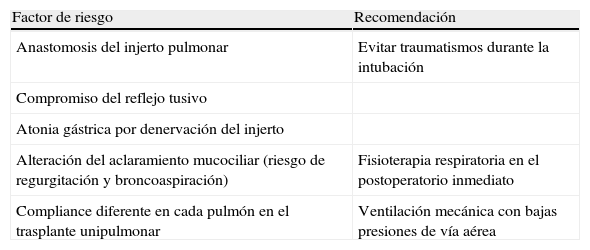
Para finalizar, se describen algunas consideraciones anestésicas para el momento del parto (tabla 1). Con respecto a la analgoanestesia regional, las técnicas de bloqueo del neuroeje (epidural, subaracnoidea o combinada subaracnoidea-epidural) son las más recomendadas, tanto para el trabajo de parto como para la cesárea, puesto que consiguen una máxima eficacia en el control de dolor y minimizan la respuesta simpática que desencadena el mismo14,15. Además permiten obviar los riesgos asociado a la intubación orotraqueal, los problemas asociados a la ventilación mecánica y la interferencia entre los fármacos empleados durante la anestesia general con los inmunosupresores. Antes de realizar cualquier bloqueo nervioso es importante dejar constancia de posible neurotoxicidad asociada a la toma de inmunosupresores.
Factores que aumentan el riesgo anestésico en las mujeres portadoras de un trasplante pulmonar
| Factor de riesgo | Recomendación |
| Anastomosis del injerto pulmonar | Evitar traumatismos durante la intubación |
| Compromiso del reflejo tusivo | |
| Atonia gástrica por denervación del injerto | |
| Alteración del aclaramiento mucociliar (riesgo de regurgitación y broncoaspiración) | Fisioterapia respiratoria en el postoperatorio inmediato |
| Compliance diferente en cada pulmón en el trasplante unipulmonar | Ventilación mecánica con bajas presiones de vía aérea |
En estas pacientes, la hipotensión arterial secundaria al bloqueo vegetativo de los bloqueos del neuroeje debe tratarse con fármacos vasoconstrictores (fenilefrina y efedrina) debido a la mayor susceptibilidad del pulmón trasplantado para desarrollar edema agudo de pulmón por la denervación y a las variaciones de la presión oncótica propias del embarazo.
La inmunosupresión obliga a extremar las condiciones de asepsia durante la inserción y manipulación del catéter epidural para evitar complicaciones infecciosas.
Si es necesaria una anestesia general, en la preinducción se recomienda extremar las condiciones de esterilidad y, administrar la profilaxis antibiótica al menos 30 minutos antes de la cirugía, para asegurarnos el adecuado nivel plasmático, y debe mantenerse de 24 a 48h postoperatorias.
En la educción anestésica es necesario confirmar la recuperación del bloqueo neuromuscular y de la conciencia de la paciente antes de la extubación.
En cuanto a las interacciones medicamentosas: la ciclosporina prolonga la duración de acción de los relajantes neuromusculares (en animales de experimentación) y el tacrolimus se metaboliza vía citocromo hepático P-450 por lo que se recomienda precaución con los antagonistas del calcio ya que interfieren su metabolismoy se recomienda no utilizar diuréticos ahorradores de potasio.
Aunque son casos aislados y no se pueden extraer conclusiones definitivas, si el embarazo es programado y alejado del trasplante, los hechos demuestran que a pesar del elevado riesgo de complicaciones, el embarazo puede ser una situación similar a las que experimentan personas no trasplantadas, el feto/ recién nacido puede no sufrir las consecuencias del tratamiento al que es sometida la madre, o si las sufre, pueden ser de carácter leve, reversible, sin que interfieran en su desarrollo. Sin embargo, la mujer trasplantada debe conocer el elevado riesgo de morbimortalidad fetal y materna que puede conllevar un embarazo y se debe recomendar evitarlo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.