La neumonía adquirida en la comunidad (NAC) es una patología muy prevalente cuya etiología viene dada por las características de la región geográfica y del paciente. El estudio de cada una de ellas es fundamental para su correcto abordaje terapéutico. Nos propusimos estudiar los cambios del agente causal de la NAC en función de la estacionalidad y la influencia de los cambios climáticos de nuestra área geográfica.
Pacientes y métodoEstudio prospectivo longitudinal de pacientes consecutivos ingresados por NAC desde enero de 2006 a diciembre de 2009. Analizamos datos sociodemográficos, comorbilidad, gravedad, agente etiológico, complicaciones y mortalidad. Correlacionamos la temperatura media y la precipitación acumulada media estacional para Streptococcus pneumoniae y Legionella pneumophila en cada estación del año. Análisis estadístico: Chi cuadrado, t de Student para muestras independientes, análisis de la varianza y correlación de Spearman.
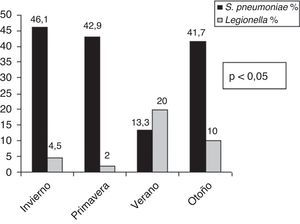
ResultadosIncluimos a 243 pacientes, 64,6% hombres y 54,7% mayores de 65 años. La mayor incidencia de NAC fue en invierno. Streptococcus pneumoniae fue el agente causal más frecuente en todas las estaciones del año a excepción del verano, en el que fue Legionella pneumophila. Observamos una correlación significativa entre la menor temperatura media estacional y la etiología neumocócica y a la inversa cuando el agente causal fue Legionella pneumophila. Sin embargo, no encontramos diferencias etiológicas por estaciones en relación con la humedad ambiental.
ConclusionesEn nuestra área, Streptococcus pneumoniae es el agente etiológico más frecuente en invierno con bajas temperaturas mientras que en verano, con altas temperaturas, es Legionella pneumophila.
Community acquired pneumonia (CAP) is a highly prevalent pathology whose etiology is determined by the characteristics of the geographic region, and the patient. The study of these features is essential for a proper therapeutic approach. Our aim was to study the changes of the causative agent of CAP brought about by the influence of seasonal and climatic changes in our geographic area.
Patients and methodA prospective and longitudinal study of patients admitted with CAP was done from January 2006 to December 2009. We analyzed demographic data, comorbidities, severity, etiologic agent, complications and mortality. We correlated mean temperature and mean cumulative rainfall for each season with Streptococcus pneumoniae and Legionella pneumophila. Statistical analyses included: Chi squared test, Student's t test for independent samples, variance analysis and Spearman's correlation.
ResultsWe included 243 patients, 64.6% men and 54.7% over the age of 65. The highest incidence of CAP was in the winter. Streptococcus pneumoniae was the most common causative agent for all seasons except in summer when the main agent was Legionella pneumophila. We observed a significant correlation between the lowest seasonal average temperature and pneumococcal etiology of CAP; inversely, with higher temperatures, Legionella pneumophila was more common. No etiological differences were found by season when related with environmental humidity.
ConclusionsIn our area, Streptococcus pneumoniae was the most common etiological agent in winter with low temperatures; in summer, with high temperatures, the most frequent was Legionella pneumophila.
La neumonía adquirida en la comunidad (NAC) es una enfermedad de gran relevancia epidemiológica que actualmente sigue siendo una causa importante de morbimortalidad en todo el mundo a pesar del tratamiento. Estudios poblacionales prospectivos muestran una incidencia anual entre el 5 y el 11% de la población adulta1, con una tasa anual que oscila alrededor de 1,62 por 100.000 habitantes2. En este sentido, la NAC es una enfermedad con una alta prevalencia que varía en función del año y del área geográfica, por lo que es necesario conocer no solo su incidencia y su morbimortalidad, sino también su variación estacional ya que puede influir sobre la necesidad de reforzar la gestión de determinados recursos sanitarios. Sin embargo, a pesar de la importancia de la distribución estacional en las infecciones respiratorias, la mayoría de las investigaciones se han centrado en el estudio de la variación estacional en referencia a la infección por Influenza virus, y apenas en patógenos bacterianos3. Además pocos estudios han investigado la posible relación entre las variaciones climáticas y la etiología de la NAC. Por todo ello, analizar la variación estacional de la distinta etiología de la NAC y determinar si las variaciones climatológicas, dentro de la misma estación, pueden ser un factor influyente sobre el agente etiológico de la NAC puede tener relevancia. El objetivo de nuestro estudio es valorar si la estación del año y la influencia de los cambios climáticos dentro de la misma estación pueden tener repercusión en la variabilidad de la etiología de la NAC.
Pacientes y métodoRealizamos un estudio prospectivo, longitudinal y observacional de pacientes adultos ingresados consecutivamente por NAC en el Servicio de Neumología del Hospital Universitario Dr. Peset de Valencia a lo largo de 4 años, desde enero de 2006 a diciembre de 2009. Los criterios de inclusión fueron la existencia de un infiltrado alveolar objetivado en la radiografía de tórax que no fuese previamente conocido, acompañado de una clínica compatible con fiebre (>38°C), tos, expectoración, dolor torácico, disnea o taquipnea y en ausencia de otro diagnóstico alternativo. Se excluyeron aquellos pacientes con ingreso previo en los últimos 15 días, reingreso en los 30 días posteriores a la inclusión, VIH positivos, pacientes con tratamiento inmunosupresor y/o corticoideo (> 10mg/día) en los últimos 6 meses y pacientes con HCAP (neumonía asociada a cuidados de la salud)4.
Se recogieron datos sociodemográficos, comorbilidades, días de evolución de la clínica, síntomas actuales, signos vitales y tratamiento antibiótico prescrito antes de su llegada al hospital y el pautado al ingreso. A todos los pacientes se les realizó estudio microbiológico y valoración de la gravedad por el Pneumonia Severity Index (PSI) de Fine5 y el CURB656. Para el diagnóstico microbiológico se realizaron los siguientes procedimientos: a) detección de antígeno de Streptococcus pneumoniae (S. pneumoniae) y antígeno de Legionella pneumophila (L. pneumophila) serogrupo 1 en orina concentrada por técnica de inmunocromatografía Binax Now® (Compañía Binax). b) Detección de bacterias en líquido pleural cuando hubo derrame pleural significativo, esputo y muestras de fibrobroncoscopia por medios de cultivo generales como agar-chocolate y selectivos como agar-MacConkey para el crecimiento de bacilos gramnegativos, manitol salado agar para el Staphylococcus aureus y Columbia colistin- nalidixic acid agar para cocos grampositivos; la identificación microbiana y las pruebas de sensibilidad se realizaron mediante el sistema VITEK® 2 (BioMérieux); en el caso de las muestras de esputo, solamente se analizaron aquellas que eran de buena calidad (presencia de menos de 10 células epiteliales y más de 25 leucocitos por campo con el objetivo 10× tras tinción de Gram). c) Detección de bacterias en sangre mediante el sistema automatizado BacT/Alert 3D® (BioMérieux); cuando el equipo detectó crecimiento bacteriano, se realizó tinción de Gram y resiembra en medios de cultivo apropiados; la identificación microbiana y las pruebas de sensibilidad se realizaron mediante el sistema VITEK® 2 (BioMérieux). d) Métodos serológicos como la quimioluminiscencia para la detección de antígeno de L. pneumophila en orina; ELISA para la detección de antígeno de L. pneumophila 1-7, Mycoplasma pneumoniae (M. pneumoniae), Varicella zoster virus y virus respiratorios (Adenovirus, Parainfluenza virus 1, 2 y 3, Influenza virus A y B y virus respiratorio sincitial); e inmunofluorescencia para Coxiella burnetti (C. burnetti) y Chlamydophila pneumoniae (C. pneumoniae). Se obtuvo suero para la detección de anticuerpos específicos frente a M. pneumoniae, C. burnetti, C. pneumoniae, L. pneumophila y virus respiratorios (Adenovirus, Parainfluenza virus 1, 2 y 3, Influenza virus A y B y virus respiratorio sincitial) en 2 muestras separadas 21 días. Se consideraron criterios diagnósticos etiológicos de NAC1 la antigenuria positiva de neumococo o Legionella, el cultivo positivo en líquido pleural, los cultivos de esputo positivos en caso de patógenos primarios, los cultivos cuantitativos positivos de muestras obtenidas mediante broncoscopia (con recuentos bacterianos mayores de 103 UFC/ml en el caso de cepillado protegido y mayores de 104 UFC/ml en el caso de lavado broncoalveolar) y la positividad en 2 hemocultivos consecutivos y en el estudio serológico; se consideró diagnóstico la detección de anticuerpos específicos de clase IgM y/o la elevación de al menos 4 veces el título de anticuerpos específicos de clase IgG (seroconversión) entre 2 muestras de suero obtenidas en un período de 3 semanas (la primera muestra recogida durante la fase aguda de la enfermedad y la segunda muestra obtenida durante la fase de convalecencia).
Posteriormente se completó el estudio con una valoración clínico-radiológica acompañada de una nueva recogida de muestras sanguíneas a los 21 días de evolución para estudio de la conversión serológica a distintos gérmenes atípicos causantes de NAC, y se recogió la mortalidad durante el ingreso hospitalario y a los 30 días del diagnóstico.
Las estaciones del año fueron definidas como primavera (marzo, abril y mayo), verano (junio, julio y agosto), otoño (septiembre, octubre y noviembre) e invierno (diciembre, enero y febrero) según criterios del Instituto Nacional de Meteorología y Medioambiente7. Los datos meteorológicos utilizados para evaluar el cambio climático en los 4 años consecutivos del estudio incluyeron la temperatura media estacional y la precipitación acumulada media estacional para cada una de las diferentes estaciones del año. La fuente que se empleó para la obtención de datos de la temperatura media estacional y la precipitación acumulada media estacional durante los 48 meses que duró nuestro estudio fue la «Fundación Centro de Estudios Ambientales del Mediterráneo. Programa de Meteorología-Climatología»8.
Análisis estadísticoLos datos fueron tabulados y analizados en una base de datos diseñada al efecto en el programa estadístico SPPS para Windows, versión 12.0 (2003 SPPS Inc, Chicago, Illinois, EE. UU.). Se realizó un estudio descriptivo de las variables cualitativas y cuantitativas recogidas para caracterizar la población estudiada. Se analizó la distribución de las frecuencias y se calcularon medidas de tendencia central, desviación estándar e intervalos de confianza al 95% (IC). La comparación de proporciones entre grupos se realizó mediante la prueba de Chi cuadrado, aplicando la fórmula exacta de Fisher cuando fue preciso. La comparación de variables cuantitativas se llevó a cabo mediante la prueba de la t de Student para muestras independientes y el análisis de la varianza, acorde a los supuestos de normalidad y homogeneidad de las varianzas. Se utilizó la correlación de Pearson o Spearman para observar el grado de asociación entre las variables. Se consideró significativo un valor p<0,05 2 colas.
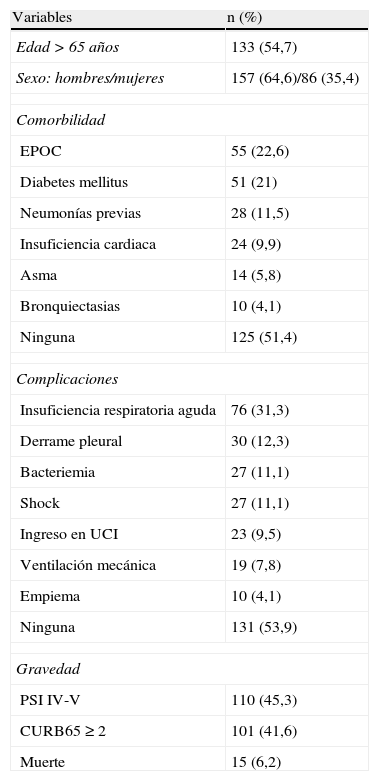
ResultadosDurante el período de estudio se incluyeron un total de 243 pacientes, con una edad media de 63,92±17,04 años, de los que 157 (64,6%) fueron hombres y 86 (35,4%) mujeres. En la tabla 1 aparecen reflejadas las principales características demográficas, comorbilidad, gravedad y complicaciones de los pacientes.
Variables demográficas, comorbilidad, gravedad y complicaciones (n=243)
| Variables | n (%) |
| Edad>65 años | 133 (54,7) |
| Sexo: hombres/mujeres | 157 (64,6)/86 (35,4) |
| Comorbilidad | |
| EPOC | 55 (22,6) |
| Diabetes mellitus | 51 (21) |
| Neumonías previas | 28 (11,5) |
| Insuficiencia cardiaca | 24 (9,9) |
| Asma | 14 (5,8) |
| Bronquiectasias | 10 (4,1) |
| Ninguna | 125 (51,4) |
| Complicaciones | |
| Insuficiencia respiratoria aguda | 76 (31,3) |
| Derrame pleural | 30 (12,3) |
| Bacteriemia | 27 (11,1) |
| Shock | 27 (11,1) |
| Ingreso en UCI | 23 (9,5) |
| Ventilación mecánica | 19 (7,8) |
| Empiema | 10 (4,1) |
| Ninguna | 131 (53,9) |
| Gravedad | |
| PSI IV-V | 110 (45,3) |
| CURB65≥2 | 101 (41,6) |
| Muerte | 15 (6,2) |
CURB65: confusion, urea, respiratory rate, blood pressure, mayores 65 años: EPOC: enfermedad pulmonar obstructiva crónica; PSI: Pneumonia Severity Index; UCI: Unidad de Cuidados Intensivos.
Entre los antecedentes patológicos de interés destaca que el 22,6% de los pacientes estaban diagnosticados de enfermedad pulmonar obstructiva crónica y el 21% de diabetes mellitus. El 45,3% se clasificaron como PSI IV-V y el 41,6% como CURB65≥2 en el momento del diagnóstico. La complicación más frecuente fue la insuficiencia respiratoria aguda en un 31,3% de los pacientes. El 9,5% de los enfermos precisó ingreso en la Unidad de Cuidados Intensivos y fallecieron 15 pacientes (6,2%) durante el episodio.
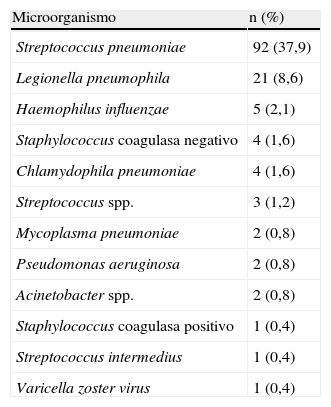
La tabla 2 muestra los diferentes agentes microbiológicos causales aislados. En 139 casos (57,2%) obtuvimos un diagnóstico etiológico de certeza. El microorganismo aislado más frecuentemente fue S. pneumoniae en 92 pacientes (37,9%), seguido de L. pneumophila, responsable de 21 NAC (8,6%).
Microorganismo etiológico
| Microorganismo | n (%) |
| Streptococcus pneumoniae | 92 (37,9) |
| Legionella pneumophila | 21 (8,6) |
| Haemophilus influenzae | 5 (2,1) |
| Staphylococcus coagulasa negativo | 4 (1,6) |
| Chlamydophila pneumoniae | 4 (1,6) |
| Streptococcus spp. | 3 (1,2) |
| Mycoplasma pneumoniae | 2 (0,8) |
| Pseudomonas aeruginosa | 2 (0,8) |
| Acinetobacter spp. | 2 (0,8) |
| Staphylococcus coagulasa positivo | 1 (0,4) |
| Streptococcus intermedius | 1 (0,4) |
| Varicella zoster virus | 1 (0,4) |
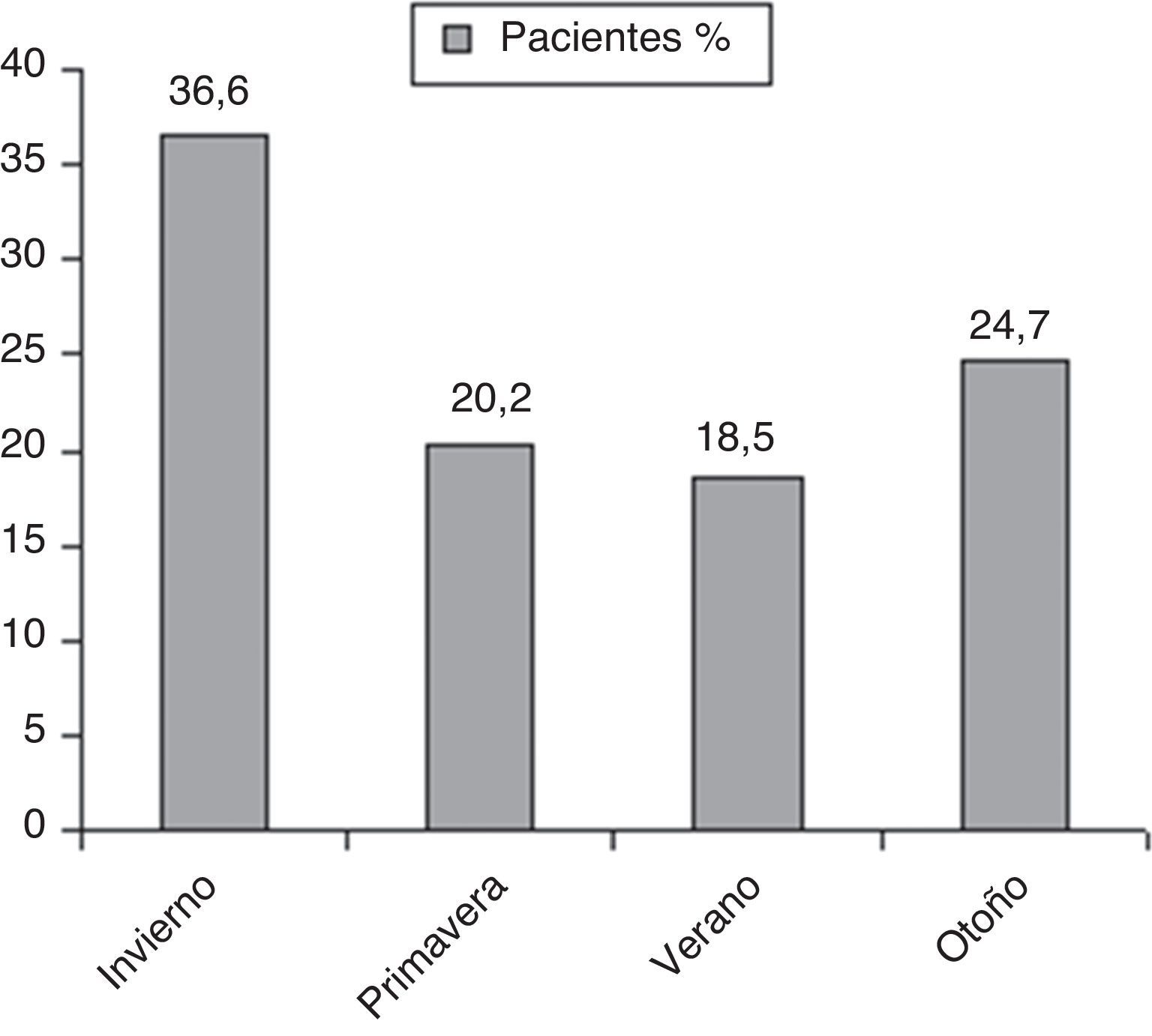
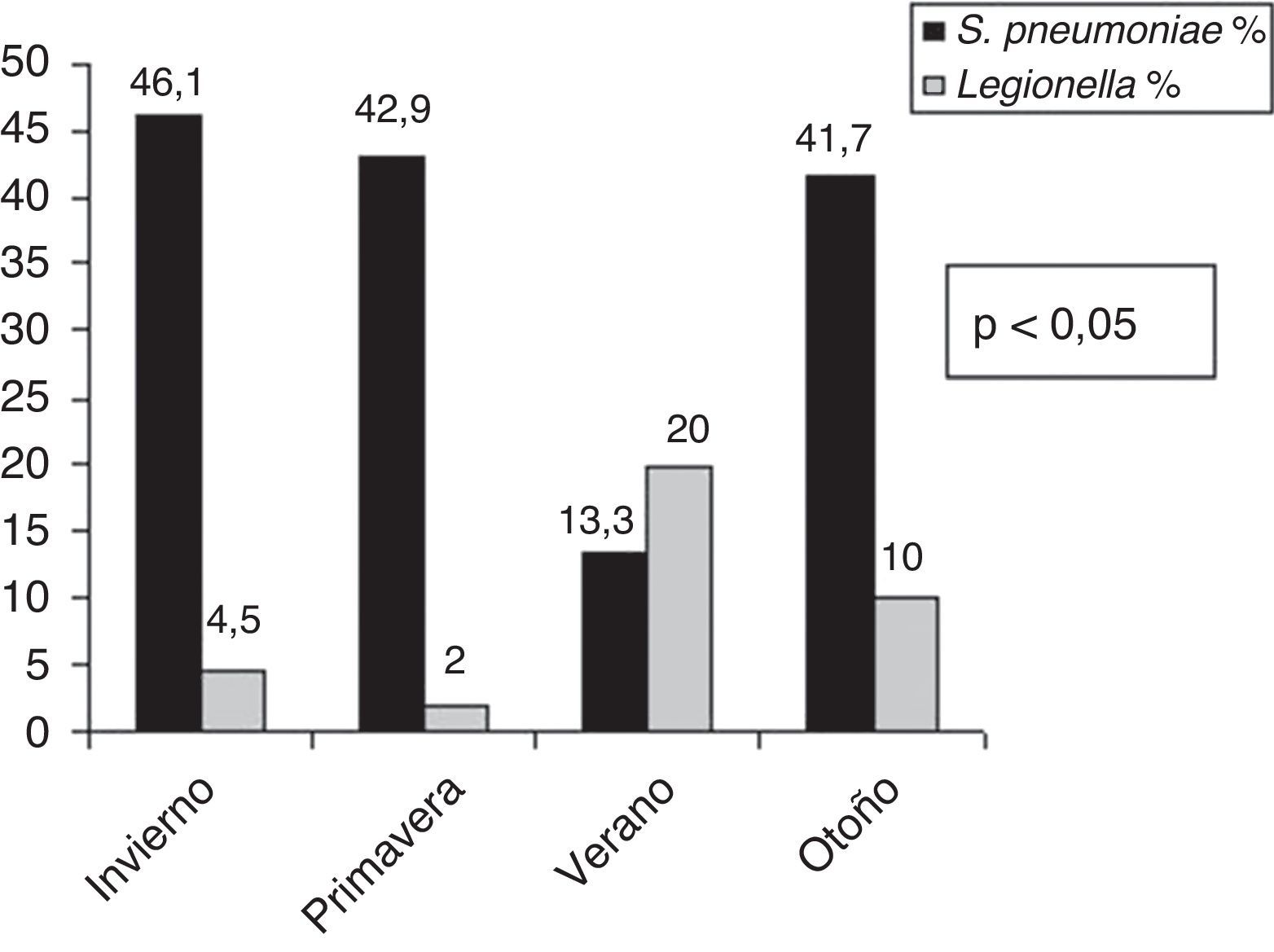
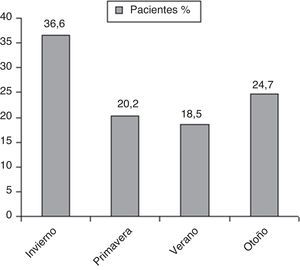
El análisis de la distribución estacional mostró una mayor incidencia de NAC en invierno (fig. 1). Encontramos diferencias estadísticamente significativas en cuanto al microorganismo causal en relación con la estacionalidad (fig. 2). Así, el 46,1% de las NAC que ingresaron durante el invierno, el 42,9% durante la primavera y el 41,7% de las que ingresaron durante el otoño fueron causadas por S. pneumoniae; mientras que el 20% de las NAC que ingresaron durante el verano fueron ocasionadas por L. pneumophila (p<0,05).
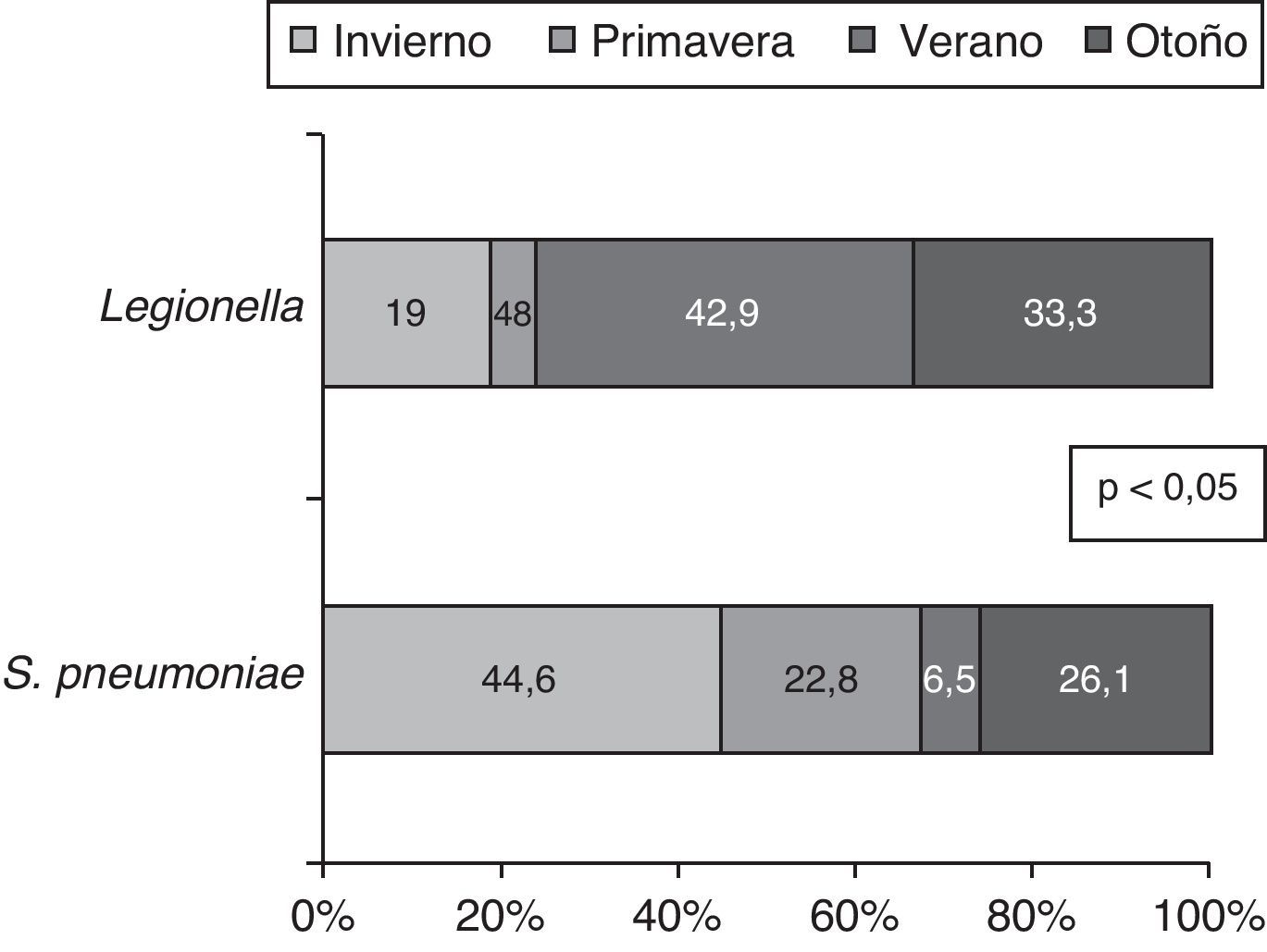
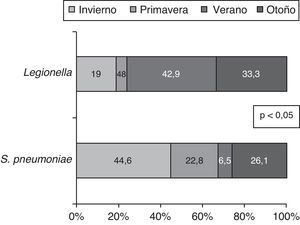
Del mismo modo, la incidencia de S. pneumoniae y L. pneumophila varía por estaciones; así, el 44,6% de los S. pneumoniae los hallamos en invierno y el 42,9% de las Legionellas en verano (p<0,05). (fig. 3)
No encontramos diferencias entre las distintas variables demográficas, comorbilidad, complicaciones, gravedad evaluada por escalas pronósticas, o número de exitus en función de la estacionalidad.
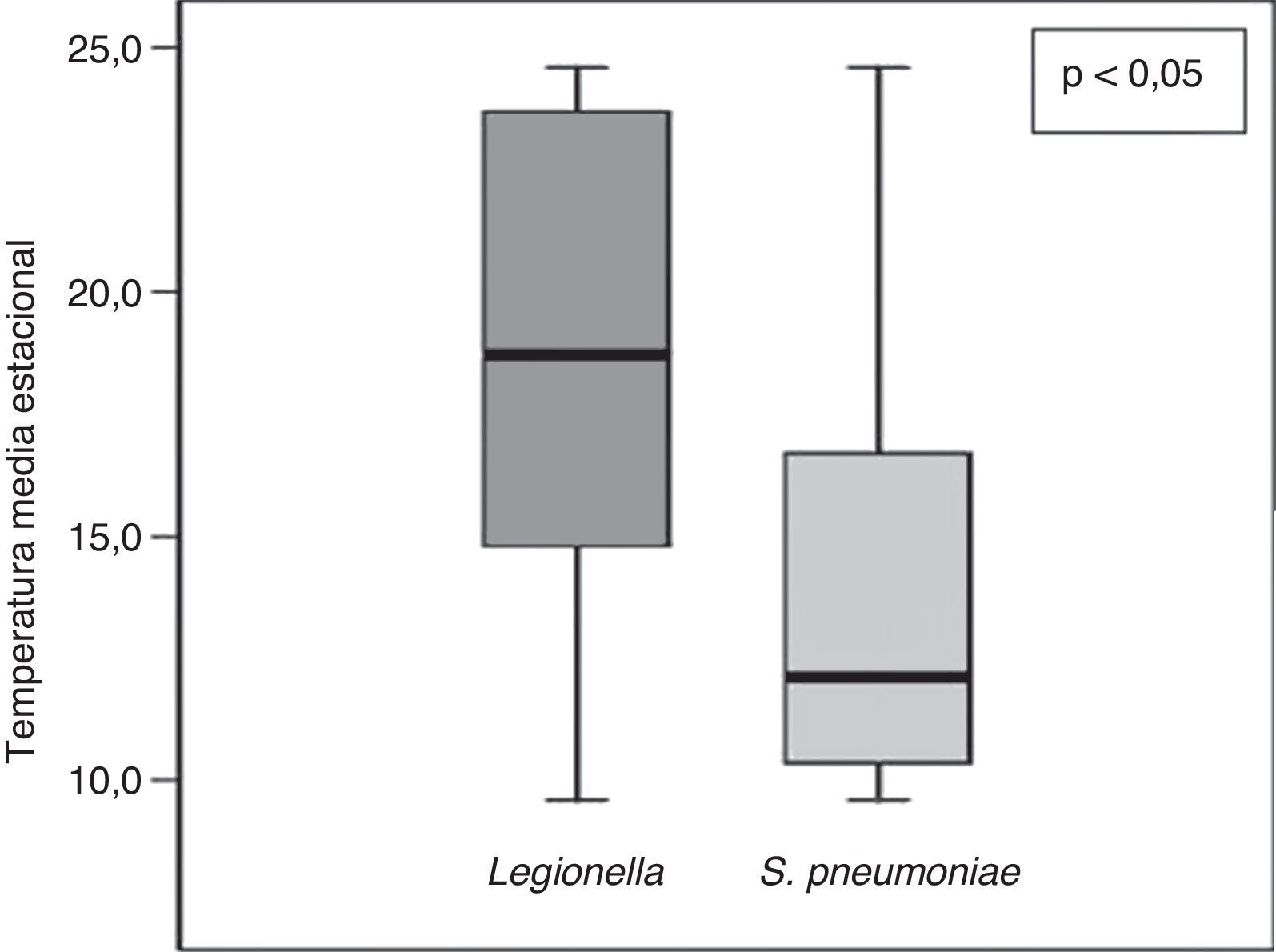
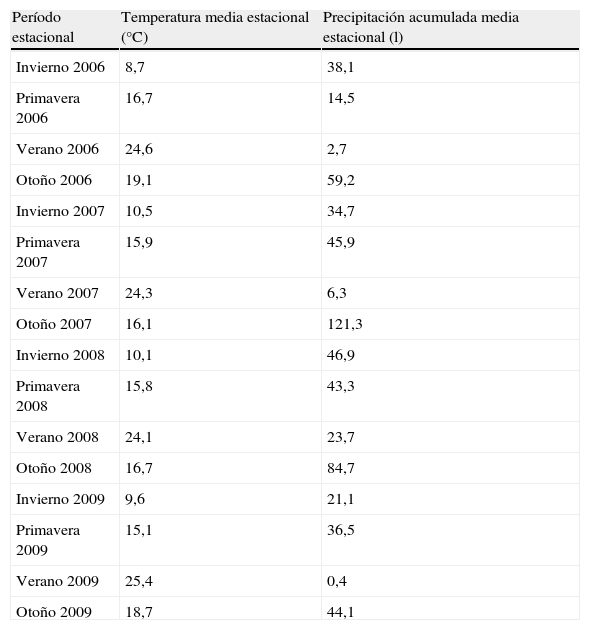
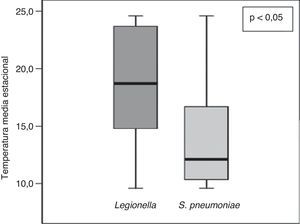
Para analizar la influencia de los cambios climatológicos se recogieron la temperatura media estacional y la precipitación acumulada media estacional de cada estación del año durante el período del estudio (tabla 3). Observamos una influencia significativa de la temperatura media estacional sobre el microorganismo causal, de manera que S. pneumoniae predominó con temperatura más baja que L. pneumophila (fig. 4). Además, observamos una correlación significativa entre la temperatura media estacional más baja y la etiología neumocócica de la NAC (r=-0,33; p<0,05), y a la inversa respecto a la NAC por L. pneumophila (r=0,24; p<0,05). En cuanto a la humedad ambiental, definida por la precipitación acumulada media, no encontramos diferencias significativas en este sentido.
Temperatura media estacional, precipitación acumulada media estacional y carácter de la precipitación por estación del año
| Período estacional | Temperatura media estacional (°C) | Precipitación acumulada media estacional (l) |
| Invierno 2006 | 8,7 | 38,1 |
| Primavera 2006 | 16,7 | 14,5 |
| Verano 2006 | 24,6 | 2,7 |
| Otoño 2006 | 19,1 | 59,2 |
| Invierno 2007 | 10,5 | 34,7 |
| Primavera 2007 | 15,9 | 45,9 |
| Verano 2007 | 24,3 | 6,3 |
| Otoño 2007 | 16,1 | 121,3 |
| Invierno 2008 | 10,1 | 46,9 |
| Primavera 2008 | 15,8 | 43,3 |
| Verano 2008 | 24,1 | 23,7 |
| Otoño 2008 | 16,7 | 84,7 |
| Invierno 2009 | 9,6 | 21,1 |
| Primavera 2009 | 15,1 | 36,5 |
| Verano 2009 | 25,4 | 0,4 |
| Otoño 2009 | 18,7 | 44,1 |
Los hallazgos más importantes de nuestro estudio son: 1) que la estación del año en la que ingresaron más NAC fue el invierno; 2) S. pneumoniae fue el microorganismo causal más frecuente en todas las estaciones del año a excepción del verano, en el que fue L. pneumophila; 3) la mayoría de los S. pneumoniae aislados en nuestra serie aparecen en invierno y L. pneumophila en verano; 4) observamos una influencia de la temperatura media estacional y el microorganismo causal, con una correlación significativa entre la menor temperatura media estacional y la etiología neumocócica de la NAC y a la inversa con la NAC por L. pneumophila; y 5) no encontramos relación entre las variaciones de la humedad ambiental por estaciones respecto a las diferencias etiológicas de la NAC.
La NAC es una enfermedad frecuente que genera una importante morbimortalidad en todo el mundo, así como una notable tasa de hospitalización, estimándose en España una tasa de 219 por 100.000 habitantes/año9,10.
La estacionalidad de una enfermedad es la tendencia a aumentar de forma sistemática su prevalencia en una determinada estación del año. Para una planificación más eficiente de los servicios hospitalarios y un mejor entendimiento de la patogénesis de una enfermedad es necesario conocer no solo variables epidemiológicas de incidencia, morbimortalidad y tasa de hospitalización, sino también si se asocia a variación estacional, y en su caso, cuál es su distribución y de qué variables climatológicas depende. Sin embargo, a pesar de la alta prevalencia de la NAC y su diferente incidencia estacional, este tema ha sido muy poco analizado en la literatura. Principalmente las investigaciones se han dirigido a la variación estacional de la morbimortalidad asociada a Influenza virus3. Por otra parte, la incidencia de la NAC es difícil de establecer por la variabilidad del diseño de los estudios, la población diana y la localización geográfica. Aun así, independientemente de estas variables, hay acuerdo respecto a que la incidencia es mayor en los meses de invierno11. Basándonos en los hallazgos de nuestro estudio, podemos decir que en nuestra área geográfica el mayor número de ingresos hospitalarios por NAC se producen en invierno. Estos resultados son similares a los de otros estudios realizados en España2, Israel12 o Taiwán13.
Con respecto a su etiología, el microorganismo más frecuente de la NAC es el S. pneumoniae14,15, sin embargo se ha documentado su variabilidad en función del área geográfica16. En nuestra serie, S. pneumoniae, tal y como se ha observado en estudios previos17–19, tiene una mayor incidencia en invierno mientras que en verano predominan los casos de L. pneumophila, todos ellos esporádicos, aunque se hayan descrito en nuestra área brotes de predominio estival20. Asimismo, otros autores en EE. UU.21, Cánada22 y Escocia23, describen una mayor incidencia de neumonía por L. pneumophila tanto en verano como en otoño. No coinciden con estos resultados otros estudios realizados en Israel12 y España24 donde no observaron predominio estacional.
La mayoría de los estudios publicados han centrado la investigación estacional de la NAC predominante según la estación de año tanto en los microorganismos etiológicos como en distintos grupos de edad y sexo. En este segundo aspecto, hay trabajos que han documentado que el envejecimiento se asocia a un mayor riesgo de NAC por S. pneumoniae y por Influenza virus25. Por el contrario, Lieberman et al.26 encontraron un mayor número de hospitalizaciones por NAC en invierno en individuos menores de 16 años mientras que otros estudios, como el de Lin et al.13 y Säynäjäkangas et al.3 coinciden con un patrón estacional similar en cada grupo de edad. Ambos estudios3,13 no observan variación estacional en función del sexo de los pacientes. Estos resultados coinciden con los nuestros, ya que no encontramos diferencias estacionales en las variables demográficas de edad y sexo.
Además de la reconocida estacionalidad de las enfermedades infecciosas, la temperatura y la humedad como variables climáticas son importantes determinantes de la supervivencia de los patógenos. Las bajas temperaturas y una disminución de la humedad en el ambiente se asocian con una mayor incidencia de infecciones del tracto respiratorio27. Por otra parte, la mayor incidencia de enfermedad neumocócica invasiva en períodos de disminución de la radiación ultravioleta puede ser explicada por efectos directos sobre la supervivencia del germen o por alteración de la función inmune en el metabolismo de 1,25- (OH)2- vitamina D28. De esta manera, los factores meteorológicos cobran relevancia sobre la incidencia de enfermedad; por otra parte, otros trabajos realizados en regiones como Israel o Taiwán muestran resultados difíciles de extrapolar a otras áreas geográficas como la nuestra, con diferentes rangos de temperatura y humedad. En este sentido, Lin et al.13 encuentran que cada grado que desciende la temperatura ambiental se asocia con un aumento en la admisión mensual de neumonías de 0,03/10.000 habitantes. En nuestra serie comprobamos la variación del microorganismo causal (S. pneumoniae y L. pneumophila) en relación con la estacionalidad y evaluamos también la influencia de los cambios climáticos en las diferentes estaciones del año, observando que la temperatura media estacional influye significativamente en la etiología de la NAC. En nuestra área geográfica, las bajas temperaturas se correlacionan con una mayor incidencia de neumonía neumocócica y las altas temperaturas con las causadas por L. pneumophila. Sin embargo, no encontramos influencia de la humedad ambiental en la etiología de la NAC. Este resultado contrasta con el estudio de Fisman et al.29 en el que se describe una asociación entre la humedad y el número de casos por Legionella, quizá porque en nuestro caso solo recogemos las NAC hospitalizadas y no todas, excluyendo los casos más leves.
Un aspecto importante de nuestro estudio, a diferencia de otros, es que no está limitado a un solo año; creemos que puede ser aventurado determinar la variación estacional referida solo a este único período de tiempo, puesto que los hallazgos pueden ser casuales y no debidos a un fenómeno efectivamente repetido anualmente. No obstante, debemos contemplar la posibilidad de que nuestros resultados, que muestran una clara distribución etiológica estacional, pudieran ser el reflejo de una epidemia que dure varios años, con brotes estacionales durante ciertas épocas anuales a lo largo de cada uno de los años de la hipotética epidemia.
Otro aspecto que merece consideración es el análisis realizado sobre la influencia de los factores meteorológicos de nuestra área geográfica, que podría extrapolarse a otras regiones con rangos similares de temperatura y humedad.
La principal limitación del estudio es que solo se obtuvieron los datos de los pacientes ingresados en el Servicio de Neumología, sin incluir los ingresados en otros servicios, como el de Medicina Interna (Geriatría), donde suelen ingresar los pacientes de edad más avanzada, y el de Hospitalización de Corta Estancia, donde ingresan las NAC más leves.
A pesar de estas limitaciones, nuestros resultados inciden en que la distribución estacional de ingresos por NAC es mayor en invierno, tal como refleja la literatura11; que en nuestro entorno, S. pneumoniae es el agente etiológico predominante en invierno y L. pneumophila en verano, en clara relación con el descenso de la temperatura media estacional para el neumococo y de manera inversa para Legionella.
En nuestro medio, disponer de estos resultados es relevante, ya que los pocos estudios que han investigado la relación entre parámetros climáticos estacionales y NAC hospitalizadas, son de otras áreas geográficas, y por lo tanto, difíciles de extrapolar a la nuestra, con diferentes rangos de temperatura y humedad.
Conflicto de interesesNo hay conflicto de intereses.