A pesar de los importantes avances que se han logrado en las últimas décadas, la enfermedad pulmonar obstructiva crónica (EPOC) continúa siendo un problema de salud de primera magnitud. Desde que en 1977 Fletcher y Peto describieron las curvas de evolución del FEV1 en los pacientes fumadores1 el concepto de la EPOC ha ido asociado invariablemente a esta alteración funcional, estableciéndose el FEV1 como principal parámetro para el diagnóstico, el tratamiento y el seguimiento de los pacientes. De esta manera, las actuales normativas nacionales e internacionales se basan en este parámetro funcional para el establecimiento de la gravedad y la instauración del tratamiento2,3.
Sin embargo, a pesar de que el FEV1 es un buen marcador pronóstico4, las estrategias de tratamiento guiadas por el FEV1 de manera exclusiva no han conseguido abarcar toda la expresión clínica de la enfermedad al existir otras variables clínicas y pronósticas cuya expresión es independiente del FEV1 y que podrían ser objetivos del tratamiento. Por este motivo, en los últimos años se ha puesto de manifiesto la necesidad de considerar otros aspectos clínicos como objetivos dentro de la estrategia terapéutica de la EPOC5. Algunas de estas variables incluyen el grado de disnea, el número de exacerbaciones, la capacidad de ejercicio o la composición corporal, entre otras. En este sentido, en los últimos años se han elaborado diversos índices o cuestionarios multidimensionales con implicación pronóstica que tienen en cuenta algunas de estas variables6–9. Sin embargo, por el momento estas iniciativas no se han traducido en propuestas de tratamiento concretas para la práctica clínica diaria. Se hace necesario, por tanto, establecer una estrategia de tratamiento que tenga en cuenta otras variables clínicas de la enfermedad que ayuden a perfilar el tratamiento de mantenimiento.
Durante las próximas líneas revisaremos la evidencia disponible para desarrollar una propuesta de estrategia que permita sistematizar el tratamiento de la enfermedad. Algunas de las afirmaciones sobre las que nos basaremos están sustentadas por la evidencia que se desprende de grandes ensayos clínicos. En otros aspectos dispondremos de trabajos clínicos menos relevantes, pero con información válida. Finalmente, durante este proceso nos encontraremos con áreas de incertidumbre sobre las que no disponemos de mucha información. En estos casos aplicaremos nuestra experiencia clínica para tomar una decisión sobre el tratamiento. Al final, obtendremos un modelo de tratamiento que tendrá aspectos de controversia, pero que servirá como marco de discusión para continuar con el debate sobre la sistematización del tratamiento de la EPOC estable.
Selección de las variablesEl primer paso necesario es la selección de las variables que vamos a incluir en el modelo de tratamiento. Existen multitud de variables clínicas, funcionales y morfológicas que podrían ser tenidas en cuenta a la hora de establecer una estrategia de tratamiento. Sin embargo, puesto que lo que queremos es obtener un modelo que sea fácilmente aplicable a la práctica clínica diaria, sería razonable contar con un número reducido de variables y que estas sean de perfil clínico.
Una asunción que hacen las actuales normativas es que los síntomas respiratorios crónicos empeoran conforme lo hace el FEV12,3. Aunque en términos globales esto es así, en los pacientes concretos sabemos que esta norma no siempre se cumple, ya que el FEV1 se relaciona escasamente con los síntomas respiratorios crónicos, como la disnea10. Por tanto, en nuestra opinión, una valoración de la clínica en situación estable debería añadirse al FEV1 como variable independiente para tener en cuenta en un modelo de tratamiento. En este sentido, es conocido que la EPOC produce síntomas muy diversos, como la disnea, la fatiga, la limitación al ejercicio, la tos o la expectoración, entre otros. Cada uno de estos síntomas podría servir de guía para establecer una estrategia de tratamiento. Además, otros conceptos más complejos, como la calidad de vida o las escalas multidimensionales, también podrían seleccionarse dentro de este eje del tratamiento. En nuestro caso, seleccionaremos la disnea por ser uno de los síntomas más frecuente e incapacitante. La categorización de los pacientes con EPOC, basándose en la disnea, ha demostrado ser un mejor predictor de supervivencia a los 5 años que el FEV111. En nuestro modelo evaluaremos la disnea según la escala modificada del Medical Research Council12 que la gradúa en 5 puntos entre 0–4.
Otro aspecto de relevancia clínica y pronóstica en la EPOC son las exacerbaciones. Aunque su definición es un tema de controversia13, se ha demostrado que los pacientes con frecuentes exacerbaciones tienen un declive del FEV1 significativamente mayor14. Además, el número de exacerbaciones tiene un impacto en la supervivencia, especialmente aquellos que precisan hospitalización15, y tienen repercusión sobre numerosas variables clínicas16. Por tanto, según lo anteriormente expuesto, el FEV1, la disnea y el número de exacerbaciones, serán las tres variables que seleccionaremos para construir el presente modelo de tratamiento.
Tratamiento de cada componente por separadoEl siguiente paso para construir el modelo sería establecer una estrategia de tratamiento para cada uno de los componentes seleccionados por separado. En este sentido, las normativas están de acuerdo en establecer que el tratamiento de base de la EPOC estable son los broncodilatadores2,3. Por tanto, el tratamiento suele empezar con estos fármacos. Por otro lado, cuando la enfermedad está muy avanzada, la triple terapia, consistente en el uso conjunto de un anticolinérgico de acción prolongada (LAMA), un beta-2-agonista de acción prolongada (LABA) y un corticoide inhalado (CI), es el tratamiento estándar empleado2,3. El problema radica en los estadios intermedios, ya que las normativas no dejan claro cuál es el camino más recomendable, añadir un broncodilatador de acción prolongada (BDAP) de otra familia o añadir precozmente un CI. Durante las siguientes líneas analizaremos cada uno de estos ejes de tratamiento de manera independiente para intentar resolver este dilema en cada uno de ellos.
Función pulmonarDesde el punto de vista funcional disponemos de ensayos clínicos que aportan información válida sobre ambas posibilidades. Por un lado, sabemos que la adición de dos broncodilatadores tiene un efecto funcional añadido17. Por otro lado, los resultados del estudio TORCH nos muestran que la introducción de un CI tiene efectos pronóstico beneficiosos, incluso en estadios precoces de la enfermedad con FEV1>50%18,19. Al comparar ambas estrategias, el único ensayo que disponemos que compara LABA+LAMA vs. LABA+CI apunta un beneficio funcional favorable hacia la combinación de broncodilatadores20. Con estos datos parece que la elección sería iniciar con dos broncodilatadores antes que introducir el CI.
Sin embargo, probablemente la mejor estrategia de tratamiento basado en la función pulmonar no sea la misma para todos los pacientes. En este sentido, cada vez disponemos de más datos sobre la variabilidad de la limitación funcional en la EPOC. Esta variabilidad de la obstrucción se puede expresar con dos conceptos distintos pero complementarios, como son la reversibilidad bronquial y la hiperrespuesta bronquial. Sobre la reversibilidad bronquial, hoy en día está aceptado que los pacientes con EPOC pueden mejorar en la prueba broncodilatadora y que lo pueden hacer en un elevado número21. Además, recientes estudios clínicos señalan una mayor respuesta al tratamiento combinado con LABA+CI entre los pacientes que broncodilatan22. Sin embargo, algunos autores sugieren que esta broncorreversibilidad parece que no es constante durante el tiempo y opinan que dividir a los pacientes según esta característica puede ser erróneo23,24, por lo que se trata de una afirmación controvertida.
Por otro lado, la hiperrespuesta bronquial parece tener relevancia en la EPOC con importancia pronóstica en la enfermedad25. Recientemente, en un trabajo de Lapperre et al26 en el que se evaluaron 114 pacientes con EPOC con FEV1 media del 61% y sin tratamiento previo con CI, los autores observaron que aquellos que iniciaban tratamiento con CI mejoraban ostensiblemente en la prueba de provocación bronquial con metacolina. Además, estos autores detectan cambios en la celularidad de estos pacientes, lo que podría identificar un fenotipo de paciente con características clínicas de mayor variabilidad y que podrían tener una mejor respuesta a los CI.
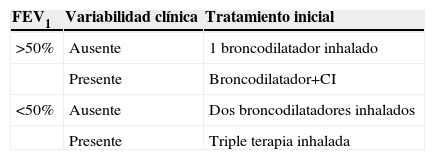
Por tanto, en los últimos años hemos ido acumulando evidencia de que los pacientes con EPOC pueden tener variabilidad en su función respiratoria, que esta variabilidad es importante en la presentación clínica y que es posible que la respuesta al tratamiento pueda ser distinta en estos pacientes, sugiriéndose un uso precoz de los CI en estos casos. En este sentido, algunos autores sugieren que aquellos pacientes con EPOC y rasgos clínicos de asma podrían tener una buena respuesta a los CI27. Aunque esta idea es aún controvertida, si se confirmara, se podría optar por iniciar un tratamiento según exista o no esta variabilidad clínica manifestada como cambios en el flujo aéreo o en la presentación clínica y crear una estrategia de tratamiento para sistematizar el tratamiento según el FEV1 resumida en la tabla 1.
Propuesta de sistematización del tratamiento de la enfermedad pulmonar obstructiva crónica en fase estable, según el componente de función pulmonar
| FEV1 | Variabilidad clínica | Tratamiento inicial |
| >50% | Ausente | 1 broncodilatador inhalado |
| Presente | Broncodilatador+CI | |
| <50% | Ausente | Dos broncodilatadores inhalados |
| Presente | Triple terapia inhalada |
CI: corticoide inhalado.
El tratamiento de la disnea sería el segundo eje de nuestro modelo. En este punto, la diferenciación entre emplear dos broncodilatadores o un broncodilatador con un CI es más controvertida. Actualmente existen numerosos ensayos clínicos que estudian el papel de la asociación de dos broncodilatadores de acción prolongada de distinta familia (LABA+LAMA). Los resultados de estos ensayos son bastante consistentes. El empleo conjunto de estos dos fármacos produce mejorías funcionales, con reducción de la necesidad de medicación de rescate, mejoría de los cuestionarios de síntomas y de la calidad de vida17,28. Por otro lado, los ensayos con LABA+CI producen mejorías en la disnea estadísticamente significativas pero, en ocasiones, estas están por debajo de la significación clínica. Finalmente, el único ensayo que ha comparado estas dos estrategias de tratamiento fue realizado por Rabe et al20, que encontraron que la asociación de broncodilatadores era superior en función pulmonar al LABA+CI. Por tanto, para el tratamiento de la disnea se podría tener la estrategia de añadir un segundo broncodilatador antes que el CI.
Sin embargo, es importante recordar que la rehabilitación respiratoria ha demostrado de manera consistente mejorías muy llamativas de la disnea y de los síntomas crónicos29. Por tanto, aquellos centros que dispongan de programas de rehabilitación respiratoria deberían incluirlos de manera precoz en este algoritmo de tratamiento.
ExacerbacionesEl tratamiento con un LABA, un LAMA o un CI ha demostrado reducir el número de exacerbaciones de manera similar, por lo que es difícil establecer una estrategia de tratamiento con este objetivo. En este sentido, es necesario recordar dos estudios importantes. El primero es el estudio OPTIMAL30, realizado para evaluar el efecto sobre las agudizaciones de añadir un CI en los pacientes en tratamiento con LABA y LAMA. El estudio fue negativo, ya que no consiguió demostrar que ninguna de las ramas del estudio fuera mejor que otra en cuanto al número de agudizaciones. Sin embargo, los autores observaron que la adición de un CI conseguía una disminución significativa de las hospitalizaciones. Estos resultados nos sugieren que para la elección del tratamiento es importante valorar el número de agudizaciones, así como su severidad. En segundo lugar, un análisis agregado de los ensayos clínicos disponibles indica que la adición de un CI consigue reducir el número de exacerbaciones frente a los broncodilatadores31. Por tanto, parece que el papel de los CI podría ser especialmente relevante en los pacientes con numerosas agudizaciones o con agudizaciones severas, especialmente si requieren hospitalización, adelantándose en estos casos el uso de CI.
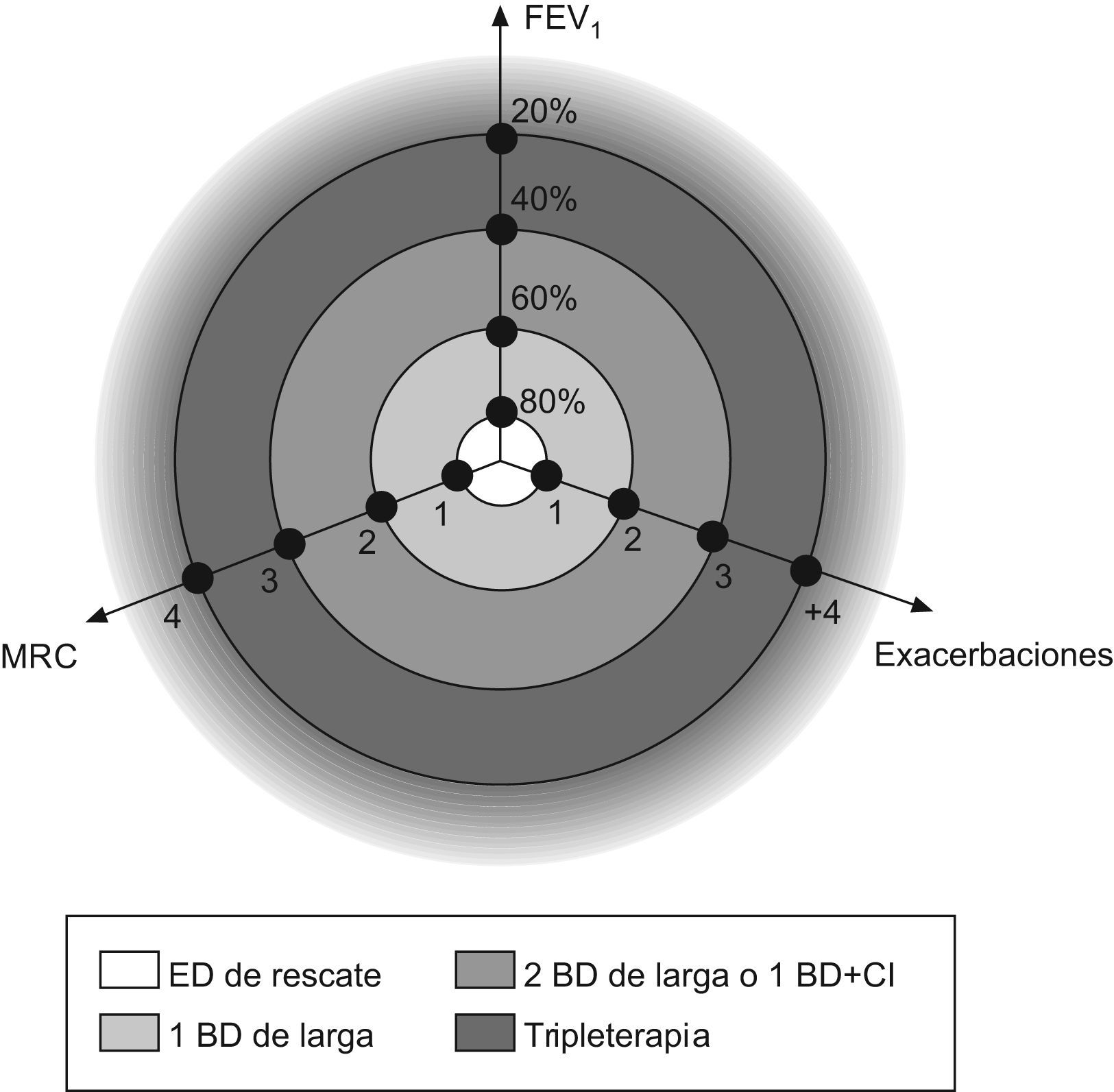
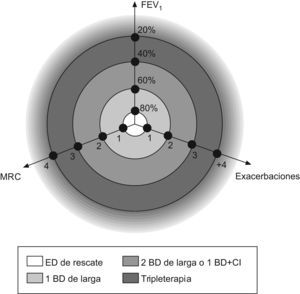
Sistematización del tratamientoUna vez que disponemos de estrategias terapéuticas para cada uno de los tres ejes, el siguiente paso sería unificarlo en un solo modelo de tratamiento que contemple los tres componentes. Una posible manera de considerar los tres ejes a la vez sería representarlo en el espacio como se ilustra en la figura 1, de manera que uniendo los puntos se podría establecer una diana de tratamiento de la EPOC. En estos ejes instauraríamos el tratamiento farmacológico en tres escalones: 1) tratamiento con un BDAP; 2) tratamiento con dos BDAP o con un BDAP y un CI, dependiendo de la presencia o no de la variabilidad clínica o de la severidad y la frecuencia de las agudizaciones, y 3) triple terapia, asociando LABA+LABA+CI. En este modelo, el eje más severo sería el que rige la estrategia del tratamiento. Así, por ejemplo, en un paciente con un FEV1 del 62%, con disnea de grado 1 de la Medical Research Council y más de dos agudizaciones, serían las agudizaciones las que regirían el tratamiento por ser el principal problema del paciente. En definitiva, consistiría en averiguar cuál de los tres (función pulmonar, síntomas crónicos o exacerbaciones) es el principal problema del paciente y establecer la estrategia del tratamiento en ese eje.
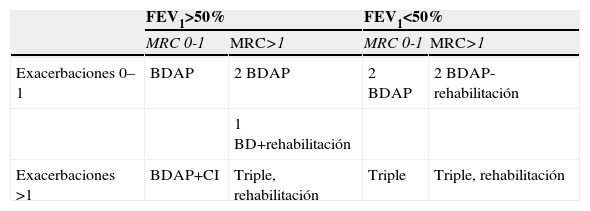
Esto mismo se puede representar en una tabla de tratamiento (tabla 2), donde al aumentar los síntomas crónicos iríamos aumentando el tratamiento broncodilatador, mientras que a mayor número de agudizaciones o severidad de estas, aumentaríamos el tratamiento antiinflamatorio.
Estrategia tridimensional del tratamiento
| FEV1>50% | FEV1<50% | |||
| MRC 0-1 | MRC>1 | MRC 0-1 | MRC>1 | |
| Exacerbaciones 0–1 | BDAP | 2 BDAP | 2 BDAP | 2 BDAP-rehabilitación |
| 1 BD+rehabilitación | ||||
| Exacerbaciones >1 | BDAP+CI | Triple, rehabilitación | Triple | Triple, rehabilitación |
BDAP: broncodilatador de acción prolongada; CI: corticoide inhalado; MRC: Medical Research Council; Triple: triple terapia.
Este modelo tiene algunas limitaciones. En primer lugar, es preciso recordar que muchas de las exacerbaciones que los pacientes con EPOC presentan no se registran32 y que estas exacerbaciones que no son referidas tienen un impacto en la calidad de vida33. Por tanto, es importante poder recoger lo más fiablemente posible las exacerbaciones de los pacientes con EPOC con vistas de establecer una estrategia de tratamiento o, si no es posible, limitar el modelo a aquellas que son objetivadas por un centro sanitario.
En segundo lugar, como ya se ha comentado, el modelo de reversibilidad bronquial es controvertido y precisa de estudios de seguimiento que aporten información sobre la importancia de esta reversibilidad bronquial a largo plazo y ensayos clínicos que profundicen en la respuesta de estos pacientes a los distintos tratamientos. Igualmente, sería preciso definir exactamente el concepto de variabilidad clínica y estudiar su efecto en el pronóstico y la respuesta al tratamiento de esos pacientes.
Otro aspecto de controversia es el número de exacerbaciones para considerarlas frecuentes. En la tabla 2 se ha puesto el límite arbitrariamente en 1, pero algunos autores encuentran este límite en dos agudizaciones al año y las diversas normativas ponen límites distintos2,3,15. Si queremos seleccionar pacientes con un número elevado de agudizaciones, probablemente habría que subir este número.
Finalmente, es preciso que los ensayos clínicos próximos avancen en la eficacia y en la seguridad de una combinación de broncodilatadores frente a una combinación de un broncodilatador y un CI, con objeto de situar estas opciones de manera adecuada dentro de una estrategia de tratamiento.
ConclusiónEn los últimos años se ha puesto de manifiesto que las estrategias de tratamiento guiadas por el FEV1 de manera exclusiva no han conseguido abarcar el tratamiento de toda la expresión clínica de la enfermedad. Se hace necesario un cambio de la estrategia del tratamiento en la EPOC que pase de la unidimensionalidad de la FEV1 a los esquemas tridimensionales, como el presente, o incluso multidimensionales, que ayuden al clínico a instaurar un esquema de tratamiento adecuado a la realidad clínica de cada caso. El presente modelo no está exento de controversia, pero pensamos que servirá como punto de partida para establecer un foro de debate que permita en un futuro establecer una estrategia de tratamiento más acorde a la realidad de los pacientes que la padecen.
Conflicto de interesesEl autor ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): Almirall, AstraZeneca, Bayer, Boehringer Ingelheim, Cantabria Pharma, Chiesi, Esteve, GlaxoSmithKline, MSD, Novartis y Pfizer.