La hiperhidrosis esencial se caracteriza por un exceso de sudoración en la palma de las manos, la planta de los pies y las axilas, debida a una hiperestimulación del sistema nervioso simpático que pasa a través del segundo y tercer ganglios torácicos simpáticos. El tratamiento de elección es la simpatectomía dorsal bilateral (SDB) por videotoracoscopia. El objetivo de nuestro estudio ha sido evaluar si las modificaciones en la función respiratoria halladas previamente en un grupo de pacientes intervenidos por SDB se mantenían a los 3 años de la cirugía.
Pacientes y métodosDel grupo de 20 pacientes estudiados previamente, pudimos reunir a 18 (3 varones y 15 mujeres) con una edad media de 35 años. Se les realizaron una espirometría y una prueba de provocación bronquial con metacolina, y se determinó la concentración de óxido nítrico en aire espirado. Los resultados se compararon con los de las pruebas efectuadas antes de la cirugía.
ResultadosA los 3 años se detectó un incremento estadísticamente significativo del porcentaje de la capacidad vital forzada basal, que pasó de un valor medio (±desviación estándar) del 96±10% al 101±11% (p=0,008). Respecto a las cifras iniciales del flujo máximo mesoespiratorio, se halló un descenso estadísticamente significativo a los 3 años de la cirugía: de un valor basal de 3,8±0,9l/s se pasó a 3,5±0,9l/s (p=0,01). La prueba de provocación bronquial con metacolina y la concentración de óxido nítrico en aire espirado no experimentaron cambios a los 3 años.
ConclusionesLas modificaciones en la función pulmonar indican una mínima afectación de la pequeña vía aérea, que persiste a los 3 años de la SDB, como consecuencia de la denervación simpática producida por la cirugía, pero sin ninguna significación clínica.
Primary hyperhidrosis is characterized by excessive sweating of the palms, soles, and axillae due to overactivity of the sympathetic nervous system at the level of the second and third sympathetic thoracic ganglia. The treatment of choice is bilateral dorsal sympathectomy performed using video-assisted thoracic surgery (VATS). The objective of our study was to determine whether lung function changes observed in a group of patients prior to bilateral dorsal sympathectomy performed using VATS were still evident 3 years after surgery.
Patients and methodsOf the 20 patients studied at baseline, we were able to obtain data for 18 (3 men and 15 women; mean age, 35 y). They underwent spirometry and a bronchial challenge test with methacholine, and the fraction of exhaled nitric oxide (FENO) was measured. The results were compared with those of the tests performed before surgery.
ResultsAt 3 years from baseline, we detected a statistically significant increase in forced vital capacity from a mean (SD) of 96% (10%) to 101% (11%) (P=.008), and a statistically significant decrease in midexpiratory flow rate from 3.8 (0.9)L/s to 3.5 (0.9)L/s (P=.01). The results of the bronchial challenge test with methacholine and the FENO remained unchanged.
ConclusionsThe lung function changes detected point toward minimal, clinically insignificant small airway alterations due to sympathetic denervation following bilateral dorsal sympathectomy performed 3 years earlier.
La hiperhidrosis esencial se caracteriza por el exceso de sudoración tanto en la palma de las manos como en la planta de los pies y las axilas, debido a una hiperestimulación del sistema nervioso simpático que pasa por el segundo y tercer ganglios torácicos (T2–T3). Esta afección representa una respuesta exagerada a una acción fisiológica como es la sudoración y afecta aproximadamente entre el 1 y el 2,8% de la población, según las series1. Aunque su fisiopatología es desconocida, se cree que podría estar causada por una hiperestimulación del sistema nervioso simpático que discurre por los ganglios torácicos, lo que provocaría una inervación anormal de las glándulas ecrinas, que son las responsables finales de la secreción excesiva del sudor en la palma de las manos2.
En la actualidad el tratamiento de elección es la simpatectomía dorsal bilateral (SDB) en un único tiempo quirúrgico, mediante videotoracoscopia de los ganglios T2–T3. Es un tratamiento seguro, rápido y eficaz, mínimamente invasivo y con escasa mortalidad en las series estudiadas2,3. El efecto secundario más frecuente es la hipersudoración compensadora (HC), localizada en la espalda, el abdomen, los glúteos y los miembros inferiores. También se han descrito alteraciones espirométricas e hiperrespuesta bronquial, atribuidas a la denervación simpática, lo que indica una mayor actividad del sistema nervioso autónomo en estos pacientes4.
Nuestro grupo, al estudiar las alteraciones en la función cardiopulmonar de un grupo de pacientes a quienes se realizó dicha intervención, observó cambios en la pequeña vía aérea sin traducción clínica5. El objetivo del presente estudio ha sido evaluar las consecuencias y la trascendencia de estas alteraciones en un plazo de tiempo superior.
Pacientes y métodosEn el estudio previo analizamos las modificaciones en la función pulmonar a los 3 meses del procedimiento quirúrgico5. A todos estos pacientes se les habían realizado una espirometría forzada, una prueba de provocación bronquial con metacolina y una prueba de esfuerzo máximo con cicloergométro, antes y a los 3 meses de la cirugía. Al cabo de 3 años de la intervención nos pusimos en contacto telefónico con dichos pacientes para revaluar su función pulmonar. De los 20 pacientes iniciales, 18 aceptaron participar en el estudio. Los 2 restantes se negaron, aunque no tenemos constancia de que presentaran síntomas o que consultaran por problemas respiratorios. Los pacientes estudiados eran 15 mujeres y 3 varones, con una edad media de 35 años (rango: 25–47), 10 de ellos (55,6%) fumadores. De los 18 pacientes sólo 2 (11,1%) tenían antecedentes de asma leve intermitente, bien controlada y sin tratamiento en el momento de la cirugía y a los 3 años. A todos ellos se les había efectuado una SDB por videotoracoscopia, con electrocoagulación de los ganglios T2–T3, y se les repitieron las pruebas de función pulmonar, con las siguientes modificaciones: incorporamos la determinación de la concentración de óxido nítrico (NO) en el aire espirado y no realizamos la prueba de esfuerzo máxima con cicloergómetro. También se les interrogó por la presencia de HC y su localización.
La espirometría se realizó con un equipo Datospir 120 (Sibelmed, Barcelona), según el procedimiento indicado por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)6, y se determinaron las variables espirométricas habituales: capacidad vital forzada (FVC), volumen espiratorio forzado en el primer segundo (FEV1), FEV1/FVC y flujo máximo mesoespiratorio (MMEF). La prueba de provocación bronquial con metacolina se practicó siguiendo la normativa de la European Respiratory Society7. En nuestro laboratorio, se considera que hay hiperrespuesta bronquial cuando la dosis de agente broncoconstrictor capaz de provocar un descenso del FEV1 basal del 20% es menor de 16mg/ml. Previamente se determinó la concentración en partículas por billón de NO en el aire espirado, mediante el sensor de quimioluminiscencia SIR-N-6008® (SIR, Madrid, España), siguiendo las recomendaciones de la American Thoracic Society8. Se realizaron 2 determinaciones técnicamente correctas y se consideró válido el valor medio. El punto de corte entre sano y patológico que se ha establecido en nuestro laboratorio es de 20ppb9. El grado de satisfacción de los pacientes se midió según la siguiente escala: “muy satisfecho”, “satisfecho” o “muy insatisfecho”. Los resultados se compararon con los obtenidos tras la cirugía3.
Análisis estadísticoLos datos se expresan como media y desviación estándar. La comparación entre los datos basales y a los 3 años de la cirugía, debido al tamaño de la muestra, se realizó mediante las pruebas no paramétricas de Wilcoxon. Las correlaciones también se calcularon mediante la prueba no paramétrica de Spearman. Se utilizó el programa estadístico SPSS en su versión 15. Se aceptó como significativo un valor de p<0,05.
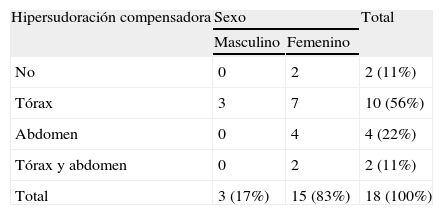
ResultadosA los 3 años de la cirugía los pacientes declararon un grado de satisfacción similar al expresado tras la intervención: 16 (88%) se mostraron muy satisfechos, uno (6%) no estaba satisfecho y uno (6%) se sentía muy insatisfecho debido al fenómeno de HC. Durante el período de tiempo transcurrido no habían experimentado ningún problema respiratorio relacionado con la presencia de disnea al realizar esfuerzos ni síntomas indicativos de hiperreactividad bronquial. El efecto secundario más destacado fue la sudoración compensadora (89%), localizada en el tronco en el 56% de los casos, en el abdomen en el 22% y en ambas localizaciones en un 11%. La distribución por sexo y localización puede observarse en la tabla 1.
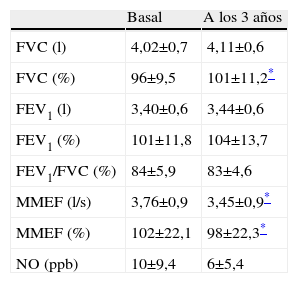
Todos los pacientes presentaron una espirometría dentro de los límites de referencia a los 3 años de la cirugía. Los valores de la FVC y del FEV1 no mostraron diferencias estadísticamente significativas, excepto cuando se comparó la FVC como porcentaje del valor de referencia, que pasó de una cifra media (desviación estándar) del 96±10% al 101±11% (p=0,008). Respecto a las cifras iniciales del MMEF, se halló un descenso estadísticamente significativo a los 3 años de la cirugía: del valor basal de 3,8±0,9 l/s se pasó a 3,5±0,9 l/s (p=0,01) (tabla 2).
Cambios en la función pulmonar a los 3 años de la cirugía
| Basal | A los 3 años | |
| FVC (l) | 4,02±0,7 | 4,11±0,6 |
| FVC (%) | 96±9,5 | 101±11,2* |
| FEV1 (l) | 3,40±0,6 | 3,44±0,6 |
| FEV1 (%) | 101±11,8 | 104±13,7 |
| FEV1/FVC (%) | 84±5,9 | 83±4,6 |
| MMEF (l/s) | 3,76±0,9 | 3,45±0,9* |
| MMEF (%) | 102±22,1 | 98±22,3* |
| NO (ppb) | 10±9,4 | 6±5,4 |
Los valores se expresan como media±desviación estándar.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; MMEF: flujo máximo mesoespiratorio; NO: concentración de óxido nítrico en el aire espirado.
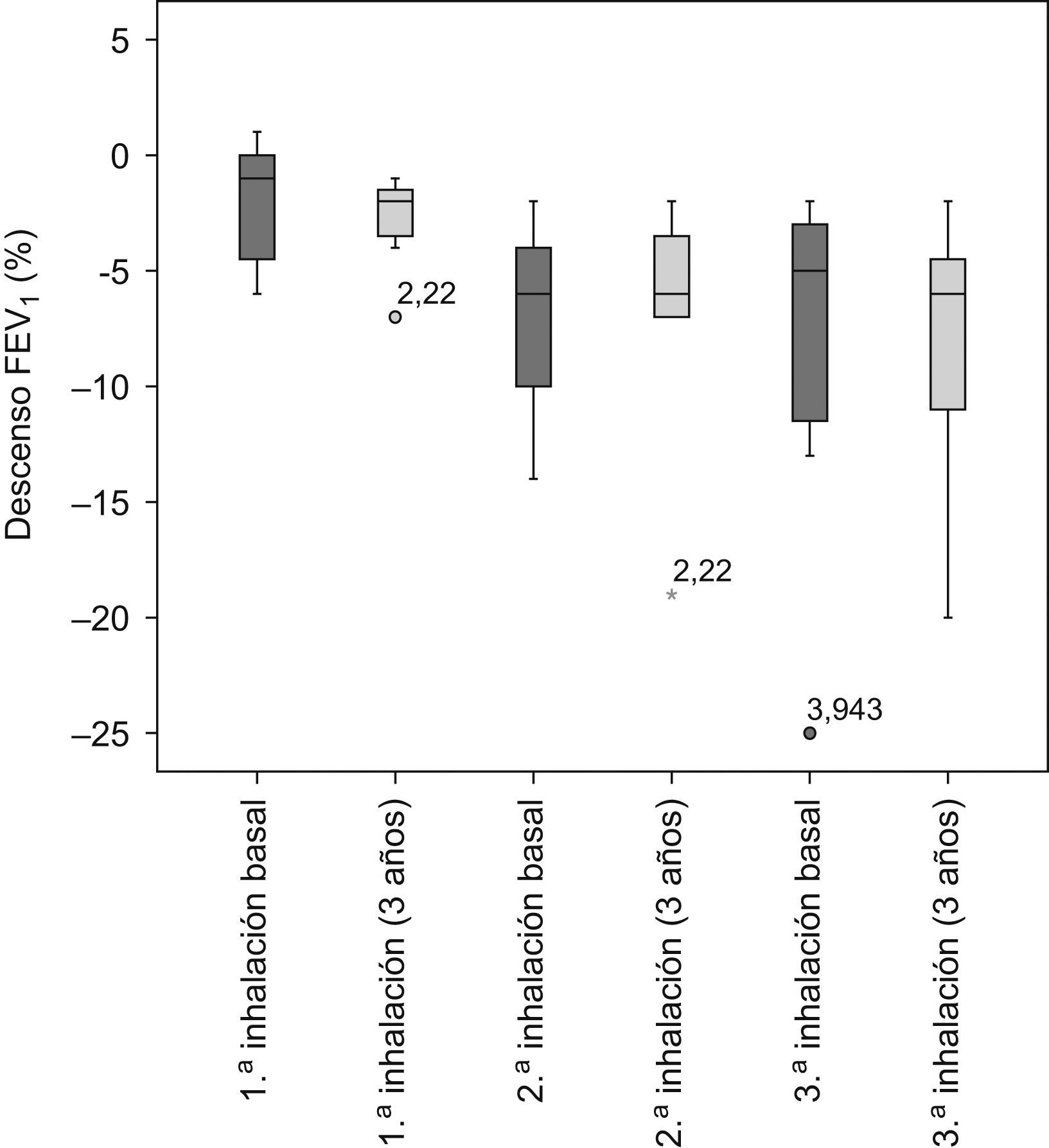
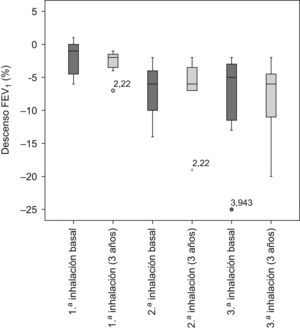
La prueba de provocación bronquial con metacolina no experimentó cambios a los 3 años de la cirugía, y en el único paciente en que era positiva tras la cirugía resultó negativa a los 3 años. Cabe destacar que todos los varones presentaron una prueba de provocación bronquial negativa, ya que el único paciente en que se positivizó era una mujer. Donde sí se observaron diferencias estadísticamente significativas fue en los valores espirométricos de la prueba de provocación bronquial: el descenso del porcentaje de la FVC, el FEV1 y el MMEF tras las diferentes inhalaciones de metacolina fue mayor a los 3 años de la cirugía.
En la figura 1 se representa el descenso del FEV1 en las diferentes inhalaciones de la prueba de provocación bronquial con metacolina, tanto basal como a los 3 años de la cirugía. Al estimar la relación entre la HC y la prueba de provocación con metacolina a los 3 años se halló un coeficiente de correlación no significativo (r de Pearson=0,3; coeficiente rho de Spearman=0,3). También se realizó el análisis de la correlación entre la edad a los 3 años de la cirugía y la HC; en este caso se observó una relación negativa, con un coeficiente de correlación de −0,4, estadísticamente significativo (p=0,05).
La concentración de NO no alcanzó valores patológicos en ninguna de las 3 determinaciones. Tan sólo se observó un incremento tras la cirugía que no llegó a ser estadísticamente significativo, pasando de 10±9 a 15±13ppb, para volver a valores aún más bajos a los 3 años de la cirugía (6±5ppb).
DiscusiónEl principal hallazgo de nuestro trabajo es haber comprobado que la alteración funcional que se detecta en la pequeña vía aérea de los pacientes a quienes se realiza una SDB por hiperhidrosis esencial se mantiene a los 3 años del procedimiento, aunque clínicamente permanecen asintomáticos.
Los estudios de que disponíamos hasta ahora evaluaban los cambios en la función pulmonar al mes, a los 3 y 6 meses de la simpatectomía. Únicamente en un trabajo reciente se aportan datos a un año de la cirugía. Ponce González et al10 estudiaron a un grupo de 37 pacientes a los que realizaron una espirometría forzada antes de la cirugía, a los 3 meses de ésta y al año. Observaron un descenso de la FVC, el FEV1 y el MMEF a los 3 meses, pero la FVC recuperó sus valores basales a los 12 meses, en tanto que el FEV1 y el MMEF mantuvieron una reducción significativa (del −2,8 y el −11,2%, respectivamente). Estos hallazgos se corresponden con los encontrados en nuestro estudio y corroboran la persistencia de una obstrucción bronquial mínima a los 3 años de la cirugía, que estaría relacionada con la influencia del sistema nervioso simpático en el tono broncomotor.
Como ya se ha comentado, la vía aérea está predominantemente inervada por el sistema nervioso parasimpático y la inervación simpática es escasa, pero influye de forma indirecta en el tono motor, pudiendo ser la causa del leve patrón obstructivo residual tras la intervención. A pesar del cuestionado papel del sistema nervioso simpático en el pulmón, una serie de estudios fisiológicos demuestran el efecto de la actividad del sistema nervioso simpático después de la SDB11,12. El primero de ellos fue el de Noppen y Vincken4, en el que se compararon los estudios de función pulmonar (espirometría, difusión y volúmenes pulmonares mediante pletismografía) de 47 pacientes antes de la simpatectomía dorsal mediante videotoracoscopia, a las 6 semanas y a los 6 meses (los estudios previos se habían realizado con técnicas invasivas, a través de toracotomía). Se encontró un descenso estadísticamente significativo del FEV1, el MMEF y la capacidad pulmonar total a las 6 semanas de la intervención. A los 6 meses los autores evaluaron de nuevo a 35 pacientes y comprobaron que los valores de la capacidad pulmonar total habían vuelto a la normalidad, mientras que el MMEF se mantenía descendido. Atribuyeron el descenso permanente del MMEF a la denervación simpática producida por la cirugía y señalaron que en los pacientes con hiperhidrosis esencial el tono broncomotor está influido por el sistema nervioso simpático, en contraste con la opinión común de que el tono motor de la vía aérea no está bajo la influencia de este sistema. Tanto el estudio de Ponce González et al10, que evalúa a los pacientes al año, como el nuestro, en el que los evaluamos a los 3 años, demuestran que la persistencia en el tiempo del descenso del MMEF está más relacionada con la simpaticólisis de los ganglios que con la videotoracoscopia.
En cuanto a la prueba de provocación con metacolina, nuestro trabajo muestra que a los 3 años de la cirugía no se observan cambios en ella. En los pacientes en que ya era positiva antes de la cirugía continuó siéndolo, y en el único en que se positivizó tras la cirugía volvió a los valores basales a los 3 años. A pesar de que hoy día está ampliamente aceptada la etiología inflamatoria13, las alteraciones autonómicas de la vía aérea podrían contribuir al sintomatología del asma. No parece que en nuestros pacientes la hiperreactividad bronquial esté relacionada con la inflamación, ya que la concentración de NO se mantuvo en valores inferiores a los considerados patológicos.
Noppen y Vincken14 también estudiaron a un grupo de 35 pacientes a quienes se realizó una prueba de provocación bronquial con histamina a las 6 semanas y a los 6 meses de la simpatectomía. Concluyeron que la denervación parcial simpática de los pulmones, con una oposición intacta del sistema nervioso parasimpático, produciría un incremento de la hiperrespuesta bronquial —sobre todo cuando el tono broncomotor está aumentado—, que sería comparable al empeoramiento de la hiperreactividad bronquial después de bloquear farmacológicamente el receptor beta en los pacientes con asma. A pesar de estos hallazgos, los pacientes de los estudios realizados no presentaron síntomas relacionados con la hiperreactividad bronquial.
En la mayoría de las series revisadas15,16 el efecto secundario más importante de la SDB es la HC, que se presenta en alrededor de un 80% de los casos. Las localizaciones más frecuentes son el tórax, la espalda y el abdomen. Habitualmente no está relacionada con el tipo de intervención realizada ni con el número de ganglios eliminados. En nuestro estudio, relacionamos la HC con la prueba de provocación bronquial con metacolina y con la edad a los 3 años de la intervención. Hallamos una correlación negativa y estadísticamente significativa con la edad, ya que los 2 pacientes que no presentaban HC eran los de edad superior. Consideramos que han de realizarse más estudios para comprobar si la hiperactividad simpática de estos pacientes desempeña algún papel en la presencia de HC tras la SDB. A pesar de ello, los pacientes muestran tras la intervención un grado de satisfacción importante, que sobrepasa con creces el hecho de presentar HC.
La limitación mayor de nuestro estudio es el tamaño de la muestra, por lo que sería interesante, ya que en nuestro país existe un grupo cooperativo dedicado a la simpatectomía videotoracoscópica, realizar pruebas de función pulmonar a los pacientes a quienes se vaya a efectuar este tipo de cirugía con el fin de conseguir unos resultados más concluyentes con un tamaño muestral mayor. Incluso podrían valorarse los cambios en la función pulmonar con las nuevas técnicas desarrolladas, como el clipping. Por otro lado, no podemos descartar del todo la existencia de algún factor de confusión al analizar la relación entre las variables, aunque, al tratarse de cambios en un mismo individuo, no nos parece que pueda apreciarse.
En conclusión, la SDB mediante videotoracoscopia puede considerarse un procedimiento quirúrgico seguro a lo largo del tiempo. Con nuestro estudio queda demostrado que el sistema nervioso simpático influye en el tono broncomotor de los pacientes con hiperhidrosis esencial. Creemos que deberían realizarse estudios con un número mayor de pacientes para corroborar las alteraciones autonómicas de la vía aérea de dichos pacientes.