La actividad previa puede modificar la contractilidad muscular, lo que puede conducir a la infra o supraestimación de la fuerza en las determinaciones funcionales. El presente trabajo se ha propuesto como objetivo valorar cambios en la presión máxima generada por el diafragma tras diferentes series de contracciones isométricas espontáneas y cuasi máximas.
MétodosSe estudiaron por duplicado 6 perros con un peso medio ± desviación estándar de 26 ± 7 kg. Se obtuvo la respuesta supramáxima del diafragma –presiones gástrica (Pgatw) y esofágica (Pestw) inducidas por estimulación frénica bilateral, y acortamiento muscular (sonomicrometría)— por estimulación simultánea supramáxima de ambos nervios frénicos, tanto en situación basal como tras series cortas (5), medianas (10) y largas (20) de esfuerzos inspiratorios espontáneos contra la vía aérea ocluida, antes y después de administrar anestesia subaracnoidea (elimina la contribución ventilatoria de los músculos intercostales).
ResultadosLa serie corta y, sobre todo, la serie mediana provocaron la potenciación de la respuesta contráctil (Pgatw de 3,2 ± 0,4 a 3,7 ± 0,3, y de 3,5 ± 0,3 a 3,9 ± 0,3 cmH2O, respectivamente; p < 0,05 ambas). La potenciación fue algo superior con anestesia subaracnoidea (un 21 frente al 11% sin anestesia, para la Pgatw tras las series medianas). La serie larga provocó, sin embargo, una disminución de la respuesta (Pgatw: 3,2 ± 0,4 a 2,5 ± 0,3 cmH2O; p < 0,05), probablemente por predominio de la fatiga sobre la potenciación.
ConclusionesLos esfuerzos previos determinan la capacidad contráctil del diafragma y resulta difícil predecir el predominio de fatiga o de potenciación en la respuesta. Este factor debería tenerse en cuenta al determinar las presiones respiratorias máximas en la clínica diaria.
Previous muscle activity can alter muscle contractility and lead to strength underestimation or overestimation in functional measurements. The objective of this study was to evaluate changes in the maximum pressure produced by the diaphragm after different series of spontaneous near-to-maximal isometric contractions.
MethodsDuplicate studies were performed on 6 dogs with a mean (SD) weight of 26 (7) kg. The supramaximal response of the diaphragm was achieved by simultaneous supramaximal stimulation of both phrenic nerves, both under basal conditions and after series of 5, 10, and 20 spontaneous inspiratory efforts against the occluded airway, performed before and after spinal anesthesia (which eliminates the ventilatory contribution of the intercostal muscles). The response was measured using the twitch gastric pressure (Pga) and twitch esophageal pressure (Pes) and by muscle shortening (sonomicrometry).
ResultsThe short series of 5 inspiratory efforts and, in particular, the medium series of 10 efforts produced potentiation of the contractile response, with a rise in the Pga from 3.2 (0.4) cmH2O to 3.7 (0.3) cmH2O, and from 3.5 (0.3) cmH2O to 3.9 (0.3) cmH2O, respectively (P=.05 in both cases). The potentiation was somewhat greater after subarachnoid anesthesia (an increase in the Pga of 21% after the medium series of 10 efforts with anesthesia vs 11% without anesthesia). However, the long series of 20 efforts produced a fall in the response, with a decrease in the Pga from 3.2 (0.4) cmH2O to 2.5 (0.3) cmH2O (P<.05), probably due to fatigue overcoming the effect of potentiation.
ConclusionsPrevious effort affects the contractile capacity of the diaphragm and it is difficult to predict the predominance of fatigue or potentiation in the response. This factor must be taken into account when determining the maximum respiratory pressures in daily clinical practice.
En reposo, el principal músculo respiratorio en personas sanas es el diafragma. Consta de 2 porciones, crural y costal, diferenciadas embriológica, anatómica y funcionalmente. Mientras que la primera fundamentalmente fija el músculo a sus estructuras vecinas, la segunda actúa como un émbolo que aumenta el tamaño de la caja torácica al contraerse. Sin embargo, en el esfuerzo inspiratorio participan también otros músculos, como los paraesternales (una porción de los intercostales internos) y los intercostales externos (sobre todo los más cefálicos y en su porción anterior)1. La evaluación de las propiedades funcionales de los músculos respiratorios es útil tanto en las enfermedades intrínsecamente respiratorias como en otras entidades.
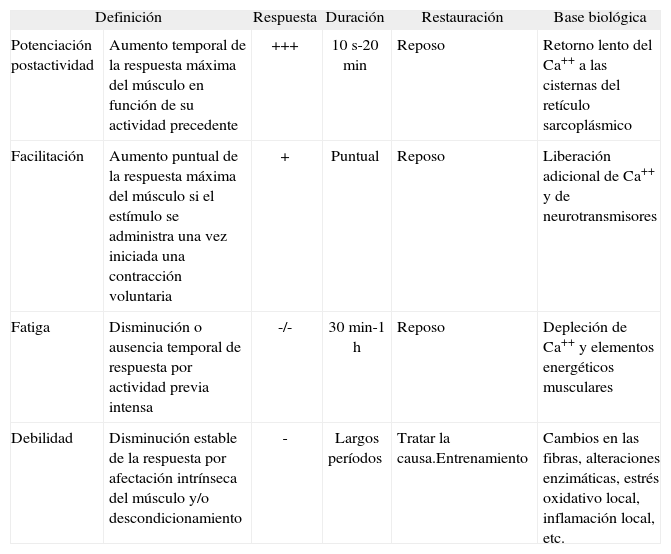
Sin embargo, ante la imposibilidad de determinar directamente la tensión contráctil en la práctica clínica, la valoración de la fuerza se realiza mediante una aproximación a partir de las presiones generadas por los músculos respiratorios1,2. Dicha determinación puede efectuarse mediante maniobras voluntarias o por estimulación tanto muscular como de las correspondientes estructuras nerviosas3-6. En ambos casos suele repetirse un número determinado de veces la maniobra, para asegurar su reproducibilidad y validez como determinación máxima7. Si además se pretende eliminar el efecto aprendizaje, se recomienda realizar varias series de maniobras antes de la considerada válida7,8. Sin embargo, esta práctica choca con la posibilidad de que la actividad previa condicione cambios en la respuesta contráctil máxima. En efecto, se sabe que las contracciones previas pueden incrementar la respuesta de un músculo (fenómeno conocido como de potenciación postactividad)9. Sin embargo, si la actividad precedente ha sido intensa, el músculo puede también disminuir su respuesta como consecuencia de la aparición de fatiga1,10. Si la sobreactividad ha sido de menor intensidad pero mantenida, algunos autores consideran que puede producir fatiga muscular crónica11, situación en la que el músculo podría cumplir sus funciones pero con deficiencias. Si, por el contrario, la actividad se halla reducida drásticamente y de forma continuada, aparecería el descondicionamiento. En el caso de la fatiga, la solución es el reposo. En cambio, si hay descondicionamiento, éste generará debilidad, y deberá procederse a entrenar el músculo. En la tabla I se describen las principales diferencias entre todos estos fenómenos.
Características fundamentales de los fenómenos de potenciación, facilitación, fatiga y debilidad musculares
| Definición | Respuesta | Duración | Restauración | Base biológica | |
| Potenciación postactividad | Aumento temporal de la respuesta máxima del músculo en función de su actividad precedente | +++ | 10s-20min | Reposo | Retorno lento del Ca++ a las cisternas del retículo sarcoplásmico |
| Facilitación | Aumento puntual de la respuesta máxima del músculo si el estímulo se administra una vez iniciada una contracción voluntaria | + | Puntual | Reposo | Liberación adicional de Ca++ y de neurotransmisores |
| Fatiga | Disminución o ausencia temporal de respuesta por actividad previa intensa | -/- | 30min-1h | Reposo | Depleción de Ca++ y elementos energéticos musculares |
| Debilidad | Disminución estable de la respuesta por afectación intrínseca del músculo y/o descondicionamiento | - | Largos períodos | Tratar la causa.Entrenamiento | Cambios en las fibras, alteraciones enzimáticas, estrés oxidativo local, inflamación local, etc. |
Nuestra hipótesis es que la actividad previa modifica la respuesta del diafragma ante la estimulación: una actividad ligera potenciará dicha respuesta, mientras que una actividad más prolongada e intensa la disminuirá, por la aparición de fatiga. El presente estudio tiene como objetivo valorar la respuesta contráctil máxima del diafragma tras diferentes series de esfuerzos submáximos, en condiciones experimentales y utilizando un modelo animal12-14.
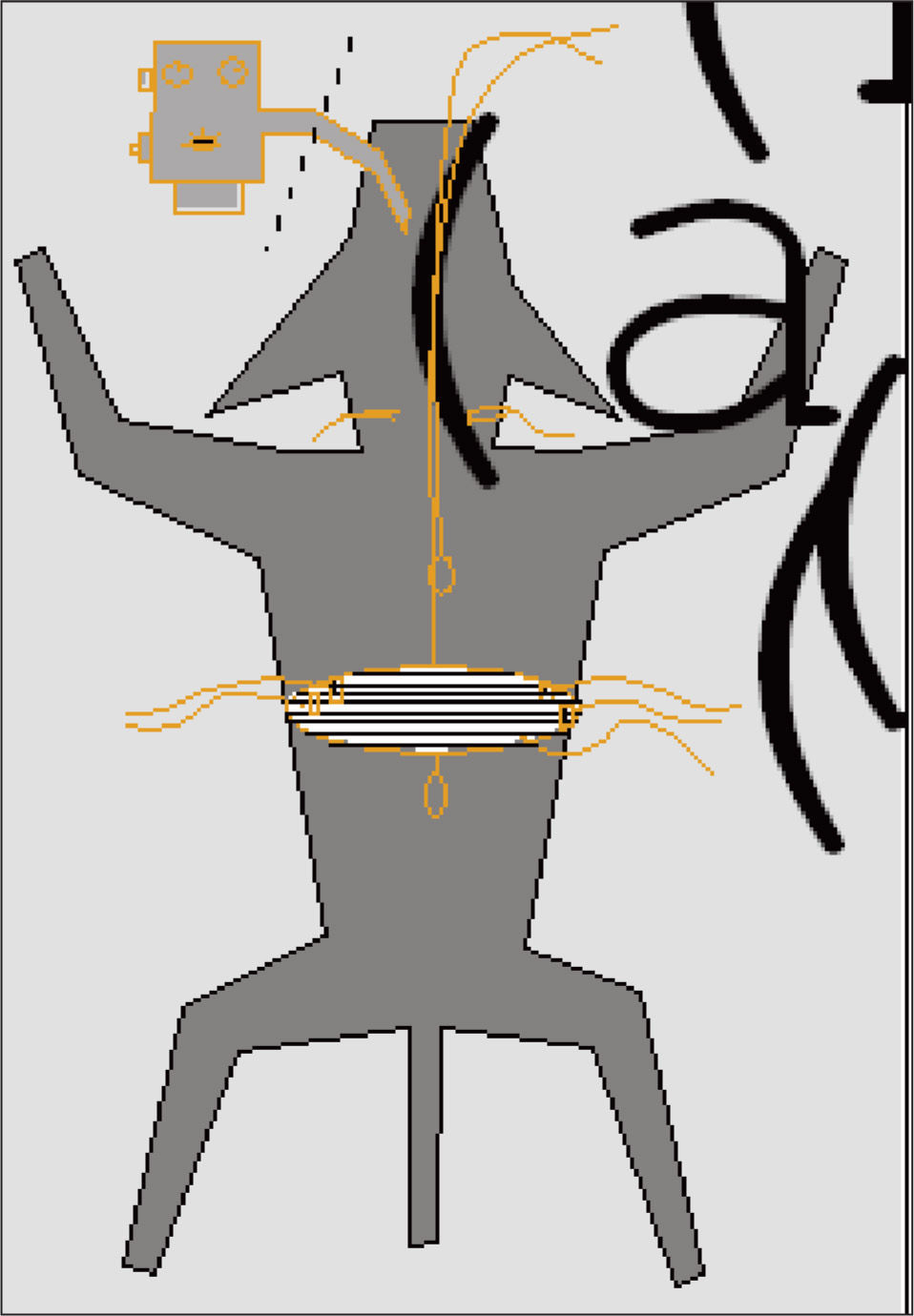
MétodosModelo animal (fig. 1)Se anestesió (25mg/kg por vía intravenosa de pentobarbital sódico, seguido de anestesia inhalada con halotano) a 6 perros mestizos, con un peso medio ± desviación estándar de 26 ± 7kg, y tras la colocación de sondas-balón esofágica y gástrica se les realizó una laparotomía alta para la colocación de cristales piezoeléctricos (sonomicrometría) y electrodos de superficie en el diafragma costal. En todo momento se les mantuvo en decúbito supino, calientes mediante lámparas quirúrgicas (temperatura rectal de 37°C) y ventilados mecánicamente (20-25ml/kg, 14 ciclos/min; Mark-8 Respirator, Bird Corporation, Palm Springs, CA, EE.UU.). Tras el cierre de la laparotomía en 2 planos se interrumpió la anestesia inhalada y los perros respiraron espontáneamente a través del tubo endotraqueal. En esta fase se mantuvo a los animales con dosis bajas del mencionado pentobarbital, de forma que no hubiese reflejo corneal. Con posterioridad se les aplicó anestesia espinal (subaracnoidea), para eliminar la contribución de los músculos intercostales al esfuerzo inspiratorio. Los procedimientos utilizados en el protocolo fueron aprobados por el Comité Ético de Investigación Animal del centro (Hopital de Notre Dame), y en todo momento se procuró reducir al mínimo las molestias y el número de animales. El tamaño muestral se calculó a partir de estudios anteriores12,14.
Estimulación eléctrica. Se colocaron 2 electrodos de plata alrededor de los nervios frénicos, (altura T2-T3), aislados de los tejidos circundantes, utilizándose un estimulador eléctrico (S-48, Grass Instruments, Quincy, MA, EE.UU.) para la emisión de los impulsos excitadores. La estimulación se realizó hasta obtener una respuesta supramáxima. Es decir, mediante impulsos de intensidad (voltaje) progresiva se obtuvo la máxima presión gástrica -aquella en que aumentos posteriores mantenían un valor estable (plateau o meseta) de presión—. La intensidad así obtenida se incrementó entonces un 25% y todos los estímulos se realizaron con dicha intensidad (aproximadamente 10V, 30Hz, 0,25ms), siempre al final de la espiración (control mediante la curva de presión esofágica) y contra la vía aérea ocluida puntualmente. En cada situación se expidieron al menos 3 estímulos. Todas las situaciones se repitieron en 2 ocasiones, separadas 15min, para minimizar el número de animales del estudio, según recomendación del comité ético local.
Respuesta del diafragma. Las sondas-balón antes mencionadas, conectadas a sendos transductores de presión (Validyne MP45-18, Northridge, CA, EE.UU.), permitieron obtener los valores de presión gástrica (Pga) y esofágica (Pes). La presión transdiafragmática (Pdi) se calculó automáticamente a partir de la diferencia aritmética entre ambas –Pga (en general positiva) – Pes (en general negativa)— (fig. 2)15. Se estableció, no obstante, la Pga inducida por estimulación frénica bilateral (Pgatw) como la variable principal de resultado, ya que la Pes inducida del mismo modo (Pestw, y por ende la Pditw) puede verse afectada directamente por la estimulación16. Además se determinaron la longitud inicial de cada hemidiafragma, su acortamiento y posterior alargamiento (contracción y relajación, respectivamente) por sonomicrometría. Para ello se colocaron durante la laparotomía un par de cristales piezoeléctricos en cada hemidiafragma costal, sobre las propias fibras musculares y separados entre sí 10-13mm. Estos cristales se conectaron a un analizador (Triton Technology INC, San Diego, CA, EE.UU.). La longitud del diafragma en un momento dado se expresa como porcentaje de la longitud inicial del músculo en situación de reposo (IFRC, o longitud a capacidad residual funcional). La velocidad contráctil se expresa como porcentaje de la distancia recorrida (en relación con la longitud en reposo) por segundo (IFRC%/s).
Además, se recogió la respuesta electromiográfica mediante 2 electrodos de cobre, recubiertos con una pieza de poliéster, colocados a 20mm de distancia en el hemidiafragma izquierdo y suturados a la fascia por vía abdominal, con un gel conductor colocado entre el electrodo y el propio músculo. Los datos obtenidos se recogieron en un polígrafo analógico de 8 canales (HP 7758 B, Hewlett-Packard, Palo Alto CA, EE.UU.) y posteriormente se digitalizaron (DT2821, Data Translation, MA, EE.UU.) y analizaron (programa Anadat-Labdat, Rht-Info, Montreal, PQ, Canadá).
Registros adicionales. Con el fin de asegurar el estado estable de los animales a lo largo del estudio, en todo momento se controlaron la saturación de oxígeno (sensor lingual), la presión parcial de anhídrido carbónico al final de la espiración y la presión arterial. Estos datos se recogieron en el polígrafo analógico antes mencionado. En 3 animales se obtuvieron además muestras arteriales, con determinación seriada, entre otras, de la presión parcial de oxígeno, anhídrido carbónico y pH.
Anestesia subaracnoidea. Tras la realización de las diferentes maniobras con contribución espontánea de los diferentes músculos inspiratorios, se procedió a la anestesia espinal con el fin de minimizar la contribución de los intercostales. Para ello, con la cabeza del animal ligeramente elevada, se inyectó una solución de tetracaína (1ml; Sigma-Aldrich, St. Louis, MO, EE.UU.) en el espacio subaracnoideo, en la región lumbar. Este procedimiento había demostrado su efectividad para hacer desaparecer la señal electromiográfica de los intercostales en otro estudio realizado en paralelo en el mismo laboratorio14. A los 30min del procedimiento anestésico se procedió nuevamente a la evaluación de la actividad del diafragma en las diferentes situaciones.
Oclusiones. Tras obtener el punto de respuesta basal, se procedió a la realización de series de oclusiones de la vía aérea, permitiendo los esfuerzos inspiratorios espontáneos del animal. Se efectuaron así series cortas (de 5 esfuerzos), medianas (de 10 esfuerzos) y largas (de 20 esfuerzos), permitiendo siempre que el animal respirase tras ellos con la vía aérea nuevamente permeable durante al menos 4 ciclos. La hipótesis es que los esfuerzos ventilatorios ocluidos se acercaron al máximo a partir de la tercera o cuarta oclusión (meseta en la respuesta), y que se realizaron con contribución espontánea de los diferentes músculos inspiratorios antes de la anestesia espinal, y ya sin la aportación de los intercostales tras dicha anestesia. Después de cada serie de esfuerzos se determinó de nuevo la respuesta del diafragma ante la estimulación eléctrica.
Protocolo de potenciaciónSe procedió a la estimulación diafragmática bilateral inmediatamente después de las series corta, mediana y larga (en este orden, para minimizar el efecto fatiga acumulativo), separadas al menos 30min una de otra, antes y después de la administración de la anestesia espinal. Como ya se ha dicho, en cada situación se expidieron al menos 3 estímulos y se realizó un duplicado en cada una de ellas.
Análisis estadísticoTodas las mediciones se expresan como media ± desviación estándar. La comparación de cada variable en las diferentes situaciones se efectuó mediante un análisis de la variancia para medidas repetidas, mientras que el grado de correlación entre variables cuantitativas se estimó mediante el coeficiente de Spearman. La significación se estableció en un valor de p ≤ 0,05 en todos los casos.
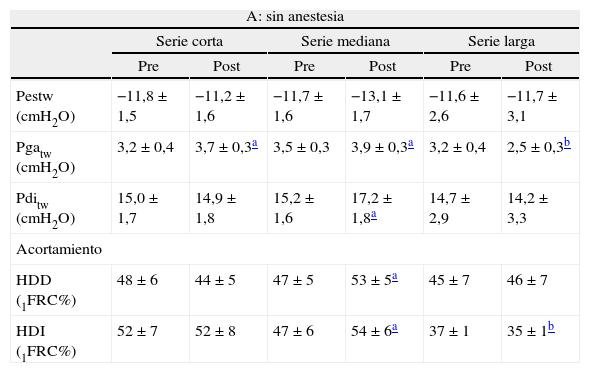
ResultadosEn la tabla II se muestran los valores basales de las variables principales del estudio, así como los obtenidos tras las diferentes series de maniobras oclusivas. Se exponen los resultados tanto en ausencia de anestesia espinal (todos los músculos respiratorios en funcionamiento) como tras la administración de ésta (abolición de la contribución de los intercostales a la ventilación).
Presiones y acortamientos musculares obtenidos por estimulación frénica bilateral supramáxima, antes y después de las diferentes series de esfuerzos oclusivos, sin (A) y con (B) anestesia espinal
| A: sin anestesia | ||||||
| Serie corta | Serie mediana | Serie larga | ||||
| Pre | Post | Pre | Post | Pre | Post | |
| Pestw (cmH2O) | −11,8 ± 1,5 | −11,2 ± 1,6 | −11,7 ± 1,6 | −13,1 ± 1,7 | −11,6 ± 2,6 | −11,7 ± 3,1 |
| Pgatw (cmH2O) | 3,2 ± 0,4 | 3,7 ± 0,3a | 3,5 ± 0,3 | 3,9 ± 0,3a | 3,2 ± 0,4 | 2,5 ± 0,3b |
| Pditw (cmH2O) | 15,0 ± 1,7 | 14,9 ± 1,8 | 15,2 ± 1,6 | 17,2 ± 1,8a | 14,7 ± 2,9 | 14,2 ± 3,3 |
| Acortamiento | ||||||
| HDD (1FRC%) | 48 ± 6 | 44 ± 5 | 47 ± 5 | 53 ± 5a | 45 ± 7 | 46 ± 7 |
| HDI (1FRC%) | 52 ± 7 | 52 ± 8 | 47 ± 6 | 54 ± 6a | 37 ± 1 | 35 ± 1b |
| B: con anestesia | ||||||
| Serie corta | Serie mediana | Serie larga | ||||
| Pre | Post | Pre | Post | Pre | Post | |
| Pestw (cmH2O) | −11,2 ± 1,5 | −10,6 ± 1,3 | −11,4 ± 1,4 | −12,6 ± 1,4 | −12,2 ± 1,5 | −12,2 ± 1,7 |
| Pgatw (cmH2O) | 3,6 ± 0,3 | 4,0 ± 0,4a | 3,8 ± 0,2 | 4,6 ± 0,2b | 4,0 ± 0,2 | 3,6 ± 0,3b |
| Pditw (cmH2O) | 14,8 ± 1,5 | 14,6 ± 1,2 | 15,2 ± 1,3 | 17,2 ± 1,4a | 16,2 ± 1,2 | 15,8 ± 1,7 |
| Acortamiento | ||||||
| HDD (1FRC%) | 53 ± 8 | 50 ± 7 | 50 ± 7 | 56 ± 7 | 41 ± 7 | 42 ± 6 |
| HDI (1FRC%) | 38 ± 5 | 37 ± 5 | 42 ± 6 | 46 ± 7 | 43 ± 7 | 44 ± 8 |
Los valores se espresan como media ± desviación estándar. HDD: hemidiafragma derecho; HDI: hemidiafragma izquierdo; 1FRC%: porcentaje sobre la longitud inicial del músculo entre ambos cristales piezoeléctricos a capacidad funcional residual; Pditw, Pestw, Pgatw: presiones esofágica, gástrica y transdiafragmática, respectivamente, inducidas por estimulación frénica bilateral en las diferentes situaciones.
Sin anestesia espinal:
Presiones respiratorias. Los valores de Pgatw y Pditw no mostraron diferencias significativas entre las diferentes series. Sin embargo, se observó una pequeña tendencia al aumento de la Pgatw entre el valor basal que precedió a la serie corta y el que precedió a la mediana. Esta tendencia no se observó con el valor basal de la serie larga.
Acortamiento muscular. No se observaron diferencias significativas entre los valores basales del hemidiafragma derecho para las 3 series. En el izquierdo, en cambio, el valor basal fue algo inferior antes de la serie larga (p < 0,01 respecto de la corta y la mediana).
Con anestesia espinal:
Presiones respiratorias. Los valores de Pgatw basal mostraron también una tendencia al aumento entre la serie corta y las series mediana (no significativo) y larga (p < 0,05).
Acortamiento muscular. El hemidiafragma derecho mostró un menor acortamiento en el valor basal que precedió a la serie larga (p < 0,01).
Efectos de los esfuerzos oclusivos sobre la respuestaSin anestesia espinal:
Presiones respiratorias (tabla IIA). Tras las series cortas se observó un aumento significativo pero discreto de la Pgatw, que no afectó al resto de parámetros evaluados. Tras la serie mediana, la potenciación fue más clara y el aumento de la Pgatw vino acompañado de incrementos de la Pestw (cercano a la significación) y la Pditw. La serie larga motivó, en cambio, una disminución de la respuesta contráctil, con descenso en la Pgatw (sin reflejo en la Pditw como consecuencia de la estabilidad en la Pestw).
Acortamiento muscular. La serie corta no motivó cambios de interés en la contractilidad. Sin embargo, se observaron mayores acortamientos en ambos hemidiafragmas tras la serie mediana. La velocidad de contracción también se enlenteció ligeramente con esta serie (3,2 ± 0,4 a 2,9 ± 0,2 para el costal izquierdo, y 3,1 ± 0,3 a 2,8 ± 0,3 IFRC%/s para el costal derecho; p < 0,05 en ambos casos). La serie larga motivó un menor acortamiento en el diafragma izquierdo. Además, la señal electromiográfica de ese diafragma indicaba cierto grado de fatiga (incremento en la raíz de la media al cuadrado de la amplitud de la señal del 150%). La velocidad de contracción, a su vez, mantuvo una ligera tendencia a disminuir (3,2 ± 0,3 a 3,0 ± 0,2 IFRC%/s, no significativo).
Con anestesia espinal:
Presiones respiratorias (tabla IIB). De forma similar a lo observado antes de la anestesia, las series corta y mediana motivaron un incremento aislado de la Pgatw (fig. 3). Además, éste se acompañó del aumento de la Pestw (cercano al límite de la significación) y de la Pditw tras la serie mediana. La serie larga, por el contrario, volvió a mostrar un descenso significativo en la Pgatw, sin repercusiones en las restantes presiones (fig. 4).
Evolución de las presiones respiratorias (gástrica o Pgatw, esofágica o Pestw, y transdiafragmática o Pditw, calculada a partir de las 2 señales anteriores) y acortamientos musculares inducidos por estimulación twitch supramáxima, antes y tras la serie mediana de esfuerzos inspiratorios isométricos con la vía aérea ocluida; en este caso, tras anestesia subaracnoidea. Para detalles, véase texto. Sm HD: sonomicrometría hemidiafragma derecho; Sm HI: sonomicrometría hemidiafragma izquierdo.
Representación gráfica de las presiones respiratorias (gástrica o Pgatw, esofágica o Pestw, y transdiafragmática o Pditw, calculada a partir de las 2 señales anteriores) y ciclo de contracciónrelajación diafragmática inducidos por estimulación twitch supramáxima, antes y tras la serie larga de esfuerzos inspiratorios isométricos con la vía aérea ocluida, también tras la administración de anestesia subaracnoidea. Sm HD: sonomicrometría hemidiafragma derecho; Sm HI: sonomicrometría hemidiafragma izquierdo.
Acortamiento muscular. La contracción de ambos hemidiafragmas fue algo superior a la basal, pero no alcanzó la significación (al límite para el derecho) tras ninguna de las series. En cambio, la velocidad de acortamiento muscular se volvió más lenta (3,0 ± 0,2 a 2,8 ± 0,2 IFRC%/s para el hemidiafragma izquierdo, y 3,1 ± 0,2 a 2,9 ± 0,2 IFRC%/s para el derecho; p < 0,05 en ambos) tras la serie mediana, sin cambios en las otras 2.
No se observaron correlaciones de interés entre las diferentes variables, manteniéndose por lo demás unos gases respiratorios estables y dentro de la normalidad a lo largo del estudio.
DiscusiónEste trabajo, realizado en un modelo con animales bajo sedación, confirma que la fuerza del diafragma se modifica en función de los esfuerzos ventilatorios precedentes. Además, demuestra por sonomicrometría que este cambio de presión se acompaña de modificaciones de la contracción muscular, tanto en magnitud como en velocidad. El resultado final puede ser una mayor o menor respuesta del músculo ante el estímulo, según predominen los fenómenos de potenciación o de fatiga.
La determinación de la fuerza máxima del diafragma o de la globalidad de los músculos respiratorios, ya sea mediante maniobras voluntarias o por estimulación, es de uso creciente en la clínica diaria. Sin embargo, a menudo se subestima la influencia de algunos factores cotidianos en la respuesta obtenida. Entre estos factores destacan el volumen pulmonar a que se obtiene la respuesta, la posible presencia de contracciones vigorosas antes de la determinación considerada válida y los cambios en la impedancia abdominal16-18. En el presente trabajo hemos investigado la influencia de la historia contráctil reciente del diafragma en su respuesta máxima. Hemos utilizado la estimulación eléctrica bilateral de los nervios frénicos, un método útil en la evaluación funcional del músculo, que se emplea tanto en la clínica como en trabajos experimentales19,20. Sus principales ventajas radican en que se tiene la certeza de estimular todo el diafragma y en que no se precisa la colaboración del sujeto o animal de experimentación. A la determinación de presiones, presente ya en trabajos anteriores9,16, hemos añadido la sonomicrometría, que permite valorar también las características de la propia contracción. Además hemos utilizado 3 patrones de actividad previa, para valorar si ese factor determina la modificación de la respuesta y en qué medida.
La potenciación, respuesta en escalera o, como más recientemente se prefiere denominar, la potenciación postactivación, es un fenómeno por el cual la actividad previa del músculo condiciona una mayor respuesta contráctil en las maniobras máximas16,21. La intensidad de la respuesta aumenta de forma progresiva hasta llegar a una meseta de potenciación máxima, al tiempo que se enlentecen la contracción y relajación22. Este fenómeno se produce tanto si las contracciones precedentes son voluntarias como si se inducen instrumentalmente22, y es más intenso tras contracciones isométricas que dinámicas23. Es más potente en varones que en mujeres, disminuye con la edad y aumenta con el entrenamiento de fuerza23. Se describió en músculos de las extremidades, pero también se ha observado en el diafragma9,18. La intensidad de la potenciación puede llegar a ser muy importante (hasta un 50-60%) y persistir desde unos 10s después de finalizar las contracciones previas hasta unos 5-20min más tarde9. Algunos autores sostienen que depende fundamentalmente de la intensidad de las contracciones precedentes9. La potenciación se ha atribuido al retorno lento del calcio a las cisternas del retículo sarcoplásmico, tras su liberación con el estímulo. Además, en el caso del diafragma se cree que existe un factor particular para este músculo: la resistencia progresivamente menor de la caja torácica a la deformación tras esfuerzos ventilatorios repetidos18.
No debe confundirse la potenciación postactivación con la llamada “facilitación”, que es un aumento de la respuesta muscular si la estimulación se produce cuando ya se ha iniciado una contracción voluntaria24. En este caso, se cree que lo que sucede es que el calcio residual, que no se había liberado en la primera parte de la contracción, lo hace al recibir un segundo impulso, con mayor liberación de neurotransmisores (acetilcolina fundamentalmente)25. Sin embargo, la respuesta específica al estímulo secundario es menor que la del primario. La razón radica en que la estimulación solamente permite reclutar algunas unidades motoras adicionales19. Como ocurre con la potenciación, la facilitación también se ha observado en el diafragma24.
La fatiga, a su vez, es un fenómeno por el cual el músculo pierde efectividad contráctil durante un determinado período. La fatiga periférica, o del propio músculo, se clasifica según disminuya su respuesta ante estimulación de alta (50-100Hz) o baja frecuencia (530Hz)26, siendo la segunda la que aparece por actividad contráctil espontánea y de intensidad fisiológica27. Se asocia a la depleción de elementos energéticos musculares, como los fosfatos de alta energía y el glucógeno, y/o a la aparición de microlesión muscular. Su recuperación es, por tanto, relativamente lenta. Aunque el fenómeno de fatiga es común a los diferentes músculos del organismo, en el diafragma presenta características metabólicas especiales, ya que su contracción es muy dependiente del calcio extracelular28. Hoy se cree que la actividad intensa y repetida sería capaz de deplecionar el calcio disponible en el retículo sarcoplásmico de las fibras29. Por otra parte, se ha observado una disminución de la respuesta del diafragma a la estimulación tras un período de contracciones intensas al respirar contra resistencias respiratorias30, lo que se relacionaría con la aparición de fatiga aguda. La fatiga del diafragma, sobre todo la de baja frecuencia, puede persistir entre 30min y 1h tras la finalización del estímulo30. Es decir, la potenciación desaparecería con mayor rapidez que la fatiga9, aunque ambos fenómenos pueden coexistir31,32.
Cabe destacar que en el presente trabajo no sólo se han documentado las presiones, sino también el grado de acortamiento muscular, que no se había contemplado en estudios precedentes. Por otra parte, en nuestro modelo las diferentes series no han tenido por objeto aumentar únicamente el número de esfuerzos, sino sobre todo conseguir mayores presiones33. En las series cortas, la potenciación es discreta y únicamente evidenciable en la Pgatw, mientras que en la serie mediana se objetiva también en la tendencia de la Pestw y en el aumento de la Pditw, así como en el mayor y más lento acortamiento del músculo. Tras la anestesia subaracnoidea, este fenómeno de potenciación se hace más evidente (aunque siempre con una magnitud moderada). Este hecho podría guardar relación con un mayor esfuerzo precedente por parte del diafragma, al que se ha retirado el auxilio de los músculos intercostales. En un trabajo precedente, una serie corta (similar a la nuestra) no fue capaz de producir potenciación21, probablemente por la baja intensidad del estímulo allí alcanzado.
En cuanto a las series largas, las Pgatw obtenidas muestran una menor respuesta muscular, tanto sin anestesia subaracnoidea como con ella. Creemos que en ambas series coexiste cierto grado de fatiga con la potenciación9,21,34,35. Desde un punto de vista mecánico, las presiones generadas por los animales al final de la serie larga eran inferiores a las iniciales, lo que, unido a los cambios en la señal electromiográfica, ya apunta a esa posibilidad. Es conocido que la fatiga disminuye la respuesta del diafragma ante la estimulación twitch30, por lo que la existencia de este fenómeno, coincidente o no con cierto grado de potenciación, podría expresarse tanto en ligeros aumentos como en estabilidad o incluso descensos de la respuesta contráctil. El resultado final dependería del peso relativo de cada factor en un momento determinado. En nuestro caso, la combinación de factores habría tenido finalmente como resultado una discreta disminución de la Pgatw, con escasa repercusión efectiva en otras presiones o en el acortamiento muscular.
Trabajos precedentes han subrayado la importancia de obtener unas presiones respiratorias máximas que sean fiables tanto en personas sanas como en pacientes. Para algunos autores, la obtención de la presión inspiratoria estática máxima en boca (PIM) tiene una reproducibilidad aceptable36,37 y además carecería de un efecto aprendizaje relevante38, al contrario que la maniobra de inhalación forzada39, que requeriría al menos 6 intentos previos hasta la obtención de la que pueda considerarse máxima38. Sin embargo, para otros como Fiz et al7, la obtención de un valor máximo y reproducible de PIM requiere como mínimo 9 determinaciones, cuando menos en pacientes con enfermedad pulmonar obstructiva crónica, ya que reproducibilidad no necesariamente implica validez del valor máximo39. El problema que entraña la necesidad de repetir tantas maniobras puede atenuarse con maniobras previas de menor intensidad8, aunque eso probablemente implique que la mejoría pueda deberse a la potenciación. Por otra parte, los mismos autores40 demostraron la aparición de fatiga inspiratoria relativamente duradera (30min), con descenso de la PIM, tras respirar contra resistencias aumentadas. Respecto de las presiones máximas inducidas por estimulación en seres humanos, suele aceptarse que su reproducibilidad es similar a la de la maniobra de inhalación forzada (sniff), y suficiente para propósitos clínicos6,37.
Las observaciones del presente trabajo tienen diversas implicaciones. Aunque no cuestiona las técnicas utilizadas habitualmente para determinar las presiones respiratorias máximas, supone una llamada de atención sobre las condiciones en que deben medirse; en concreto, sobre la actividad previa de los músculos respiratorios, ya que ésta puede determinar el incremento o la disminución de la respuesta contráctil. En otras palabras, en primer lugar hay que tener en cuenta la actividad espontánea del músculo y dudar de la veracidad de determinaciones realizadas en situación de inestabilidad clínica, donde potenciación y fatiga pueden existir aisladamente o combinarse. La coexistencia de ambos fenómenos puede estar presente; por ejemplo, en pacientes en quienes se esté valorando la pertinencia de la desconexión de la ventilación mecánica, tanto en los incapaces de colaborar, en los que se decida realizar esfuerzos repetidos contra la vía aérea ocluida para conocer su fuerza inspiratoria máxima, como en pacientes en los que ha habido un esfuerzo ventilatorio previo importante (p. ej., por prueba con tubo en T). En el primero de los casos, la dificultad radicará en establecer el número adecuado de esfuerzos oclusivos para obtener una respuesta válida sin potenciación ni fatiga; en el segundo, en la imposibilidad de conocer cuál de los 2 factores predomina en un momento dado, lo que dificulta su comparación con otras determinaciones en el mismo sujeto.
Por otra parte, está la situación de determinación funcional de las presiones respiratorias máximas en pacientes con enfermedad estable. Aquí deberemos considerar el esfuerzo que suponen las maniobras previas a la considerada válida, ya que hemos visto que existe cierta potenciación incluso tras pocos esfuerzos. Si han de repetirse demasiadas maniobras para obtener un valor válido, probablemente sea preferible dejar pasar un período razonable y comenzar de nuevo.
Una posible limitación de nuestro modelo es que se ha realizado en animales laparotomizados y bajo sedación. Es improbable que, tras el cierre por planos de la incisión quirúrgica, ésta haya tenido efectos relevantes sobre los resultados. En todo caso, esta circunstancia fue idéntica en todas las situaciones y habitual en este tipo de estudios12-14,33-41. Por otra parte, se sabe que el pentobarbital puede reducir algo la actividad de los músculos respiratorios42. Sin embargo, este efecto se considera de pequeña magnitud43, no modifica la contribución relativa de los diferentes músculos respiratorios43 y es muy inferior a que inducen sus alternativas inhaladas44. Por ello, el tipo de sedación empleada en el presente estudio se ha utilizado ampliamente en los trabajos de mecánica muscular12-14,44,45. Además, se tomó la precaución de que el factor de sedación fuera estable a lo largo de todas las situaciones en que se modificó la rigidez de la pared abdominal.
A pesar de todo lo expuesto, debemos considerar que la determinación de presiones respiratorias es un método relativamente estable para un mismo individuo, tanto para las variables obtenidas mediante maniobras voluntarias como para las derivadas de la estimulación6,18,19,37. Sin embargo, aun sin dudar de su utilidad clínica, debemos tener en cuenta los factores estudiados en este trabajo (potenciación y fatiga) para una mejor valoración de los resultados.
Estudio financiado con una beca del Medical Research Council de Canadá. La estancia de J. Gea y J.B. Gáldiz en Montreal estuvo financiada parcialmente con una ayuda BAE del Fondo de Investigaciones Sanitarias (FIS) del Ministerio de Sanidad de España.