Evaluar la capacidad diagnóstica de la angiografía pulmonar con tomografía computarizada multidetector (TCMD) y mapa de yodo en el diagnóstico del tromboembolismo pulmonar (TEP), en pacientes con enfermedad por coronavirus COVID-19.
MétodosEstudio observacional retrospectivo sobre 81 pacientes consecutivos ingresados con infección respiratoria por COVID-19, a los que se realizó TCMD ante la sospecha clínica de TEP [disnea súbita, dolor torácico, hemoptisis, insuficiencia respiratoria grave (IRG) que no corrige con flujo elevado de O2] y/o elevación del D-dímero.
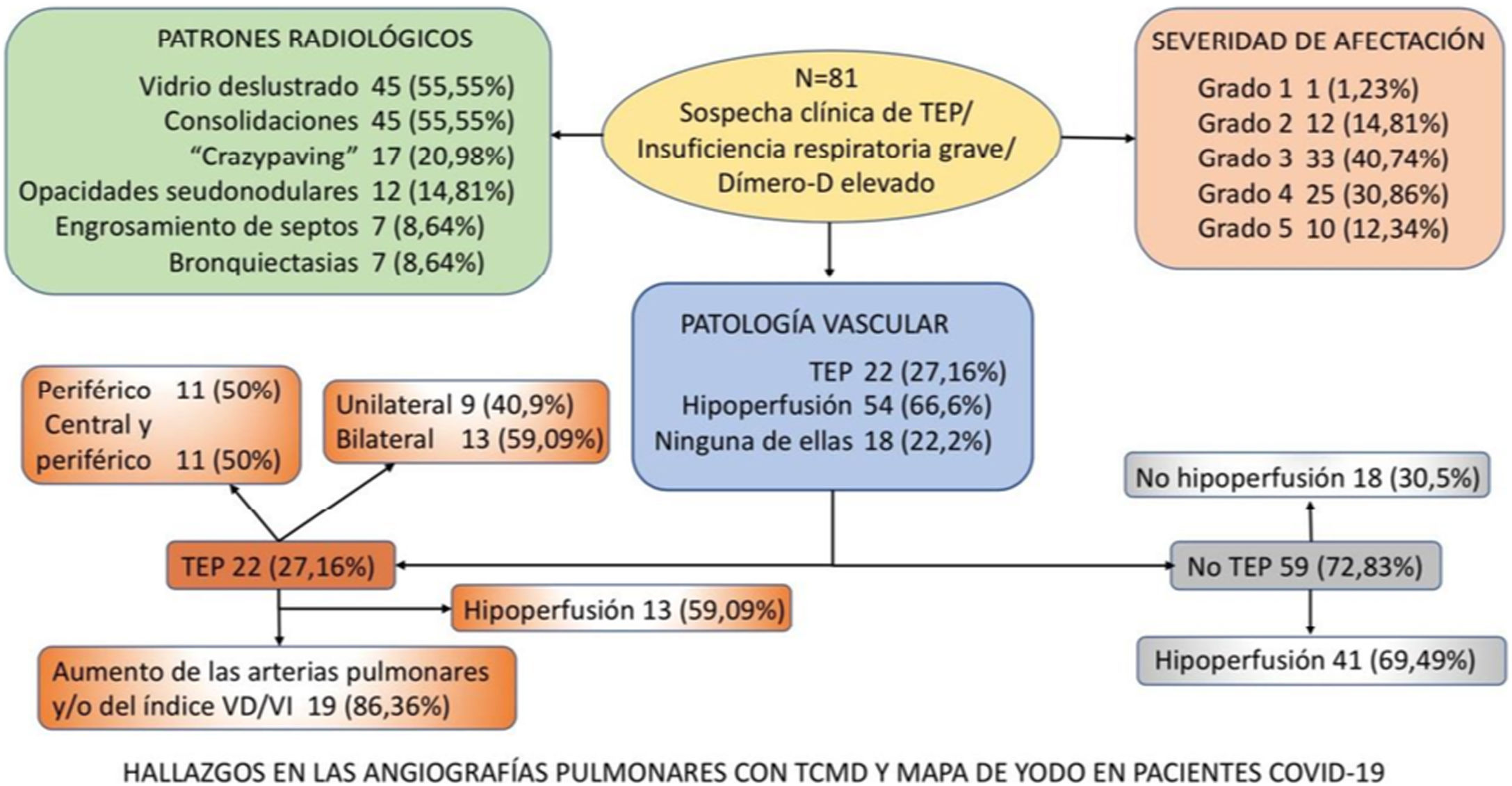
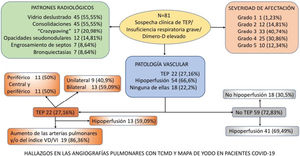
ResultadosDe los 81 pacientes estudiados, 64 (79,01%) varones, identificamos TEP agudo en 22 (27,16%), en 13 (59,09%) bilateral y en 13 (59,09%) con áreas de hipoperfusión. De los 59 (72,83%) pacientes sin TEP en 41 (69,49%) se observó hipoperfusión (en un caso atribuible a enfisema pulmonar). En 18 (22,2%) del total de pacientes no se vio ni TEP ni hipoperfusión. El patrón «crazy paving» es un factor de riesgo para desarrollar TEP (OR1,94; IC95% 0,28-13,57), así como los patrones «consolidaciones» (OR 1,44; IC95% 0,24-8,48) y «engrosamiento septos/bronquiectasias» (OR 1,47; IC95% 0,12-17,81).
Los pacientes con IRG refractaria al O2 mostraron un riesgo 6,36 veces superior para el hallazgo de hipoperfusión en el mapa de yodo.
ConclusiónLa angiografía pulmonar con TCMD y mapa de yodo, al añadir la imagen funcional a la anatómica, es capaz de demostrar, además del TEP en arterias principales, lobares y segmentarias, la presencia de hipoperfusión en vasos distales, lo cual la convierte en una herramienta de gran utilidad para la adecuada orientación diagnóstica y terapéutica de los pacientes con afectación pulmonar por COVID-19.
To evaluate the diagnostic capacity of pulmonary angiography with multidetector computed tomography (MDCT) and iodine mapping in the diagnosis of pulmonary thromboembolism (PTE) in patients with Covid-19 disease.
MethodsRetrospective observational study of 81 consecutive patients admitted with Covid-19 respiratory infection who underwent MDCT for clinical suspicion of PTE (sudden dyspnea, chest pain, hemoptysis, severe respiratory failure (SRF) not corrected with high O2 flow) and/or raised D-dimer.
ResultsOf the 81 patients studied [64 (79.01%) men], acute PTE was identified in 22 (27.16%), bilaterally in 13 (59.09%), and 13 (59,09%) showed areas of hypoperfusion. Of the 59 (72.83%) patients without PTE, hypoperfusion was observed in 41 (69.49%) (attributable in one case to pulmonary emphysema). In 18 (22.2%) of the total number of patients, neither PTE nor hypoperfusion were seen. A crazy paving pattern is a risk factor for developing PTE (OR 1.94; 95% CI 0.28-13.57), as are consolidations (OR 1.44; 95% CI 0.24-8.48) and septal thickening/bronchiectasis (OR 1.47; 95% CI 0.12-17.81).
Patients with O2-refractory SRF showed a 6.36-fold higher risk for hypoperfusion on the iodine map.
ConclusionBy adding the functional image to the anatomical image, pulmonary angiography with MDCT and iodine mapping can demonstrate not only PTE in main, lobar and segmental arteries, but also the presence of hypoperfusion in distal vessels. This makes it a highly useful tool for the accurate diagnosis and therapeutic orientation of patients with Covid-19 lung involvement.
La enfermedad por coronavirus COVID-19, surgida en Wuhan, China en diciembre del 2019 y causada por el virus SARS-CoV-2, en tres meses se ha convertido en una pandemia1,2 tal y como ha sido declarado por la Organización Mundial de la Salud el 11 de marzo de 2020.
La tomografía computarizada (TC) de tórax es de especial relevancia en el diagnóstico de la enfermedad por coronavirus, pues aunque la radiografía simple de tórax, por su bajo coste y alto rendimiento diagnóstico es la primera técnica de imagen a realizar3, la TC permite identificar alteraciones de forma más precoz, siendo más sensible4, habiéndose descrito en la literatura una sensibilidad de alrededor del 98% para detectar esta enfermedad5. Este dato es especialmente relevante en pacientes con alta sospecha (clínica y analítica) y resultados negativos de la RT-PCR (del inglés Real-Time Polymerase Chain Reaction), que se considera la prueba estándar de referencia para el diagnóstico, pero que alcanza una tasa de falsos negativos de hasta el 29% según las series6.
Además de las manifestaciones clínicas7 y radiológicas publicadas hasta la fecha8,9 en la práctica clínica se ha evidenciado una elevada tasa de enfermedad tromboembólica en probable relación con coagulopatía asociada10,11. La disfunción de las células endoteliales inducida por la infección resulta en un exceso de producción de trombina y en un bloqueo de la fibrinólisis12,13, lo que conlleva un estado de hipercoagulabilidad. Además, la hipoxia severa presente en pacientes con esta enfermedad COVID-19 también puede estimular la trombosis14. Recientemente, se ha demostrado la presencia de oclusión y microtrombosis entre los hallazgos histológicos de una resección pulmonar en un paciente COVID-19 crítico que fue sometido a un trasplante pulmonar15 y en una serie de necropsias pulmonares en pacientes COVID-1916. A pesar de que la angiografía pulmonar con tomografía computarizada multidetector (TCMD) es la técnica de imagen de elección para descartar tromboembolismo pulmonar (TEP) desde hace varias décadas17,18 pequeños defectos de repleción en las ramas arteriales distales, de pequeño calibre, pueden pasar desapercibidos. La angiografía pulmonar TCMD con mapa de yodo se ha equiparado a la gammagrafía de perfusión19, por tanto aumenta la sensibilidad para la detección de TEP19–21, siendo considerado el mapa de yodo un indicador de microtrombosis, lo cual permitiría el inicio de anticoagulación a dosis terapéuticas con la presumible reducción en la tasa de mortalidad que esta patología lleva asociada10,22,23.
Actualmente es escasa la literatura que ponga de manifiesto la relación entre la enfermedad tromboembólica y la afectación pulmonar en pacientes COVID-1924,25. En esta línea nos hemos planteado valorar la capacidad diagnóstica de la angiografía pulmonar con TCMD y mapa de yodo en pacientes COVID-19 con elevada sospecha clínica para TEP y su relación con parámetros analíticos.
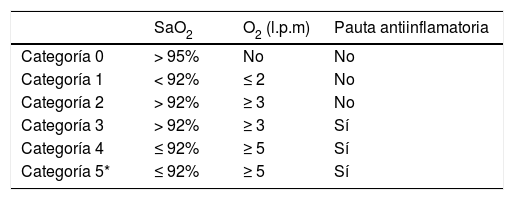
MétodosEstudio observacional retrospectivo sobre 81 pacientes consecutivos ingresados con infección respiratoria por COVID-19 en el período del 23 marzo al 8 de abril de 2020. De los 81 pacientes en 49 (60,49%) la infección por COVID-19 se confirmó mediante PCR de cepillado nasal y nasofaríngeo, en 16 (19,75%) la PCR fue negativa y en otros 16 (19,75%) esta determinación no se pudo realizar. Estos 32 (39,5%) pacientes fueron ingresados con el diagnóstico de neumonía por SARS-CoV-2 de alta probabilidad por la situación epidemiológica (familiar de COVID-19 positivo), características clínicas, analíticas y radiológicas. Los pacientes fueron categorizados según la gravedad de la insuficiencia respiratoria e inicio de tratamiento antiinflamatorio (tabla 1).
Clasificación de los pacientes según el grado de insuficiencia respiratoria y pauta antiinflamatoria
| SaO2 | O2 (l.p.m) | Pauta antiinflamatoria | |
|---|---|---|---|
| Categoría 0 | > 95% | No | No |
| Categoría 1 | < 92% | ≤ 2 | No |
| Categoría 2 | > 92% | ≥ 3 | No |
| Categoría 3 | > 92% | ≥ 3 | Sí |
| Categoría 4 | ≤ 92% | ≥ 5 | Sí |
| Categoría 5* | ≤ 92% | ≥ 5 | Sí |
A todos los pacientes se les realizó una angiografía pulmonar con TCMD y mapa de yodo ante sospecha clínica de TEP por presentar disnea súbita, dolor torácico, hemoptisis, insuficiencia respiratoria grave (IRG) que no corrige con flujo elevado de O2 (pacientes categorizados de nivel > 3) y/o elevación del D-dímero (normal < 500 ng/mL). Todos los pacientes firmaron el consentimiento informado para la realización de la TC con contraste yodado.
Las angiografías pulmonares se realizaron en un TCMD Aquilion ONE (Canon Medical Systems) con software V8.3 release SP9004G, con mapa de yodo (en escala de color) mediante técnica de sustracción avanzada. El contraste empleado fue Ultravist® 370 mg/mL (60-80 mL a 4,5 mL/s, seguido de 40 mL de suero salino) y se adquirió la angiografía con bolus tracking, colocando el ROI (region of interest) en aorta ascendente con umbral de 100 UH. La adquisición se realizó en dirección craneocaudal con 120 kV, ajuste estándar de la dosis con control de exposición automático (60-80 mA) y pitch de 0,8.
El posprocesado del mapa de yodo se realiza automáticamente en la estación de trabajo del Aquilion ONE, utilizando umbrales de atenuación entre -950 y -600 UH, quedando excluidos del análisis los tejidos con densidades situadas fuera de este rango (arterias pulmonares, atelectasias, derrames y tumores, aunque contengan yodo). Por tanto, no se puede valorar si hay o no hipoperfusión en el interior de áreas de consolidación de localización periférica, típicas de la afectación por COVID-19.
Todos los estudios fueron revisados por dos radiólogos expertos en patología pulmonar tromboembólica con más de 15 años de experiencia, que revisaron la calidad del mapa de yodo (excluyendo aquellos con artefactos o con errores en la adquisición de la angiografía). Se realizó posproceso MIP (proyección de máxima intensidad), con grosor de 10 mm y 30 mm para mejor valoración de las anomalías vasculares centrales y periféricas y reconstrucciones MPR (multiplanares), con medidas de las arterias pulmonares y del índice VD/VI en plano de cuatro cámaras.
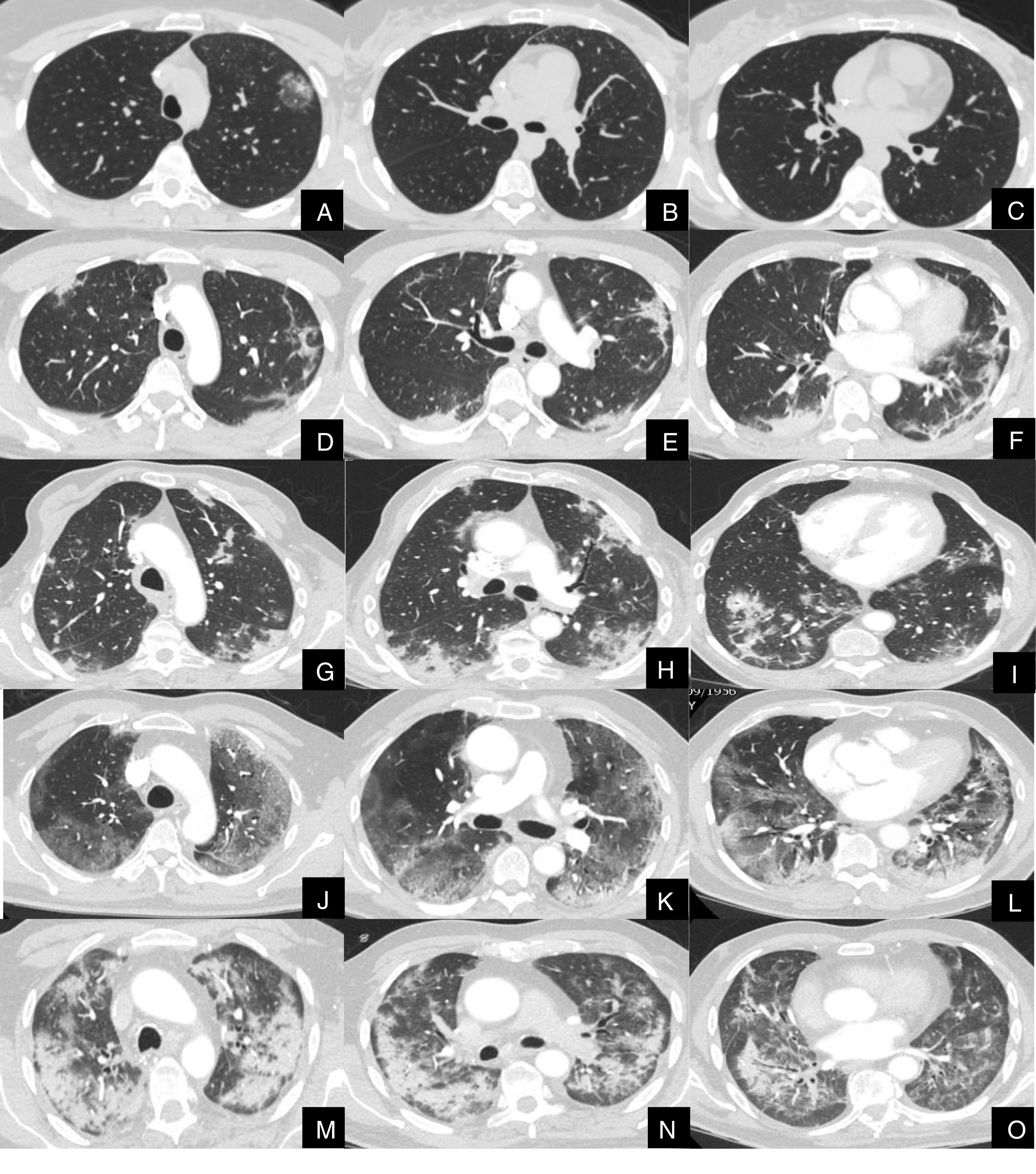
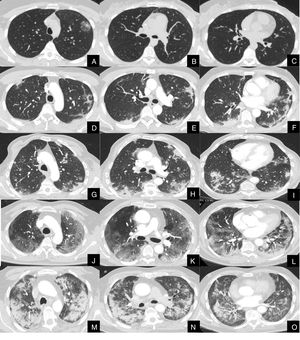
La severidad de la afectación parenquimatosa se clasificó visualmente según la extensión del parénquima afectado en 5 grados: grado 1, muy leve (1-5%), grado 2, leve (6-25%), grado 3, moderada, (26-50%), grado 4 severa (51-75%) y grado 5, muy severa (76-100%) (fig. 1).
Imágenes axiales de angioTC pulmonar en ventana de parénquima a nivel de lóbulos superiores, medios e inferiores, que muestran los diferentes grados de afectación parenquimatosa en pacientes con infección respiratoria por COVID-19.
A, B y C: grado muy leve. Opacidad redondeada en vidrio deslustrado con signo del halo invertido en lóbulo superior izquierdo.
D, E y F: grado leve. Consolidaciones parenquimatosas subpleurales de escasa cuantía y de predominio en segmentos posteriores de lóbulos inferiores.
G, H y I: grado moderado. Consolidaciones subpleurales más extensas que en el grado leve, con signo del halo invertido en lóbulo inferior derecho.
J, K y L: grado severo. Vidrio deslustrado extenso con afectación de todos los lóbulos pulmonares y consolidaciones en segmentos posteriores de ambos lóbulos inferiores.
M, N y O: grado muy severo. Extensas consolidaciones parenquimatosas de predominio periférico con afectación de casi la totalidad del parénquima pulmonar.
Los datos radiológicos y parámetros clínicos recogidos se resumen en la tabla 2.
Datos radiológicos de la angiografía pulmonar con TCMD y mapa de yodo y parámetros clínicos registrados
| Datos radiológicos | Parámetros clínicos |
|---|---|
| TEP central y/o periférico | Días desde el inicio de síntomas |
| Tamaño de arterias pulmonares | Categorización de insuficiencia respiratoria (Tabla 1) |
| Índice VD/VI | Diagnóstico clínico de TEP (disnea súbita, dolor torácico, hemoptisis) |
| Datos del posprocesado MIP | D-dímero actual y previo |
| Hipoperfusión parcheada o difusa | PCR |
| Severidad del daño pulmonar | Ferritina |
| Patrón radiológico predominante | Índice de masa corporal |
| Otros hallazgos en neumonía COVID-19 | Comorbilidad protrombótica (EPOC, cardiopatía, previa ETEV/TEP, cáncer) |
Se realizó un análisis estadístico mediante modelo de regresión logística, teniendo en cuenta variables de confusión o interacción [edad, sexo, índice de masa corporal (IMC), patología cardiaca y respiratoria], para tratar de describir y explicar la respuesta (TEP si/no, e hipoperfusión si/no) y evaluar la contribución de cada una de las variables del modelo.
Las variables incluidas para explicar la respuesta fueron: Edad, sexo, patología cardiaca, EPOC y D-dímero (< 3.000 y > 3.000). Se incluyeron datos clínicos sugestivos de TEP (disnea, insuficiencia respiratoria refractaria a O2 elevado, dolor torácico y hemoptisis), hipoperfusión en el mapa de yodo y patrones radiológicos (vidrio deslustrado, «crazy paving», consolidaciones, opacidades seudonodulares, engrosamiento de septos/bronquiectasias).
ResultadosRealizamos angiografía pulmonar con TCMD con mapa de yodo en 81 pacientes con infección respiratoria por COVID-19: 64 (79,01%) hombres y 17 (20,98%) mujeres con una media de edad de 68 años.
De las 81 angiografías 64 (79,01%) se realizaron entre el 7° y el 20° día desde el inicio de los síntomas de la infección.
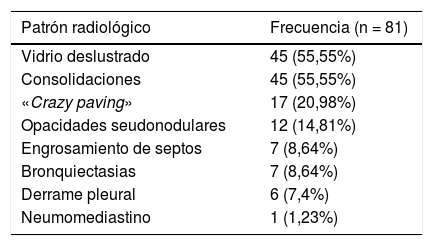
Los patrones radiológicos de afectación pulmonar predominante y su frecuencia se muestran en la tabla 3.
Patrones radiológicos de afectación predominante en TC y su frecuencia
| Patrón radiológico | Frecuencia (n = 81) |
|---|---|
| Vidrio deslustrado | 45 (55,55%) |
| Consolidaciones | 45 (55,55%) |
| «Crazy paving» | 17 (20,98%) |
| Opacidades seudonodulares | 12 (14,81%) |
| Engrosamiento de septos | 7 (8,64%) |
| Bronquiectasias | 7 (8,64%) |
| Derrame pleural | 6 (7,4%) |
| Neumomediastino | 1 (1,23%) |
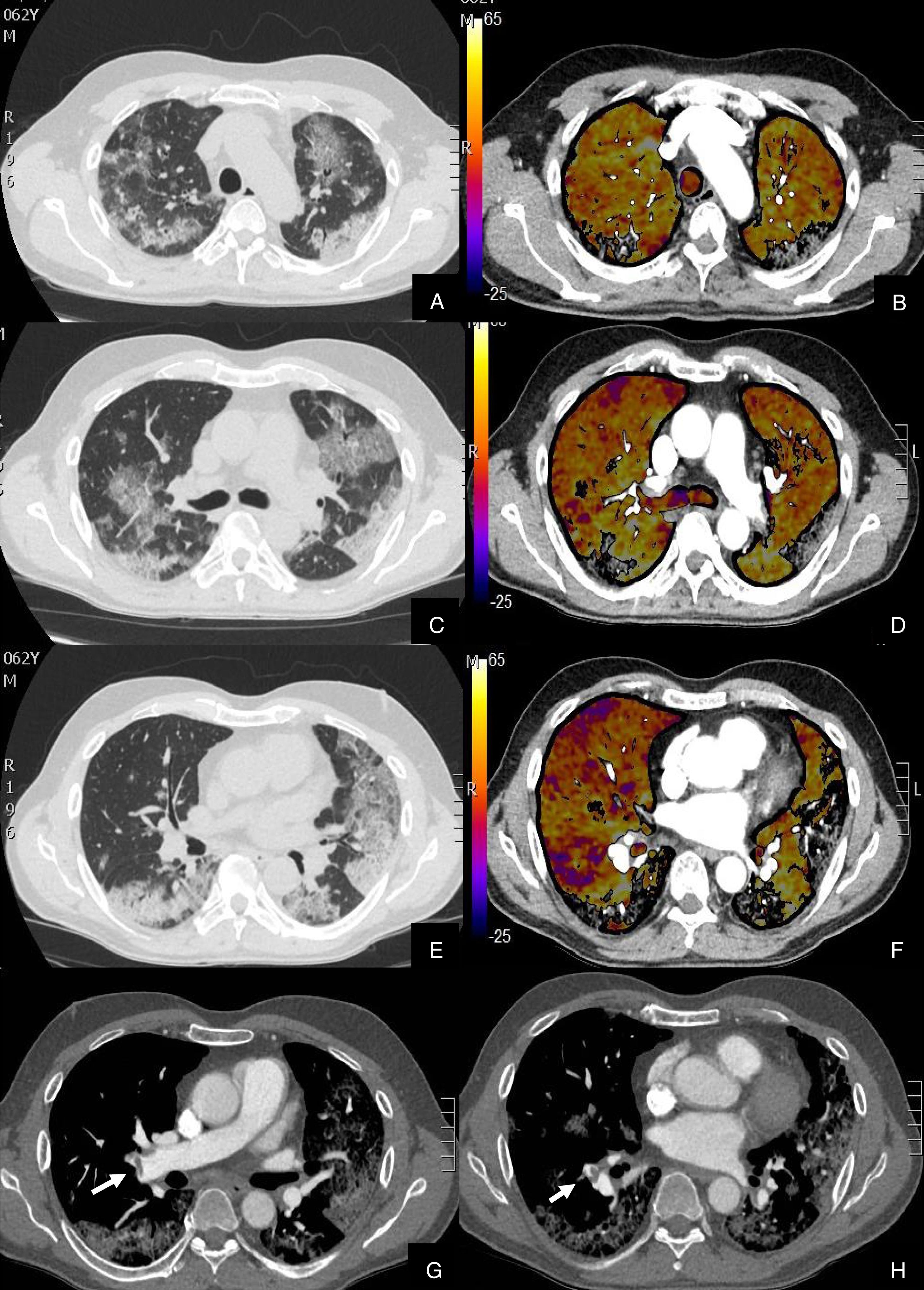
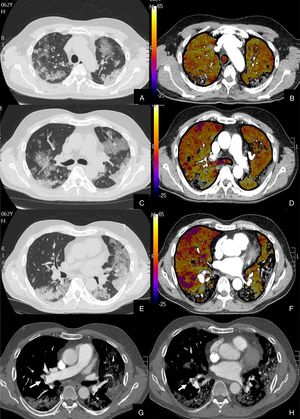
Se diagnosticó de TEP agudo a 22 (27,16%) pacientes, de los cuales, 11 (50%) presentaban TEP central y periférico y 11 (50%) sólo TEP periférico (fig. 2). El TEP fue bilateral en 13 (59,09%) pacientes. En tres (13,63%) pacientes se observó consolidación periférica triangular en el territorio de las arterias ocluidas, sugestiva de infarto pulmonar, hallazgo recientemente reportado en literatura en estos pacientes26.
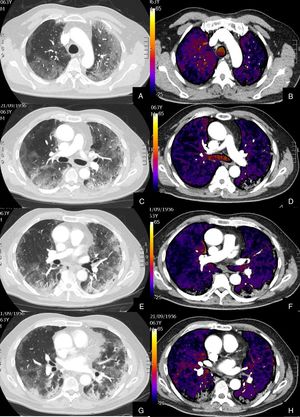
Paciente con alta sospecha de COVID-19, con D-dímero de 80.000, disnea y fiebre de 15 días de evolución.
Imágenes axiales de la angiografía pulmonar con TC y mapa de yodo en ventana de pulmón (A, C, E) desde cayado hasta lóbulos inferiores y la correlación con el mapa de yodo (B, D, F) e imágenes axiales (G y H) en ventana de mediastino.
Parénquima con extensa afectación en «crazy paving» subpleural y peribroncovascular de predominio en segmentos posteriores, con TEP agudo en arteria lobar inferior derecha y segmentarias inferiores derechas (flechas blancas) y leve hipoperfusión periférica en LID (áreas parcheadas azules) en relación con el tromboembolismo.
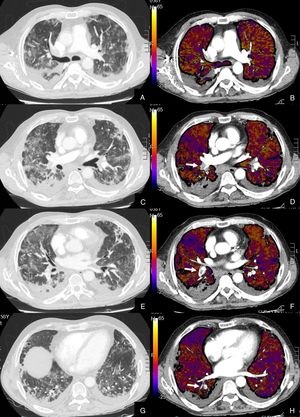
De los 22 (27,16%) pacientes con TEP, 19 (86,36%) presentaban aumento de calibre de las arterias pulmonares principales derecha e izquierda (> 22 mm) y/o aumento del índice VD/VI y 13 (59,09%) presentaban además del TEP, hipoperfusión en el mapa de yodo (fig. 3).
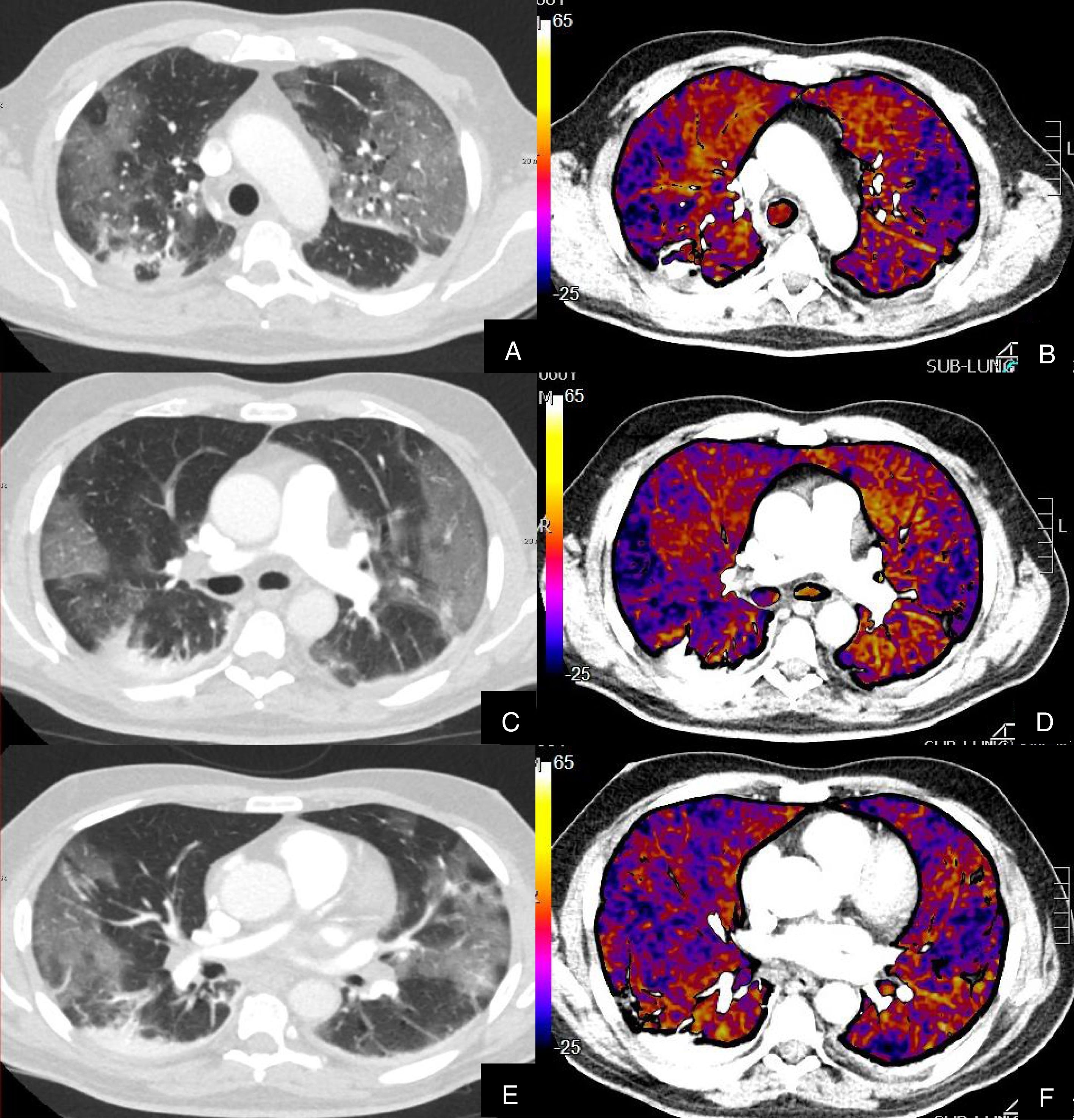
Paciente con COVID-19 con disnea, dolor torácico tipo pleurítico y elevación del D-dímero.
Imágenes axiales de una angiografía pulmonar con TC y mapa de yodo, con ventana de parénquima (A, C, E, G) desde lóbulos superiores hasta lóbulos inferiores y sus correspondientes imágenes del mapa de yodo (B, D, F, H).
Parénquima con extensa afectación en vidrio deslustrado y derrame pleural bilateral de pequeña cuantía. TEP unilateral en arteria lobar inferior derecha y segmentarias inferiores derechas (flechas). El mapa de yodo pone de manifiesto numerosas áreas de hipoperfusión (azules) parcheadas bilaterales (fundamentalmente en las zonas de pulmón afectado) por probable microtrombosis /alteraciones de la circulación en el lecho capilar.
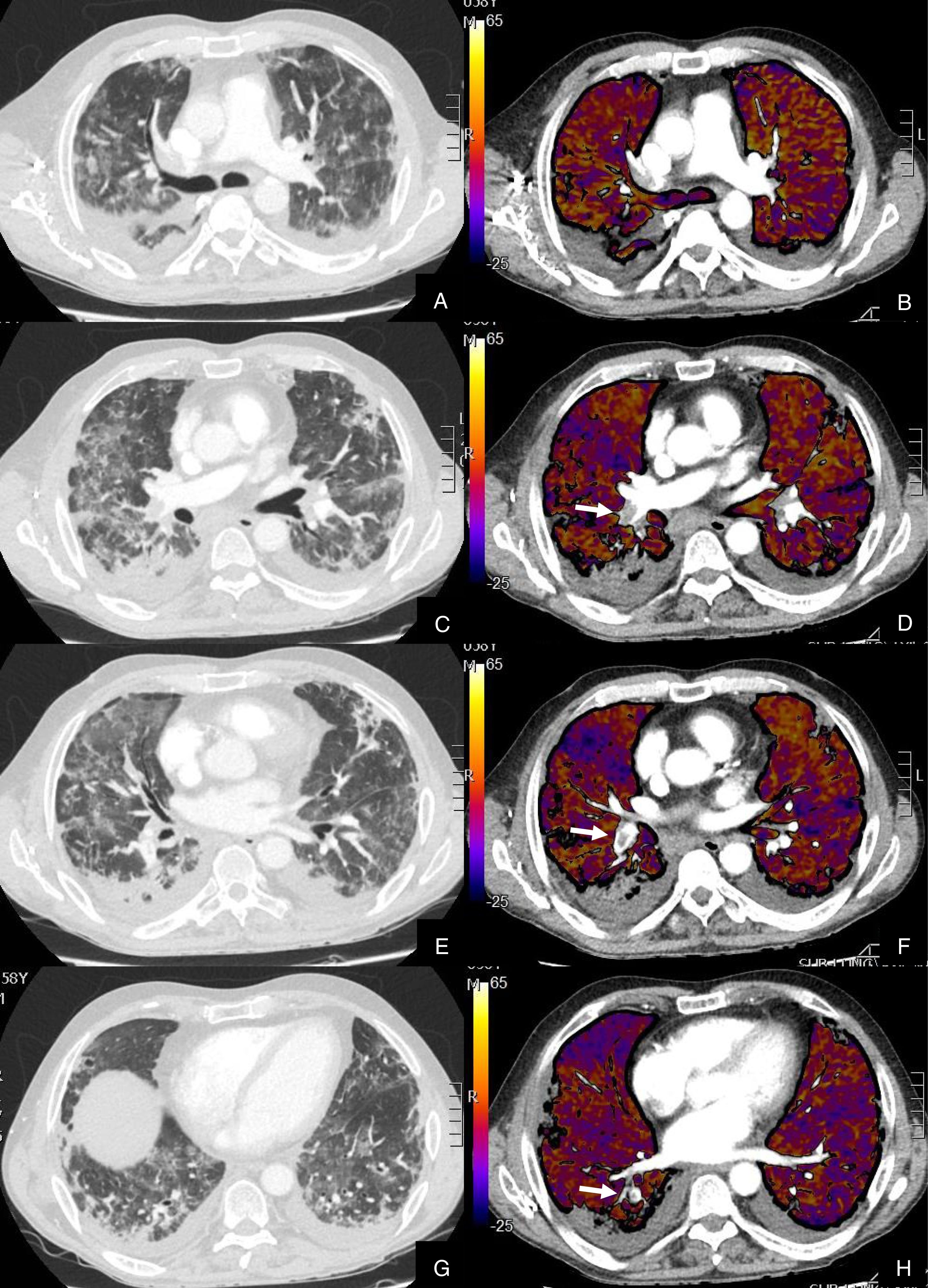
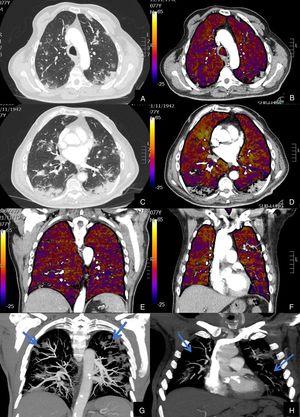
De los 59 (72,83%) pacientes sin TEP visible, 41 (69,49%) presentaban hipoperfusión en el mapa de yodo y asimetría vascular con falta de relleno de las arterias subsegmentarias distales en el posprocesado MIP grueso (fig. 4). La hipoperfusión en el mapa de yodo fue parcheada (fig. 5) o difusa (fig. 6).
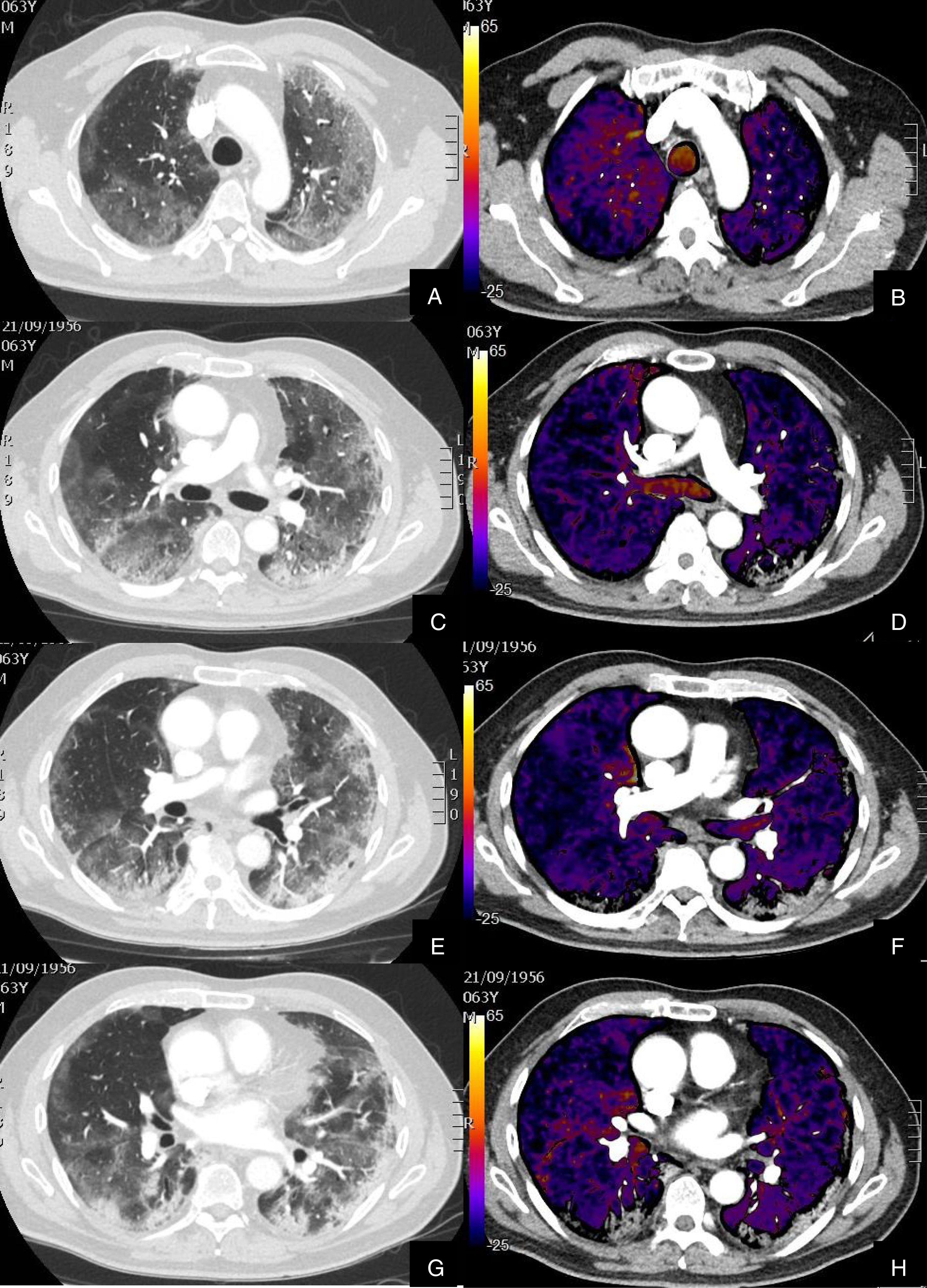
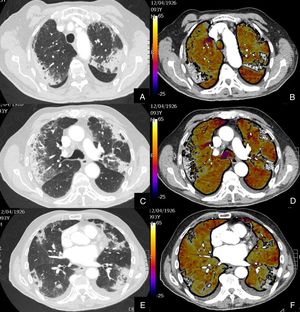
Paciente con COVID-19 con insuficiencia respiratoria grave a pesar de mejoría de parámetros inflamatorios.
Imágenes axiales de angiografía pulmonar con TC y mapa de yodo, con ventana de pulmón (A, C) en cayado y lóbulos inferiores y su correlación con las imágenes del mapa de yodo axial (B, D), coronales (E, F) y reconstrucción MIP coronal en ventana de mediastino (G, H).
Parénquima con moderada afectación parenquimatosa, con consolidaciones subpleurales parcheadas de predominio en lóbulos inferiores y extensas áreas de hipoperfusión (azules) parcheadas de predominio subpleural en el mapa de yodo, que se correlacionan con la falta de relleno del territorio vascular distal en el MIP coronal (flechas azules), sin TEP visible.
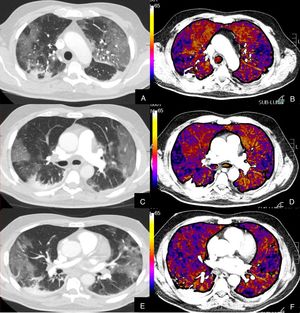
Paciente con COVID-19 que persiste con desaturación a pesar de mejoría clínica.
Imágenes axiales de la angiografía pulmonar con TC y mapa de yodo con ventana de pulmón (A, C, E) desde cayado hasta lóbulos inferiores y su correlación con las imágenes del mapa de yodo (B, D, F).
Parénquima con extensa afectación en vidrio deslustrado de predominio subpleural con consolidación de pequeño tamaño en LID, sin TEP visible, con áreas parcheadas de hipoperfusión (zonas azules) en el mapa de yodo, de predominio periférico, que coinciden con las zonas en vidrio deslustrado.
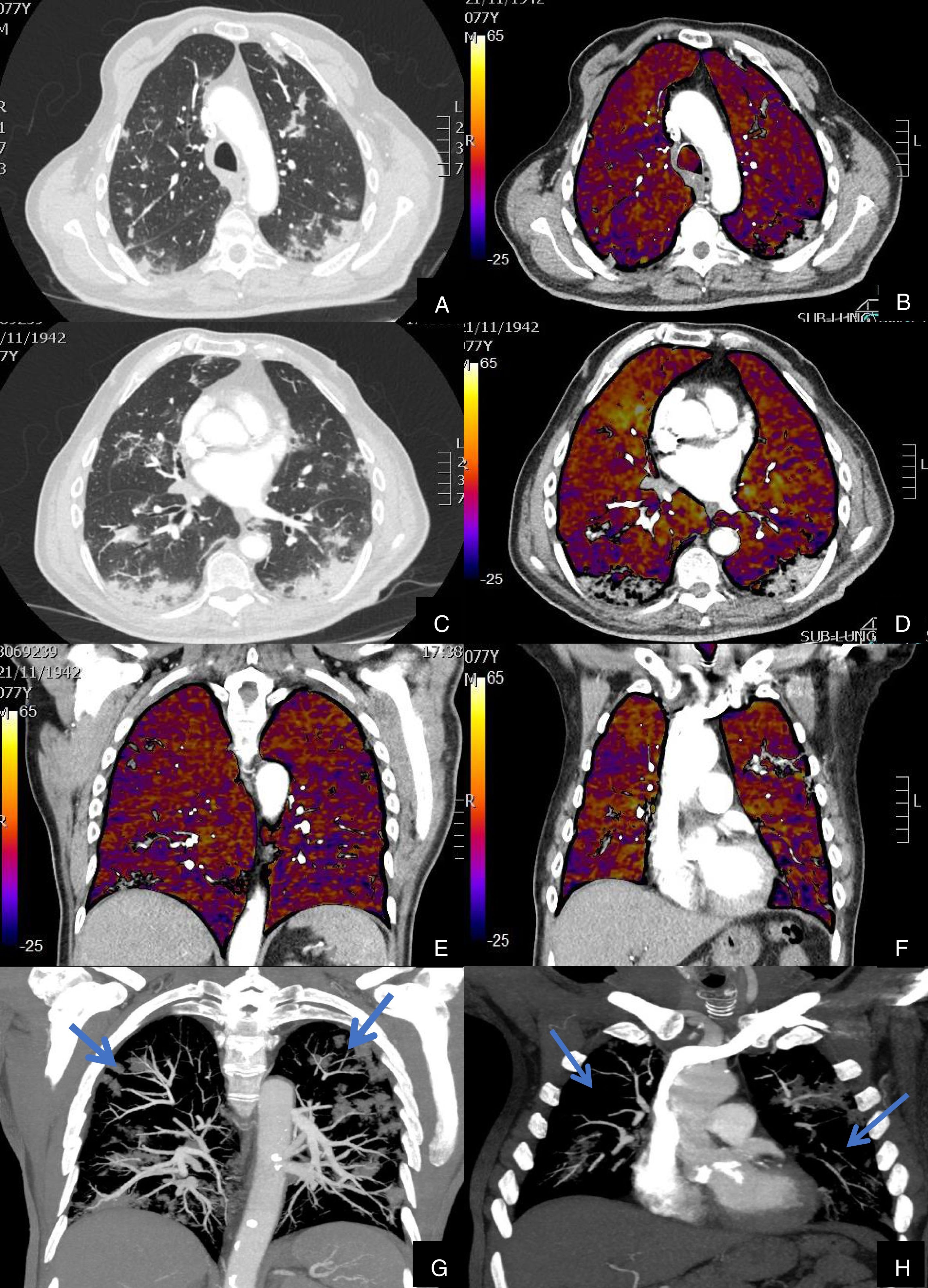
Paciente con COVID-19 que después de una semana de ingreso hospitalario persiste con desaturación que no corrige con flujo elevado de O2.
Imágenes axiales de la angiografía pulmonar con TC y mapa de yodo en ventana de parénquima (A, C, E, G) desde el cayado aórtico hasta los lóbulos inferiores y su correlación con el mapa de yodo (B, D, F, H).
Parénquima con afectación severa en vidrio deslustrado de predominio subpleural y segmentos posteriores de todo el pulmón, sin TEP visible. El mapa de yodo muestra una severa hipoperfusión difusa de todo el pulmón tanto afectado como sano (zonas azules y negras) en probable relación con microtrombosis difusa del lecho capilar.
Las áreas de hipoperfusión parcheadas se observaron en todos los casos tanto en el parénquima afectado por la infección como en el parénquima normal. En un paciente la hipoperfusión difusa visualizada en el mapa de yodo se correlacionaba con extenso enfisema panlobar y cinco (12,19%) presentaban hipoperfusión más extensa que el enfisema, considerándose en éstos la existencia de microtrombosis en el lecho capilar.
No se detectó TEP ni áreas hipoperfundidas en 18 (22,2%) pacientes (fig. 7).
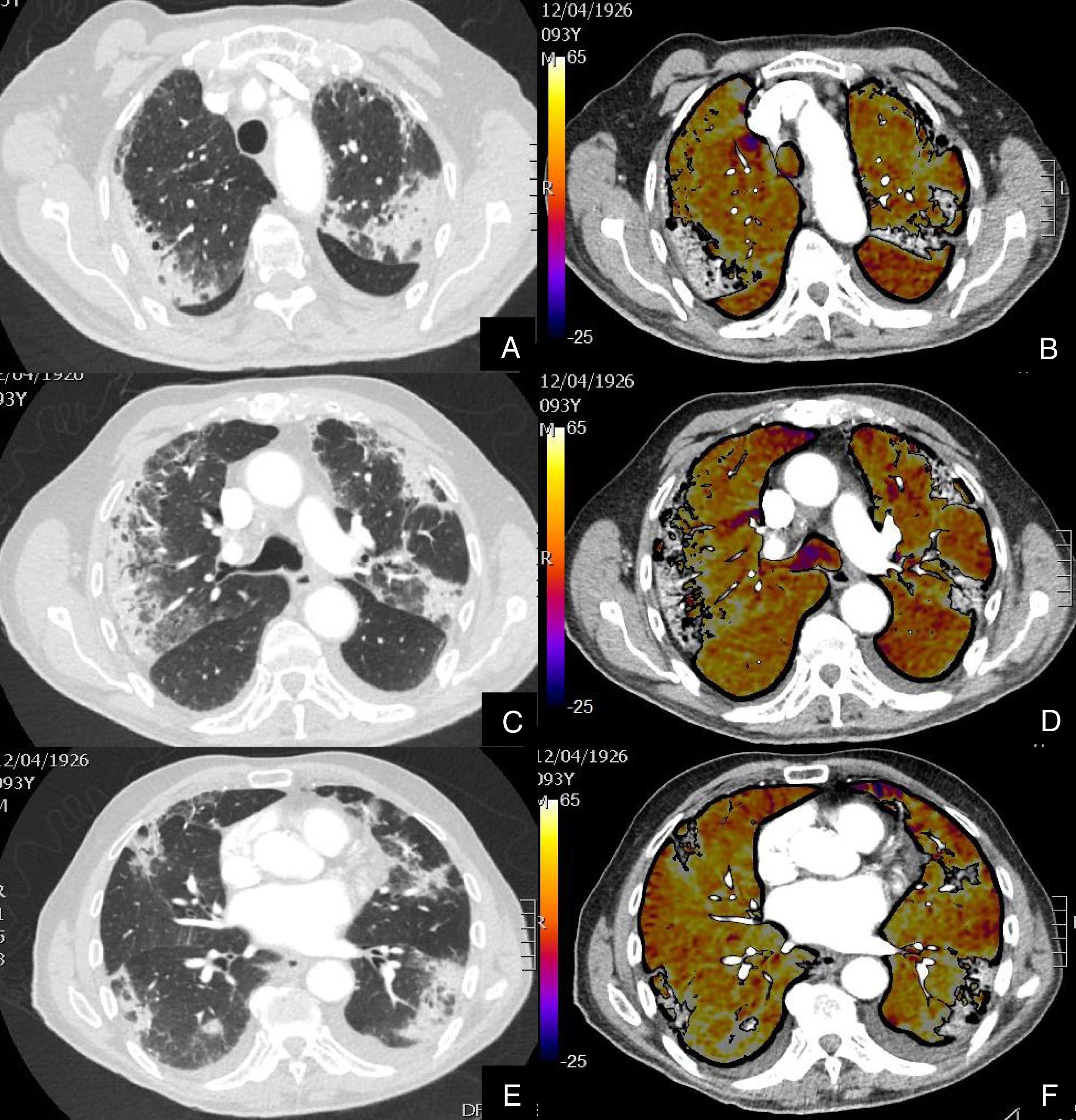
Paciente que, a pesar de buena evolución de su enfermedad por infección COVID-19, presenta elevación del D-dímero.
Imágenes axiales de una angiografía pulmonar con TC y mapa de yodo, en ventana de parénquima (A, C, E) a nivel de lóbulos superiores, medios e inferiores y sus correspondientes imágenes del mapa de yodo (B, D, F).
Paciente con afectación moderada por COVID-19, con consolidaciones subpleurales de predominio en segmentos posteriores y basales, sin TEP en arterias pulmonares principales ni periféricas ni defectos de perfusión en el mapa de yodo (colores amarillos, naranjas).
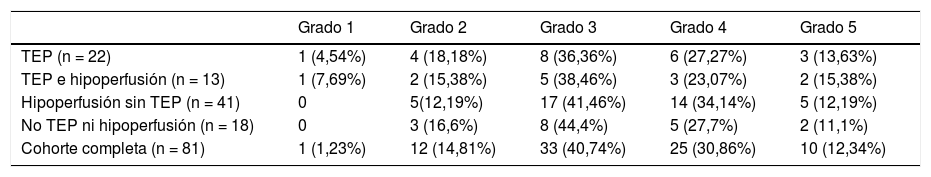
La severidad de la afectación pulmonar COVID-19 en los cuatro grupos de pacientes descritos según los hallazgos en la angiografía pulmonar con TC se muestra en la tabla 4.
Comparación del grado de afectación parenquimatosa COVID-19 y la patología vascular diagnosticada en la angiografía pulmonar con TCMD
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | Grado 5 | |
|---|---|---|---|---|---|
| TEP (n = 22) | 1 (4,54%) | 4 (18,18%) | 8 (36,36%) | 6 (27,27%) | 3 (13,63%) |
| TEP e hipoperfusión (n = 13) | 1 (7,69%) | 2 (15,38%) | 5 (38,46%) | 3 (23,07%) | 2 (15,38%) |
| Hipoperfusión sin TEP (n = 41) | 0 | 5(12,19%) | 17 (41,46%) | 14 (34,14%) | 5 (12,19%) |
| No TEP ni hipoperfusión (n = 18) | 0 | 3 (16,6%) | 8 (44,4%) | 5 (27,7%) | 2 (11,1%) |
| Cohorte completa (n = 81) | 1 (1,23%) | 12 (14,81%) | 33 (40,74%) | 25 (30,86%) | 10 (12,34%) |
Se registraron ocho (9,87%) éxitus durante el ingreso.
En el apéndice se desglosan en un diagrama los hallazgos radiológicos (patología parenquimatosa y vascular) de las angiografías pulmonares con mapa de yodo.
En el análisis de regresión logística se han excluido variables como el IMC por pérdida de valores o anticoagulación y dislipemia por colinealidad con otras variables.
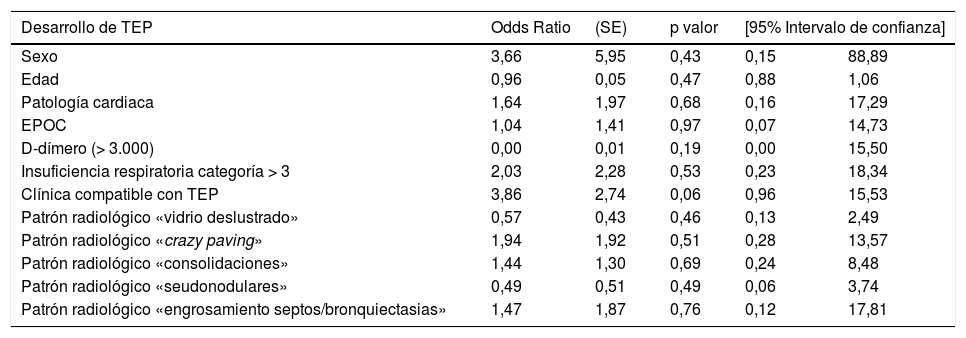
En este análisis (tabla 5) encontramos que en pacientes COVID-19, ser mujer posee 3,66 veces más de riesgo de TEP que ser hombre. La patología cardiaca de base incrementa el riesgo en 1,64 veces más de padecer TEP, mientras que la EPOC no lo modifica. La edad por otra parte no llega a ser un factor de riesgo para el mismo como tampoco cifras de D-dímero superiores a 3.000 o cambios sobre su valor previo.
Relación TEP-variables clínicas y radiológicas
| Desarrollo de TEP | Odds Ratio | (SE) | p valor | [95% Intervalo de confianza] | |
|---|---|---|---|---|---|
| Sexo | 3,66 | 5,95 | 0,43 | 0,15 | 88,89 |
| Edad | 0,96 | 0,05 | 0,47 | 0,88 | 1,06 |
| Patología cardiaca | 1,64 | 1,97 | 0,68 | 0,16 | 17,29 |
| EPOC | 1,04 | 1,41 | 0,97 | 0,07 | 14,73 |
| D-dímero (> 3.000) | 0,00 | 0,01 | 0,19 | 0,00 | 15,50 |
| Insuficiencia respiratoria categoría > 3 | 2,03 | 2,28 | 0,53 | 0,23 | 18,34 |
| Clínica compatible con TEP | 3,86 | 2,74 | 0,06 | 0,96 | 15,53 |
| Patrón radiológico «vidrio deslustrado» | 0,57 | 0,43 | 0,46 | 0,13 | 2,49 |
| Patrón radiológico «crazy paving» | 1,94 | 1,92 | 0,51 | 0,28 | 13,57 |
| Patrón radiológico «consolidaciones» | 1,44 | 1,30 | 0,69 | 0,24 | 8,48 |
| Patrón radiológico «seudonodulares» | 0,49 | 0,51 | 0,49 | 0,06 | 3,74 |
| Patrón radiológico «engrosamiento septos/bronquiectasias» | 1,47 | 1,87 | 0,76 | 0,12 | 17,81 |
Los pacientes categorizados con insuficiencia respiratoria > 3 y la sospecha clínica de TEP muestran una clara asociación con el hallazgo de TEP identificando un riesgo de 2,03 y 3,86 veces superior, respectivamente.
Respecto a los patrones radiológicos observados, el patrón «crazy paving» es un factor de riesgo sugestivo del diagnóstico posterior de TEP (OR 1,94; IC95% 0,28-13,57), así como los patrones «consolidaciones» (OR 1,44; IC95% 0,24-8,48) y «engrosamiento septos/bronquiectasias» (OR 1,47; IC95% 0,12-17,81).
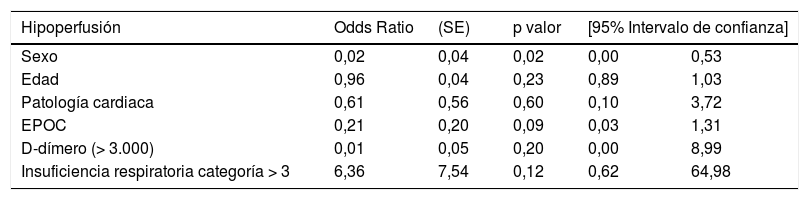
No hemos encontrado asociación estadística significativa entre la hipoperfusión y los parámetros clínicos. Sin embargo, los pacientes COVID-19 con insuficiencia respiratoria grave refractaria al O2 presentaron un riesgo de hipoperfusión 6,36 veces superior (OR 6,36; IC95% 0,62-64,98) que los pacientes sin este grado de insuficiencia respiratoria (tabla 6).
Relación hipoperfusión-variables clínicas
| Hipoperfusión | Odds Ratio | (SE) | p valor | [95% Intervalo de confianza] | |
|---|---|---|---|---|---|
| Sexo | 0,02 | 0,04 | 0,02 | 0,00 | 0,53 |
| Edad | 0,96 | 0,04 | 0,23 | 0,89 | 1,03 |
| Patología cardiaca | 0,61 | 0,56 | 0,60 | 0,10 | 3,72 |
| EPOC | 0,21 | 0,20 | 0,09 | 0,03 | 1,31 |
| D-dímero (> 3.000) | 0,01 | 0,05 | 0,20 | 0,00 | 8,99 |
| Insuficiencia respiratoria categoría > 3 | 6,36 | 7,54 | 0,12 | 0,62 | 64,98 |
No encontramos diferencias estadísticamente significativas entre el hallazgo de TEP o áreas de hipoperfusión y el resultado de la PCR.
DiscusiónLas mayores limitaciones de nuestro estudio son la falta de estudios previos de este tipo en una enfermedad de reciente aparición y el tamaño de la muestra para algunos parámetros que podrían haber modificado los resultados de éste. Nos referimos al bajo número de mujeres incluidas, que puede influir en que ser mujer posea 3,66 veces más de riesgo de TEP que ser hombre o la pérdida del valor del D-dímero al ingreso en 19 (23,45%) pacientes y que podría explicar que cambios en el D-dímero sobre su valor previo no lleguen a ser un factor de riesgo para TEP.
La TC de tórax pone de manifiesto diferentes hallazgos en función de la severidad y el tiempo de evolución de la neumonía por el SARS-CoV-227. El hallazgo radiológico más frecuente por TC en nuestra serie de pacientes fue la presencia de opacidades en vidrio deslustrado, uni o bilaterales y de predominio subpleural, presentes en el 55,5% de nuestros pacientes. Sin embargo, en la literatura, se ha registrado una incidencia de hasta el 98% de opacidades pulmonares en vidrio deslustrado en pacientes con COVID-19, frecuentemente acompañadas de otros signos como engrosamiento de septos con patrón reticular o consolidaciones28–31, habiéndose asociado estas últimas con una progresión de la enfermedad32. Se ha descrito también el signo «del halo invertido» que puede aparecer en la neumonía organizada criptogenética33. El patrón de «crazy paving», que se ha descrito hasta en el 36% de los pacientes COVID-1934, tuvo una incidencia del 20,98% en nuestra serie. Otras manifestaciones menos frecuentes reportadas en la literatura como engrosamiento de paredes bronquiales y bronquiectasias fueron observadas en el 8,64% de nuestros pacientes, mientras que el derrame pleural, el cual se describe más raramente, estaba presente en el 7,4% de los TC incluidos en nuestro estudio.
La angiografía con TC aporta, por otra parte, un valor añadido para el diagnóstico de TEP, dada su sensibilidad (82%) y especificidad (94,9%)35, con datos directos como visualización del trombo (fig. 2) o la oclusión completa vascular, así como datos indirectos como alteración de la vascularización en el posprocesado MIP, lo que probablemente se corresponde con TEP periférico oclusivo en el lecho vascular distal (fig. 4). Además, permite estratificar el riesgo en pacientes con TEP con base en los signos indirectos de disfunción del VD (aumento del índice VD/VI y reflujo a venas suprahepáticas) o aumento de tamaño de las arterias pulmonares.
Las publicaciones relacionadas con la incidencia del TEP en los pacientes COVID-19 son escasas. Grillet et al. describen una incidencia del 23% en una serie de 100 pacientes24, mientras que en el trabajo de Leonard-Lorant et al. la incidencia de TEP en pacientes COVID-19 fue del 30%25, similar a la detectada por nuestro grupo (27,16%). En la reciente publicación de la serie de 38 necropsias en Italia, se describe microtrombosis en arterias de calibre inferior a 1 mm en 33 (86,84%) pacientes16. No obstante, existen sólo algunos artículos que valoran de forma puntual el papel del mapa de yodo como imagen funcional añadida a la información proporcionada por la angioTC26,36, sin existir todavía estudios con un número elevado de pacientes.
En el mapa de yodo los defectos de perfusión son visibles como áreas de menor o nula concentración de yodo, de forma muy intuitiva por la escala de color, en el software que hemos utilizado, en tonos azules o negros (figs. 5 y 6). Las imágenes del mapa de yodo ayudan en la detección de émbolos en vasos de pequeño calibre (hasta 2 mm), que inicialmente pueden pasar inadvertidos, al correlacionar los defectos de perfusión con las imágenes de la angiografía37, aumentando la sensibilidad de la angiografía pulmonar con TC para detectar TEP19–21. Sin embargo, el riesgo de TEP podría estar infraestimado en el patrón «consolidaciones», dado que no podemos valorar defectos de repleción en los vasos dentro de un área consolidativa ni tampoco hipoperfusión en el mapa de yodo en estas áreas.
En nuestra serie, en 41 (50,61%) pacientes se observaban zonas de hipoperfusión en el mapa de yodo en relación con falta de relleno de las arterias subsegmentarias distales en el posprocesado MIP, sin llegar a visualizar trombos (fig. 4), lo que podría estar en relación con vasoconstricción y con los hallazgos de endotelitis y microtrombosis descritos en las series de autopsias publicadas16.
El mapa de yodo permite identificar defectos de perfusión mucho antes que la angiografía - TC convencional, lo cual tiene importancia pronóstica21. En el estudio multicéntrico retrospectivo publicado en 2017 por Takx et al38, se observó un aumento de la mortalidad en pacientes con defectos de perfusión evidentes en el mapa de yodo, aunque no se apreciaran claros trombos en las imágenes de la angiografía con TC. Hemos observado hipoperfusión en el mapa de yodo en 54 (66,6%) pacientes, de los cuales 41 (75,92%) no presentaban TEP visible. En 40 de estos 41 se interpretó la hipoperfusión como probable microtrombosis, puesto que el mapa de yodo se ha equiparado a la gammagrafía de perfusión19, siendo en uno de los casos la hipoperfusión atribuible a extenso enfisema, factor a tener en cuenta para interpretar correctamente el mapa de yodo20,21. En nuestra revisión, la mayor frecuencia de TEP e hipoperfusión no se correlacionan con mayor grado de severidad de afectación parenquimatosa, tal y como se refleja en la tabla 4, por lo que pensamos que probablemente el daño vascular sea independiente del daño alveolar o se produzca en distintas fases de la infección.
El análisis estadístico no nos ha permitido encontrar asociación con datos antropométricos ni enfermedades previas, aunque es muy destacable el incremento significativo del riesgo de hipoperfusión (según el mapa de yodo), de hasta 6,36 veces más, en los pacientes diagnosticados de COVID-19 que presentan insuficiencia respiratoria grave que no corrige con concentraciones elevadas de O2 [categoría > 3 en nuestra serie (tabla 1)].
El diagnóstico de hipoperfusión no llegó a considerarse factor de riesgo asociado al diagnóstico posterior de TEP, sin embargo, hay que tener en cuenta el tamaño de la muestra (81 pacientes) que puede influir en los resultados, tanto en el efecto del riesgo como en la significación estadística, siendo la Odds ratio en nuestro estudio de 0,94 (IC95% 0,24-3,73). Un mayor tamaño de la muestra y el control evolutivo de los casos que hemos analizado, quizás nos permita establecer la relación entre la insuficiencia respiratoria refractaria al O2 y la hipoperfusión como marcador precoz de TEP.
Aunque el manejo de los TEP de pequeño tamaño es controvertido, en los pacientes COVID-19 se ha demostrado una mortalidad muy elevada en aquellos con una marcada elevación del D-dímero22, aunque en nuestro estudio no hemos demostrado asociación estadística significativa entre el incremento del D-dímero y el diagnóstico de TEP o hipoperfusión. Además, se ha observado que es más probable que se produzca fallo multiorgánico en pacientes sépticos que desarrollan coagulopatía, por lo que la inhibición de la síntesis de trombina puede redundar en un descenso de la mortalidad en este grupo, siendo el único tratamiento ampliamente disponible la heparina de bajo peso molecular, que ya se recomienda a dosis profilácticas en todos los pacientes COVID-19 que requieren ingreso hospitalario. Los beneficios de la terapia anticoagulante en estos pacientes ya han sido publicados10,22,23, por ello ante los hallazgos de TEP así como signos de hipoperfusión sugestivos de microtrombosis en el mapa de yodo, en nuestro centro se inició el tratamiento anticoagulante en dosis terapéuticas con vigilancia estrecha, programando un nuevo control mediante TCMD en dos meses dado que aún es desconocida la evolución de la enfermedad y las posibles secuelas que pueda ocasionar, siendo el TEP crónico y la hipertensión pulmonar una de nuestras mayores preocupaciones.
ConclusiónLa angiografía pulmonar con TCMD y mapa de yodo, al añadir la imagen funcional a la anatómica, es capaz de demostrar, además del TEP en arterias principales, lobares y segmentarias, la presencia de hipoperfusión en vasos distales, lo cual la convierte en una herramienta de gran utilidad para la adecuada orientación diagnóstica y terapéutica de los pacientes con afectación pulmonar por COVID-19.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.