La proteinosis alveolar pulmonar (PAP) es una rara enfermedad que se caracteriza por la acumulación en el alvéolo pulmonar de un material lipoproteico derivado del surfactante alveolar, lo que provoca el consiguiente deterioro del intercambio gaseoso. Su patogenia está relacionada con alteraciones en la capacidad fagocítica del macrófago alveolar. Desde hace pocos años existe un nuevo tratamiento para la PAP consistente en la administración de factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) por vía subcutánea. El tratamiento comúnmente aceptado y que ha demostrado mayor eficacia en la PAP es el lavado pulmonar total. Una alternativa a este tratamiento es la administración por vía inhalada en aerosolterapia de este factor. La administración del GM-CSF por vía inhalada es segura y eficaz para el tratamiento de la PAP y supone una alternativa al tratamiento con lavado pulmonar total y GM-CSF por vía subcutánea. Presentamos un caso de PAP tratada con GM-CSF por vía inhalada y su evolución clínica y funcional tras un año de tratamiento.
Pulmonary alveolar proteinosis is a rare disease characterized by the accumulation of lipoproteinaceous material derived from alveolar surfactant in the alveoli, with a consequent deterioration in gas exchange. Pathogenesis is related to impaired phagocytic function of alveolar macrophages. In recent years, a new treatment for pulmonary alveolar proteinosis—consisting of subcutaneous administration of granulocyte-macrophage colony-stimulating factor (GM-CSF)—has become available. The commonly accepted treatment, and the one to have shown greatest efficacy in pulmonary alveolar proteinosis, is whole lung lavage. Instead of subcutaneous administration, GM-CSF can also be inhaled as an aerosol. This route of administration of GM-CSF is safe and effective in the treatment of pulmonary alveolar proteinosis and represents an alternative to subcutaneous administration or whole lung lavage. We present a patient with pulmonary alveolar proteinosis who was treated with inhaled GM-CSF and describe her clinical and functional outcome after 1 year of treatment.
La proteinosis alveolar pulmonar (PAP) es una rara enfermedad caracterizada por la acumulación en el alvéolo pulmonar de un material lipoproteico derivado del surfactante alveolar, lo que provoca el consiguiente deterioro del intercambio gaseoso. Su incidencia estimada es de 0,36 casos por millón de habitantes, con una prevalencia de 3,7 por millón de habitantes1. La forma de presentación más frecuente es la que ocurre en adultos jóvenes previamente sanos, que desarrollan disnea de esfuerzo progresiva, hipoxemia y alteraciones radiológicas características2. El tratamiento recomendado consiste en la realización de un lavado broncoalveolar total con suero fisiológico para extraer el material proteináceo que ocupa el espacio aéreo, con el objeto de conseguir la mejoría clínica y funcional.
La patogenia de esta enfermedad está relacionada con alteraciones en la capacidad fagocítica del macrófago alveolar. Desde hace pocos años existe un nuevo tratamiento para la PAP consistente en la administración de factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) por vía subcutánea3, con resultados esperanzadores. Una alternativa sería el tratamiento con este factor estimulante de colonias administrado por vía inhalada en aerosolterapia.
Presentamos un caso tratado con GM-CSF por vía inhalada y la evolución clínica y funcional al cabo de 12 meses de tratamiento.
Observación clínicaMujer de 31 años, exfumadora (consumo acumulado de 13 paquetes/año). Presentaba desde unos 4 meses antes tos seca persistente, disnea progresiva hasta hacerse de grado 2 en la escala del Medical Research Council (MRC)4, febrícula y pérdida de unos 2kg de peso. En la exploración física se evidenciaban finos crepitantes inspiratorios en ambas bases pulmonares y acropaquías. El resto era normal.
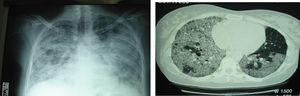
Los resultados de los análisis realizados fueron los siguientes: hemoglobina de 16,9g/dl, hematócrito del 48%, leucocitos de 9.200/μl, neutrófilos del 66,8%, plaquetas de 260.000/μl, velocidad de sedimentación de 52mm en la primera hora y lactatodeshidrogenasa de 770U/l; los resultados del factor reumatoide, hormonas tiroideas, anticuerpos antinucleares, anticitoplásmicos antineutrófilo, enzima conversiva de la angiotensina y serología para neumonía atípica fueron negativos. La exploración funcional mostró un patrón restrictivo, con capacidad vital forzada (FVC) de 2.270ml (52%), volumen espiratorio forzado en el primer segundo (FEV1) de 2.230ml (61%), FEV1/FVC del 98%, capacidad pulmonar total de 3.550ml (62%), volumen residual de 1.110ml (69%), capacidad de difusión de monóxido de carbono (DLCO) corregida por volumen alveolar del 43%. Los resultados de la gasometría arterial fueron los siguientes: presión arterial de oxígeno (PaO2) de 60mmHg, presión arterial de anhídrido carbónico (PaCO2) de 34mmHg y pH de 7,42. En la prueba de la marcha de 6min recorrió 570m. En electrocardiograma el ritmo era sinusal con trazado normal. La radiografía de tórax mostraba un patrón alveolar en vidrio deslustrado bilateral, de predominio en los lóbulos inferiores. La tomografía computarizada de alta resolución evidenció áreas de vidrio deslustrado con engrosamiento de los septos interlobulillares, más marcado en la zona subpleural, y discreto engrosamiento del intersticio peribroncovascular. Se realizó una fibrobroncoscopia sin hallazgos macroscópicos. El lavado broncoalveolar mostró un líquido lechoso, proteináceo, positivo a la reacción del ácido peryódico de Schiff y rojo oleoso. Los cultivos microbiológicos, incluidos hongos y micobacterias, fueron negativos. Se estableció el diagnóstico de proteinosis alveolar idiopática.
En los 2 meses posteriores la paciente experimentó un importante deterioro clínico y funcional, con incremento de la disnea hasta hacerse de grado 3 en la escala del MRC, progresión de las alteraciones radiológicas y notable insuficiencia respiratoria (PaO2 de 53mmHg, PaCO2 de 33mmHg y pH de 7,40), con FVC del 45% y DLCO del 25%. Se le realizaron 2 lavados pulmonares totales en un intervalo de 2 meses, con lo que se consiguió una mejoría tanto clínica como funcional (PaO2 de 64mmHg, FVC del 60% y DLCO del 61%). A los 5 meses del segundo lavado pulmonar presentó un aumento de la disnea, progresión de la afectación radiológica (fig. 1) e importante deterioro en el intercambio gaseoso, con PaO2 de 40mmHg, PaCO2 de 32mmHg, pH de 7,37 y DLCO del 23%. En la prueba de la marcha de 6min recorrió 338m, alcanzó una saturación mínima del 75% y presentó disnea de 8/10 puntos medida con una escala visual analógica. Se determinaron las concentraciones séricas de anticuerpos frente a GM-CSF y se encontraron títulos elevados (4,43nM). Debido al deterioro clínico y de oxigenación a pesar de los 2 lavados pulmonares totales, se inició tratamiento con GM-CSF por vía inhalada en aerosolterapia (sargramostim) a dosis de 250μg cada 12h en semanas alternas. El fármaco se administró diluido en 10ml de suero fisiológico y la paciente lo inhaló con una pieza bucal utilizando como dispositivo de aerosolterapia un nebulizador neumático, según las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica5.
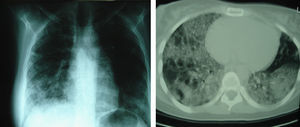
Tras 12 meses de tratamiento no han aparecido efectos adversos y la respuesta clínica ha sido buena. La disnea ha mejorado (ha pasado nuevamente a ser de grado 1 en la escala del MRC), al igual que la prueba de la marcha de 6min (la paciente recorrió 142m más sin presentar saturaciones inferiores al 85%). La tomografía computarizada de alta resolución reveló una discreta mejoría, con persistencia de los focos parcheados bilaterales (fig. 2). También los parámetros ventilatorios reflejan una discreta mejoría —FVC de 1.980ml (51%) y capacidad pulmonar total de 3.331ml (59%)— y la DLCO corregida por volumen alveolar ha mejorado (51%). De forma llamativa, el intercambio gaseoso mejoró considerablemente —en la gasometría arterial la PaO2 era de 88mmHg, la PaCO2 de 40mmHg y el pH de 7,45—, estando los valores muy lejos de las graves hipoxemias presentes antes del inicio del tratamiento con GM-CSF, por lo que ha podido retirarse la oxigenoterapia domiciliaria. La evolución clínica y funcional se refleja en la tabla 1.
Evolución clínica y funcional
| Inicial | Tras BAL | Inicio GM-CSF | Tras tratamiento | |
| FVC | 1.750ml (45%) | 2.329ml (60%) | 1.490 (37%) | 1.980ml (51%) |
| DLCO (%) | 25 | 61 | 23 | 51 |
| PaO2 (mmHg) | 53 | 64 | 40 | 88 |
| Disnea MRC | 3 | 2 | 3 | 1 |
| PM6M (m) | 570 | 670 | 338 | 480 |
DLCO: capacidad de difusión del monóxido de carbono; FVC: capacidad vital forzada; PaO2: presión arterial de oxígeno; PM6M: prueba de la marcha de 6min.
Presentamos un caso tratado con GM-CSF por vía inhalada, después de 2 lavados pulmonares totales, con el que se obtuvo muy buena respuesta clínica y en el intercambio gaseoso, lo que permitió retirar la oxigenoterapia domiciliaria.
La PAP se caracteriza por la acumulación en el alvéolo pulmonar de un material lipoproteico derivado del surfactante alveolar. No hay inflamación en la vía aérea y la arquitectura pulmonar se encuentra conservada6. Se sabe que su patogenia está relacionada con una alteración en la homeostasis del surfactante, en la que hay una producción normal, pero un defecto en su aclaramiento por parte de los macrófagos alveolares7. Esta remoción se debe en un 75–80% a los neumocitos tipo II y en un 20–25% a la acción del macrófago alveolar. Datos recientes apuntan a que en la patogenia de la PAP estaría implicado el GM-CSF. No parece que el déficit de producción tenga un papel importante en su patogenia, aunque podría tratarse de una alteración del receptor común del GM-CSF en las células mononucleares, lo que llevaría a un descenso de la respuesta de los macrófagos al estímulo de la citocina8. La presencia de autoanticuerpos circulantes frente al GM-CSF podría explicar algunos aspectos de la enfermedad. Se han encontrado anticuerpos neutralizantes del GM-CSF en el lavado broncoalveolar de 11 pacientes con PAP idiopática, pero no en muestras tomadas de 2 pacientes con PAP secundaria, en 14 pacientes con otras enfermedades pulmonares y en personas sanas9. En el caso aquí descrito se detectaron títulos elevados de autoanticuerpos frente a GM-CSF. Estos anticuerpos causan además una disfunción de los neutrófilos, que en parte sería la responsable de la alta incidencia de complicaciones infecciosas por gérmenes poco habituales como Nocardia10.
El tratamiento comúnmente aceptado y que ha demostrado mayor eficacia en los pacientes con proteinosis alveolar es el lavado pulmonar total. La técnica está bien estandarizada11 y está indicada cuando hay un diagnóstico histológico definitivo y alguna de las alteraciones siguientes: a) PaO2 menor de 65mmHg; b) gradiente alveoloarterial mayor de 40mmHg; c) presencia de un cortocircuito mayor del 12%, y d) disnea en reposo. Es una técnica laboriosa, que requiere la anestesia general del paciente y no está exenta de complicaciones. Después del lavado pulmonar suele producirse una mejoría importante, sobre todo en la disnea. Aunque el curso es variable, el 30–40% de los pacientes requieren un solo lavado, mientras que el resto necesitan lavados a intervalos de 6–12 meses12. En el caso aquí presentado se realizaron 2 lavados en un corto período de tiempo (2 meses), con rápido deterioro posterior de los síntomas, lo que hizo que se planteara el tratamiento con sargramostim.
Actualmente se acepta el uso del GM-CSF, ya sea por vía intravenosa, subcutánea o inhalada, en la PAP, aunque no hay estudios aleatorizados que hayan valorado su eficacia. En la literatura médica hay varias series de pacientes tratados, en los que se observan porcentajes de respuesta mayores que la tasa de remisión espontánea de la enfermedad (20%). La respuesta en términos funcionales y de intercambio gaseoso es evidente al cabo de 4–6 semanas de tratamiento. La vía subcutánea es la más empleada, pero la vía inhalada ha mostrado ser segura y eficaz13. Las concentraciones séricas son mayores tras la administración subcutánea, con mayor probabilidad de efectos no deseados, aunque en general son leves y poco frecuentes (exantema, fiebre, dolor óseo). El sargramostim es el compuesto que presenta el mejor perfil de seguridad.
En conclusión, el tratamiento por vía inhalada en aerosolterapia con GM-CSF es seguro y eficaz en el tratamiento de la PAP, y representa una alternativa al lavado pulmonar total y al tratamiento por vía subcutánea.