El género Cryptococcus incluye diferentes especies de hongos levaduriformes capsulados de los que solo C.neoformans se considera patógeno humano, su cápsula polisacárida le confiere virulencia protegiendo al hongo de la fagocitosis y acción del complemento. Dentro de esta especie, según los componentes de la cápsula, se han descrito 4 serotipos, A, B, C y D. Los serotipos A y D se identifican como C. neoformans var. neoformans y los antígenos B y C como C. neoformans var. gattii. Existen diferencias entre las 2 variedades tanto desde el punto de vista patogénico como de distribución geográfica. Mientras C. neoformans var. neoformans es de distribución mundial y se asocia con infección en los pacientes inmunodeprimidos, C. neoformans var. gattii se ha descrito en infecciones de pacientes inmunocompetentes y su distribución está más restringida a países tropicales y subtropicales1.
C. neoformans var. neoformans puede afectar a cualquier individuo, si bien es más frecuente en pacientes con algún factor predisponente (infección por VIH, consumo de fármacos inmunosupresores, conectivopatías, cirrosis, etc.)2.
A pesar de que las heces de paloma son la fuente más importante de infección, estos animales no padecen la enfermedad. En el hombre se adquiere por vía respiratoria y no se ha demostrado transmisión de persona a persona. Mientras que las vías respiratorias suelen ser la puerta de entrada, la afectación pulmonar se diagnostica en contadas ocasiones, siendo la afectación neurológica la más frecuente. Las lesiones pulmonares ocasionadas por el criptococo son muy variadas: nódulos, masas, infiltrados intersticiales, consolidación alveolar o linfadenopatías3,4. El derrame pleural, bien sea aislado o asociado a enfermedad pulmonar es una manifestación infrecuente2–6.
Describimos un caso de pleuritis por C. neoformans en un paciente inmunocompetente.
Varón de 78 años con antecedentes de enfermedad renal crónica estadio 3a, fibrilación auricular permanente, insuficiencia cardíaca con fracción de eyección preservada, hepatopatía alcohólica y síndrome de overlap (EPOC+SAHS) en tratamiento con CPAP. Consultó en nuestro centro por clínica de 4-5 días de evolución de dolor pleurítico derecho de inicio brusco, acompañado de aumento de disnea habitual, tos con expectoración mucosa y febrícula vespertina. En la exploración física presentaba buen estado general, tensión arterial 139/68mmHg, frecuencia cardíaca 83lpm, temperatura axilar de 37,5°C, SatO2 basal del 95%. Presentaba adenopatías axilares derechas móviles, sin adenopatías palpables en otros territorios. La auscultación cardíaca era arrítmica, y en la auscultación pulmonar el murmullo vesicular estaba disminuido en base derecha con roncus bilaterales; resto de la exploración física, sin interés.
En la analítica sanguínea destacaba una discreta anemia y una elevación de marcadores inflamatorios. En la radiografía de tórax se apreciaba un derrame pleural derecho.
Se realizó una toracocentesis diagnóstica, y se obtuvo líquido con características bioquímicas de exudado: pH 7,45, glucosa 121mg/dl, proteína 4,1g/dl, ADA 24,7U/l, hematíes 25.200μl, células nucleadas 3.100μl (polimorfonucleares 39%, linfocitos 23%, macrófagos 38% y células mesoteliales reactivas). Se envió una muestra de líquido pleural para cultivo, recogiéndose asimismo cultivo de esputo y hemocultivos.
Se intensificó el tratamiento diurético con furosemida y se inició cobertura antibiótica empírica con ceftriaxona. En el 4.° día del ingreso el paciente se encontraba afebril, con balance hídrico negativo y mejoría del dolor pleurítico y disnea. En este contexto se recibe información del laboratorio de microbiología de aislamiento de levaduras en el líquido pleural, por lo que se realizó una nueva toracocentesis. Se recogieron nuevamente hemocultivos, se realizó un fondo de ojo (sin alteraciones) y serología de VIH (negativa), y se inició tratamiento con fluconazol.
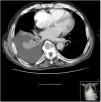
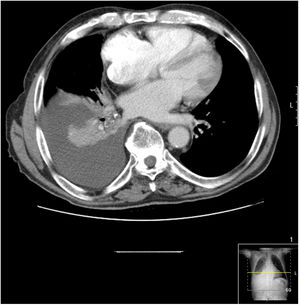
Se realizó una TC torácica en la que se observó derrame pleural derecho libre de 5cm de espesor, que provocaba atelectasia pasiva del lóbulo inferior derecho (fig. 1), sin otras alteraciones.
Los hemocultivos y el cultivo de esputo fueron negativos. La levadura se identificó como C. neoformans por 2 métodos microbiológicos distintos. Mediante el sistema VITEK® 2 (Biomerieux, Marcy l‘Etoile, Francia) y por espectrometría de masas con el sistema MALDI-TOF (Bruker). La levadura se aisló igualmente en el segundo cultivo de líquido pleural. Se solicitó la detección del antígeno de criptococo en suero que fue negativo.
Se modificó el tratamiento a voriconazol 200mg/cada 12h y se realizó una toracocentesis evacuadora, con posterior resolución del derrame. Se completó tratamiento durante un mes de forma ambulatoria. En revisión posterior en consultas externas tras finalización del tratamiento antifúngico el paciente se encontraba en situación basal.
La pleuritis por C. neoformans es una entidad poco frecuente, que ocurre principalmente en pacientes inmunodeprimidos. En una revisión reciente2 en la que se incluyen 25 casos de derrame pleural por criptococo observan que 20 de los 25 pacientes presentaban algún tipo de inmunosupresión; entre los factores predisponentes más frecuentes se encontraba la infección por VIH (7 casos), el trasplante de órgano sólido (5 casos) o las neoplasias (4 casos). En una revisión previa6 de 30 casos, se documentó una enfermedad subyacente en 17 casos, mientras que en 10 no existía ningún factor predisponente. En esta cohorte se observó que la mayor parte de los pacientes presentan derrame pleural por criptococo en el contexto de una criptococosis diseminada, siendo la infección localizada únicamente a nivel torácico más frecuente en pacientes inmunocompetentes6. Nuestro paciente, si bien tiene un diagnóstico previo de hepatopatía alcohólica, no presentaba datos clínicos, analíticos o de imagen sugestivos de enfermedad hepática avanzada, que como hemos mencionado es uno de los factores habitualmente asociados a esta infección.
La pleuritis por criptococo se puede encontrar, por tanto, de forma aislada, asociado a consolidación neumónica o no, o en el contexto de una criptococosis diseminada. Para el diagnóstico de derrame pleural por criptococo, se precisa aislar el microorganismo en cultivo de líquido pleural o biopsia pleural4. En caso de enfermedad criptocócica diseminada podría ser de ayuda la detección del antígeno criptocócico en sangre. Nuestro paciente presentaba un derrame por C. neoformans aislado, sin consolidación pulmonar (descartada en la TC) ni diseminación a otros órganos (lo que podría justificar que el antígeno criptocócico en suero fuese negativo). Si bien en el caso que aquí presentamos se aísla criptococo en 2 cultivos de líquido pleural, en ocasiones los cultivos pueden resultar negativos dado la pequeña cantidad de inóculo presente en el líquido pleural3,5. En caso de resultar negativo el cultivo, podría ser de ayuda el antígeno criptocócico en líquido pleural (no realizado en nuestro caso), dado que el derrame no es más una respuesta inflamatoria al antígeno criptocócico5.
El mecanismo de entrada de la infección al espacio pleural suele ser por vía pulmonar, aunque también podría acceder vía hematógena. Creemos más probable en nuestro caso la primera vía, y especulamos con la posible participación de la CPAP en la génesis de la misma7. En este sentido recogimos cultivos de las tubuladuras y líquido de humidificación, que fueron negativas, aunque se recogieron al 6.° día del ingreso, con cambio del líquido, por lo cual no se pudo confirmar esta hipótesis.
Como conclusión, la pleuritis por criptococo es una entidad poco frecuente que puede aparecer en sujetos inmunocompetentes, por lo que debería tenerse en cuenta en el diagnóstico diferencial del derrame pleural en este tipo de pacientes. Ante la sospecha de que la fuente de infección en nuestro paciente pudiese haber sido la CPAP, sería preciso insistir a los usuarios de este tipo de dispositivos sobre la importancia de su adecuada utilización y desinfección, por las graves consecuencias que pueden derivarse de su empleo incorrecto.